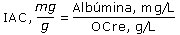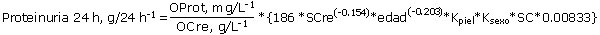Introducción
En el lupus eritematoso sistémico (LES) el riñón sufre un daño inflamatorio que, al hacerse crónico con el tiempo, da lugar a la pérdida de las funciones del órgano y causa la enfermedad renal crónica (ERC).1,2 La nefropatía lúpica puede afectar entre el 30 y 50 % de los pacientes diagnosticados con LES,3,4) e influye decisivamente en la evolución de la enfermedad y en la calidad de vida del paciente.
La afección renal asociada al LES suele diagnosticarse según los signos clínicos de nefritis, el cuadro de hipertensión arterial, y la reducción del filtrado glomerular.5 La biopsia renal se indica para establecer la calidad y gravedad del daño renal presentes a fin de ajustar las acciones terapéuticas.6
El daño renal asociado al LES podría diagnosticarse también a partir de la presencia de proteínas en una muestra de orina. La proteinuria puede aparecer precozmente en el LES y, por ello, suele considerarse un importante indicador para diagnosticar la nefropatía lúpica;7,8) sin embargo, no siempre se indica oportunamente el análisis de proteinuria de 24 horas, y los resultados pueden estar sesgados debido al volumen de orina empleado en el análsis.9 Luego, sería ventajoso implementar una estrategia que se integrara al examen complementario de la función renal del paciente con LES para determinar la proteinuria.
Los autores han planteado un modelo determinístico de la proteinuria de 24 horas a partir de la relación proteína/creatinina (RPC).10 Los datos demográficos de los sujetos como el sexo, la edad y el color de la piel se emplearon para ajustar la capacidad de generación endógena de creatinina.10 La exactitud diagnóstica de la proteinuria de 24 horas estimada de la RPC fue mayor que 90 %.10
La figura 1 muestra la equivalencia de la proteinuria de 24 horas determinada indistintamente de la colección de orina o de la RPC según los datos de los propios autores.
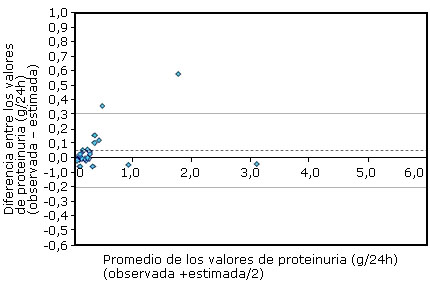 La concordancia entre los métodos se estimó mediante un gráfico Bland-Altman.Se emplearon las colecciones de orina de 29 adultos.Línea discontinua: promedio de las diferencias. Líneas continuas: intervalo de confianza al 95 % para el promedio de las diferencias.
La concordancia entre los métodos se estimó mediante un gráfico Bland-Altman.Se emplearon las colecciones de orina de 29 adultos.Línea discontinua: promedio de las diferencias. Líneas continuas: intervalo de confianza al 95 % para el promedio de las diferencias.Figura 1 Concordancia entre los valores de proteinuria de 24 h observados en una colección de orina y los estimados de la relación proteínas/creatinina.
La figura 2 muestra la equivalencia entre los valores de albuminuria de 24 horas obtenidos bien después del análisis de la colección de orina bien estimada del índice albúmina/creatinina. De los registros del Laboratorio de Estudios de la Función Renal (Servicio de Laboratorio Clínico, Hospital Pediátrico Docente “Juan Manuel Márquez”, La Habana) se tomaron los datos demográficos, antropométricos y bioquímicos de 17 adultos y se utilizaron posteriormente para predecir la albuminuria de 24 horas. Aunque el número de las observaciones impidió evaluar mejor la utilidad diagnóstica del índice albúmina/creatinina (IAC), la diferencia entre los métodos fue solo 20 mg/24 h en concentraciones entre 20 y 50 mg/24 h. El intervalo al 95 % para las diferencias entre los métodos tuvo en cuenta, menos una, todas las parejas de valores de albuminuria.
Concluidos los ejercicios estadísticos para comparar los valores de proteinuria/albuminuria, solo faltó averiguar si el modelo determinístico desarrollado para predecir la proteinuria de 24 h pudiera aplicarse igualmente en el estudio de la nefritis lúpica. Por eso, se realizó este trabajo que tuvo como objetivo conocer cómo se comporta la relación proteína/creatinina y, por consiguiente, la proteinuria estimada a partir de esta relación en los pacientes con diagnóstico de LES y su relación con el filtrado glomerular y el tiempo de evolución de la enfermedad.
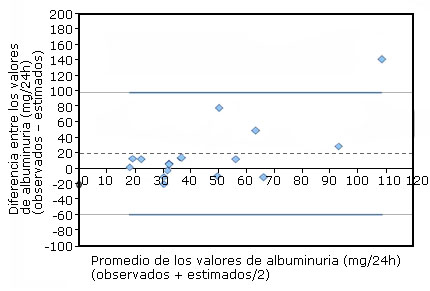 La concordancia entre los métodos se estimó mediante un gráfico Bland-Altman.Se emplearon las colecciones de orina de 17 adultos.Línea discontinua: promedio de las diferencias. Líneas continuas: intervalo de confianza al 95 % para el promedio de las diferencias.
La concordancia entre los métodos se estimó mediante un gráfico Bland-Altman.Se emplearon las colecciones de orina de 17 adultos.Línea discontinua: promedio de las diferencias. Líneas continuas: intervalo de confianza al 95 % para el promedio de las diferencias.Figura 2 Concordancia entre los valores de albuminuria de 24 h observados en una colección de orina y los estimados del índice albúmina/creatinina.
Métodos
Lugar del estudio: Servicio de Reumatología del Hospital Clínico-Quirúrgico “10 de Octubre”, La Habana, Cuba, reconocido como centro de referencia nacional para el diagnóstico, tratamiento y seguimiento del LES.
Diseño del estudio analítico transversal
Fueron seleccionados para participar en este estudio los pacientes con LES de ambos sexos mayores de 18 años que ingresaron en el servicio de reumatología entre octubre de 2013 y septiembre de 2014 después de leer y firmar el acta de consentimiento informado.
Fueron excluidos del estudio los enfermos que decidieron no participar (sin que ello afectara la calidad del proceso diagnóstico que se realizó con ellos), aquellos que tenían infección de las vías urinarias, hematuria o cualquier otro padecimiento que afectaban la sensibilidad, la especificidad y la exactitud de los métodos analíticos empleados para determinar las sustancias de interés para el estudio, los pacientes encamados y aquellos que tuvieran, además, hipertensión arterial o padecieran diabetes mellitus.
De cada paciente incluido en el estudio se relacionaron el sexo (masculino/femenino), el color de la piel (blanco/negro/otro), la edad (en años cumplidos) y el tiempo de evolución de la enfermedad, así como los meses transcurridos desde el diagnóstico de LES.
La edad se dividió como sigue: edad < 60 años / edad ≥ 60 años; y el tiempo de evolución de la enfermedad se dividió de la siguiente forma: hasta 12 meses, entre 13 y 60 meses, y más de 60 meses.
Se relacionaron la talla (en centímetros) y el peso (en kilogramos) de los pacientes con exactitud de una décima mediante los procedimientos descritos en la literatura11-12) y la superficie corporal (SC, m2) y el índice de masa corporal (IMC, kg/m2) se calcularon según las ecuaciones descritas también en la literatura.13-14
Se calculó el valor del IMC y se calificó de la manera siguiente:13 peso menor para la talla: IMC menor que 18,5 kg/m2; peso adecuado para la talla: entre 18,5 y 24,9 kg/m2 y peso excesivo para la talla: mayor o igual que 25.0 kg/m2.
El filtrado glomerular (eFG) se calculó a partir de los valores corrientes de creatinina sérica de acuerdo con la ecuación empleada en el estudio de las modificaciones de la dieta en la enfermedad renal (MDRD por sus siglas en inglés).15 Las concentraciones de creatinina sérica se obtuvieron después de analizar una muestra de sangre extraída en ayunas mediante punción antecubital utilizando el modo cinético de la reacción de Jaffé.16 El valor del eFG (mL/min * 1.73/m2 SC) se dividió como sigue: valor menor o igual que 60 y valor disminuido mayor que 60. El valor corriente de la creatinina sérica ((mol/L) se dividió en valores esperados menor o igual que 128,0 y valores aumentados mayor que 128,0.
Las cantidades de proteínas totales (OProt, g/L), de albúmina (OAlb, mg/L), y de creatinina (OCre, (mol/L) excretadas en una muestra de orina colectada de la primera micción de la mañana, se determinaron mediante tinción con el rojo de pirogalol,17 mediante el método de inmunoprecipitación con anticuerpos adsorbidos sobre micropartículas de látex18 y mediante el modo cinético de la reacción de Jaffé,16 respectivamente. En todos los casos se siguieron las instrucciones del fabricante de los reactivos empleados en las determinaciones analíticas (Empresa de Productos Biológicos “Carlos Juan Finlay”, La Habana, Cuba).
Las unidades de sustancia de creatinina se convirtieron en las correspondientes unidades de masa mediante la ecuación:
Los métodos analíticos se llevaron a cabo en un autoanalizador HITACHI 902 (Boehringer-Manheim, Alemania). Se garantizó que el coeficiente de variación del método analítico fuera < 10 %.
La RPC (g/g) se calculó a partir de la proteinuria y creatininuria corrientes según la siguiente ecuación:
El índice albúmina/creatinina (IAC) se calculó a partir de los valores de albuminuria y creatinuria hallados en los pacientes después de aplicar el método analítico:
La RPC se convirtió en un estimado de la proteinuria de 24 horas (g/24 h) mediante la siguiente ecuación:
donde:
OProt |
cantidad de proteínas totales |
SCre |
concentración sérica de creatinina expresada en mg/dL |
Kpiel |
constante dependiente del color de la piel del sujeto |
Ksexo |
constante dependiente del sexo del sujeto |
donde:
OAlb |
cantidad de albúmina total |
OCre |
cantidad de creatinina total |
SCre |
concentración sérica de creatinina expresada en mg/dL |
Kpiel |
constante dependiente del color de la piel del sujeto |
Ksexo |
constante dependiente del sexo del sujeto |
La constante dependiente del color de la piel del sujeto (Kpiel) es igual a 1,212 si la piel es negra y es igual a 1,000 si la piel es blanca. Por su parte, la constante dependiente del sexo (Ksexo) es igual a 0,742 si el sexo es femenino y es igual a 1, 000 si es masculino.
Se consideraron anómalos los valores de proteinuria mayores que 0,150 g/24h y de albuminuria mayores que 30 mg/24 h.
Los datos demográficos, clínicos, antropométricos y analíticos de los pacientes incluidos en el estudio se anotaron en los formularios creados ad hoc para esta investigación y se ingresaron en un contenedor digital desarrollado en ACCESS para OFFICE versión 7.0 de WINDOWS (Microsoft, Redmond, Virginia, Estados Unidos). El contenedor digital incluye una aplicación NEFROCALC que permite el cálculo automatizado de la excreción urinaria de una sustancia de interés mediante diferentes modelos biomatemáticos.19
Los datos reunidos se redujeron según el tipo de la variable hasta estadígrafos de locación (media), dispersión (desviación estándar) y agregación (frecuencias y porcentajes). Los valores de la proteinuria de 24 horas se distribuyeron según el eFG y el tiempo de evolución del LES. La relación entre las variables del estudio se midió mediante pruebas de independencia basadas indistintamente en la distribución t de Student o la distribución ji-cuadrado.20 Se empleó un nivel menor que el 5 % para denotar las asociaciones significativas.21
Este estudio fue aprobado para su realización por el jefe del servicio hospitalario de Reumatología, así como también por el Consejo Científico y el Comité de Ética de la institución. En todo momento se respetaron los principios éticos sobre las investigaciones biomédicas con seres humanos21 formulados en la Declaración de Helsinki. Al paciente se le explicaron los objetivos de la investigación y la utilidad que reportaría, y se le hizo saber que no afectaría en lo más mínimo su estado de salud. Además, se le aseguró que, en caso de no aceptar o abandonar el estudio, continuaría recibiendo la atención médica prescrita, se le harían las pruebas indicadas por el médico de cabecera y se le garantizó que la información obtenida se utilizaría estrictamente con fines científicos y nunca se divulgaría.
Resultados
El estudio quedó integrado finalmente por 60 pacientes con nefrosis lúpica que cumplieron los criterios de selección planteados en el diseño de la investigación. Esta cifra representó el 42,2 % de los pacientes atendidos en el servicio durante el tiempo de observación del estudio.
La tabla 1 muestra las características demográficas, clínicas y antropométricas de los pacientes incluidos en el estudio. Prevalecieron los sujetos de piel blanca (75,0 %), las mujeres (95,0 %), y los sujetos mayores de 60 años (96,7 % del total). La edad promedio fue de 39,7 ± 12,0 años. Casi la mitad de los enfermos tenía más de 5 años de evolución de la enfermedad lúpica. Padecía exceso de peso el 60 % de los pacientes y obesidad el 13,3 %.
Tabla 1 Características demográficas, clínicas y antropométricas de los pacientes.
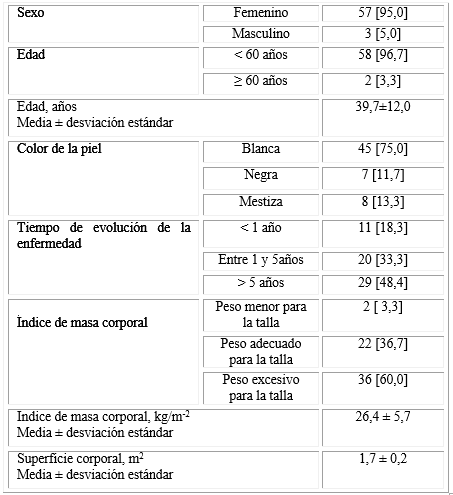
Fuente: Elaboración propia basada en los registros del estudio.
La tabla 2 muestra las características bioquímicas de los pacientes estudiados. Solo el 13,3 % de los pacientes lúpicos mostraron valores de creatinina sérica mayor que 128 µmol/L: punto de corte empleado en la evaluación bioquímica, apenas la cuarta parte de los enfermos estudiados mostró valores de eFG mayores que 60 mL/min * 1.73/m2 SC. Sin embargo, los valores promedio de la proteinuria de 24 horas superaron el punto de corte del diagnóstico de la excreción aumentada de proteínas, y el 55,0 % de los pacientes mostraron valores de proteinuria de 24 horas mayores que 0,15 g/24 h. Los valores promedio de la albuminuria de 24 horas fueron mayores que el punto de corte para el diagnóstico de valores patológicos de albuminuria patológica, y el 66,7 % de los enfermos presentó valores de albuminuria de 24 horas mayores que 30,0 mg/24 h.
Tabla 2 Características bioquímicas de los pacientes del estudio.
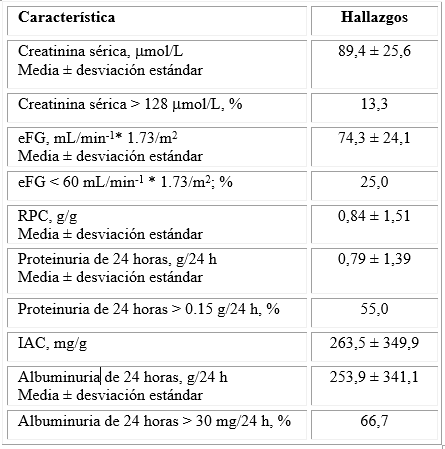
eFG: filtrado glomerular estimado de la creatinina sérica. RPC: relación proteínas/creatinina, IAC: índice albúmina/creatinina.
Fuente: Elaboración del autor según los resultados del estudio.
Las figuras 3 y 4 muestran la relación observada entre los indicadores de daño glomerular y el estado de la función glomerular. Para cualquiera de los dos indicadores empleados en el estudio, se observó un incremento exponencial de los valores de proteinuria/albuminuria estimados para 24 horas con respecto a cada unidad de reducción del eFG.
 Fuente: Elaboración del autor según los resultados del estudio.
Fuente: Elaboración del autor según los resultados del estudio.Figura 3 Asociación entre la proteinuria estimada de 24 horas y el filtrado glomerular.
En el caso de la proteinuria de 24 horas para un valor de eFG de 134,9 mL/min * 1,73/m2, la proteinuria estimada fue de 0,02 g/24 h; mientras que para un eFG de 67,4 mL/min * 1,73/m2, esta alcanzó un valor de 0,79 g/24 h: un incremento de casi 40 veces respecto al valor inicial. Para un valor de eFG de 27,3 mL/min * 1,73/m2, la proteinuria fue de 3,10 g/24 h, lo que representa un incremento de 155 veces.
Por su parte, para un valor de eFG de 134,9 mL/min * 1,73/m2, la albuminuria fue de 23,8 mg/24 h; mientras que para un eFG de 67,4 mL/min * 1,73/m2, el valor de albuminuria fue de 351,4 mg/24 h: un aumento de 15 veces respecto al valor inicial. Para un eFG de 27,31 mL/min * 1.73/m2, la albuminuria fue de 684,11 mg/24 h, un aumento (casi) del 30 %.
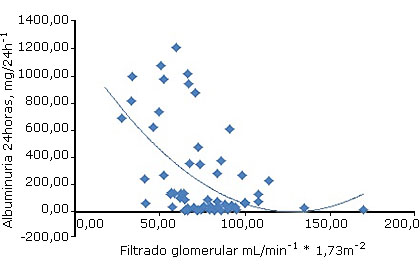 Fuente: Elaboración del autor según los resultados del estudio.
Fuente: Elaboración del autor según los resultados del estudio.Figura 4 Asociación entre la albuminuria estimada de 24 horas y el filtrado glomerular.
La tabla 3 muestra la asociación entre el filtrado glomerular y la excreción urinaria de las proteínas estudiadas. Los valores patológicos de proteinuria/albuminuria se concentraron en los pacientes con eFG < 60 mL/min * 1,73/m2. La relación entre el eFG disminuido y la excreción patológicamente elevada de las proteínas en la orina fue significativa (p < 0.05; prueba de independencia basada en la distribución ji-cuadrado).
Tabla 3 Relación entre el filtrado glomerular (estimado de la ecuación MDRD) y la excreción de proteínas en la orina.

§ p < 0.05
Fuente: Elaboración del autor según los resultados del estudio.
Las figuras 5 y 6 muestran la relación entre la tasa de excreción de la sustancia de interés (proteinuria/albuminuria), el filtrado glomerular, y el tiempo de evolución de la enfermedad. A medida que se prolongó el tiempo de evolución de la enfermedad lúpica, la tasa de excreción de la sustancia aumentó linealmente. Los pacientes con más de 60 meses de evolución mostraron valores de proteinuria mayores que 1,0 g/24 h y de albuminuria mayores que 400 mg/24 h. Por el contrario, el filtrado glomerular se mantuvo estable, en un valor promedio de 80 mL/min * 1,73/m2 SC en cualquier momento de la evolución de la enfermedad lúpica.
 Fuente: Elaboración del autor según los resultados del estudio.
Fuente: Elaboración del autor según los resultados del estudio.Figura 5 Relación entre la proteinuria de 24 horas, el filtrado glomerular, y el tiempo de evolución de la enfermedad lúpica.
La frecuencia de valores anormalmente elevados de proteinuria de 24 horas, es decir, mayores que 0,15 g/24 h en los distintos momentos de evolución de la enfermedad fue hasta los 12 primeros meses de evolución de 25,0 %; entre 13 y 60 meses de evolución, 38,9 % y más de 60 meses, 79,3 %.
La frecuencia de valores anómalos de albuminuria mayores que 30 mg/24 h en los distintos momentos de evolución de la enfermedad hasta los 12 primeros meses de evolución fue 53,8 %; entre 13 y 60 meses de evolución, 50,0 % y más de 60 meses, 82,7 %.
Discusión
Este trabajo ha discutido los beneficios de incluir la proteinuria de 24 horas (tal y como se estima a partir de la RPC) dentro del protocolo de diagnóstico de la nefropatía lúpica. Los valores aumentados de la proteinuria de 24 horas se asociaron a un eFG disminuido. Igualmente, los valores aumentados se observaron en aquellos enfermos con largo tiempo de padecimiento de la afección lúpica, y el comportamiento de la albuminuria de 24 horas fue similar en todo momento: un indicador relevante del daño renal. Estos resultados son más significativos por cuanto el filtrado glomerular falló como indicador para revelar la importancia del tiempo de evolución de la enfermedad sobre la función renal.
Otros trabajos han explorado el comportamiento del daño glomerular en el LES, de acuerdo con las recolecciones de orina de 24 horas. Polanco y otros (2013) encontraron valores preservados de creatinina sérica en el 63 % de los pacientes diagnosticados de LES, cuando el 68 % de ellos presentaba proteinuria patológica.22
Si bien la colección de 24 horas es el estándar de oro en el estudio de la excreción urinaria de una sustancia,23 las dificultades inherentes en la obtención de volúmenes adecuados de orina han causado, en parte, la exclusión de estas determinaciones de los protocolos de seguimiento del LES.24,25 Los índices de excreción de una sustancia se han empleado como una solución intermedia,26-28 aun cuando su interpretación correcta encuentra todavía dificultades.29-31
Este estudio se aparta de los estudios precedentes basados en la recolección de orina de 24 horas ya que propone una ecuación predictiva de la proteinuria de 24 horas en pacientes lúpicos basada en el índice de excreción de la sustancia de interés y en el conocimiento de la creatinina sérica, y amplía así los resultados antes publicados10) a la validación clínica de los distintos modelos de predicción de la excreción urinaria de una sustancia a partir del índice de excreción La proteinuria de 24 horas (y por extensión, la excreción urinaria de cualquier sustancia) puede estimarse con una exactitud mayor o igual que 80 %) a partir de la RPC y una vez que esta relación se ajusta según las propiedades antropométricas del sujeto o, como en este estudio, según el sexo, la edad, el color de la piel y la creatinina sérica; la RPC se convierte en una alternativa interesante para la recolección de orina con el objetivo de estudiar la función renal.
La lógica indica que el tiempo de evolución de la enfermedad lúpica incrementa el riesgo de aparición de daño renal. La nefritis lúpica se desarrolla habitualmente dentro de los primeros 36 meses de la enfermedad y es causa de muerte en la tercera parte de los pacientes,3-6,8) por eso se recomienda controlar cada 3 meses la nefropatía lúpica en los pacientes con LES activo mediante análisis para determinar la proteinuria de 24 horas empleando la ecuación predictiva desarrollada en esta investigación.
Conclusiones
En este estudio tanto la albuminuria como la proteinuria de 24 horas pronosticadas a partir de los respectivos índices de excreción indican la existencia de nefropatía concurrente entre los pacientes con LES de larga evolución. Estos modelos abren un amplio campo de posibilidades para el mejor seguimiento del enfermo, así como para identificar tempranamente el padecimiento y llevar a cabo el tratamiento apropiado de las complicaciones de la afección lúpica.
Se han tomado todas las medidas para que la exactitud tanto de la proteinuria como de la albúmina como indicadores pronósticos de la nefritis lúpica sea mayor que el 80 %. No obstante, la nefropatía lúpica se ha diagnosticado en presencia de proteínas en la orina en cantidades cuantificables, y no de una biopsia renal. A fin de validar la ecuación predictiva aquí empleada, la nefropatía lúpica debería diagnosticarse independientemente mediante la correspondiente biopsia. También sería interesante investigar la relación que tiene la proteinuria de 24 horas con la cistatina C como indicador de daño glomerular como se ha pronosticado aquí.