Introducción
Las miopatías inflamatorias idiopáticas (MII) son un grupo raro de trastornos musculares autoinmunes heterogéneos que atacan tanto a los niños como a los adultos. Afectan principalmente los músculos con debilidad, aunque pueden aparecer manifestaciones musculares adicionales que dañan la piel, las articulaciones, los pulmones o el corazón, debido a la naturaleza sistémica inflamatoria de estas enfermedades.1
Utilizando los recientes criterios de clasificación de la European League Against Rheumatism / American College of Rheumatology, las MII se pueden clasificar en los siguientes subgrupos: polimiositis, miositis por cuerpos de inclusión (IBM), dermatomiositis, dermatomiositis amiopática, dermatomiositis juvenil y miositis juvenil que no sean dermatomiositis juvenil.2 La miopatía necrotizante inmunomediada es una entidad clínica distintiva recientemente reconocida definida principalmente por necrosis muscular mediante la biopsia con poco infiltrado inflamatorio; sin embargo, debido a los pequeños tamaños de las muestras estudiadas se ha incluido en el subgrupo de la polimiositis.3
La dermatomiositis y la polimiositis son formas tratables de MII y generalmente se presentan con debilidad de la extremidad proximal, con manifestaciones cutáneas distintas en el caso de la dermatomiositis. La miositis por cuerpos de inclusión es la MII más común por encima de los 50 años y se caracteriza por una debilidad muscular progresiva en los músculos proximales y distales sin ningún tratamiento eficaz hasta hoy.4
Aunque los métodos de imágenes aún no se han introducido en los criterios de clasificación de la miositis, el uso de imágenes musculares en la evaluación de las MII ha crecido a lo largo de los años. Las diferentes técnicas de imagen han demostrado ser útiles, pero la resonancia magnética (RM) sigue siendo el estándar de oro para la imagen muscular.
Mediante la RM se puede visualizar de manera sensible la distribución de la afectación muscular, tanto los cambios de actividad como el daño. Las secuencias de recuperación de inversión de tau corta o ponderada en T2 con supresión grasa son muy sensibles para la detección del edema muscular o facial, que se muestran como áreas hiperintensas en la imagen de RM.
Las imágenes ponderadas en T1 son útiles para detectar la infiltración grasa del músculo, y el remplazo de grasa conduce a un aumento de la intensidad intramuscular. Sin embargo, estos cambios no son exclusivos de la miositis y pueden verse en otras afecciones como trauma y rabdomiólisis. Los inconvenientes de la RM consisten en que es un procedimiento costoso, requiere mucho tiempo, no está ampliamente disponible y es difícil de obtener en los pacientes con implantes metálicos o marcapasos.
Una alternativa rentable a la resonancia magnética es el ultrasonido. Los avances en la tecnología de ultrasonido han permitido el desarrollo de nuevas técnicas para analizar la inflamación muscular. Se han realizado una variedad de estudios para evaluar el potencial del ultrasonido como herramienta para el diagnóstico y el seguimiento de la miositis.
Ultrasonido muscular
La ecografía es una modalidad no invasiva que permite obtener imágenes en tiempo real con alta resolución espacial. Es fácil de aplicar en el entorno clínico y prácticamente no tiene contraindicaciones para el paciente.5 Su utilidad es creciente para la evaluación de tejidos blandos y actualmente se usa en un amplio espectro de subcampos médicos.
El tejido muscular sano, cuando se ve en sección transversal, es relativamente hipoecoico. Se cree que esto es el resultado de una alta profusión de sangre en el tejido muscular. Muestra un patrón moteado, moderadamente ecogénico, causado por los reflejos del tejido conectivo perimisial.5 En el plano longitudinal, los reflejos del tejido conectivo perimisial dan como resultado un patrón lineal, pennate o triangular.
El epimisio, una vaina de tejido elástico fibroso que rodea al músculo, aparece hiperecoico (o blanco) en la ecografía. Esto facilita la discriminación del tejido muscular de los tejidos circundantes. Los huesos y depósitos de calcio muy densos, que reflejan todas las ondas de ultrasonido, aparecen blancos o hiperecoicos con sombreado acústico posterior.
Cuando el músculo se vuelve anormal, se pueden ver varios cambios estructurales. Con afecciones que causan remplazo de grasa y fibrosis, el músculo se vuelve más blanco como resultado de un aumento en el número de superficies reflectantes dentro del músculo.
Dependiendo de la gravedad, el eco óseo subyacente puede reducirse o estar ausente. Esta observación fue descrita por primera vez por Heckmatt y otros en 1980,6 quien más tarde propuso una escala de cuatro puntos para clasificar la intensidad del eco reflejado desde el músculo que se conoce actualmente como el criterio de Heckmatt: grado 1, normal; grado 2, aumento del eco muscular, mientras el hueso aún es distinto; grado 3, aumento marcado en el eco muscular y eco óseo reducido; grado 4, eco muscular muy fuerte y pérdida completa del eco óseo. Además, los cambios en el grosor muscular también pueden ocurrir en los músculos afectados y se pueden medir con un calibrador digital.
El objetivo de esta revisión es ofrecer una visión general de las diferentes técnicas de ultrasonido que se han estudiado y proporcionar información a los reumatólogos sobre el papel actual del ultrasonido en el campo de las MII.
Desarrollo
Existen diversos factores que pueden influir en la medición de los parámetros musculares. Primero, es importante estandarizar la configuración de la máquina, el plano de visión y la posición del paciente, ya que estos pueden afectar la medición de la intensidad del eco y el grosor muscular. Convencionalmente, se utiliza una sonda de ultrasonido lineal con suficiente frecuencia (al menos 6-12 MHz) para obtener imágenes del músculo esquelético periférico.
Debido a las diferencias en la composición estructural del tejido muscular, las intensidades de eco de los músculos sanos pueden diferir entre los grupos musculares y, por lo tanto, lo mejor es comparar las intensidades de eco entre los mismos grupos musculares.
Además, la intensidad del eco muscular muestra un ligero aumento con la edad y tiende a ser mayor en las mujeres que en los hombres.7,8 Este efecto está asociado con el remplazo de tejido contráctil por otros tejidos como la grasa. Asimismo, el grosor muscular es mayor en los hombres que en las mujeres y parece disminuir gradualmente con la edad,8 y también se relaciona con el peso y el uso del músculo, como la diferencia entre la mano izquierda o derecha, por ejemplo.
Hay alguna evidencia de que el grosor más alto de la grasa subcutánea conduce al aumento de la intensidad del eco, que se cree que se debe al aumento de la grasa intramuscular asociada.9
Un último factor es que la contracción muscular y el estado posterior al ejercicio están asociados con un aumento de la ecogenicidad y el tamaño muscular.10,11,12
Cambios en la calidad muscular
Atrofia e inflamación
Se pueden observar varios cambios estructurales en los músculos patológicos. Los cambios musculares crónicos como la atrofia y la infiltración de grasa se discriminan más fácilmente que las manifestaciones agudas como el edema y la inflamación.
La atrofia muscular que se asocia con una disminución del parénquima muscular conduce a un aumento en la intensidad del eco muscular que hace que el músculo parezca más pequeño y más blanco en la imagen.6,7 La atrofia también se puede apreciar comparando el músculo atrófico con una extremidad contralateral o un músculo sano adyacente.
En cambio, la atrofia muscular bilateral leve o la afectación más difusa que se puede observar en la miositis podría ser difícil de detectar. Pero el remplazo de grasa en la inflamación muscular crónica también produce un aumento de la intensidad del eco muscular.
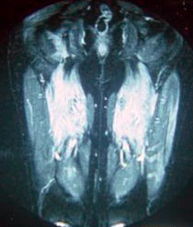
La inflamación muscular aguda se caracteriza histopatológicamente por infiltraciones perivasculares, endomisiales o perimisiales de las células inmunes.13 Sorprendentemente, parece que la inflamación muscular aguda también conduce a un aumento de la intensidad del eco, incluso cuando todavía no se esperan cambios estructurales en el tejido muscular (Fig. 1).14 Algunos estudios explican este aumento en la intensidad del eco como el resultado de una combinación de la inflamación aguda con el edema acompañante.15
Sin embargo, algunos estudios sugieren que el edema muscular que aparece histopatológicamente como tejido conectivo peri- y endomisial suelto (Fig. 2) se muestra en la imagen como fibras musculares inflamadas, con un aumento del grosor muscular y una disminución en la intensidad del eco muscular.14 Como la literatura actual es ligeramente contradictoria en este aspecto, el edema intramuscular aún no se caracteriza tan bien como en la resonancia magnética y necesitará más estudios.
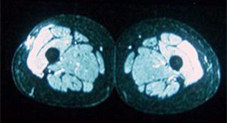
Fig 2 Polimiositis: aumento de intensidad de señal en algunos grupos musculares en corte transversal.14
Otras afecciones musculares
Otros cambios patológicos en el tejido muscular, como contusiones y desgarros musculares, también se pueden visualizar adecuadamente. Las contusiones musculares aparecen como lesiones circunscritas con ecogenicidad anecoica o mixta.16 La presencia de sangre coagulada y edema da como resultado una ecogenicidad más mixta que un hematoma completamente licuado.
El sangrado intersticial con fascículos intramusculares dislocados, comúnmente causados por una lesión por estiramiento, se observa como un aumento difuso en la ecogenicidad muscular y un aumento en el tamaño muscular en la imagen.16
Apariencia de la rotura muscular
Puede variar desde áreas sutiles poco ecogénicas con hinchazón y disrupción ultraestructural local, hasta la pérdida completa de la integridad muscular longitudinal, dependiendo de la gravedad de la lesión. La evaluación de la brecha dentro de las fibras musculares puede estudiarse dinámicamente utilizando la contracción muscular activa y el movimiento pasivo, lo que puede ser útil para decidir el manejo operativo.
El tejido cicatricial generalmente se forma después de lesiones musculares más graves y se visualiza como un área hiperreflectiva, a veces rodeada por una zona de menor reflectividad. La rabdomiólisis o necrosis del músculo esquelético se aprecia en el músculo como miofibrillas engrosadas con pérdida del patrón del músculo estriado y áreas regionales de mayor intensidad de eco.17
Los exudados pueden rodear el tejido muscular necrótico y aparecer como bolsas hiporreflectantes. La apariencia heterogénea no es muy específica y puede confundirse fácilmente con otras anomalías musculares como los hematomas subcutáneos e intramusculares. Las calcificaciones son fácilmente detectables como estructuras altamente ecogénicas con sombreado acústico posterior.13
Los estudios fisiológicos y dinámicos también se pueden emplear para evaluar las propiedades fisiológicas de los músculos y estos se usan con mayor frecuencia en el campo de la medicina deportiva o la fisioterapia.8 Los parámetros medidos con frecuencia comprenden el grosor muscular, el ancho y el área de la sección transversal, que comúnmente se miden antes y después de una intervención.
Durante la contracción, el músculo aumenta en tamaño de sección transversal y disminuye longitudinalmente, mientras que la intensidad del eco aumenta a medida que los haces musculares se engrosan. También se puede observar un aumento en el ángulo de penetración de las fibras musculares durante la contracción muscular.18
En el caso del daño muscular inducido por el ejercicio que causa dolor se ha observado un aumento en el área transversal del músculo, que se cree que se debe al edema muscular. Además, puede haber un aumento en la intensidad del eco del músculo, y el ángulo de penetración de las fibras dañadas es mayor.18
Estudios ultrasonográficos en las miositis
La intensidad del eco es el principal parámetro de resultado para la mayoría de los estudios de ultrasonografía en MII. En 1989, Heckmatt y otros introdujeron un método para cuantificar la medición de la intensidad del eco muscular mediante la determinación de una región de interés del tejido muscular y calcular la escala de grises media dentro de esta región de interés.19 Este método ahora se usa comúnmente en el campo de la investigación, además del análisis subjetivo solo.
El beneficio de esta forma cuantitativa de análisis es que depende menos de la subjetividad y la experiencia del operador en comparación con la interpretación visual. Esto hace que los resultados sean más comparables y objetivos.20
Además, la medición cuantitativa tiende a alcanzar una mayor sensibilidad que el análisis subjetivo, ya que puede detectar una intensidad de eco anormal en los músculos donde los cambios en la imagen de ultrasonido convencional son sutiles.21
Es importante tener en cuenta que los valores de intensidad de eco de diferentes máquinas no son directamente comparables debido a las influencias específicas del sistema en los valores de la escala de grises. El requisito para el uso del análisis cuantitativo con fines de diagnóstico es que estén disponibles valores de referencia específicos de hardware y software de músculos sanos.20
Dermatomiositis y polimiositis
En la ecografía, los músculos afectados por dermatomiositis y polimiositis manifiestan intensidades de eco más altas que los músculos sanos.
La intensidad del eco parece aumentar con una mayor duración de la enfermedad debido a una mayor atrofia y remplazo de grasa en los músculos.22 También puede normalizarse después del inicio del tratamiento, paralelamente a la mejora en la condición clínica.23 Un estudio reciente con pacientes con dermatomiositis y polimiositis en su mayoría evidenció que los hallazgos se correlacionan bien con la actividad de la enfermedad.24Stonecipher y otros han descrito un aumento en la intensidad del eco de los músculos deltoides, bíceps y tríceps en pacientes con dermatomiositis, incluso cuando las enzimas musculares eran normales.25
Como las enzimas musculares normales pueden verse en la dermatomiositis a pesar de la enfermedad activa, esto sugiere que un ultrasonido positivo puede indicar, en presencia de un nivel normal de creatina quinasa, una enfermedad subclínica, pero también clínicamente manifiesta.
Uno de los primeros estudios de Reimers y otros trataron de correlacionar las imágenes con los hallazgos histopatológicos en la biopsia muscular.13 Su estudio mostró que los músculos en la dermatomiositis y polimiositis con edema histopatológicamente probado eran significativamente menos ecogénicos que aquellos sin edema, mientras que el grosor muscular fue mayor en las personas con edema, lo que puede deberse a la inflamación de las fibras.7 Además, los músculos con infiltración de grasa tenían intensidades de eco más altas y menor grosor muscular, lo que apuntaba a atrofia concurrente.
Ha habido una notable alteración de la intensidad del eco del músculo con cambios en la angulación de los transductores en la dermatomiositis aguda. Los autores han pensado que esto se relaciona con la atrofia perifascicular, aunque este efecto también se ha descrito en músculos sanos.13
También se sabe que el tamaño muscular se altera en pacientes con dermatomiositis y polimiositis. Parece que la miositis aguda se asocia con un tamaño muscular normal o una ligera inflamación muscular, mientras que la miositis crónica se presenta con un espesor disminuido debido a la atrofia relacionada.13Maurits y otros también hallaron una disminución del grosor muscular en la dermatomiositis y polimiositis en comparación con los controles normales.8
Kim S, Chi-Fishman y otros estudiaron el diámetro muscular durante la contracción en 9 pacientes que padecían principalmente de dermatomiositis y polimiositis.26 Su estudio mostró que los cambios inducidos por la contracción en el diámetro muscular del recto femoral son más pequeños en los músculos afectados por la miositis en comparación con los músculos sanos.
El grosor fascial también se puede medir con ultrasonido, y también se ha descrito un engrosamiento notable de la fascia deltoidea en pacientes con dermatomiositis y polimiositis, que apunta a la fascitis.27
Dermatomiositis juvenil
Similar a lo que ocurre con la dermatomiositis en los adultos, la ecogenicidad muscular es mayor en los músculos afectados de pacientes con dermatomiositis juvenil que en los controles sanos. Collison y otros, en un estudio retrospectivo, demostraron que después de un promedio de 10 años después del inicio de los síntomas, 6 de 10 pacientes con dermatomiositis juvenil aún tenían una mayor ecogenicidad en al menos un grupo muscular, a pesar de que se sometieron a tratamiento y se creía que estaban en remisión, lo que indicaba la existencia de una posible fibrosis residual con cambios en estos grupos musculares.28
Habers y otros observaron en un estudio prospectivo que la intensidad del eco aumentaba en los primeros 3 meses después del inicio del tratamiento en la dermatomiositis juvenil antes de que se normalice, mientras que el grosor muscular disminuyó en el primer mes después del inicio del tratamiento.14 Se presume que este efecto es el resultado de la reducción del edema, que tendría un efecto de disminución en la intensidad del eco.
Bhansing y otros evidenciaron que la intensidad del eco muscular fue capaz de discriminar entre alta y baja actividad de la enfermedad en la dermatomiositis juvenil.29 Se encontró una correlación significativa entre la intensidad del eco, la escala de evaluación de miositis infantil y los niveles de enzimas musculares. Esto ilustra que podría ser una herramienta útil y ventajosa en el seguimiento de la dermatomiositis juvenil, por su facilidad de uso con los niños.
Miositis por cuerpos de inclusión
La intensidad del eco es mayor en los músculos afectados por la IBM y parece seguir un patrón específico de afectación muscular que puede ser bastante característico.29
En un estudio con 6 pacientes de IBM, encontraron intensidades de eco más altas del flexor profundo de los dedos (FDP) en la IBM en comparación con pacientes de polimiositis y dermatomiositis, mientras que el flexor cubital del carpo permaneció notablemente inalterado.30
Mostraron que la relación flexor profundo de los dedos / flexor cubital del carpo podría utilizarse potencialmente para discriminar entre estas enfermedades. Nodera y otros estudiaron los flexores de los dedos y el tríceps sural, y observaron una mayor intensidad de eco en el gastrocnemio que en el sóleo, lo que resulta en una sensibilidad del 72,7 % y 100 % de especificidad para la IBM, en comparación con la polimiositis, dermatomiositis.30
Un estudio más amplio exploró el patrón de afectación muscular en la IBM en comparación con la polimiositis y dermatomiositis normales y concluyó que el músculo flexor común profundo de los dedos, el gastrocnemio y el recto femoral eran los músculos que más discriminaban a la IBM cuando escaneaban siete grupos musculares.31 Un aumento heterogéneo de la intensidad del eco en los músculos afectados en casos graves también fue visto en la IBM, descritos como un patrón de “palomitas de maíz”.
El análisis de las imágenes por ultrasonido depende notoriamente de la subjetividad y la experiencia del operador. El análisis en la escala de grises es una técnica simple para cuantificar los resultados, pero depende en gran medida de los valores dependientes de la máquina y, por lo tanto, es difícil de comparar entre diferentes centros.
Por lo tanto, existe la necesidad de emplear nuevas técnicas para estos estudios con resultados universalmente comparables.20 Los avances tecnológicos han dejado espacio para nuevas modalidades para superar este desafío de cuantificación en la evaluación ecográfica de las MII.
Conclusiones
Aunque la resonancia magnética sigue siendo el estándar de oro para obtener imágenes musculares, tiene desventajas como su alto costo, requiere mucho tiempo, no está ampliamente disponible y es difícil de obtener en los pacientes con implantes metálicos o marcapasos.
La ecografía muscular es una herramienta próxima en la evaluación de los trastornos neuromusculares. Es fácilmente aplicable en diversos entornos clínicos, no tiene contraindicaciones y proporciona una alternativa rentable a otras modalidades de imágenes como la resonancia magnética.
Sin embargo, esta técnica depende en gran medida de la experiencia del examinador y en la actualidad se emplea principalmente en centros especializados. No obstante, es un instrumento factible, no invasivo, fácil de implementar y útil como un analizador de enfermedades musculares y como una herramienta de diagnóstico para las miopatías inflamatorias.