Introducción
La sarcoidosis es una enfermedad granulomatosa no caseificante, multisistémica, de causa desconocida, que compromete el pulmón y los ganglios linfáticos mediastinales entre el 90-95 % de los casos. También puede afectar otros órganos como las glándulas salivales, piel, ojos, hígado, bazo, corazón, huesos y sistema nervioso central. El compromiso torácico representa la principal causa de morbilidad y mortalidad.1
La sarcoidosis tiene una incidencia de 10 por cada 100 000 personas al año. La mayoría desarrolla la forma torácica, aunque solo la mitad presenta síntomas respiratorios. Resultan escasas las notificaciones acerca de las manifestaciones clínicas, epidemiológicas y las comorbilidades entre los caucásicos.2
El origen de la enfermedad se remonta a 1899, cuando Boeck dio el nombre a diversas lesiones sarcoidales benignas en las regiones extensoras de los miembros superiores de un paciente de 36 años. En el estudio microscópico se encontró la presencia de células epitelioides con un núcleo grande y pálido, asociado a algunas células gigantes que tenían apariencia de sarcoma, razón por la cual se le atribuyó la denominación de sarcoidosis, que se conserva hasta nuestros días.2
La frecuencia varía en las diferentes regiones geográficas, y se informa una incidencia de entre 5 a 40 casos por cada 100 000 habitantes por año, aunque es mayor en los países escandinavos y en la población afronorteamericana, pero es ligeramente más común en las mujeres.2,3
La causa resulta desconocida y se han implicado agentes infecciosos, polvos inorgánicos o sustancias orgánicas, así como fenómenos alérgicos por drogas medicamentosas. La enfermedad se caracteriza por una inflamación granulomatosa no necrotizante con acumulación de linfocitos T-CD4+ y monocitos en los tejidos afectados.
Su presentación clínica tiene una distribución mundial, con la participación de factores genéticos, y abarca una amplia gama de manifestaciones desde formas agudas y limitadas hasta el compromiso crónico con daño orgánico progresivo y la muerte. Afecta predominantemente a mujeres, con una distribución bimodal de 25-29 años y 65-69 años.1,2
La presentación clínica de la sarcoidosis depende de la extensión y la gravedad del órgano afectado. Varía desde la ausencia de síntomas hasta la aparición de insuficiencia de órganos. Los pulmones y los ganglios linfáticos intratorácicos son los órganos más afectados (más del 90 % de los pacientes); le siguen en orden de frecuencia la piel, los ojos, hígado, bazo y la sarcoidosis ósea. Otros órganos afectados, pero de menor frecuencia, son el sistema nervioso central y periférico (neurosarcoidosis) y la sarcoidosis cardiaca.3,4
El curso clínico de la sarcoidosis varía desde anormalidades radiográficas detectadas en un paciente asintomático hasta una enfermedad crónica progresiva refractaria al tratamiento. Puede presentarse de forma aguda o crónica con la posibilidad de remisión completa en las etapas iniciales de la enfermedad.
Su diagnóstico está dado por la correlación de datos clínicos, radiográficos, histopatológicos y la presencia de granulomas no caseosos en el material de biopsia de los órganos afectados excluyendo otras enfermedades granulomatosas.
La terapia inmunosupresora es la piedra angular en el tratamiento de la enfermedad y está indicada cuando hay evidencia de una enfermedad sintomática y progresiva o cuando están involucrados órganos vitales como el sistema nervioso, cardiovascular u oftalmológico.5
Caso clínico
Se presenta a un paciente masculino de 45 años de edad, raza blanca, sin hábitos tóxicos, que es referido por presentar edemas y dolor en ambos tobillos, nódulos subcutáneos en ambos miembros inferiores y síntomas generales como fatiga fácil y pérdida de peso. Se le realiza un examen clínico y se detecta en la radiografía de tórax un marcado ensanchamiento mediastinal determinado probablemente por linfoadenopatía hiliar bilateral (Fig. 1).
Al examen físico, se recogen como datos positivos la presencia de edema con predominio maleolar derecho, nódulos subcutáneos y eritema nudoso en ambos miembros inferiores. No presentaba síntomas respiratorios ni datos positivos al examen del aparato respiratorio. Se realizan pruebas funcionales respiratorias, cuyos resultados estaban dentro de los parámetros normales.
Los hallazgos de laboratorio mostraron, como dato significativo, linfopenia. Los marcadores de respuesta inflamatoria como la eritrosedimentación y la proteína C reactiva fueron negativos, así como la determinación del valor de anticuerpos anticitoplasma de neutrófilos (ANCA) y anticuerpos antinucleares (ANA) fueron normales. Se realizó estudio físico-químico de la orina donde se constató aumento de la excreción del calcio y aumento del índice calcio/creatinina, aunque no se detectó hipercalcemia. En el ultrasonido abdominal aparecieron imágenes de litiasis en ambos riñones. Se indicó un ecocardiograma con resultados en los parámetros normales.
Se realizó, además, ecografía de partes blandas del edema del miembro inferior izquierdo donde se informó imágenes de baja ecogenicidad redondeada, de aspecto nodular, por lo que se realizó biopsia, cuyo resultado determinó paniculitis, eritema nudoso, sin signos de malignidad.
En la radiografía posteroanterior y lateral del tórax se observó linfoadenopatía hiliar bilateral, pero no se identificó la presencia de infiltrados pulmonares ni fibrosis pulmonar (estadio I) (Fig. 1).
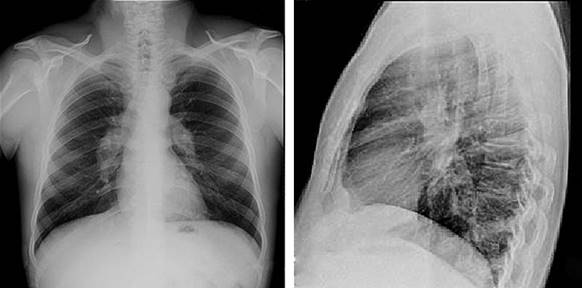
Fig. 1 Linfoadenopatía hiliar bilateral (estadio I). No se identifica la presencia de infiltrados ni fibrosis pulmonar.
En la tomografía axial (TAC) contrastada de tórax (ventana mediastinal) se apreció el ensanchamiento mediastinal, con presencia de múltiples adenopatías paratraqueales en el contorno superior derecho e izquierdo del mediastino y las regiones hiliares bilaterales (Fig. 2).
Se decide, entonces, realizar tomografía por emisión de positrones o PET-CT (positron emission tomography, por sus siglas en inglés) a partir de la reciente introducción de esta avanzada tecnología en nuestra institución, por lo cual este se convierte en el primer paciente estudiado por esta enfermedad con esta tecnología en el Centro de Investigaciones Médico Quirúrgicas (CIMEQ) en Cuba. Como resultados del estudio se informó que las imágenes de fusión obtenidas con la 18 fluorodesoxiglucosa (18F-FDG/PET-CT) revelaron áreas anómalas de hipermetabolismo glucolítico en el mediastino e hilios pulmonares. Todo ello apunta hacia el diagnóstico de un proceso inflamatorio localizado a ese nivel (Fig. 3).

Fig. 2 TAC contrastada de tórax (ventana mediastinal) donde se aprecia el ensanchamiento mediastinal con presencia de múltiples adenopatías paratraqueales en los contornos superior derecho e izquierdo del mediastino y las regiones hiliares bilaterales.
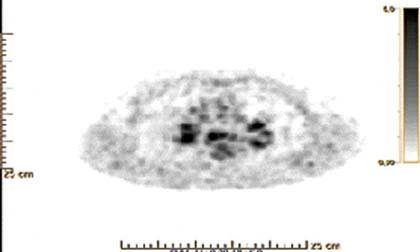
Fig. 3 Tomografía por emisión de positrones obtenida con la 18 fluorodesoxiglucosa (18F-FDG/PET-CT), donde se observa imágenes de fusión en el mediastino e hilios.
Se discute el caso en el colectivo médico con las especialidades de reumatología, medicina interna, medicina nuclear, imagenología y cirugía, y se arribó a la conclusión diagnóstica de que se trataba de un paciente con sarcoidosis pulmonar en estadio I, cuya expresión inicial fue a modo de un síndrome de Löfgren. Se discute, además, la conveniencia de realizar o no toracoscopía con toma de una muestra histológica por biopsia pulmonar para diagnóstico nosológico definitivo a partir de la información brindada por los estudios imagenológicos probados, particularmente mediante la PET-CT. La valoración del riesgo-beneficio ante la situación anatómica de las lesiones nos inducen a descartar este procedimiento invasivo.
Se establece el diagnóstico sobre la base de la tipicidad del cuadro y los hallazgos clínicos del paciente con un característico síndrome de Löfgren, e imágenes radiográficas simples que remedan la toma mediastinal de la sarcoidosis, los resultados del estudio tomográfico convencional contrastado y con la tecnología PET-CT, que si bien no confirma el diagnóstico positivo del tipo de proceso inflamatorio granulomatoso, no sugiere un proceso tumoral pulmonar maligno.6,7,8
El síndrome de Löfgren es un fenotipo clínico distintivo de sarcoidosis, descrito por vez primera por el neumólogo suizo Sven Löfgren en 1946. Las manifestaciones clínicas más frecuentes son las cutáneas (33 % de los pacientes). Otras manifestaciones pueden aparecer de forma insidiosa, aunque el síndrome típico aparece de forma aguda en sujetos jóvenes. El síndrome de Löfgren es un tipo agudo de sarcoidosis caracterizada por una triada: artritis, eritema nodoso y linfoadenopatía bilateral. Clínicamente aparece el eritema nodoso, la linfoadenopatía hiliar bilateral, poliartritis que suele ser migratoria, y en nuestro paciente como en otros casos se presenta en los miembros inferiores, particularmente en los tobillos y sin lesiones granulomatosas en piel.3,4
El genio epidemiológico, la anamnesis e historia familiar y personal, así como todos los estudios realizados no apoyan los diagnósticos diferenciales con otras entidades clínicas fundamentalmente granulomatosas. Se estudió particularmente granulomas sifilíticos, tuberculosis, beriliosis, silicosis, vasculitis ANCA asociadas, procesos neoplásicos malignos y linfomas.
Mediante una profunda evaluación del riesgo-beneficio, decidimos imponer tratamiento inmunosupresor con esteroides a dosis elevadas y seguimiento estrecho. Observamos una evolución muy positiva e inmediata desde el punto de vista clínico y radiográfico. Después de varias semanas de tratamiento se apreciaron los cambios con marcada mejoría hasta pasados 3 meses que constatamos prácticamente una casi desaparición de las imágenes (Fig. 4).
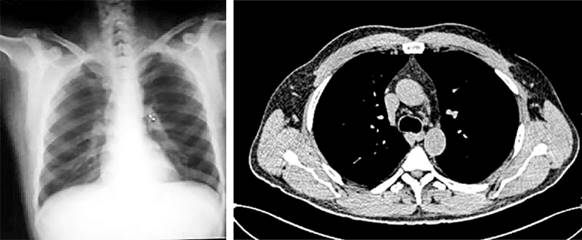
Fig. 4 Radiografía de tórax y TAC: Paciente con historia de sarcoidosis luego de 3 meses de tratamiento con drogas esteroideas. Se aprecia un discreto ensanchamiento hiliar con prácticamente la desaparición de las lesiones inicialmente halladas en la radiografía simple de tórax, la TAC y la 18F-FDG/PET-CT realizadas.
Discusión
En la sarcoidosis, el pulmón es el órgano más afectado (90 % de los casos). Si bien el diagnóstico es anátomo-patológico, en situaciones particulares como en el caso que nos ocupa se puede establecer sobre la base de hallazgos clínicos y radiográficos. Desde hace unos años se ha incluido una técnica de avanzada como el PET-CT, que aunque no sustituye a la histología, aporta información significativa para confirmar la existencia de un proceso inflamatorio no maligno.9,10,11,12
Nuestro grupo presentó este caso de un paciente masculino de 45 años. Las notificaciones internacionales muestran la incidencia entre 5 a 40 casos por cada 100 000 habitantes por año que alcanza un pico máximo a los 25-35 años. Un segundo pico de incidencia ocurre en las mujeres entre los 45-65 años de edad, lo que fluctúa a nivel mundial probablemente debido a diferencias en cuanto a la expresión de la enfermedad o los métodos de pesquisaje y seguimiento empleados.2,3
En nuestro estudio se presenta la enfermedad en un paciente sin síntomas respiratorios, donde se le detecta mediante la radiografía de tórax la presencia de linfoadenopatía hiliar bilateral, área que precisa de técnicas altamente invasivas y de difícil acceso para la toma por biopsia de muestras histológicas y que tienen un riesgo elevado. Se suma a ello que las formas clínicas de presentación son variables: a veces los pacientes resultan asintomáticos, con escasos síntomas, poco específicos o, como en nuestro caso, prevalecen los síntomas generales periféricos no respiratorios, aunque muestra, sin embargo, anormalidades radiográficas pulmonares. En más del 90 % de los individuos con sarcoidosis, hay afectación de los pulmones y el método más usado en primera instancia para detectar la enfermedad pulmonar sigue siendo la radiografía de tórax.5
Otras manifestaciones clínicas presentes en este paciente fueron las manifestaciones dermatológicas de la enfermedad. La denominada sarcoidosis cutánea afecta al 25-30 % de los casos. Estos desarrollan lesiones específicas como los granulomas, enfermedad microscópica como pápulas, placas, lupus pernio, cicatrices sarcoidóticas y otras raras como alopecia, parches hipopigmentados que responden bien a los corticoides. También se han hallado manifestaciones reactivas no específicas como el eritema nodoso,10,13 o algunas detectables por biopsia como se ha reportado y constatamos en nuestro paciente.14,15
En Brasil, Torquato y otros constataron que la participación cutánea resulta común y alcanza entre el 9-37 % de los casos con edad promedio de 49,6 años y predominio en personas blancas.16 La participación cutánea resulta común con una incidencia variable entre pacientes con sarcoidosis cutánea. Entre 1994 y el 2018 hallaron 72 casos con 74 % de prevalencia en mujeres, edad promedio de 49,6 años y de piel blanca 61 %.16
Se ha señalado que una serie de casos pueden desarrollar eritema nodoso, proceso que en el 55 % de los pacientes resulta de causa idiopática, si bien las causas pueden ser infecciosas, drogas, enfermedades sistémicas, malignidad, entre otras, incluida la sarcoidosis. La patogenia contempla los depósitos de inmunocomplejos en las vénulas del septum graso subcutáneo, que causa histopatológicamente una paniculitis neutrofílica clásicamente sin vasculitis. Puede resolver sin tratamiento, aunque en la práctica lleva tratamiento de soporte.14,15,17 En nuestro paciente realizamos biopsia con histología confirmatoria.
El conjunto de manifestaciones clínicas antes señaladas en nuestro paciente nos permitieron plantear el diagnóstico de sarcoidosis y su expresión a modo del síndrome de Löfgren con su triada clásica de eritema nodoso, artralgias y linfoadenopatía hiliar bilateral.7,11 Este síndrome puede resolver espontáneamente en algunos casos en 2 años, y suele afectar a jóvenes nórdicos. El HLA-DR3 se ha reportado en asociación con esta entidad en los países occidentales. Existen casos reportados en Japón, aunque existen diferencias en los haplotipos.9,10
Hutchinson fue el primero en reportar casos de sarcoidosis en 1877, aunque se consideraba que las lesiones de piel se debían a la gota. La asociación entre eritema nodoso y linfoadenopatía hiliar bilateral fue reconocida desde los años 40. En 1952 el clínico suizo Sven Löfgren describió por vez primera la triada usualmente con artritis de tobillos.10 El síndrome de Löfgren afecta a jóvenes entre 25-40 años, con un segundo pico entre 45-60 años más frecuente en las mujeres. En algunos estudios se hallaron discrepancias de si se trataba de una sola enfermedad o eran entidades diferentes.11
Otras manifestaciones presentes en este paciente y que coinciden con los reportes internacionales son el cuadro febril, la fatiga fácil y la pérdida de peso, síntomas constitucionales presentes en el 45 % de los pacientes afectados.13,18
Se detectó, además, la presencia de hipercalciuria en el estudio metabólico de la orina, que aparece en un tercio de los pacientes con sarcoidosis y cuyo mecanismo anormal está dado por la mayor producción de 1,25-hidroxivitamina D por el propio granuloma, lo cual estimula la absorción de calcio por el intestino y ocasiona hipercalcemia e hipercalciuria detectadas en los estudios realizados. Consideramos que la hipercalcemia e hipercalciuria fue la causa fundamental de la generación de la litiasis renal bilateral constatada en este paciente.6,19
La radiografía y la TAC son los métodos imagenológicos más comúnmente usados para detectar la afectación pulmonar. El compromiso intratorácico de la sarcoidosis está presente en el 97 % de los pacientes. El 87 % de los casos presenta adenomegalias intratorácicas y el 50 % infiltrados pulmonares. En nuestro paciente se aprecia la presencia de linfoadenopatía hiliar bilateral en un paciente clínicamente asintomático y compromiso paratraqueal derecho e izquierdo. Basados en los hallazgos radiográficos del tórax definidos por Siltzbach, este paciente se encontraba en un estadio I; o sea, la presencia de adenomegalias hiliares o mediastinales sin evidencia de enfermedad pulmonar (50 % de los pacientes).15,12 Este hallazgo también puede encontrarse en enfermedades infecciosas fúngicas o micobacterianas, neoplásicas, linfoma o secundarismo.
La PET-CT con fluorine 18 fluorodesoxiglucosa (18F-FDG) es una sensible herramienta en la evaluación de actividad inflamatoria de la sarcoidosis en cualquier órgano, aunque no se incluya entre los estudios estandarizados para realizar el diagnóstico en la práctica diaria. A nuestro juicio, probablemente la poca disponibilidad y alcance de esta tecnología y su elevado costo influyan en su menor utilización y estandarización diagnóstica para esta entidad clínica. No obstante, resultan crecientes las evidencias de su valor diagnóstico y del manejo terapéutico de estos pacientes, especialmente para caracterizar las lesiones, la guía dirigida para la toma de biopsias, así como para evaluar la reversibilidad de las lesiones como respuesta al tratamiento con drogas esteroideas, debido a que la captación del radiofármaco se encuentra aumentada en la enfermedad activa y puede disminuir con el tratamiento. La técnica permite evitar innecesarios procederes invasivos.20,21
Por último la PET-CT, cuenta con una sensibilidad del 91,7 %, según algunos estudios, y puede elevarse hasta el 100 % luego de excluir la participación de la piel.22,23,24
De todas formas, tiene sus limitaciones para establecer el diagnóstico definitivo en estas entidades, dado que las lesiones benignas pulmonares son metabólicamente activas y por ello indistinguibles del cáncer de pulmón.
La 18F-FDG/PET-CT parece tener un SUVmax más elevado para establecer el diagnóstico diferencial entre sarcoidosis y lesiones pulmonares benignas. Las lesiones inflamatorias y granulomas muestran una captación de moderada a alta del radiofármaco, aunque los granulomas parecen tener un valor más elevado. Esta información puede ayudar a establecer el diagnóstico diferencial entre ambos procesos.25,26
Al margen de las reconocidas limitaciones de los medios diagnósticos utilizados, las imágenes obtenidas incluido el 18F-FDG/PET-CT permitieron descartar otras importantes alteraciones que constituyen hallazgos atípicos y pueden estar presentes en el 25-30 % de los casos descritos en la literatura y que comprenden adenomegalias unilaterales o asimétricas, cavitaciones pulmonares, consolidaciones en el parénquima, opacidades en vidrio esmerilado, anormalidades de la vía aérea y derrame pleural, entre otros, todo lo cual nos sugería con mayor fuerza que se trataba de lesiones granulomatosas pulmonares por sarcoidosis.15,24,26,27
De manera particular, en los resultados de la tomografía por emisión de positrones realizada al paciente las imágenes de fusión revelan áreas anómalas de hipermetabolismo glucolítico en el mediastino e hilios pulmonares, pero tanto la intensidad como el patrón de captación de la 18-FDG resultaron inespecíficos y generalmente no son válidas para el diagnóstico inicial definitivo.
La gran mayoría de los pacientes con sarcoidosis presentan enfermedad estable o remisión completa. Esta última ocurre entre el 60-90 % de los casos con enfermedad en estadio I; entre el 40-70 % en estadio II; entre el 10-20 % en estadio III y de 0 % en estadio IV. El resto de los pacientes desarrolla enfermedad crónica caracterizada por fibrosis pulmonar y menos del 8 % muere por esa afección.24
En el orden terapéutico se ha señalado como tratamiento de elección, luego de las medidas generales y de sostén del paciente, así como sintomáticas, el uso de drogas inmunosupresoras. Se prefiere el empleo de esteroides de elección en dosis moderadas a alta sostenidas en ocasiones durante 6-12 meses. Un estudio mostró que el tratamiento con corticoesteroides fue administrado al 43,4 % de los 255 pacientes diagnosticados y agentes ahorradores de esteroides en 7,7 % de los casos. Un total de 111 pacientes (18,9 %) mostraron actividad al cierre del estudio, otro grupo tuvo remisión espontánea (83; 32,5 %) y 61 (10,4 %) tuvieron remisión con el tratamiento de esteroides. En tanto, 165 (28,1 %) evolucionaron a la cronicidad hacia la sarcoidosis torácica crónica.15
La evolución positiva al regresar paulatinamente las lesiones pulmonares a lo largo del tratamiento puede ser seguida mediante el uso de la PET-CT. El síndrome de Löfgren y la linfoadenopatía mediastinal se han evaluado como indicadores de buen pronóstico.15,23
Algunos autores señalan que el tratamiento debe estar basado en antiinflamatorios no esteroideos (AINE) y esteroides, los cuales han mostrado en algunas series una gran eficacia, aunque en algunos casos refractarios ha sido necesario el uso de drogas de segunda línea modificadoras como el metrotexate y terapia biológica anti-TNFa y anti-CD20.19,25
Conclusiones
Si bien la tecnología de avanzada 18F-FDG/PET-CT no resulta una prueba específica en el orden diagnóstico para pacientes con sarcoidosis, sí constituye una herramienta eficaz para descartar muchas lesiones pulmonares atípicas asociadas, determinar la distribución y localización de las lesiones para la toma eficiente de biopsia si fuera necesario, y el seguimiento y evolución terapéutica de los pacientes. En casos seleccionados como el que presentamos resultó de gran valor en la toma de decisiones y evitó la realización de técnicas diagnósticas altamente invasivas.















