INTRODUCCIÓN
El agua es esencial para la humanidad, por lo que su uso racional y el control de agentes contaminantes en los residuales de procesos industriales constituyen objetivos de la investigación científica. En particular, el tratamiento de los residuales líquidos antes de ser vertidos a los cuerpos de agua naturales para eliminar la mayor cantidad de contaminantes constituye una de las vías para evitar la contaminación ambiental.
Entre los métodos aplicados, la adsorción mediante materiales de bajo costo como las zeolitas, las tobas vítreas, las arcillas y bioadsorbentes constituyen una alternativa viable para la recuperación de iones metálicos (Albadarin et al. 2012; Batista 2016; Córdova 2015; Ghassabzadeha et al. 2010; Niboua et al. 2010; Keng et al. 2014).
Investigaciones en las que se han usado minerales activados (Machado-Infante, Ramírez-Caballero y Barajas-Meneses 2016) demuestran que en minerales la adsorción de hierro(II) a partir de soluciones acuosas se describe mediante la ecuación isoterma de adsorción de Langmuir y el modelo cinético de pseudosegundo orden. De igual modo, Vera-Alatrista (2006) demuestra la posibilidad del uso de la adsorción para disminuir la presencia de contaminantes en aguas residuales, entre ellos hierro(II).
La limpieza química de las calderas en las termoeléctricas constituye una fuente de residuales líquidos con alta concentración de metales, incluido el hierro(II).
Esta investigación tuvo el objetivo de analizar la capacidad de adsorción de la toba vítrea del yacimiento Magueyal de Santiago de Cuba, como adsorbente del hierro(II) del residual líquido que se genera durante la limpieza química de las superficies internas de las calderas en las termoeléctricas.
MATERIALES Y MÉTODOS
Características del mineral adsorbente
El mineral arcilloso, sin tratamiento previo o activación, inicialmente se sometió a trituración y clasificación, seleccionando la muestra con una granulometría de 0,25 mm. La caracterización química y superficial de este material se expone en investigaciones precedentes (Blanco-Flores et al. 2009; Fernández-Hechevarría et al. 2016). El mineral posee propiedades adsorbentes y se caracteriza por el alto contenido de óxidos de silicio y aluminio (Tabla 1).
En la etapa inicial se investigó la adsorción de iones hierro(II) en soluciones moduladas, preparadas usando sulfato de hierro(II) hexahidratado puro para análisis, con concentraciones similares a los residuales reales de la limpieza química en las termoeléctricas. El estudio incluyó la adsorción conjunta con iones cobre(II) para analizar su influencia en la remoción de iones hierro(II).
En la segunda etapa se analizó la capacidad de adsorción de la toba vítrea con la utilización de soluciones residuales reales obtenidas de la etapa de decapado ácido en una caldera, donde la concentración de iones hierro(II) fue de 5,1 g/L. Para disminuir la acidez de la solución se realizó un tratamiento con hidróxido de sodio hasta que el pH del residual fuese igual a siete unidades y la concentración de iones hierro(II) de 14,8 mg/L, superior al límite máximo permisible, según la norma NC 521: 2007.
Métodos de estudio cinético
Existen varios modelos matemáticos empíricos que permiten obtener los parámetros cinéticos de adsorción con los cuales es posible describir el fenómeno físico o químico que tiene lugar. Entre estos se encuentran: modelo de pseudoprimer orden, pseudosegundo orden, segundo orden y difusión intraparticular (Azizian 2004).
La adsorción en la interface sólido-líquido en un sistema perfectamente mezclado es descrita, generalmente, por las etapas siguientes:
Etapa 1. Difusión del soluto desde el seno de la fase líquida hacia la película líquida que rodea el adsorbente.
Etapa 2. Difusión a través de la película líquida que rodea las partículas del adsorbente.
Etapa 3. Difusión en los poros del adsorbente o difusión intraparticular.
Etapa 4. Adsorción en los sitios activos del material.
Se considera que la velocidad del proceso está controlada por las etapas 2 y 3, difusión externa y la difusión intraparticular, respectivamente.
Modelo de pseudoprimer orden (modelo de Lagergren)
Este modelo se usa frecuentemente para adsorbentes homogéneos y adsorción física, la velocidad de adsorción es proporcional a la concentración de soluto y está descrito por la ecuación (1).
Donde:
Modelo de pseudosegundo orden
En el modelo de pseudosegundo orden se asume que la velocidad del paso controlante puede estar dada por la quimisorción, que involucra la fuerza de valencia a través del intercambio de electrones entre el adsorbato y el adsorbente (Plazinski, Dziuba y Rudzinski 2013). El modelo está representado por la ecuación (2).
Donde:
Modelo de segundo orden
Este es un modelo muy utilizado en quimisorción sobre materiales altamente heterogéneos y está representado por la ecuación (3).
Donde:
Modelo de la difusión intraparticular
La velocidad de adsorción se determina usualmente con el uso del modelo de difusión intraparticular. Lo cual se logra graficando la cantidad de iones adsorbidos por peso unitario de adsorbente (qt), en función del tiempo (t). La adsorción en la interface sólido-líquido, en un sistema perfectamente mezclado, es descrita normalmente en tres pasos:
Paso 1: Difusión a través de la película que rodea las partículas del adsorbente, llamada también difusión externa.
Paso 2: Difusión en los poros del adsorbente o difusión intraparticular.
Paso 3: Adsorción en los sitios activos del material.
Se considera que la velocidad controlante de los pasos 1 y 2 viene dada por la transferencia de masa externa y la difusión intraparticular, respectivamente. El paso 3 generalmente es el más rápido de todos.
La constante de difusión intraparticular (superficie interna y difusión en el poro) puede ser calculada a través de la ecuación (4).
Donde:
Isotermas de adsorción
El estudio de adsorción puede realizarse mediante la identificación de la forma y la curvatura de las isotermas de adsorción y mediante su formulación matemática. La forma de las isotermas depende, en gran medida, del tipo de adsorbente y el adsorbato, por tanto, las mismas serán diferentes para cada tipo de estos.
Las isotermas de adsorción experimentales se dividen, por lo general, en seis categorías, según la clasificación de la IUPAC, pero solo se utilizan las cinco primeras (Figura 1).
Para el análisis de los datos experimentales se han desarrollado diversos modelos matemáticos, siendo los más utilizados el de Langmuir, Freundlich y Langmuir-Freundlich. Aunque existen otros modelos como el de Redlinch-Peterson, Toth, Tempkin, entre otros.
Isoterma de Langmuir
Este modelo considera que la superficie está idealmente limpia y homogénea. La adsorción ocurre en sitios específicos del adsorbente y todos son idénticos. Solo un adsorbato ocupa cada sitio y una vez formada la monocapa cesa la adsorción. El modelo puede ser descrito por la ecuación (5).
Donde:
Qads |
: cantidad de soluto adsorbido por peso unitario de adsorbente (mol/g). |
Nm |
: capacidad máxima de adsorción (mol/g). |
KL |
: constante de saturación (mol/L). |
Ceq |
: concentración del adsorbato en la disolución en el equilibrio (mol/L). |
Las características esenciales del modelo de Langmuir pueden ser expresadas en términos del factor de separación (RL), el cual está definido por la ecuación (6).
De acuerdo con el valor de RL la forma de la isoterma puede ser interpretada de la siguiente forma:
RL > 1: adsorción no favorable
RL = 1: adsorción lineal
0 < RL < 1: adsorción favorable
RL = 0: adsorción irreversible.
Isoterma de Freundlich
Este modelo fue establecido empíricamente y se basa en que la adsorción es de naturaleza física, no hay asociación de las moléculas adsorbidas y la superficie del adsorbente es heterogénea. Es un modelo útil para determinar la adsorción en soluciones líquidas, y riguroso para los casos que ocurren en superficies heterogéneas. El modelo clásico de Freundlich está descrito por la ecuación (7).
Donde:
Qads |
: cantidad de soluto adsorbido por peso unitario de adsorbente (mol/g). |
1/n |
: coeficiente de Freundlich (1<n<10). |
kF |
: constante de Freundlich (mol/g). |
Ceq |
: concentración del adsorbato en la disolución en el equilibrio (mol/L). |
Isoterma de Langmuir-Freundlich
El modelo de Langmuir-Freundlich es una combinación de los mismos, por lo que representa una adsorción mediante una combinación de mecanismos sobre materiales heterogéneos. La ecuación (8) describe este modelo.
Donde:
ANÁLISIS Y DISCUSIÓN DE LOS RESULTADOS
Estudio cinético del proceso de adsorción
El análisis de los resultados del estudio cinético de la adsorción mostró el incremento progresivo de la Qads hasta los 80 min en que se alcanza el equilibrio con 0,047 mg/L de hierro(II). La utilización de los modelos de pseudoprimer orden, pseudosegundo orden y segundo orden (Tabla 2) permitió comprobar que el proceso es descrito por el modelo de pseudoprimer orden, con un coeficientes de correlación (R2=0,9771) (Toor y Jin 2012).
El proceso de transferencia de hierro(II) desde la fase líquida a la sólida tiene lugar en tres etapas:
La difusión de los iones a través de la película líquida que rodea al adsorbente
La difusión intraparticular
La adsorción de los sitios activos.
Al ajustar el modelo de difusión lineal se comprobaron las etapas, como se muestra en la Figura 2, siendo la difusión a través de la capa de líquido que rodea al adsorbente la que limita el proceso.
Teniendo en cuenta este comportamiento representado en la primera y segunda zona lineal, difusión intraparticular y difusión a través de la película de líquido, respectivamente, son influyentes en la velocidad del proceso de remoción del hierro(II). Los parámetros cinéticos de las etapas del proceso se indican en la Tabla 3.
Isotermas de adsorción
Los resultados experimentales de la adsorción del hierro(II) en la toba vítrea (Figura 3) mostraron el incremento de la cantidad de soluto adsorbido por unidad de peso de adsorbente (Qads), en función de la concentración de los iones hierro(II), una vez alcanzado el equilibrio; dicho resultado es similar al descrito por la isoterma tipo II.
El análisis comparativo de los resultados experimentales con las ecuaciones isotermas de adsorción de Freundlich, Langmuir, Langmuir-Freundlich (Figura 4) demostró que la primera ecuación isoterma describe con mayor exactitud la adsorción de los iones hierro(II) en la toba vítrea del yacimiento de Magueyal.
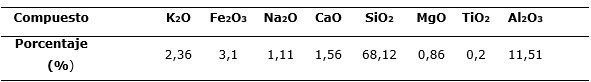
Figura 3 Isoterma de adsorción experimental de iones hierro(II) en el mineral de Magueyal en estado natural.
Los parámetros de cada modelo para la adsorción de hierro(II) en el mineral de Magueyal en estado natural se indican en la Tabla 4. Los mejores resultados se obtuvieron ajustando la isoterma de adsorción experimental a la de Freundlich, lo que indica que la adsorción tuvo lugar en una superficie heterogénea del adsorbente, siendo posible la adsorción de varias capas del adsorbato. El factor de separación (RL) calculado para el rango de concentración inicial del ión seleccionado para realizar el experimento alcanzó valores en el intervalo de 0 a 1, lo que demuestra que la adsorción de iones hierro(II) en la toba vítrea es adecuada.
Los resultados son similares a los obtenidos en las investigaciones para la adsorción de iones cobre(II) en las tobas vítreas del yacimiento de Magueyal (Garrudo 2013; Salazar y Pérez 2015) y en la adsorción en dióxido de silicio amorfo sintético (Prieto-García et al. 2012). Además, se determinó que la capacidad máxima de adsorción del mineral estudiado fue de 34,4 mg/g; siendo este un valor superior a los reportados para el carbón granular y la clinóptilolita e inferior en los casos de minerales modificados y al carbón activado.
Otro aspecto investigado en la eficiencia de recuperación de hierro(II) fue el efecto de la presencia de cobre(II) en la solución sintética, mediante la planificación de experimentos, considerando como variables independientes la concentración de cobre(II), la temperatura y la agitación. Se comprobó estadísticamente, con un nivel de confianza del 95 %, la influencia positiva de la concentración de cobre(II), mientras que el resto de las variables no son significativas; no así la combinación de los factores, siendo la de mayor influencia la combinación concentración de cobre(II) y la temperatura. La no influencia del cobre(II) en la remoción de hierro(II) es similar a otras investigaciones de remoción conjunta de iones metálicos (Alslaibi et al. 2014).
En la Tabla 5 se muestran los resultados de la remoción de hierro(II) en soluciones sintéticas y reales en la toba vítrea del yacimiento de Magueyal.
En las pruebas con soluciones reales para tiempos de contactos distintos, tal como se indica en la Tabla 5, se comprobó el incremento de la remoción de iones hierro(II) hasta alcanzar el 33,5 %, con respecto al tiempo de contacto. Estos resultados son similares a los obtenidos en la adsorción de iones hierro(II) cuando se utilizan soluciones sintéticas, lo que demuestra que la presencia de otros iones no afecta considerablemente la selectividad del adsorbente por los iones en estudio, en la solución residual real.
CONCLUSIONES
La cinética del proceso de remoción de los iones hierro(II) se describe por el modelo de pseudoprimer orden, siendo la difusión externa la etapa limitante.
La isoterma de adsorción experimental se corresponde con el tipo II y el mejor ajuste se logra con el modelo de Freundlich; se alcanza la máxima capacidad de adsorción de 34,4 mg/g, para los iones hierro(II).
Los resultados obtenidos en la remoción de iones hierro(II), mediante el método de adsorción con el empleo de la toba vítrea del mineral de Magueyal es adecuado, ya que se logra disminuir el impacto ambiental negativo del residual líquido producido en las calderas de las termoeléctricas durante la limpieza química de las mismas.














