INTRODUCCIÓN
El hidróxido de níquel(II) es un producto que se utiliza ampliamente en sistemas de almacenamiento de energía, entre los cuales pueden mencionarse las baterías recargables del tipo Ni-Fe, Ni-Zn, NiMH e ión litio (Chen et al. 1999; Sun et al. 2011; Chang et al. 2016).
Varios autores (Shin 1996; Benet et al. 2002; Fierro 2012) han reportado los requisitos de calidad del hidróxido de níquel(II) para su utilización en baterías recargables, algunos de los cuales se relacionan a continuación:
Forma de partículas: Esféricas
Fase mineralógica: Beta hidróxido de níquel
Densidad aparente: 1 400 kg/m3 a 1 700 kg/m3
Densidad compactada: 1 800 kg/m3 a 2 200 kg/m3
Área superficial específica: 20 m2/g a 88 m2/g
Uno de los métodos más empleados para la producción de hidróxido de níquel(II) a escala comercial es la precipitación química que se realiza a partir de una solución de sulfato de este metal, con el uso de un ión donador de amonio e hidróxido de sodio (Shin 1996; Ito et al. 1999; Olbrich et al. 2009; Zhang et al. 2009).
Con frecuencia se utiliza la solución de sulfato de níquel porque los iones sulfato facilitan la precipitación y reducen la cantidad de impurezas absorbidas en la superficie de las partículas de hidróxido de níquel (Chen et al. 1999).
El proceso puede efectuarse mediante coprecipitación del níquel y otras especies metálicas tales como: cobalto, manganeso y zinc, empleando soluciones de alta pureza (Ito et al. 2009; Olbrich et al. 2009; Van Bommel y Dahn 2009).
El grado de coprecipitación y las características químicas y físicas del producto obtenido dependen de las condiciones de síntesis empleadas: temperatura, pH, régimen hidrodinámico, concentraciones de reactivos, entre otras.
El pH y el tiempo de envejecimiento suelen ser decisivos en la fase mineralógica del compuesto que se obtiene, pudiendo precipitar el hidróxido de níquel(II) en algunos de sus polimorfos más importantes (Freitas et al. 2007): alfa, de fórmula química 3Ni(OH)2∙2H2O y beta de fórmula Ni(OH)2 (Kovalenko, Kotok y Bolotin 2016).
Se ha reportado, además, que la temperatura y la velocidad de agitación influyen en la forma de la superficie, el tamaño de partículas y la densidad compactada del hidróxido obtenido (Ito et al. 1999; Weiwei et al. 2015) y estas, a su vez, determinan el área superficial específica.
La concentración de amoníaco en el reactor tiene importante influencia en la cristalinidad, la forma y las densidades aparente y compactada del polvo resultante (Fierro et al. 2007; Fierro 2012). Con el amoníaco, se logra que la reacción de formación del hidróxido de níquel sea más lenta. Inicialmente se forma un complejo amoniacal de níquel, que luego se descompone gradualmente en la reacción con el hidróxido de sodio.
Las interrelaciones entre las condiciones de síntesis y las características de calidad descritas en los trabajos referidos anteriormente fueron obtenidas empleando reactivos y soluciones de alta pureza. El comportamiento con otros materiales de menor pureza pudiera ser diferente, en dependencia de sus características específicas.
El uso de materiales generados en etapas intermedias o residuales de procesos metalúrgicos para obtener hidróxido de níquel para baterías recargables no está muy extendido, pero adquiere cada vez más importancia ante la necesidad de contar con materias primas más baratas y reducir el impacto medio ambiental de los procesos.
La composición química de estos materiales puede ser compleja, con altas concentraciones de impurezas, que pudieran modificar las interrelaciones entre las condiciones de síntesis y las características del producto, con potenciales perjuicios para desempeño electroquímico.
Varios estudios reportan la obtención de hidróxido de níquel a partir de soluciones residuales de procesos de electrólisis (Benet et al. 2002; Fierro 2012) y utilizando las soluciones generadas a partir de baterías y catalizadores gastados (Yang et al. 2016). En estos casos, se realizó la separación de las impurezas hasta los niveles requeridos y luego se aprovecharon métodos de síntesis ya establecidos, tales como la precipitación química a partir de soluciones de sulfato de níquel (II), con la utilización de un ión donador de amonio e hidróxido de sodio (Shin 1996; Ito et al. 1999; Nie, Ma y Xi 2014).
El producto obtenido como resultado de estos procesos tuvo un desempeño electroquímico comparable con los alcanzados a partir de materiales de alta pureza, pero las condiciones de síntesis de cada uno de ellos fueron ajustadas en dependencia de las características específicas del material de partida empleado.
Un tratamiento similar pudiera ser aplicado al sulfuro de níquel, obtenido en una etapa intermedia del proceso de lixiviación carbonato amoniacal de minerales lateríticos, realizado en la Fábrica Ernesto Che Guevara, ubicada en Moa, Cuba.
El referido sulfuro es secado y parcialmente oxidado, luego se lixivia a presión atmosférica hasta lograr una solución de sulfato de níquel(II), que contiene menores cantidades de cobalto, hierro, cobre, manganeso, calcio, magnesio y amoníaco.
La solución así obtenida fue empleada por Cisneros, Leyva y Capote (2015) para evaluar, de manera preliminar, la obtención de hidróxido de níquel, con vistas a su posible uso en la producción de baterías recargables. Se determinó la influencia de parámetros tales como: temperatura, tiempo y pH en la eficiencia de precipitación de níquel, cobalto y manganeso, pero no se estableció la dependencia entre estos parámetros y las características físicas del hidróxido, de modo tal que permitiera seleccionar las relaciones más favorables para efectuar el proceso.
El presente trabajo tuvo el objetivo de evaluar el efecto de la temperatura, el pH, las concentraciones de reactivos y la agitación en algunas características físicas y químicas del hidróxido de níquel(II) obtenido mediante precipitación química, a partir de una solución de sulfato de níquel(II) que se produce durante la lixiviación del sulfuro de níquel resultante del procesamiento de minerales lateríticos con la tecnología Caron.
MATERIALES Y MÉTODOS
Materiales
Se emplearon soluciones de sulfato de níquel(II), generadas en la lixiviación del sulfuro de níquel de la Empresa Ernesto Che Guevara (Tabla 1), soluciones de hidróxido de amonio (25 %), hidróxido de sodio grado técnico (98 % de pureza). Se utilizó agua destilada para preparar las soluciones con las concentraciones previstas en el diseño de experimentos y para el lavado de las muestras de hidróxido de níquel(II).
Equipos
La instalación empleada para realizar las pruebas de obtención de hidróxido de níquel(II) estuvo compuesta por: un reactor de 8 L de capacidad, provisto de camisa de calentamiento, agitador de velocidad variable, termostato, medidor de pH y dos bombas peristálticas de flujo regulable.
Se utilizó el espectrofotómetro de absorción atómica (EAA), con llama y generador de hidruros, modelo SOLAR 929, UNYCAM, para la determinación de la composición química de los reactivos, materiales y productos obtenidos.
La identificación de las fases presentes en el producto precipitado se realizó por difracción de rayos x, a través del método de polvo en un difractómetro X'PERT3 de PANalytical con radiación de Cu y filtro de níquel.
Se empleó un equipo ASAP 2020 de la Micromeritics para el estudio de superficies, mediante la determinación de adsorción física (fisisorción) de nitrógeno por el método volumétrico. Se puntualizó la superficie específica por el método BET (Brunauer, Emmett y Teller).
Metodología
Se tomaron las cantidades especificadas de solución de sulfato de níquel y de hidróxido de amonio y se añadieron al reactor, regulando el flujo, de forma tal que se terminen de adicionar al mismo tiempo, formándose un complejo amoniacal de níquel. Tanto el complejo formado, como la solución de hidróxido de sodio, se añadieron continuamente al reactor usando bombas peristálticas, manteniendo constante el flujo del primero y variando el segundo en dependencia del pH. Una vez alcanzado el pH de trabajo se continuó agitando la mezcla durante el tiempo previsto para la prueba. La pulpa de hidróxido de níquel obtenida se filtró, separando el sólido (hidróxido de níquel) del licor remanente. Se lavó el hidróxido de níquel, utilizando agua destilada. El secado se realizó en estufa a 85 oC, durante 24 horas y el producto obtenido fue posteriormente molido en molino de bolas.
Programa de experimentos
Se planificó un diseño de experimentos factorial (Tabla 2), de un cuarto de fracción, a dos niveles con seis variables y cinco réplicas en el nivel medio, para un total de 21 pruebas. Los rangos de estudio de cada parámetro del proceso de síntesis se establecieron tomando como referencia el estudio preliminar realizado por Cisneros, Leyva y Capote (2015).
Tabla 2 Variables y niveles del diseño de experimentos
| Variable | Niveles | ||
| Mínimo | Máximo | Medio | |
| Temperatura, oC | 30 | 70 | 50 |
| pH, u | 9 | 13 | 11 |
| Concentración de Ni, g/L | 57 a 60 | 120 a 135 | 90 a 100 |
| Concentración de NH3, g/L | 185 a 190 | 235 a 250 | 210 a 220 |
| Concentración de NaOH, g/L | 220 a 230 | 250 a 270 | 235 a 240 |
| Velocidad de agitación, rpm | 265 | 500 | 382 |
Se mantuvieron constantes los siguientes parámetros, tomando en consideración las condiciones y resultados reportados por Cisneros, Leyva y Capote (2015).
Parámetro UM Valor
Tiempo: min 100
Relación molar NH3/Ni u 0,5
Se determinaron las siguientes propiedades químicas y físicas del hidróxido de níquel: composición química, fases mineralógicas presentes en el compuesto obtenido, área superficial específica, (ASE), por el método BET (ISO 18757: 2003) y densidad aparente, Da (ISO 23145-1(E) 2007).
El análisis estadístico de los resultados se realizó mediante el programa Statgraphics Centurion XV, con el cual se obtuvieron las ecuaciones de regresión que permitieron graficar el comportamiento de las diferentes características químicas y físicas del hidróxido ante los cambios en las condiciones de síntesis.
RESULTADOS
En la Tabla 3 y las Figuras 1 a 4 se muestran resultados obtenidos para los ensayos programados.
Tabla 3. Condiciones de precipitación y resultados
| Prueba | T | pH | cNi | cNH3 | cNaOH | Agit. | Ni | Da. 103 | ASE |
|---|---|---|---|---|---|---|---|---|---|
| No | oC | u | g/L | g/L | g/L | rpm | % | kg/m3 | m2/g |
| 1 | 30 | 13 | 57 | 185 | 260 | 500 | 59,13 | 0,83 | 134 |
| 2 | 30 | 9 | 57 | 235 | 220 | 500 | 55,19 | 0,76 | 32 |
| 3 | 70 | 13 | 135 | 185 | 260 | 265 | 59,10 | (…) | 114 |
| 4 | 50 | 11 | 96 | 210 | 240 | 382 | 54,61 | 0,87 | 76 |
| 5 | 30 | 9 | 57 | 185 | 220 | 265 | 46,77 | 0,93 | (…) |
| 6 | 70 | 9 | 57 | 185 | 260 | 265 | 57,99 | 0,18 | 81 |
| 7 | 70 | 13 | 57 | 185 | 220 | 500 | 60,65 | 1,16 | 58 |
| 8 | 30 | 13 | 135 | 185 | 220 | 265 | 53,86 | 0,77 | 125 |
| 9 | 50 | 11 | 96 | 210 | 240 | 382 | 54,21 | 1,03 | 81 |
| 10 | 70 | 9 | 135 | 235 | 220 | 265 | 55,33 | 0,40 | 88 |
| 11 | 30 | 13 | 57 | 235 | 220 | 265 | 51,10 | 0,88 | 98 |
| 12 | 50 | 11 | 96 | 210 | 240 | 382 | 53,76 | 0,69 | 78 |
| 13 | 70 | 13 | 135 | 235 | 220 | 500 | 55,52 | 1,01 | 56 |
| 14 | 30 | 9 | 135 | 235 | 220 | 265 | 57,83 | 0,66 | 52 |
| 15 | 50 | 11 | 96 | 210 | 240 | 382 | 51,40 | 0,87 | 65 |
| 16 | 70 | 9 | 57 | 235 | 220 | 500 | 55,90 | 0,18 | 87 |
| 17 | 70 | 9 | 135 | 185 | 220 | 500 | 55,21 | 0,43 | 87 |
| 18 | 30 | 9 | 135 | 185 | 220 | 500 | 56,21 | 0,55 | 32 |
| 19 | 30 | 13 | 135 | 235 | 220 | 500 | 51,34 | 0,72 | 83 |
| 20 | 50 | 11 | 96 | 210 | 240 | 382 | 53,66 | 0,85 | 81 |
| 21 | 70 | 13 | 57 | 235 | 220 | 265 | 55,94 | 0,77 | 127 |
T - temperatura; cNi- concentración de níquel; cNH3- concentración de hidróxido de amonio; cNaOH- concentración de hidróxido de sodio; Agit.- velocidad de agitación; Ni - contenido de níquel en el hidróxido; Da- densidad aparente; ASE- área superficial específica
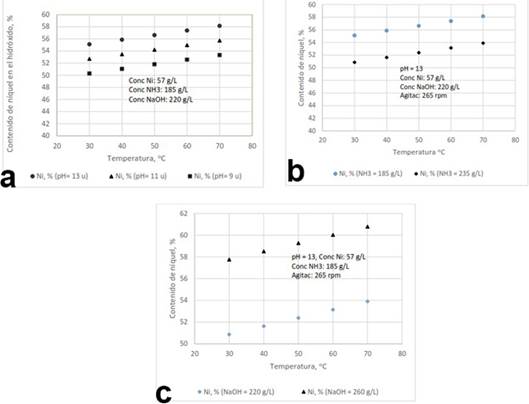
Figura 1 a) Relación del pH y la temperatura con el contenido de níquel en el hidróxido, b) Relación de la concentración de amoníaco y la temperatura con el contenido de níquel en el hidróxido y c) Relación de la concentración de hidróxido de sodio y la temperatura con el contenido de níquel en el hidróxido.
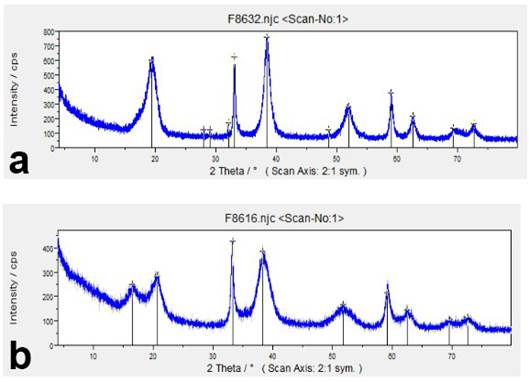
Figura 2 a) Difractograma de las muestras del grupo I. (pH = 11 y 13), b) Difractograma de las muestras del grupo II. (pH = 9).
DISCUSIÓN
Composición química
Al analizar el comportamiento del contenido de níquel en el hidróxido para las diferentes condiciones de síntesis se pudo constatar que este se incrementó con el aumento de la temperatura, el pH y la concentración de hidróxido de sodio (Figura 1 a, b, y c). Para todos los valores de pH estudiados, el contenido de níquel fue mayor en el producto sintetizado a temperaturas superiores, obteniendo los máximos valores a pH igual a 13, lo que corrobora los resultados obtenidos por Song y demás colaboradores (2002) para soluciones de sulfato de níquel de alta pureza.
Cuando se trabajó con concentraciones más bajas de amoníaco se obtuvieron contenidos superiores de níquel en el hidróxido, confirmando que se reduce la velocidad de formación del complejo amoniacal, lo que favorece la generación de hidróxido de níquel por la reacción entre el hidróxido de sodio y el níquel que no ha formado complejo.
La agitación y la concentración de níquel no tuvieron efecto significativo sobre el contenido de níquel en el hidróxido en los niveles estudiados.
Análisis por difracción de rayos x (DRX)
Los difractogramas del hidróxido obtenido en las pruebas muestran dos tipos bien definidos de comportamientos, el primero de ellos se ajusta al patrón característico de la teoprastita o beta hidróxido de níquel; el segundo grupo difiere del anterior por la presencia, además, de fases hidratadas de sulfato de níquel, como se muestra en la Figura 2.
Las diferencias esenciales de los dos comportamientos antes mencionados estuvieron vinculadas con el pH de precipitación: el primero de ellos correspondió a las pruebas realizadas con pH iguales a 11 y 13; el segundo grupo, a las pruebas realizadas con pH igual a 9.
Las principales fases detectadas se muestran en la Tabla 4. Se pudo constatar que solo en los niveles de pH igual a 11 y 13 se pudo obtener el polimorfo beta hidróxido de níquel, que es más estable para las baterías recargables.
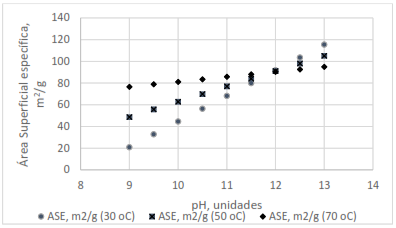
Área superficial específica (ASE)
La Figura 3 muestra que con el incremento del pH de síntesis aumenta el área superficial específica, probablemente porque se acrecienta la velocidad de nucleación, debido al aumento de la sobresaturación producto de la reacción química, con la consiguiente reducción de la velocidad de crecimiento y del tamaño de las partículas (Song et al. 2002).
Se observó que, con el incremento de la temperatura, el cambio en el área superficial específica fue menor, obteniendo los valores más altos a 30 oC. En las pruebas realizadas a pH 13 y a temperaturas inferiores se alcanzaron los valores superiores, que fueron iguales o mayores que 100 m2/g. El resto de los resultados estuvo en un rango entre 20 m2/g y 88 m2/g, acorde con lo reportado por otros autores (Krynitz, Naumann y Olbrich 1995; Shin 1996; Cabañas 2012), para un hidróxido de níquel, útil para baterías recargables.
La velocidad de agitación y las concentraciones de níquel, amoníaco e hidróxido de sodio no tuvieron influencia significativa en los rangos evaluados. Se observó, además, que a pH 12 se obtuvo un mismo valor de área superficial específica, lo que puede atribuirse a un compromiso entre las velocidades de nucleación y crecimiento de las partículas.
En general, el área superficial específica mostró una tendencia al incremento con el aumento del pH de síntesis, atenuándose este efecto para los mayores valores de temperatura. A pH igual 12 se logró un hidróxido de níquel(II) con área superficial específica en el rango requerido para su empleo en baterías recargables, independientemente de la temperatura empleada.
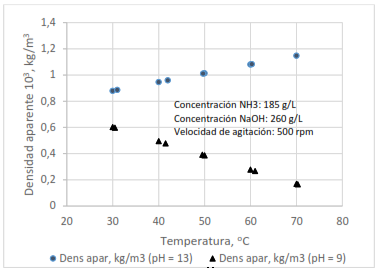
Densidad aparente
Como se muestra en la Tabla 3, para las diferentes condiciones evaluadas se obtuvieron densidades aparentes entre 0,18.103 y 1,16.103 kg/m3, los cuales se encuentran por debajo del valor 1,4.103 kg/m3, que es el mínimo requerido para el empleo del hidróxido de níquel en baterías recargables, según lo referido por varios autores (Shin 1996; Benet et al. 2002; Fierro 2012).
Al analizar la influencia de las diferentes condiciones de síntesis en la densidad aparente se constata que esta se favoreció con el incremento de la temperatura cuando se trabajó a pH 13, sin embargo, el comportamiento fue contrario cuando se trabajó a pH 9 (Figura 4). En este último caso, según los resultados del análisis de difracción por rayos x, el producto obtenido es una mezcla de hidróxido y sales hidratadas de níquel con menor densidad que el hidróxido, por lo que debe resultar una densidad final de partícula y aparente más pequeña. El mejor resultado se obtuvo en la prueba 7, realizada a 70 oC, pH 13 y velocidad de agitación igual a 500 rpm.
La densidad aparente está condicionada por el tamaño de partícula, distribución, forma, estructura y superficie reactiva. Un incremento en la irregularidad y la porosidad de los polvos disminuye la densidad. Polvos conformados por partículas esféricas son más densos (Milne 2015).
En este trabajo, los bajos valores de densidad aparente pudieran indicar la presencia de partículas de pequeño tamaño con formas irregulares, provocadas por la baja relación amoníaco/níquel empleada y/o insuficiente tiempo de residencia para la cristalización, por lo que será conveniente evaluar el efecto del incremento en estos dos parámetros sobre la densidad.
CONCLUSIONES
Para el proceso de precipitación de hidróxido de níquel a partir de soluciones acuosas del sulfuro de níquel, generado en la lixiviación carbonato amoniacal de minerales lateríticos, la temperatura, el pH y la agitación tienen un efecto similar a los resultados obtenidos con soluciones de níquel de alta pureza, lo cual influye positivamente sobre el contenido de níquel en el hidróxido, el área superficial específica y la densidad aparente. Asimismo, se obtiene beta hidróxido de níquel como fase mineralógica principal, que muestra valores satisfactorios en las propiedades estudiadas para su posible uso en las baterías recargables, a excepción de la densidad aparente.