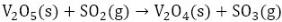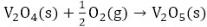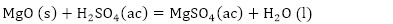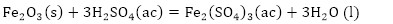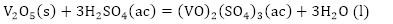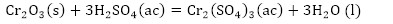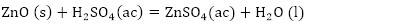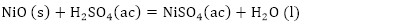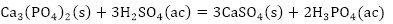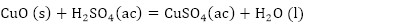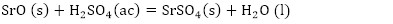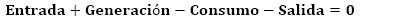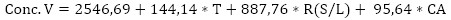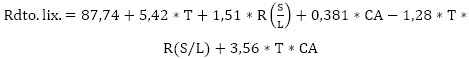INTRODUCCIÓN
En el proceso de producción de ácido sulfúrico por el método de contacto se utiliza un catalizador de pentóxido de vanadio (V2O5) soportado sobre sílice, el cual contribuye a la transformación del dióxido de azufre (SO2) en trióxido de azufre (SO3), debido a que la reacción (1) es muy lenta, fuertemente exotérmica (ΔHR = 189,24 kJ) y reversible (Baran 2017). La conversión del SO2 tiene lugar según las reacciones 2 y 3 (Pernett et al. 2016; Mohanty et al. 2011):
El catalizador de V2O5, al agotarse y salir de servicio, es obligatoriamente almacenarlo por tiempo indefinido, incrementándose los costos y la cantidad de residual almacenado (Alonso et al. 2008).
Las inversiones realizadas en Cuba para aumentar la producción de ácido sulfúrico en las plantas Rayonitro, de Matanzas y Comandante Pedro Soto Alba, de Moa (Anuario Estadístico 2019), traen como resultado un aumento en la cantidad de residuales catalíticos generados, los que se unen a los existentes en el país.
Se estima que existen almacenadas unas 900 t de estos residuales procedentes de la antigua fábrica sulfometales Patricio Lumumba, de Santa Lucía, Pinar del Río y de la Comandante Pedro Soto Alba de Moa, Holguín (Confinatorio Nacional 2018).
En las instalaciones de la Central Electronuclear (CEN) de Juraguá, en Cienfuegos, fue creado el Confinatorio Nacional de Desechos Peligrosos, por la seguridad que una instalación de ese tipo ofrece, debido al rigor y profundidad de los estudios que antecedieron a su construcción (ACN 2015), en el cual se pretende confinar los catalizadores agotados dada la ausencia de un procedimiento adecuado para su procesamiento.
Los catalizadores agotados contienen entre el 3 % y 10 % de V2O5, resultando una fuente importante de vanadio (≥ 1,68 % de V), metal estratégico del cual no se reportan yacimientos en Cuba; solo se reportan pocos depósitos en los que se encuentra concentrado, obtenido a partir de diferentes menas y residuales industriales (González 2012; Marinov y Paunova 2003).
Son numerosos los estudios relacionados con la recuperación de vanadio de catalizadores agotados mediante lixiviación, donde se evalúa la extracción utilizando diferentes agentes lixiviantes: ácidos, básicos y orgánicos (Erust et al. 2016).
El tratamiento mediante lixiviación ácida de los catalizadores agotados permite extraer el vanadio contenido en ellos, el cual puede ser recuperado posteriormente para su procesamiento o uso directo en la obtención de una aleación especial de vanadio o la confección de la carga aleante de un consumible de soldadura. Es por ello que el objetivo del trabajo fue evaluar el proceso de lixiviación ácida de los catalizadores agotados de la fábrica Patricio Lumumba.
MATERIALES Y MÉTODOS
Materia prima y reactivos
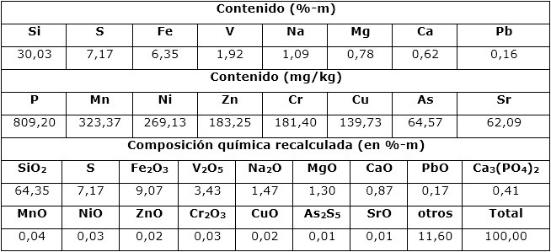
Se utilizó una muestra de catalizador agotado procedente de la fábrica sulfometales Patricio Lumumba, del Grupo Empresarial Geominsal, Santa Lucía, provincia de Pinar del Río. La caracterización química del residual catalítico, así como la composición recalculada a partir de los posibles compuestos químicos que deben constituir este residual, se muestran en la Tabla 1.
La muestra de catalizador agotado fue triturada en un molino de disco, hasta un diámetro de partícula < 0,25 mm y, posteriormente, secada en una estufa a 120 °C durante tres horas, para eliminar la humedad contenida en ella; finalmente fue enfriada hasta temperatura ambiente, en una desecadora.
Como reactivo lixiviante se utilizó ácido sulfúrico de calidad técnica al 29,95 %, a partir del cual fueron preparadas las disoluciones a las concentraciones siguientes: 2,9 %; 5,7 %; 5,8 %; y 11,4 % (v/v).
Para determinar el contenido de vanadio se prepararon las siguientes disoluciones:
Equipamiento
Como equipos se usaron: balanza analítica marca Denver, modelo SI-234 con un máximo de pesada de 230 g y una precisión de 0,1 mg; estufa Boxun para el secado de las muestras; mufla marca Nabertherm, recubierta de ladrillo refractario capaz de alcanzar 1 400 °C, para la calcinación de la muestra.
Para la lixiviación se utilizaron agitadores mecánicos Janke y Kunkel, cuya velocidad de agitación fue controlada con un tacómetro Shimpo EE-2; un baño de María marca Prazitherm y una centrífuga Heal Force modelo Neofuge 15 para separar el líquido procedente de la lixiviación del sólido residual.
Se utilizó un espectrofotómetro ultravioleta visible marca Génesis 6 y la aplicación Visionlite versión 2.1 para determinar la concentración de vanadio en las muestras, a partir de la formación de un complejo rojo cereza entre el vanadio y el peróxido de hidrógeno (Harvey 2000; Drużyński, Mazurek y Białowicz 2014).
Proceso de lixiviación ácida
El procedimiento de trabajo consistió en mezclar la muestra de catalizador agotado con una disolución de ácido sulfúrico diluido (agente lixiviante), con el objetivo de separar los elementos solubles (lixiviables) del resto de los compuestos que conforman el residual, los que permanecen como residuos insolubles.
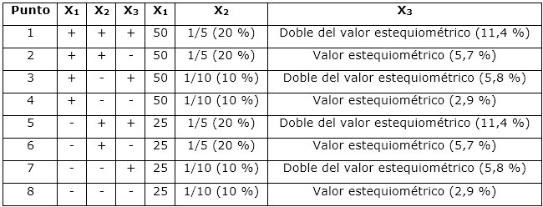
El proceso se ejecutó a través de un diseño de experimentos factorial completo (23), de tres factores a dos niveles, donde las variables independientes fueron: X1: temperatura (°C), X2: relación sólido/líquido (S/L) y X3: concentración de ácido sulfúrico (%). La matriz del diseño de experimento y los parámetros fundamentales para garantizar los niveles de variación en las variables independientes del diseño experimental se muestran en la Tabla 2.
Se mantienen como parámetros constantes: el tiempo de lixiviación (1 h); el tamaño de partícula (< 2,5 mm); y el número de Reynolds para garantizar un régimen de agitación turbulento (Re=10 000) durante el procesamiento.
La muestra de catalizador agotado se mezcló con 100 ml de disolución de ácido sulfúrico diluido a la concentración correspondiente a la matriz experimental. Las temperaturas de trabajo fueron 25 °C y 50 °C. Para mantener los 50 °C dentro del beaker se utilizó un baño de María regulado a 55 °C.
La agitación del catalizador agotado con el agente lixiviante se realizó usando un agitador mecánico, el que permitió trabajar bajo un régimen de agitación turbulento. El sistema de agitación utilizado quedó formado por un beaker de 250 ml y un agitador de paleta plana, con su eje desplazado del centro del recipiente. La relación entre la longitud del impulsor (Dp) y el diámetro del beaker (Dr) es 0,441; la que se encuentra dentro del intervalo establecido (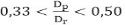 ) (Genck 2007).
) (Genck 2007).
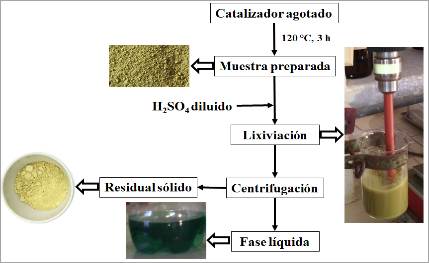
Transcurrido el tiempo de lixiviación, la fase líquida fue separada del sólido residual mediante centrifugación a 314,16 rad/s (3 000 rpm). En la Figura 1 se muestra el esquema general del procesamiento a través de un diagrama de bloques, en el que fueron incluidas imágenes de las distintas etapas del proceso y de los productos presentes en cada una de ellas.
RESULTADOS Y DISCUSIÓN
Potencialidades del residual catalítico
De acuerdo con la composición química del residual catalítico (Tabla 2) pueden preestablecerse las reacciones químicas principales que deben ocurrir durante el procesamiento químico. Como resultado de estas reacciones, los compuestos lixiviables con el ácido sulfúrico, presentes en el catalizador, deben pasar a la solución en forma de sulfatos: Na2SO4, MgSO4, Fe2(SO4)3, (VO)2(SO4)3, MnSO4, Cr2(SO4)3, ZnSO4, NiSO4 y CuSO4, y los que no se disuelven quedarán como residuos insolubles (SiO2, As2S5 y S). El CaSO4, PbSO4 y SrSO4, cuyas Kps son 2,4(10-5; 1,6(10-8 y 3,2(10-7, respectivamente (Harvey 2000), deben formar precipitados, los que pasarían a formar parte del residuo sólido insoluble.
Las principales reacciones químicas (4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16) que deben ocurrir durante la lixiviación del catalizador agotado son las siguientes:
A partir de la composición química del catalizador agotado (Tabla 1) y las reacciones químicas que deben ocurrir durante el procesamiento hidrometalúrgico se realizó un balance de masa, tomando como base la masa de catalizador a usar en los experimentos planificados, mediante la aplicación de la ecuación 17 (Perdomo et al. 2019):
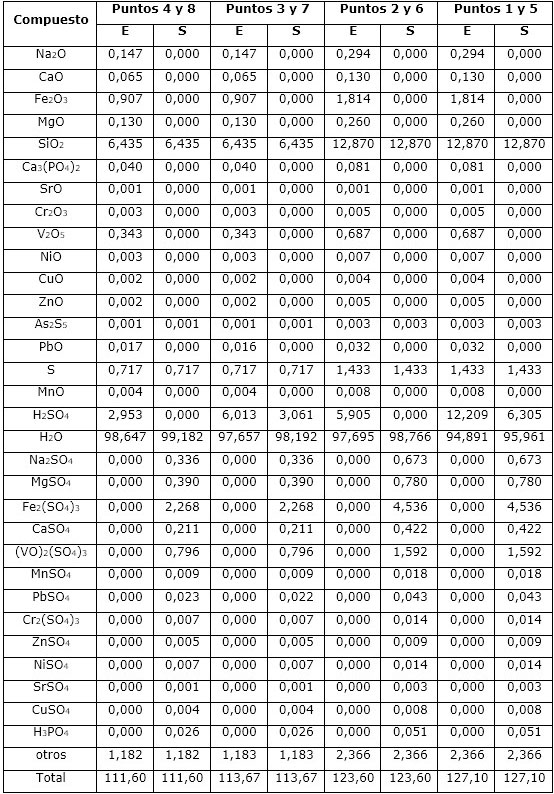
El balance de masa se realizó a partir de los datos del diseño de experimento (Tabla 2), variándose la relación S/L y la concentración del ácido sulfúrico. Por tanto, se tomaron 10 g y 20 g de catalizador agotado; se fijó el volumen de disolución de ácido sulfúrico en 100 ml y se calculó la masa de ácido contenida en ese volumen, según la concentración prevista. En la Tabla 3 se muestra el balance total para el procesamiento del catalizador mediante lixiviación con ácido sulfúrico, resumiéndose las cantidades de entrada (E) y salida (S) de cada compuesto.
A partir del balance de masa total del proceso se determinó la cantidad de líquido y de residual sólido que se generan durante la lixiviación. El proceso debe generar entre 103 g y 110 g del líquido procedente de la lixiviación, formado por más del 87 % de agua, el que debe contener Fe2(SO4)3 entre 2 % y 4,3 %, (VO)2(SO4)3 entre 0,7 % y 1,5 % y MgSO4 de 0,3 % a 0,7 %; sales que constituyen los componentes mayoritarios y fundamentales del producto a recuperar. El líquido también debe contener Na2SO4, que representa entre un 0,3 % y 0,6 % del lixiviado. El resto de los compuestos que conforman la fase líquida constituyen menos del 0,1 % de este.
En el caso de los puntos 1, 3, 5 y 7, de máxima concentración de ácido, en el líquido deben quedar determinadas cantidades de ácido sulfúrico libre, las que representan el 2,9 % y 5,7 % del lixiviado de acuerdo con la relación S/L, 1/10 y 1/5, respectivamente.
En el residual sólido que se genera una vez finalizado el procesamiento químico, teóricamente, se obtendrían 7,4 g y 14,8 g de sólido, según la cantidad de catalizador inicial que se tome, 10 o 20 g, lo que representa el 74 % del mismo. Este nuevo residual debe estar formado fundamentalmente por el SiO2, el que constituye el soporte del catalizador y representa el 87 % aproximadamente del sólido generado; le sigue el S con ≈ 9,7 % y el CaSO4 formado durante la lixiviación (ecuaciones 12 y 14), el cual debe representar el 2,9 %. El resto de los compuestos se encuentran por debajo del 1 %; el plomo debe precipitar como PbSO4, formando parte del residual sólido y representando ≈ 0,3 % de este residuo.
Lixiviación ácida
Cuando aumenta la relación S/L se hace necesario incrementar la velocidad de agitación para garantizar la turbulencia en el recipiente, lo que permitiría el mantenimiento de la movilidad constante del sólido y así la adecuada interacción entre ambas fases, por lo que la transferencia de materia tendrá lugar en todos los puntos (Granger-Brown 1988).
En el diseño experimental planteado se trabaja con las variables relación S/L y concentración de ácido, lo cual implica variaciones en la densidad y viscosidad en la mezcla, por lo que se estableció un régimen turbulento (Re = 10 000) para todos los experimentos. De acuerdo con la expresión del número de Reynolds, para lograr esta condición es necesario variar la velocidad de rotación para cada punto experimental, valor que se obtiene de la ecuación 18.
Donde: N = velocidad de rotación (rps)
d = diámetro del agitador (m)
ρ = densidad del fluido (kg(m-3)
μ = viscosidad (kg(m-1·s-1) (Chambergo et al. 2017).
Para los cálculos fueron determinadas la densidad de la mezcla para cada punto experimental y la viscosidad para las mezclas catalizador/ácido sulfúrico a las temperaturas de trabajo (25 °C y 50 °C). La densidad del catalizador agotado triturado (< 0,25 mm) es de 2,043 g/ml.
Una vez obtenidos los valores de densidad y viscosidad se determina la velocidad de agitación requerida para garantizar un régimen turbulento. Los resultados se muestran en la Tabla 4.
La lixiviación se desarrolló según el diseño de experimentos planificado (Tabla 2). Transcurrido el tiempo de lixiviación, la fase líquida se separa del residuo sólido mediante centrifugación. Los sólidos residuales obtenidos presentan, de manera general, coloración amarilla pálida, los que son secados en estufa a 120 °C.
La fase líquida resultante de la lixiviación presenta coloración verdosa, se observan diferencias en cuanto a su intensidad (Figura 2); los puntos 1, 2, 5, 6 resultaron más oscuros, lo que se corresponde con los puntos en que la relación S/L es máxima (+), evidenciando una mayor concentración de elementos lixiviados.
De cada experimento se tomó una alícuota de 2 ml de la fase líquida y se le determinó el contenido de vanadio, mediante espectroscopia ultravioleta visible. A partir de una curva de calibración se determinó la concentración de vanadio (Tabla 5) para cada punto experimental.
En la Tabla 5 se puede observar que la concentración de vanadio osciló entre 1 448 mg/L y 3 730 mg/L, correspondiéndole la mayor concentración al experimento 1, en el cual todos los parámetros del diseño son máximos. Le sigue el punto 2, donde la concentración del ácido corresponde al valor estequiométrico (-), pero las demás variables son máximas (+), seguidos de los puntos 5 y 6. Estos cuatro experimentos tienen en común que la relación S/L es máxima (relación 1/5, 20 % de catalizador agotado), obteniéndose concentraciones entre 3 190 mg/L y 3 730 mg/L de V.
En los cuatro experimentos restantes (3, 4, 7 y 8), donde la relación S/L es mínima (relación 1/10, 10 % de catalizador agotado), el contenido de vanadio en el lixiviado varió entre 1 448 mg/L a 1 872 mg/L. Estas marcadas diferencias entre los dos grupos se deben a que para el primer grupo la disponibilidad de componentes lixiviables es el doble.
Si se comparan los puntos para los cuales solo varía la temperatura, se obtiene que los mayores contenidos de vanadio se alcanzan en aquellos experimentos donde la temperatura es máxima (50 °C), lo cual evidencia el efecto positivo de este factor.
Para la variable concentración de ácido sulfúrico, en la Tabla 5 se aprecia que al aumentar la concentración del ácido (en el intervalo estudiado), para valores fijos de las otras dos variables, se produce un aumento del contenido de vanadio, debido a que hay mayor disponibilidad de ácido para reaccionar con el residual, facilitando la difusión de los compuestos lixiviables hacia la fase líquida, aunque tiene como desventaja el incremento del consumo de reactivo lixiviante.
A partir de la concentración de vanadio en la fase líquida se puede determinar el rendimiento de la lixiviación con relación al valor teórico determinado, cuyos resultados se muestran en la Tabla 5. En esta se puede observar que el mayor rendimiento de vanadio, durante la lixiviación, le corresponde al experimento 3, seguido del 1, correspondiéndole al 3 los valores máximos de concentración de ácido y de temperatura, así como la mínima relación S/L. En el experimento 3 se recupera el 97,3 % del vanadio teóricamente contenido en la fase líquida, determinado a partir del balance de masa.
Para el punto 1, donde todos los factores son máximos, el rendimiento es del 96,9 %, observándose altos valores en ambos casos, aunque debe destacarse que el punto 1 tiene como ventaja que es capaz de procesar el doble de la masa de catalizador que el punto 3, para similares condiciones de operación, con lo cual se lograría un incremento considerable de la productividad.
Procesamiento estadístico de los resultados
Las variables dependientes del diseño experimental fueron:
El procesamiento estadístico de los resultados obtenidos se realizó utilizando el software STATGRAPHICS Centurion XV, el que permitió obtener los diagramas de Pareto, mostrados en la Figura 3, y la ecuación de regresión del modelo, ajustado para cada variable respuesta.
Concentración de vanadio en la fase líquida (Conc. V)
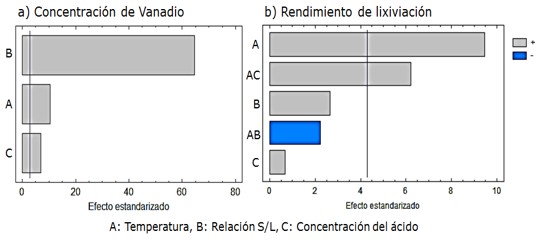
En el diagrama de Pareto (Figura 3 a) se observa que las tres variables independientes ejercen influencia significativa y positiva sobre la concentración de vanadio en la fase líquida procedente de la lixiviación, donde la mayor influencia la ejerce la relación S/L, lo cual está relacionado con la mayor disponibilidad del elemento metálico, facilitando su extracción.
La temperatura favorece la extracción del vanadio al disminuir la densidad y viscosidad de la mezcla, posibilitando el paso del metal a la fase líquida. La menor influencia sobre la concentración de vanadio, aunque también positiva, la ejerce la concentración del ácido sulfúrico, aspecto que se justifica a partir del establecimiento de la relación estequiométrica como punto mínimo.
La ecuación (19) muestra la ecuación de regresión obtenida para la variable concentración de vanadio, la que se caracteriza por un R2 (ajustada) = 99,84 %, para un nivel de confianza del 95,0 %.
Donde:
T: temperatura, R(S/L): relación sólido/líquido
CA: concentración del ácido sulfúrico.
Rendimiento de lixiviación (Rdto. lix.)
En la Figura 3 b se muestra el diagrama de Pareto con la influencia de las variables independientes sobre el rendimiento de la lixiviación, donde se puede apreciar que para este caso solo resultaron significativas la temperatura y su interacción con la variable concentración del ácido sulfúrico, ambas positivas.
La mayor influencia la ejerció la temperatura, lo que puede estar relacionado con el efecto positivo de la temperatura sobre la velocidad de reacción, unido a la disminución de la viscosidad y densidad, aspecto que se ve fortalecido por la interacción de la temperatura con la concentración del ácido, obteniéndose los mayores rendimientos en los experimentos donde estas dos variables están en los niveles altos (experimentos 1 y 3).
El modelo que representa el comportamiento de la variable rendimiento de la lixiviación se muestra en la ecuación (20), la que tiene un R2 (ajustada) = 95,10 %.
Si se realiza un análisis de la función deseabilidad, a partir de los resultados del procesamiento estadístico de las vari.ables dependientes seleccionadas para evaluar el diseño experimental, se obtiene que los mejores resultados le corresponden al experimento 1, en el cual todos los parámetros se encuentran en sus niveles máximos, pero podría influir de manera negativa en la etapa de precipitación, ya que elevaría el consumo de solución precipitante debido al exceso de ácido adicionado, aspecto que debe ser estudiado más adelante.
CONCLUSIONES
El balance de masa realizado, a partir de los datos de composición química del catalizador agotado y las posibles reacciones químicas a ocurrir durante la lixiviación, permite determinar que como resultado del procesamiento químico del residual se obtendría entre 103 g y 110 g de la fase líquida y de residual sólido: 7,4 g y 14,8 g el cual estaría formado por un 87 % de SiO2.
En el procedimiento elegido se observa que las variaciones de los parámetros de operación de la lixiviación permiten obtener en la fase líquida concentraciones de V entre 1 448 mg/L y 3 730 mg/L, correspondiéndole los mayores contenidos (de 3 193 a 3 730 mg/L) a los experimentos donde la relación sólido/líquido se encontraron en el nivel máximo.
El diseño de experimento factorial completo (23) realizado, manteniendo régimen de agitación turbulento y variando la temperatura, concentración del ácido sulfúrico y la relación sólido/líquido, permite extraer hacia la fase líquida entre el 75 % y 97 % del vanadio contenido en el residual, donde las variables independientes temperatura y concentración del ácido en los niveles máximos ejercen la mayor influencia sobre el rendimiento.