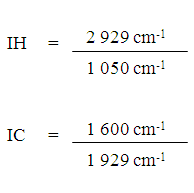Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Ciencias Técnicas Agropecuarias
versão On-line ISSN 2071-0054
Rev Cie Téc Agr vol.22 no.2 San José de las Lajas apr.-jun. 2013
ARTÍCULO ORIGINAL
Propiedades químicas y química-físicas de derivados estructurales de ácidos húmicos obtenidos de vermicompost. Actividad biológica
Chemical and chemistry-physical properties of derived structurals of humics acid obtained of vermicompost. Biological activity
M.Sc. Rafael Huelva López, M.Sc. Dariellys Martínez Balmori, Dr. C. Andrés Calderín García, M.Sc. Orlando L. Hernández González y Ph.D. Fernando Guridi Izquierdo
Universidad Agraria de La Habana ¨Fructuoso Rodríguez Pérez¨(UNAH), MAyabeque, Cuba
RESUMEN
La modificación química de los ácidos húmicos (AH) puede ser usada como una herramienta para entender su estructura química, la que es muy compleja. Nuevos resultados muestran que existe una relación entre sus funciones y propiedades químicas modificadas con cambios en la actividad biológica que manifiestan sobre el crecimiento de las plantas. En el presente trabajo se utilizaron reacciones químicas de acetilación, metilación y amonificación para modificar la estructura de los AH obtenidos de vermicompost de estiércol vacuno, los que se evaluaron por su contenido de C, coeficiente E4/E6 y su acidez. En los derivatizados y el AH sin derivatizar se analizaron los cambios estructurales mediante la Espectroscopia Infrarrojo de Reflactancia Difusa con Transformada de Fourrier (DRIFT) y a través de sus espectros los índices de hidrofobicidad (IH) y de condensación (IC) de las moléculas. Los resultados muestran cambios importantes en todos los indicadores estudiados de manera diferenciada en dependencia del tipo de agente derivatizante. La respuesta encontrada en el bioensayo para Ácido Indol Acético (AIA) mostró incrementos en el contenido equivalente del biorregulador a favor de los derivados estructurales y por encima de la actividad encontrada para el AH sin derivatizar.
Palabras clave: sustancias húmicas, ácidos húmicos, derivatización, ácido indol acético.ABSTRACT
The chemical modification of the húmic acids (AH) can be used as a tool to understand their chemical structure, which is very complex. New results show that exists a relationship among their functions and chemical properties modified with changes in the biological activity that they manifest on the growth of the plants. Presently work chemical reactions of acetilatión, metilatión and amonificatión were used to modify the structure of those AH obtained of vermicompost of bovine manure, those that were evaluated by their content of C, coefficient E4/E6 and their acidity. In the derivatizaded and the AH not derivatizated the structural changes were analyzed by the Infrared Espectroscopy of Diffuse Reflactancy with Fourrier Transformed method (DRIFT) and through their spectra the hidrofobicity indexes (IH) and of condensation (IC) of the molecules. The results show important changes in all the studied indicators showed differences in dependence of agent's used. The results found in the bioassays for Indol Acetic Acid (AIA) showed increments in the equivalent content of the biorregulator in order to derivatizaded and higher activity that AH not derivatizated.
Keywords: humic substances, humic acids, derivatizatión, indol acetic acid.
INTRODUCCIÓN
Se ha demostrado por diferentes autores que la utilización de productos obtenidos a partir de diferentes fuentes orgánicas como el vermicompost y otros compostajes son utilizados por sus reconocidos efectos beneficiosos (Peyvast et al., 2007; Calderin y et al., 2009).
Nardi et al. (2002), en un resumen sobre los efectos de las sustancias húmicas sobre el crecimiento y desarrollo de los vegetales, señalan la influencia positiva sobre el transporte de iones facilitando la absorción, la acción directa sobre procesos metabólicos tales como: respiración, fotosíntesis y síntesis de proteínas, mediante el aumento o disminución de la actividad de diversas enzimas, el contenido de metabolitos y la actividad tipo hormonal de estas sustancias.
El conocimiento de la estructura de las Sustancias Húmicas (SH), a pesar de su gran heterogeneidad, es totalmente necesaria para poder describir su reactividad química y su participación en los procesos biológicos que tienen lugar en las plantas pues esta interacción aún no queda clara hoy en día (Baigorri et al., 2007).
Las Sustancias Húmicas (SH) son macromoléculas muy complejas donde se encuentran diferentes grupos funcionales que le permiten actuar como polielectrolitos de ácidos débiles y ser sitios de reacción con diferentes agentes químicos; es aceptado que esta consideración es válida para cada una de sus fracciones donde también se incluyen a los Ácidos Húmicos (AH) como uno de sus componentes.
La mayor parte de estos sitios de reacción son atribuidos a la presencia de oxígeno en los grupos funcionales OH de alcoholes, fenoles, carboxilos y otros, siendo los de grupos carboxilos y fenólicos los de mayor interacción y cantidad.
En la actualidad se discute que estas sustancias estructuralmente poseen un dominio hidrofóbico y otro hidrofílico y una determinada relación entre ambos es la causante de los efectos biológicos de estimulación encontrados en las plantas ya enunciados por diferentes autores (Canellas et al., 2008). Se han presentado por Canellas et al. (2010), evidencias experimentales mostrando que la hidrofobicidad y la cantidad de grupos funcionales ácidos de AH son necesarios en la estimulación de la bioactividad de estas sustancias.
En el estudio de la estructura y propiedades de las moléculas es habitual realizar modificaciones estructurales por medio de reacciones específicas y/o el bloqueo de determinados grupos funcionales en las moléculas mediante Métodos y Técnicas Espectroscópicas (Spaccini y Piccolo, 2009).
El objetivo del presente trabajo fue obtener derivados estructurales (acetilado, metilado y amoniacal) de AH conseguidos a partir de vermicompost de estiércol vacuno y evaluar algunas de sus propiedades químicas y químico-físicas, así como su actividad fitohormonal (¨like-auxine¨).
MÉTODOS
Como sustrato de partida se utilizó vermicompost de estiércol vacuno de tres meses de maduración procesado con la lombriz roja africana, siendo la alimentación de los bovinos basada fundamentalmente en pastos.
Extracción y purificación de ácidos húmicos (AH). La extracción de sustancias húmicas se realizó a partir del vermicompost siguiendo la metodología propuesta por IHHS (2008) con NaOH (0,1 mol/L) en una proporción de 1:10 (m de vermicompost: v disolución) y agitación durante 8 horas. Los ácidos húmicos (AH) presentes fueron precipitados mediante la adición de HCl (0,01 mol/L) y luego centrifugados; posteriormente fueron purificados con HCl: HF: H2O en proporción 1:1:98 (v:v:v).
Derivatización de los AH. Los AH fueron modificados estructuralmente con Anhídrido acético y Cloruro de Tionilo mediante las técnicas descritas por Andjelkovic et al. (2006), obteniéndose los derivados: AH acetilado (AH-Ac) y AH metilado (AH-Met) respectivamente. Para el derivado amoniacal se empleó 30 mL de NH4OH (7,5 %) y 500 mg de AH en un equipo de reflujo y agitador magnético a 450 C por espacio de 1 hora. El producto obtenido (AH-NH3) fue lavado previamente, centrifugado y secado a 500 C.
Caracterización de los AH y derivados. En los AH y sus derivados se determinó el % de carbono por el método de Tyurin y el coeficiente óptico E4/E6 (valores de absorbancia a 465 y 665 nm). Se calculó además la acidez total, la acidez de los grupos -COOH y la producida por los grupos -OH, utilizando el procedimiento descrito por Canellas et al. (2008).
La caracterización químico-física de los principales grupos presentes en los AH y sus derivados estructurales fue realizada mediante Espectroscopia Infrarrojo de Reflactancia Difusa con Transformada de Fourrier (DRIFT). Los espectros fueron registrados en un equipo PE Spectrum-One, obteniéndose los espectros individuales en el intervalo de frecuencia de barrido de 7004000 cm-1 con resolución de 4 cm-1.
Índices de Hidrofobicidad y de Condensación. Utilizando los espectros de las moléculas transformadas y el AH original fueron determinados los índices de hidrofobicidad (IH) y de condensación (IC) de los AHs según Freixo et al. (2002) las que se basan en las relaciones entre las absorbancias de las bandas referidas en las siguientes expresiones:
Actividad Biológica. Para determinar la actividad biológica de los AH se utilizó el «Biotest» para la fitohormona Ácido Indol Ácetico (AIA) (Ortega y Rodés, 1986) utilizando semillas de maíz (Zea mays; var: 7928). En el cálculo del contenido medio equivalente de la fitohormona fue necesario utilizar como referencia una curva patrón de AIA con respecto a la longitud de la raíz de las plántulas.
Los datos de cada uno de los indicadores fueron tratados convenientemente con Microsoft Office Excel 2007 y fue realizado un ANOVA simple y la comparación de medias por el Test de Tukey con un percentil de 0.05 (Statgraphics Plus 5.1)
RESULTADOS Y DISCUSIÓN
Los valores del % de C y del coeficiente óptico E4/E6 de las sustancias húmicas obtenidas aparecen en la Tabla 1. El valor de %C para el AH obtenido a partir de vermicompost es ligeramente superior a los reportados por la IHHS (2008). No obstante, se encuentra dentro del rango de valores reportados para estas sustancias aisladas de otros orígenes (Calderín, 2010).
Nótese el aumento significativo experimentado por los derivados funcionales AH-Ac y AH-Met en cuanto al % de C, debido a una adecuada eficiencia en la esterificación y metilación de los grupos OH presentes en la estructura; al mismo tiempo es posible inferir que el bloqueo con cloruro de tionilo con respecto al anhidrido tiende a ocurrir sobre un mayor número de grupos OH, pudiendo abarcar tanto a los que se encuentran en C primarios como en C secundarios, debido posiblemente a un menor impedimento estérico de la molécula entrante (CH3-), siendo más extensiva que la inclusión del acetilo (CH3-CO-) en la molécula. En el caso del derivado amoniacal, era de esperarse un % C similar al AH de origen debido a que en este caso el grupo entrante sería el grupo -NH2, con la consiguiente formación de amidas.
Los derivatizados poseen valores de la relación E4/E6 inferiores al AH de origen y por tanto existe la posibilidad de una mayor complejidad y grado de condensación en estas moléculas modificadas, siendo el AH-NH3 el menos condensado de todos.
Los procesos de acetilación, metilación y amonificación de los AH provocan una disminución de sus propiedades ácidas con respecto al AH de origen, resultados que se presentan en la Tabla 2.
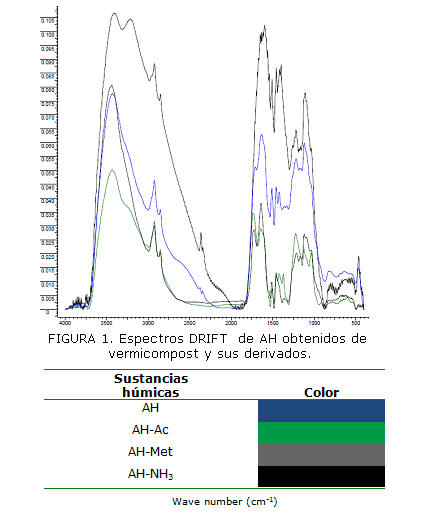
Aunque el AH-NH3 fue el que más contribuyó a la disminución de la acidez total, el AH-Met fue el derivado que al parecer tuvo una mayor interacción con los grupos -OH de ácidos carboxílicos de la molécula originaria, dado los menores valores de acidez de este grupo funcional. En la Figura 1 se muestran los espectros DRIFT obtenidos de las sustancias húmicas estudiadas. Para realizar las atribuciones a las principales bandas de absorción relacionadas con las reacciones implicadas en este estudio se tuvieron en cuenta las reportadas en la literatura especializada y los trabajos presentados por Chen et al. (2008); Dobbss et al. (2009); Spaccini y Piccolo (2009) y Calderin et al. (2012).
Todos los espectros poseen las bandas características de los grupos funcionales atribuibles a las sustancias húmicas en general ya referidas por IHHS (2008). Sin embargo, se obtienen diferentes intensidades y corrimientos en aquellas bandas relacionadas con las reacciones que tienen lugar con los agentes derivatizantes y el AH. Es por ello que en el espectro del AH aparece una banda fuerte y ancha en la zona de 3 400 cm-1 asignada a -OH de ácidos carboxílicos, alcoholes y fenoles, la que se encuentra ligeramente desplazada en los espectros de los AH derivatizados. Además, la intensidad de la banda disminuye en estos últimos, lo que está en correspondencia con los resultados de acidez (Tabla 2). Es necesario señalar que en esta zona, para el caso del derivatizado AH-NH3 se aprecia una segunda banda (32 3,31 cm-1) atribuible a la vibración NH de amidas, lo que corroboraría la interacción del NH4OH con los ácidos carboxílicos del AH, con la consiguiente formación de amidas.
Otras bandas de mayor intensidad son aquellas que aparecen sobre los 1 730 y 1 650 cm-1 atribuibles a la vibración C=O de ácidos, esteres, éteres, amidas y quinonas. En el espectro AH-Ac la banda en 1 730 cm-1 de esteres es más intensa, mientras que en el espectro AH-NH3 la banda es más intensa alrededor de los 1 600 cm-1 con relación a la anterior atribuible a C=O de amidas. Todo lo anterior pudiera estar relacionado con la incorporación del grupo NH2 a la estructura del AH cuando este es tratado con NH4OH. Otras bandas como las de 2 929, 2 856 y 1 100 cm-1 son atribuibles a los estiramientos simétricos y asimétricos de C-H alifáticos y de C-O de esteres y éteres presentes en todas las moléculas.
Los valores de índice de Condensación (IC) presentados en la Tabla 3 indican que los AH derivatizados tienen un menor grado de condensación que el AH de origen según la estimación realizada por la expresión de Freixo et al. (2002), lo que no se corresponde con los valores obtenidos mediante el coeficiente E4/E6.
Por otra parte, los valores del índice de hidrofobicidad (IH) de estas sustancias poseen similar comportamiento frente a los agentes derivatizantes, es decir, el IH aumenta en todos los derivatizados en comparación con el valor encontrado para el AH de origen. Téngase en cuenta que los agentes derivatizantes anhídrido acético, cloruro de tionilo e hidróxido de amonio provocan la inclusión de los grupos acetilo, alquilo y amino respectivamente en las estructuras de los derivatizados por lo que la hidrofobicidad ha de aumentar en correspondencia con estos agentes.
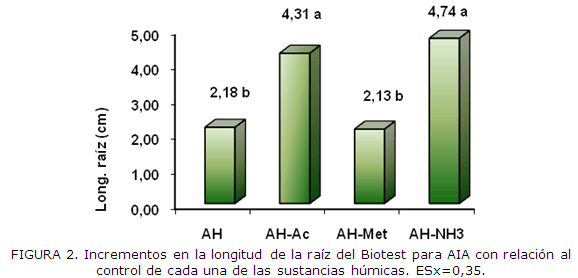
Es posible considerar que el bloqueo de algunos grupos funcionales ácidos por los agentes derivatizantes hayan provocado un desbalance de los dominios hidrofóbico e hidrofílico al igual que la pérdida de la acidez en estos AH derivatizados, lo cual podría repercutir en sus actividades biológicas. En la Figura 2 se muestran los resultados del Biotest de Ácido Indol Acético (AIA) evaluándose el incremento de la longitud de la radícula de semillas de maíz. Los AHs derivatizados propiciaron una mayor elongación y por tanto de bioestimulación del crecimiento del órgano con respecto al control (sin AIA) y en concordancia con estos incrementos (Figura 3) una actividad fitohormonal equivalente de AIA superior. Estos resultados indican que las modificaciones estructurales producidas en el AH no conllevaron a la pérdida de su bioactividad, y que la misma no depende totalmente ni de la acidez ni del grado de hidrofobicidad de los AH, de esta forma para el AH acetilado y el AH-NH3con bajos valores de acidez y mayor hidrofobicidad la bioestimulación del crecimiento fue superior. Resultados semejantes en cuanto al incremento de la longitud de raíces de plántulas de maíz por otro método ha sido reportado por Canellas et al. (2010) utilizando seis fracciones de diferente masa molecular de AH extraídos de vermicompost.
CONCLUSIONES
Los derivados de AH obtenidos mostraron modificaciones estructurales y funcionales en dependencia del agente químico derivatizante utilizado y en consonancia las moléculas obtenidas mostraron menos acidez y por tanto aumentó su carácter hidrofóbico y su actividad biológica.
AGRADECIMIENTOS
Para el M.Sc. Eduardo Ruíz Vasallo, por su colaboración en la investigación.
REFERENCIAS BIBLIOGRÁFICAS
1.ADNJELKOVIC T., J. PEROVIC, M. PURENOVIC, S. BLAGOJEVIC, R. NIKOLIC, D. ADNJELKOVIC & A. BOJIC: Spectroscopic an Potenciometric studies on derivatized natural humic acid, Analytical Sciences, Russia, 2006.
2.BAIGORRI, R., M. FUENTES, G. GONZÁLEZ & J. GARCÍA: Analysis of molecular aggregation in humic substances in solution, Colloid surf., 6: 301-306, 2007.
3.CALDERIN, A., L. BERBARA, L. PORTUONDO, F. GURIDI, L.O. HERNANDEZ, R. HERNANDEZ & R. NORA: "Humic acids of vermicompost as an ecological pathway to increase resistance of seedlings to water stress", African Journal of Biotechnology, 11(13): 3125-3134, 2012.
4.CALDERIN, A., F. GURIDI, A. MOLLINEDA, E. GARCÍA, J. PIMENTEL, R. HUELVA, R. VALDÉS y O.L. HERNÁNDEZ: "Efectos biológicos de derivados del humus de lombriz sobre el crecimiento de plántulas de maíz (Zea Mays L., Var. Canilla)", Revista Centro Agrícola, 36(1): 27-31, 2009.
5.CALDERÍN, A.: Retención de metales pesados y actividad biológica de la fracción residual de un vermicompost. Tesis (en opción al título de Master en Agroquímica), Universidad Agraria de La Habana, 2010.
6.CANELLAS, L.P., A. PICCOLO, L.B. DOBBS, R. SPACCINI, L. OLIVARES, B. ZANDONADI & R. FAÇANHA: "Chemical composition and bioactivity properties of size-fractions separated from a vermicompost humic acid", Chemosfere, 78: 457-466, 2010.
7.CANELLAS, P.C., A.G SANTOS, J. BUSATO, R. SPACCINI, A. PICCOLO, L. MARTIN: "Bioactivity and chemical characteristic of humic acids from tropical soils", Soil.Sci., 173: 624-637, 2008.
8.CHEN, H., R. BERNDTSSON, M. MINGGUANG & K. ZHU: Characterization of insolubilized humic acid and its sorption behaviours, Elsevier. Sc. Direct. Environ Geol DOI 10.1007/s00254-008-1472-0, 2008.
9.DOBBSS, B.L. M.V. RUMJANECK, A.M. BALDOTTO, X.C. VELLOSO e P.L CANELLAS: "Caracterizaçao química e espectroscópica de ácidos húmicos e fúlvicos isolados de camada superficial de latossolos brasileiros (1)". Rev. Bras. Cienc. Solo, 33(1), 2009.
10.FREIXO, A. A., P. CANELLAS e A. MACHADO: "Propiedades espectrais da matéria orgânica leve-libre intra-agregado de dois latossolos sob plantio direito e preparo convencional", R. Bras. Ci. Solo. 26: 445-453, 2002.
11.IHHS-INTERNATIONAL HUMIC SUBSTANCES SOCIETY: From Molecular Understanding to Innovative Applications of Humic Substances. In: 14th International Meeting. September 14-19, Russia, Volumen I p 43-47, Russia, 2008.
12.NARDI, S., D. PIZZEGHELLO, A. MUSCOLO, A. VIANELLO: "Physiological effects of humic substances on higher plants", Soil Biology & Biochemistry, 34: 1527-1536, 2002.
13.ORTEGA, E. y R. RODES: Prácticas de Laboratorio de Fisiología Vegetal, pp. 133-136, Fac. Biología. Universidad de la Habana, Ed. Pueblo y Educación, La Habana, Cuba, 1986.
14.PEYVAS, G.H., J.A OLFATO, S. MADENI & A. FORGHANI: "Effect of vermicompost on the growth and yield of spinach (Spinacia oleracea L.)", Journal of Agriculture and Enviroment, 6(1), 2007.
15.SPACCINI, R. & A. PICCOLO: "Molecular characteristics of humic acids from compost increasing maturity stages", Soil Biology and Biochemistry, 41: 1154-1172, 2009.
Recibido: 23de diciembre de 2011
Aprobado: 28 de nero de 2013
Rafael Huelva Lopez, Prof . Aux., Facultad de Agronomía, Departamento de Química, Autopista Nacional Km 231/2, Carretera a Tapaste, San José de las Lajas, Mayabeque. Cuba. Correo electrónico:rafael@unah.edu.cu