My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cofin Habana
On-line version ISSN 2073-6061
Cofin vol.11 no.1 La Habana Jan.-June 2017
Artículo Original
Mejora del proceso de almacenamiento y distribución de productos comerciales basada en gestión de riesgos en una organización biofarmacéutica cubana
Improvements in the Process of Commodity Storage and Distribution of Commercial Products in a Biopharmaceutical Cuban Organization Based in the Risk Management
Madelen Castillo SantaelenaI, Vivian Isabel Antúnez SaizII, Edith Martínez DelgadoIII
I Organización biofarmacéutica cubana madelen@cim.sld.cu
II Universidad de la Habana, Cuba. vivian@ceted.uh.cu
III CUJAE, Cuba. edithmd@ind.cujae.edu.cu
RESUMEN
La gestión y el mantenimiento de la cadena de frío de un producto biofarmacéutico es una actividad de gran complejidad y exige un alto nivel de rigurosidad. Su ruptura ocasionaría el deterioro de los productos, por lo que es importante identificar, controlar y monitorear los puntos críticos durante el almacenamiento y distribución de los mismos. Debido a esto, cobra especial relevancia el enfoque basado en riesgos que en este tipo de industria ha tenido una evolución conceptual y normativa. El presente artículo muestra tanto el diseño como la aplicación de un procedimiento para la mejora del proceso de almacenamiento y distribución de productos comerciales en una organización biofarmacéutica cubana.
PALABRAS CLAVE: cadena de frío, gestión de riesgos, industria biofarmacéutica.
ABSTRACT
Biopharmaceutical cold chain management and maintenance is a very complex and highly rigorous activity. A broken cold chain may have a negative impact to the safety, efficacy or quality of biopharmaceuticals, so it is of great importance to identify, control, and monitor critical points in their storage and distribution. That is why risk-based approach is of special significance, which has conceptually and normatively evolved in the biopharmaceutical industry. This paper presents the design and application of a procedure to be followed in order to improve the process of commodity storage and distribution in a Cuban biopharmaceutical company.
KEYWORDS: cold chain, risk management, biopharmaceutical industry
Introducción
La industria farmacéutica y biotecnológica a nivel mundial ha identificado la excelencia operacional como una necesidad competitiva ante los acelerados cambios de su entorno. En Cuba, esta industria está llamada a desempeñar un papel trascendental en la actualización del modelo socio-económico, en la medida en que se consolida como un sector exportador con impacto en la salud pública cubana y regional.
La organización superior de dirección empresarial BioCubaFarma tiene, entre sus objetivos fundamentales, mantener e incrementar los estándares de salud y calidad de vida de la población cubana y ser una fuente de capital y exportaciones, a partir de todo el potencial científico acumulado a lo largo de los años. Las organizaciones biofarmacéuticas cubanas son entidades integradas a ciclo completo que investigan, desarrollan, producen y comercializan productos novedosos, de alto valor agregado, con altos estándares de calidad, y de gran impacto social. De ahí que la dirección de todos sus procesos revista gran complejidad. Además, es altamente regulada.
En estas organizaciones, las conexiones entre la ciencia y la economía funcionan en ambas direcciones. No sucede solamente que los resultados de la ciencia se convierten rápidamente en nuevos productos y servicios, sino que la realización comercial (principalmente exportadora) de esos productos y servicios se convierte en una fuente de financiamiento de la investigación científica misma (Lage, 2015).
La industria biofarmacéutica, por su origen científico y tecnológico y sus aplicaciones, es completamente multidisciplinaria. Por otra parte, desde el punto de vista de sus mecanismos gerenciales y sus estrategias de desarrollo, sobre todo a partir de los años 90, la integración es un signo distintivo de la misma, ya sea mediante alianzas, colaboración, licenciamiento, mecanismos de armonización, producción compartida y muchas otras modalidades de desempeño que obligan tanto al conocimiento cabal de las contrapartes comerciales, de los clientes, como al científico para la obtención de nuevos medicamentos y para el desarrollo de sus bases tecnológicas, y al de los mecanismos regulatorios y otros elementos de información, tanto en los procesos de creación de valor, como en los productos y servicios que resultan del complejo proceso de investigación, producción y comercialización (Orozco, 2008).
Este tipo de industria se ha caracterizado por estar regida por un nutrido y complejo conjunto de regulaciones muy fuertes. Una de las más reconocidas en este ámbito lo constituyen las Buenas Prácticas de Producción (BPP). La exigencia del cumplimiento de estas normas data desde la década del 60 del siglo XX, y actualmente se ha convertido en un método ampliamente utilizado por las autoridades regulatorias de todos los países del mundo. Estas regulaciones han evolucionado y se renuevan constantemente en dependencia del interés de los productores y de otras partes interesadas.
En el año 2007, sale a la luz un conjunto de regulaciones y guías de armonización que han demostrado la evolución conceptual por la que ha transitado este sector. En ellas se pueden destacar la Guía International Council for Harmonisation (ICH) Q10:2008 que tiene como propósito la descripción de un sistema de gestión de la calidad en la industria biofarmacéutica; la ICH Q8:2007 que aborda la información que debe incluirse en el Documento Técnico sobre el desarrollo farmacéutico de un producto; y la ICH Q9:2005 que se orienta hacia la gestión de los riesgos de calidad, elemento este de vital importancia para este tipo de industria en la que se deben disminuir al máximo las desviaciones de los productos.
Esta última regulación provee principios y herramientas para la gestión de riesgos y se basa en dos aspectos fundamentales. El primero se refiere a que la evolución del riesgo debe basarse en el conocimiento científico y debe tener en cuenta la protección del paciente como elemento primordial. De esta manera, el esfuerzo, la formalidad, y la documentación de la gestión de riesgo debe corresponderse con el nivel del mismo. En segundo lugar, propone un modelo para la gestión de riesgos formado por varias etapas que comprenden la identificación y evaluación del riesgo, y el control del mismo con su consecuente aceptación. Luego, se pasa a la medición de los resultados y se les da seguimiento.
La presente investigación se orienta hacia una organización biofarmacéutica cubana y tiene como objetivo general desarrollar un procedimiento para la mejora del proceso de almacenamiento y distribución de los productos comerciales con un enfoque de riesgos.
Modelo de diagnóstico
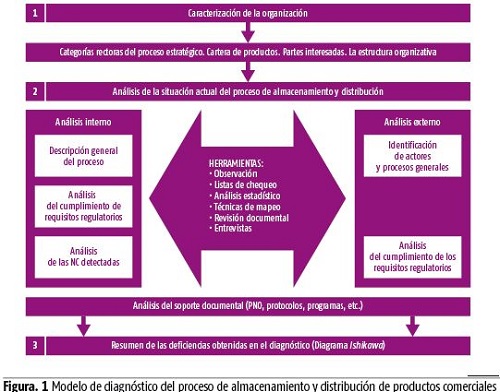
La investigación se realiza a través del diseño de un modelo de diagnóstico, compuesto por tres etapas fundamentales como se muestra en la figura. La primera se refiere a la caracterización general de la organización farmacéutica; la segunda, aborda el análisis de la situación actual del proceso de almacenamiento y distribución desde las dimensiones interna y externa; y la tercera sistematiza las deficiencias encontradas en el diagnóstico. Cada una de estas fases se sustenta en el uso de diversas herramientas y técnicas como: revisión documental, procedimientos normalizados de operación (PNO), listas de chequeo, entrevistas a directivos y especialistas del centro vinculados al proceso objeto de investigación, análisis de no conformidades (NC), entre otras. (figura 1)
A continuación se muestra la descripción de cada una de las etapas:
Etapa I. Caracterización de la organización objeto de investigación
Esta etapa tiene como propósito conocer las características generales de la organización biofarmacéutica, es decir, las que rigen el proceso estratégico a través de nociones como la misión, visión, los objetivos estratégicos y el objeto social. Se abordan también las partes interesadas de la entidad: principales clientes (nacionales e internacionales) y agencias regulatorias. Además, se destaca su cartera de productos y servicios, así como las fases en que se encuentran y la estructura organizativa. Para la obtención de datos se realizaron consultas de la documentación del centro, observaciones y entrevistas a especialistas.
Etapa II. Análisis de la situación actual del proceso de almacenamiento y distribución de productos comerciales
Esta etapa se propone realizar la descripción del proceso de almacenamiento y distribución de los productos comerciales. Se efectúa la identificación de los factores que influyen en el desempeño del proceso como el tipo de envase, los registradores de temperatura, las rutas de distribución, la cadena de frío, así como de las no conformidades asociadas al proceso, y el análisis de las quejas y reclamaciones de los clientes. Desde una dimensión externa, se identifican los actores que intervienen en la cadena de frío, a partir del análisis de la gestión de la misma con énfasis en el almacenamiento y la distribución. Se procura, además, la caracterización de los actores que intervienen en cumplimiento de los requisitos regulatorios. Para este aspecto se utilizaron herramientas como revisión documental, observación directa y entrevistas a especialistas.
Etapa III. Resumen de las principales deficiencias obtenidas en el diagnóstico del proceso de almacenamiento y distribución de productos comerciales
Esta etapa tiene como objetivo analizar los diferentes factores, tanto internos como externos que influyen en el proceso de almacenamiento y distribución. Es preciso, asimismo, sistematizar las problemáticas y determinar las causas que inciden en cada una de ellas. Es por esto que en esta etapa se realiza un resumen de las principales deficiencias asociadas al proceso de almacenamiento y distribución en función de determinar las causas, a través de la consulta con los directivos y especialistas vinculados al proceso objeto de estudio. A su vez, se propone la utilización del diagrama causa-efecto, que permite la agrupación de las causas a partir de diferentes dimensiones.
Procedimiento para la mejora del proceso de almacenamiento y distribución de los productos comerciales basada en la gestión de riesgos
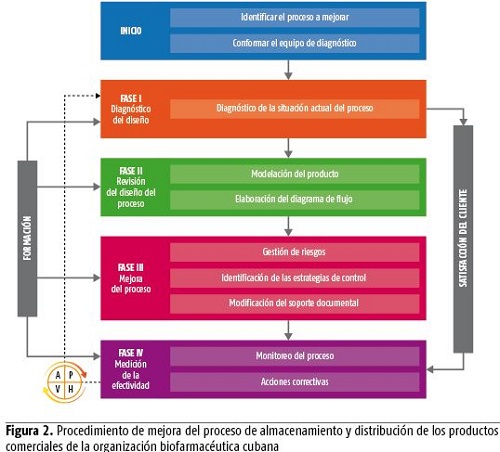
Para el diseño del procedimiento se tuvo en cuenta el ciclo Deming PHVA (planificar, hacer, verificar, actuar). Este permite, una vez aplicado, mantener la mejora continua del proceso. En la figura se muestra el esquema del procedimiento propuesto que consta de cinco fases fundamentales: inicio, diagnóstico del proceso, revisión, mejora y medición de la efectividad. Estas, a su vez, están conformadas por varias etapas. (figura 2)
A continuación se realiza una descripción más detallada de cada fase con sus etapas correspondientes.
1. Inicio: esta fase tiene como objetivo realizar la identificación del proceso y conformar el equipo de diagnóstico.
Etapa1. Identificación del proceso a mejorar y levantamiento de toda la información relacionada con el ámbito regulatorio actual del mismo.
Herramientas: entrevistas a directivos, trabajo en equipo y revisión de documentos.
Etapa 2. Conformación del equipo de diagnóstico que va a evaluar la situación actual del proceso, comunicar las oportunidades de mejoras propuestas a raíz de los resultados obtenidos en el diagnóstico, y dirigir las actividades del procedimiento de mejora que se propone.
Para determinar el nivel de competencia que poseen se realizó una encuesta. En la conformación de este equipo se deben seleccionar como expertos aquellos consultores de competencia alta (K ? 0,80). Además, se puede valorar utilizar expertos de competencia media (0,50 ? K < 0,80), en caso de que el coeficiente de competencia promedio de todos los posibles expertos sea alto. Nunca se utilizarán expertos de competencia baja (K < 0,50).
Herramientas: tormenta de ideas, entrevistas a directivos y especialistas del centro, trabajo en equipo, método de expertos.
2. Fase I: tiene como objetivo realizar el diagnóstico de la situación actual del proceso y preparar a la organización para la mejora. Este se lleva a cabo a partir de un modelo de diagnóstico compuesto por tres períodos fundamentales que permiten lograr una mayor estructuración y coherencia.
Herramientas: trabajo en grupo, revisión de documentos, estudio de regulaciones vigentes, observación, entrevistas a los especialistas y jefes del proceso, listas de chequeo para evaluar el cumplimiento de los requisitos y gráficos de pareto. El procesamiento estadístico de la información se realiza haciendo uso del software MINITAB en su versión16.0.
Etapa 1. Se resumen las principales deficiencias encontradas a lo largo del diagnóstico y se agrupan según los siguientes factores: materia prima, mano de obra, maquinaria, medio ambiente, medición y métodos.
Herramientas: Diagrama Ishikawa de las 6 M haciendo uso del software Microsoft Visio 2010.
3. Fase II: tiene como objetivo el análisis detallado del diseño del proceso y las características del mismo con el propósito de actualizarlo o mejorarlo. Para una estructuración coherente de la fase se han de concretar las siguientes etapas:
Etapa 1. Revisión de la modelación del producto en función de los atributos de calidad, su contenido en valor, y los requerimientos del mercado al que se dirige. Aplicación de la metodología de dimensionamiento del producto, herramienta que parte de establecer los elementos que conforman el corazón del producto, y llega hasta los más externos donde radica la interrelación del centro con el resto de los actores que interactúan en el sistema de valor.
Herramientas: dimensionamiento del producto, técnicas participativas, entrevistas.
Etapa 2. Elaboración o actualización del diagrama de flujo del proceso. El equipo debe reunirse para su conformación teniendo en cuenta todas las actividades que se realizan durante el proceso y el ámbito regulatorio actual.
Herramientas: trabajo en grupo, revisión documental (ámbito normativo vigente y del sistema de calidad), empleo de Microsoft Visio 2010 para la elaboración del flujograma de proceso.
4. Fase III: tiene como objetivo organizar, identificar y proponer las oportunidades de mejoras para elevar la eficacia del proceso y establecer las estrategias de control. La componen las siguientes etapas:
Etapa 1. Gestión de los riesgos del proceso basada en las normativas ICH Q9 y la Regulación 58 de la Parental Drug Association (PDA) que permiten evaluar el riesgo desde una perspectiva integral, atendiendo a todos los factores que inciden en el proceso.
Herramientas: método de análisis de los modos de fallos y efectos (AMFE), revisión y análisis de las normativas ICH Q9 y en el RT No.58 de la Federal Drug Administration (FDA).
Etapa 2. Identificación de las estrategias de control y de mejora para todos los modos de fallos potenciales. Se consideran prioritarios aquellos con un nivel de prioridad del riesgo (NPR) moderado e importante y los que tengan un índice de severidad de 10, independientemente del valor del NPR.
Etapa 3. Modificación del soporte documental que describe los detalles de las actividades a realizar y evidencia la ejecución de las mismas. Esta documentación consta, fundamentalmente, de PNO, listas de chequeo, registros, protocolos y reportes que validan que el proceso cumpla con las BPP y las Buenas Prácticas de Distribución (BPD). La metodología debe servir como plataforma para la descripción de los pasos a seguir en la mejora del proceso.
Herramientas: revisión documental, tormenta de ideas, entrevistas, sistema documental digital.
5. Fase IV: tiene como propósito garantizar las mediciones del proceso, a partir de las cuales se podrán tomar las acciones necesarias que permitan reducir las brechas detectadas como un elemento de retroalimentación en la mejora del mismo. La componen las siguientes etapas:
Etapa 1. Monitoreo el proceso. Se realiza a partir del establecimiento, la revisión o la actualización de los indicadores del mismo para valorar el impacto de los cambios y estimar posibles mejoras, mediante el análisis de los aspectos de la satisfacción del cliente y de la formación del personal.
Herramientas: establecimiento y monitorización de indicadores.
Principales resultados de la aplicación del procedimiento de mejora
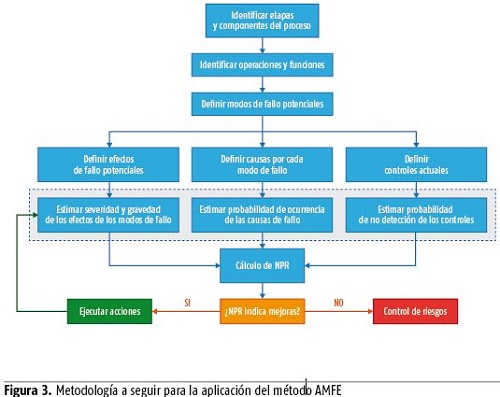
Uno de los resultados fundamentales de la aplicación del procedimiento descrito fue la identificación, evaluación y tratamiento de los riesgos asociados a cada una de las fases del proceso analizado a partir de la herramienta del AMFE. A continuación se muestra la metodología seguida para la aplicación de este instrumento: (figura 3)
Durante la aplicación del AMFE se realizó una tormenta de ideas con el equipo de diagnóstico donde la pregunta central fue ¿qué puede ir mal en cada etapa del proceso? A partir de este primer análisis se seleccionaron los modos de falla de mayor impacto para aplicar el método.
La evaluación del riesgo se realiza mediante la estimación de la severidad del fallo (S), la ocurrencia del mismo (O) y la detección (D). En función de esto se procede al cálculo del NPR= S x O x D que representa una valoración global del fallo. Se utilizó una escala del 1 a 10 para evaluar cada una de las variables involucradas en el análisis. Los riesgos pueden clasificarse teniendo en cuenta todos estos aspectos en: intolerables, importantes, moderados, tolerables y triviales.
Una vez determinado el NPR se pasa a la generación de medidas correctivas para eliminar o reducir el riesgo teniendo en cuenta su tipología, y a través del establecimiento de un orden de prioridad en las medidas proyectadas. Del mismo modo, se debe realizar un control periódico para monitorear los resultados obtenidos. La evaluación se realiza atendiendo a cada uno de los subprocesos: almacenamiento, preparación del envío, despacho y transportación.
Se detectaron dos riesgos tolerables que representan un 15 % del total; 6, moderados que constituyen un 46 %; y 5, importantes que representan un 38 %. Las mejoras se enfocaron hacia las dos últimas calificaciones.
Por otra parte, también fue modificado el soporte documental asociado al proceso objeto de investigación, mediante la confección de un nuevo protocolo de validación del proceso de transportación. Para la realización del mismo, la organización productora debe considerar una serie de variables que permiten asegurar la calidad y seguridad del producto a distribuir atendiendo a:
1. Las características de la ruta:
Las rutas de transporte: origen-destino.
La duración total del tránsito y temperatura: origen-destino.
2. Los componentes del empaque:
Soluciones isotérmicas.
Pastillas refrigerantes.
Tipo de producto: presentación y composición.
3. Aseguramiento del envío:
Termómetros infrarrojos.
Sistema de transporte.
4. Comportamiento de la temperatura:
Temperatura cinética media.
Informe del monitoreo de temperatura durante el envío.
La transportación de un producto termosensible desde el productor hasta el almacén del destinatario final es una etapa importante en su conservación. Las vacunas son productos biológicos sumamente sensibles a las variaciones de temperatura por lo que para garantizar su estabilidad y eficacia precisan conservarse de 2 a 8°C hasta su administración. De ahí que el diseño y aplicación de este protocolo contribuyó a elevar el control de la totalidad de los procesos y elementos utilizados en toda la cadena de frío de los productos comerciales biofarmacéuticos, y la calidad, eficacia y seguridad de los mismos.
Conclusiones
A partir del modelo de diagnóstico propuesto se logra la detección de problemas que afectan la satisfacción de las partes interesadas en la organización, así como su sistematización a través del diagrama causa-efecto ponderado, que posibilitó la identificación de las principales causas de los problemas que precisan rápida solución.
El diseño y aplicación del procedimiento para la mejora del proceso de almacenamiento y distribución de productos comerciales, en la organización biofarmacéutica cubana, tuvo su basamento en el ciclo Deming, y lo componen tres fases fundamentales: diagnóstico, revisión, mejora y medición. Las complementa un procedimiento de análisis de riesgos a través del método AMFE, que permitió evaluar los riesgos asociados a este proceso y proyectar soluciones para garantizar la calidad de los productos con un enfoque hacia toda la cadena de frío.
Entre los resultados de mayor impacto de la investigación se encuentra el diseño de un protocolo de validación, que contribuyó a elevar el control de la totalidad de los procesos y elementos utilizados en la cadena de frío, lo que incrementó la calidad, eficacia y seguridad de los productos biofarmacéuticos. Fueron definidos indicadores de efectividad que monitorean el desempeño del proceso, referidos a la satisfacción de las partes interesadas y la capacitación del personal.
REFERENCIA BIBLIOGRÁFICAS
CASTILLO, M. (2015): "Procedimiento para la mejora del proceso de almacenamiento y distribución de los productos comerciales del Centro de Inmunología Molecular", tesis de Maestría en Gestión de la Calidad Total, CUJAE, La Habana, Cuba.
ICH Q9: 2005: "Quality Risk Management", Bruselas, Bélgica, <http://www.ich.org/search.html?id=192&q=Quality+Risk+Management> [15/12/2014].
ICH Q8: 2007: "Quality Risk Management", Bruselas, Bélgica, <http://www.ich.org/search.html?id=192&q=Q+8+> [15/12/2014].
ICH Q10: 2008: "Pharmaceutical Quality System", Bruselas, Bélgica, <http://www.ich.org/search.html?id=192&q=Pharmaceutical+Quality+System> [15/12/2014].
LAGE, A. (2015): La economía del conocimiento y el socialismo. Preguntas y respuestas. Editorial Academia, La Habana, Cuba.
OROZCO S, E. (2008): "La inteligencia organizacional en la industria biofarmacéutica", Ciencias de la Información, vol. 28, n.o 1, <http://www.scielo.br/pdf/ci/v28n1/28n1a07.pdf.> [15/12/2014].
PDA 39 (2005): "Reporte 39 /PDA Journal of Pharmaceutical Science and Technology", Maryland, Estados Unidos, <https://trarchive.pda.org/read/account_titles/173183> [15/12/2014].
PDA 52 (2011): "Reporte 52 / Guidance for Good Distribution Practices for the Pharmaceutical Supply Chain", Maryland, Estados Unidos, <https://trarchive.pda.org/read/account_titles/173183> [15/12/2014].
PDA 53 (2011): "Reporte 53/ Guidance for Industry: Stability Testing to Support Distribution of New Drug Products", Maryland, Estados Unidos, <https://trarchive.pda.org/read/account_titles/173183> [15/12/2014].
PDA 58 (2012): "Reporte 58/ Risk Management for temperature- Controlled Distribution", Maryland, Estados Unidos, <https://trarchive.pda.org/read/account_titles/173183> [15/12/2014].
Recibido: 1/6/2016
Aceptado: 10/7/2016
Madelen Castillo Santaelena. Organización biofarmacéutica cubana. Correo electrónico: madelen@cim.sld.cu
Vivian Isabel Antúnez Saiz. Universidad de la Habana, Cuba. Correo electrónico: vivian@ceted.uh.cu
Edith Martínez Delgado. CUJAE, Cuba. Correo electrónico: Correo electrónico: edithmd@ind.cujae.edu.cu