INTRODUCCIÓN
Dentro del género Phaseolus , el frijol común (Phaseolus vulgaris L.) es la especie más ampliamente cultivada en el mundo (Hnatuszko-Konka et al., 2019). En Cuba es un cultivo de gran importancia. Constituye un componente esencial de la canasta básica familiar y de la dieta alimenticia diaria para la mayoría de la población cubana. Esta planta presenta un promedio de 22% de proteínas (Miranda-Lorigados et al., 2006) y contiene además, abundante fibra dietética, diferentes tipos de carbohidratos, vitaminas y minerales (FAO, 2017).
Sin embargo, la producción nacional de P. vulgaris no suple la demanda de este cultivo en Cuba, por lo que el país tiene que destinar gran cantidad de divisas en la importación (Lamz et al., 2016).
En Cuba, como en la mayoría de los países del mundo, existe preocupación por el cambio climático y sus posibles impactos en el sector productivo. La producción de frijol común se ha visto afectada por varios factores bióticos y abióticos. Los estreses ambientales, como el hídrico, salinidad, temperaturas extremas, entre otros, influyen en el crecimiento y productividad de las plantas (Müller y Munné-Brosch, 2015; Driedonks et al., 2018). Especialmente, las etapas de desarrollo que comprende la fase reproductiva en frijol común, son sensibles a las altas temperaturas lo que trae consigo una reducción en el número de legumbres y de semillas debido a la mayor abscisión de flores y legumbres (Omae et al., 2012).
En frijol común las investigaciones relacionadas con la tolerancia al estrés por calor se han centrado fundamentalmente en evaluaciones ex vitro de la respuesta aérea de las plantas. En este sentido, la selección de indicadores que permitan caracterizar la respuesta de las plantas en tales condiciones de estrés ha sido objeto de varias investigaciones. Se menciona por ejemplo el contenido de agua de las hojas (Omae et al., 2012) así como la pérdida de electrólitos y la liberación de fosfato inorgánico en tejido foliar (Collado et al., 2016b).
Por otra parte, las técnicas de mejoramiento genético in vitro pueden facilitar la obtención de cultivares resistentes frente a condiciones adversas como las altas temperaturas (Collado et al., 2016b) pero es indispensable, como premisa, contar con un protocolo de regeneración de plantas.
A pesar de las dificultades en la regeneración de plantas in vitro en frijol común, se ha obtenido plantas vía organogénesis (Arellano et al., 2009; Quintero-Jiménez et al., 2010; Collado et al., 2013; Castillo et al., 2015; Collado et al., 2016a; Hnatuszko-Konka et al., 2019) y embriogénesis somática (Kwapata et al., 2010; Nafie et al., 2013; Cabrera-Ponce et al., 2014). Para ello se han utilizado como explantes plántulas intactas, ejes embrionarios, cotiledones, nudos cotiledonales, peciolos, entrenudos, brotes axilares, hipocotilos y hojas (Veltcheva y Svetleva, 2005; Dang y Wei, 2009; Gatica et al., 2010).
En el Instituto de Biotecnología de las Plantas se desarrolló un protocolo de regeneración de brotes de P. vulgaris cv. ‘ICA Pijao’, vía organogénesis indirecta (Collado et al., 2013) que podría ser utilizado en los experimentos de transformación genética y en la regeneración in vitro de líneas obtenidas en los programas de mejoramiento genético en la búsqueda de cultivares tolerantes a altas temperaturas. Además, se ha realizado la selección de variables fisiológicas, para determinar la respuesta ante estrés térmico inducido de cultivares de frijol común crecidos en casa de cultivo (Collado et al., 2016b). Sin embargo, el desarrollo de protocolos de selección in vitro a altas temperaturas en este cultivar permitiría elevar la eficiencia de la selección al trabajar in vitro con volúmenes mayores de plantas antes de transferirlas a casas de cultivo o campo. En ese contexto, los indicadores para determinar la respuesta de las plantas deben ajustarse a dichas condiciones. Por lo antes expuesto, el presente trabajo se realizó con el objetivo de determinar el efecto del tratamiento térmico a altas temperaturas sobre la germinación in vitro de P. vulgaris L. cv. ‘ICA Pijao’.
MATERIALES Y MÉTODOS
Material vegetal y tratamiento térmico
Se emplearon semillas maduras de 1-4 meses de cosechadas del cultivar ‘ICA Pijao’ obtenidas en casa de cultivo bajo condiciones semicontroladas. Dicho cultivar está incluido en los programas de mejoramiento genético que se desarrollan en el país, ya que es uno de los más atractivos para los pequeños productores, presenta un rendimiento elevado y posee hábito de crecimiento erecto lo que permite la cosecha mecanizada. Este cultivar es originario de Colombia y produce semillas pequeñas de color negro (código hex: #000000).
Se estudiaron dos condiciones de tratamiento de calor, este procedimiento se realizó antes del proceso de desinfección de las semillas. Se emplearon 100 semillas por tratamiento, las cuales fueron expuestas al tratamiento térmico durante dos horas (Morales et al., 2006).
Los tratamientos realizados se describen a continuación:
Tratamiento 1: Las semillas fueron expuestas a temperatura ambiente (28 ± 2 °C) (Control). Para ello, se colocaron en placas de Petri de 9.0 cm de diámetro y se sellaron con Parafilm.
Tratamiento 2: Las semillas fueron expuestas a 35 ± 2 °C en una incubadora IF-3B (SAKURA-JAPÓN). Para la realización del tratamiento, las semillas se colocaron en placas de Petri de 9.0 cm de diámetro, se sellaron con Parafilm y se expusieron al tratamiento térmico.
Tratamiento 3: Las semillas se sumergieron en agua a 35 ± 2 °C en un baño térmico (LAUDA E 100). Para la realización del tratamiento las semillas se colocaron en bolsas de polipropileno confeccionadas con malla para sombreo de color negro con porcentaje de sombra de 50%.
El experimento se repitió dos veces en el tiempo.
Germinación in vitro
Posterior al tratamiento térmico las semillas se desinfectaron y para ello se siguió el protocolo descrito por García et al. (2008). Una vez desinfectadas, se colocaron 10 semillas por frasco para un total de 100 semillas por tratamiento, en un medio de cultivo de germinación compuesto por Sales MS (Murashige y Skoog, 1962), 1.0 mg l-1 de tiamina, 1.13 mg l-1 de 6- bencilaminopurina (6-BAP), 30 g l-1 de sacarosa, 7.0 g l-1 de agar (BIOCEM). Los medios de cultivo en estado semisólido se distribuyeron en frascos de vidrio con capacidad total de 250 ml, a los que se les adicionaron 30 ml de medio de cultivo. Los frascos fueron colocados en cámara de crecimiento a oscuridad constante y temperatura de 28 ± 2 °C.
A los tres días de cultivo, se cuantificó el número de semillas germinadas por frasco de cultivo y se calculó el porcentaje de germinación por frasco (PG) de acuerdo con la siguiente ecuación: PG = (SG/NTS) x 100. Siendo SG es el número de semillas que emitió radícula a las 72 horas y NTS es el número total de semillas. Además, en 60 semillas por tratamiento seleccionadas al azar, se evaluaron las variables asociadas a la germinación de las semillas: longitud y grosor de la radícula (cm) y longitud de la plúmula (cm). Para ello, se empleó una regla graduada (cm) y un pie de rey.
Análisis estadístico
Para el análisis de los valores de porcentaje de germinación, longitud y grosor de la raíz y largo de la plúmula se emplearon las pruebas H de Kruskall Wallis y U de Mann Whitney (p≤0.05) previa comprobación de los supuestos de normalidad y homogeneidad de varianza. El paquete estadístico empleado fue Statistic Packaged for Social Science (SPSS) versión 21.0 sobre Windows.
RESULTADOS Y DISCUSIÓN
El tratamiento térmico a 35 ± 2 °C (incubadora o inmersión en agua en baño térmico) no redujo la germinación in vitro de semillas de P. vulgaris cv. ‘ICA Pijao’ por debajo del 90% (Figura 1). El tratamiento 3 (inmersión en agua a 35 ± 2 °C en baño térmico) mostró el menor valor con diferencias significativas con respecto a los otros tratamientos.
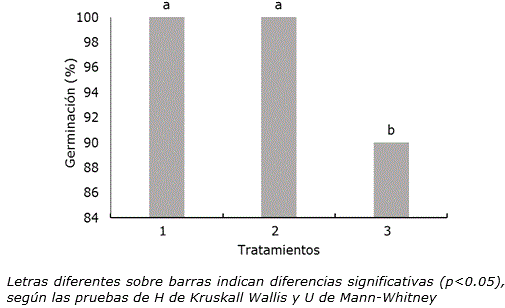
Figura 1. Influencia de las condiciones de tratamiento térmico en la germinación in vitro de semillas de Phaseolus vulgaris L. cultivar ‘ICA Pijao’ a los tres días de cultivo. n=100. 1: Control, semillas a temperatura ambiente (28 ± 2 °C), 2: semillas a 35 ± 2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35 ± 2 °C en un baño térmico durante 2 h.
En la respuesta observada en el tratamiento 2 (semillas a 35 ± 2 °C en una incubadora durante 2 h) sin diferencias significativas con el control, pudieron influir las condiciones ambientales a las que se encontraban expuestas las semillas para su germinación in vitro. Posterior al tratamiento térmico las semillas se colocaron dentro de un frasco y sobre medio de cultivo que proporciona la humedad necesaria. En este sentido, Grey et al. (2011) indicaron que para cierto rango de temperaturas elevadas, la velocidad de absorción de agua y de las reacciones químicas es mayor y las semillas germinan sin dificultad.
La germinación de semillas comprenden tres etapas sucesivas que se superponen parcialmente: la absorción de agua por imbibición, el inicio de la actividad enzimática y del metabolismo respiratorio y el crecimiento y división celular. En las primeras horas se produce una intensa absorción de agua por los tejidos de la semilla; dicho incremento va acompañado de un aumento proporcional en la actividad respiratoria (Doria, 2010). La disminución en la germinación de las semillas tratadas por inmersión en agua a 35 ± 2 °C durante 2 h (tratamiento 3) podría estar relacionada con afectaciones producidas por el agua caliente en la semilla (Alexander y Sánchez, 2002). Aunque es necesaria el agua para la rehidratación de las semillas, un exceso de ella actuaría desfavorablemente para la germinación, pues dificultaría la llegada de oxígeno al embrión y el consumo se incrementa considerablemente cuando comienza la imbibición de la semilla (Matilla, 2008).
Este resultado podría responder también a las características propias de la semilla ya que con frecuencia la inmersión en agua caliente se emplea en otras especies para favorecer la germinación. Por ejemplo, Ramos (2015) mediante la aplicación de tratamientos pregerminativos a semillas de Irapay (Lepidocaryum tenue Mart.), obtuvieron 100% de germinación después de sumergirlas en agua caliente (50 °C) durante tres minutos.
Adicionalmente, los resultados evidenciaron que la longitud de la radícula se afectó en las semillas sometidas a los tratamientos térmicos sin diferencias significativas entre ellos (Figura 2).
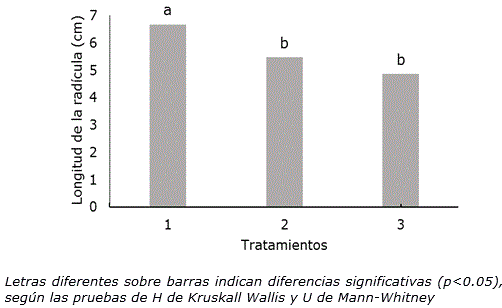
Figura 2. Longitud de la radícula de Phaseolus vulgaris L. cultivar ‘ICA Pijao’ en las dos condiciones de tratamiento térmico ensayados a los tres días de cultivo. n=60. 1: Control, semillas a temperatura ambiente (28 ± 2 °C), 2: semillas a 35 ± 2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35±2 °C en un baño térmico durante 2 h.
La temperatura de 35 °C aplicada a las semillas, durante dos horas, pudo haber influido en una disminución de los niveles endógenos de reguladores del crecimiento como citoquininas y auxinas, que propiciaron una disminución del crecimiento y por consiguiente una reducción en la longitud de la radícula. Según Vásquez y Torres (2006) las altas temperaturas influyen en el incremento del contenido de ácido abscísico (ABA) que es un inhibidor y se activan los sistemas oxidativos, los cuales reducen el nivel de auxina libre y provocan una disminución de la elongación de las células. El crecimiento es un proceso asociado, tanto con el incremento del número de células (división celular), como en su tamaño (alargamiento celular). La disminución de la longitud de la radícula se pudiera interpretar como una inhibición en el alargamiento celular, ya que este es más sensible a condiciones de estrés que la división celular (Hsiao y Xu, 2000).
En el caso del tratamiento 2 (semillas a 35 ± 2 °C en una incubadora durante 2 h), el efecto pudo deberse, además, a la deshidratación de los tejidos del embrión que provocan los tratamientos térmicos a la semilla (Chaves-Barrantes y Gutiérrez-Soto, 2017) que se debe entre otros fenómenos a que las altas temperaturas afectan considerablemente la permeabilidad de las membranas celulares en las radículas (Kurepin et al., 2015). Contrario a estos resultados, Moo-Muñoz et al. (2016) indicaron que el secado en horno con temperatura constante de 35 °C en semillas de Capsicum chinense Jacq., promueve una mayor longitud de la radícula. Los resultados obtenidos en la presente investigación cuando las semillas fueron tratadas en la incubadora a 35 ± 2 °C se produjo una disminución de 1.2 cm de la radícula en relación con el tratamiento control (tratamiento 1).
Los resultados demostraron, igualmente, que con el tratamiento térmico se afectó el grosor de la radícula. Esta variable fue significativamente menor en el tratamiento por inmersión en agua a 35 ± 2 °C (Figura 3). Este resultado podría estar relacionado con las afectaciones sufridas por el embrión cuando las semillas estuvieron expuestas en agua a 35 ± 2 °C durante dos horas, lo que podría propiciar dificultades para la estimulación del crecimiento secundario en la radícula (Vázquez y Torres, 2006; Matilla y Rodríguez-Gacio, 2013).

Figura 3. Grosor de la radícula de P. vulgaris L. cultivar ‘ICA Pijao’ en las dos condiciones de tratamiento ensayadas a los tres días de cultivo. n=60. 1: Control, semillas a temperatura ambiente (28 ± 2 °C), 2: semillas a 35 ± 2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35 ± 2 °C en un baño térmico durante 2 h.
Al igual que en las variables anteriores, la longitud de la plúmula se redujo significativamente (p≤0.05), bajo las dos condiciones de tratamiento térmico a 35 ± 2 °C (Figura 4). Al estar las semillas tratadas durante dos horas a 35 ± 2 °C posiblemente se generó una disminución en el metabolismo de los carbohidratos lo que influyó negativamente en el crecimiento de la plúmula (Vázquez y Torres, 2006).

Figura 4. Longitud de la plúmula de Phaseolus vulgaris L. cultivar ‘ICA Pijao’ en las dos condiciones de tratamiento ensayadas a los tres días de cultivo. n=60. 1: Control, semillas a temperatura ambiente (28±2 °C), 2: semillas a 35±2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35±2 °C en un baño térmico durante 2 h.
De acuerdo con el criterio de Chaves-Barrantes y Gutiérrez-Soto (2017), las plantas en general sufren estrés por temperaturas bajas o altas con respecto al umbral que se ha establecido para cada especie. En este sentido, indicaron, a partir de referencias de la literatura científica, que el frijol común tiene un umbral máximo de 34 °C. En este trabajo las semillas se sometieron a tratamiento térmico durante 2 h a 35±2 °C y aunque la germinación no se redujo por debajo del 90% sí se observó un efecto negativo en la longitud y grosor de la radícula y en la longitud de la plúmula.
Las estudios sobre el efecto de condiciones de estrés por calor en la zona radicular de las plantas son más escasos que los que se han dedicado al área aérea debido posiblemente a las dificultades en la observación de las raíces en el campo (Huang y Gao, 2000). No obstante, Polanía et al. (2009), analizaron en invernadero el desarrollo y la distribución de raíces de 16 cultivares de fríjol común bajo estrés. Estos autores identificaron y caracterizaron los mecanismos radicales asociados a la tolerancia e igualmente algunos de respuesta en la parte aérea de la planta. Este método resultó apropiado para determinar diferencias fenotípicas en longitud total y específica de raíces así como distribución de raíces a diferentes profundidades. En correspondencia con lo anterior, la identificación en este trabajo de variables que se afectan durante la germinación in vitro de semillas del cultivar ‘ICA Pijao’ pretratadas a 35 ± 2 °C, podría enriquecer la caracterización de líneas de plantas obtenidas por métodos de mejoramiento genético y ser tomadas como indicadoras para la selección in vitro de tolerancia al estrés inducido por altas temperaturas.
Finalmente, considerando los resultados, la facilidad de aplicación y la no afectación de la germinación, lo cual garantiza que se trabaje con el máximo de semillas disponibles, se recomienda utilizar el tratamiento térmico a 35 ± 2 °C en incubadora.
CONCLUSIONES
El tratamiento térmico a semillas de P. vulgaris cv. ‘ICA Pijao’ a 35 ± 2 °C durante 2 h reduce la longitud de la plúmula así como la longitud y el grosor de la radícula de semillas germinadas in vitro. Atendiendo a lo anterior este tratamiento podría emplearse para inducir estrés por altas temperaturas en dicho cultivar en un protocolo de selección in vitro .














