INTRODUCCIÓN
El cocotero (Cocos nucifera L.) (Arecaceae), es uno de los cultivos básicos en la economía agrícola de algunos países del sudeste asiático como Indonesia, Malasia y Filipinas y es considerada como una de las 20 plantas cultivadas más importantes en el mundo. Se encuentra distribuida principalmente entre las islas del océano Indico y Pacífico, África y el continente americano (Lima et al., 2015).
En el año 2016, la producción mundial de nueces de coco superó las 59 000 000 t, asociado a más de 90 países. Dicha producción se concentra en países como Indonesia (28.13%), Filipinas (23.89%) e India (16.61%). Colombia ocupa la vigésimo cuarta posición, por aportar sólo 0.23% de la producción. Sin embargo, la eficiencia de la producción en Colombia es de 8.62 t ha-1, y supera el promedio mundial (5 t ha-1). Ello se atribuye al clima y a la fertilidad de los suelos (Trujillo y Arias, 2013).
El cultivo de la palma de coco en Colombia se desarrolla principalmente en el litoral pacífico, pero ha disminuido debido a la enfermedad conocida como el anillo rojo, causada por el nemátodo Bursaphelenchus cocophilus (Cobb) y su vector Rhynchophorus palmarum (L.), que ocasiona graves pérdidas económicas a los agricultores (Mosquera y Viáfara, 2008). Además, el cultivo no cuenta con la atención técnica adecuada y las dificultades relacionadas con el mantenimiento han hecho que los productores agrícolas nacionales de coco cada día sean menos, al encontrar mejores alternativas económicas en otros cultivos (Trujillo y Arias, 2013).
Según Altamirano et al. (2011) con los consecuentes problemas técnicos, sociales y económicos que presenta el cultivo, una de las alternativas para aumentar la producción de coco es sembrar cultivares híbridos. Las palmeras de coco híbridas, resultantes del cruzamiento controlado entre materiales altos con enanos, presentan mejores características que sus progenitores, debido a una complementariedad de los componentes del rendimiento y la posible presencia de heterosis (Ramanandam et al., 2017). Dentro de las características que presentan los híbridos están la precocidad, y gran cantidad de frutos por racimo de los cultivares enanos, con la rusticidad y mayor tamaño de frutos del cultivar criollo alto Pacifico, además de otras ventajas como el bajo porte de la planta lo que facilita el manejo del cultivo, mayor densidad de siembra (141 palmas por hectárea), mayor rendimiento y sabor más dulce del agua (Altamirano et al., 2011; Balderas y González, 2013).
El aumento en las capacidades de producción es difícil de lograr si solo depende de la propagación natural a través de la semilla. Además, propagar cultivares híbridos de cocotero usando semillas sexual no es lo indicado debido a la segregación, por lo que se debe considerar enfoques alternativos (Namboothiri et al., 2008; Solís-Ramos et al., 2012). En ese sentido, el cultivo de tejidos vegetales in vitro puede ser utilizado para apoyar programas de mejoramiento genético, para propagar palmas élite seleccionadas en diferentes regiones y para reemplazar plantaciones comerciales obtenidas de semillas sexual (Ocampo y Núñez, 2007).
Desde esta perspectiva, la embriogénesis somática es uno de los métodos de regeneración de plantas que puede proporcionar una alternativa conveniente para propagar C. nucifera, gracias a su potencial para la multiplicación clonal en esta especie (Perera et al., 2009). De acuerdo con Nascimento-Gavioli et al. (2017), durante la embriogénesis somática, las células se desdiferencian pasando a un estado embriogénico, por lo que cambian su expresión genética antes de volver a ingresar al ciclo celular para formar tejidos especializados similares a los que se obtienen durante la embriogénesis cigótica, lo que garantiza la conservación de la identidad genética y mejora la calidad fitosanitaria del material vegetal con el que se trabaja. De acuerdo con lo anterior, el objetivo de esta investigación fue inducir la formación de callos con estructuras embriogénicas a partir del cultivo in vitro de inflorescencias inmaduras en cultivares híbridos de cocotero.
MATERIALES Y MÉTODOS
Localización
El estudio se realizó en el Laboratorio de Cultivo de Tejidos de la Unidad de Biotecnología del Centro Internacional de Agricultura Tropical (CIAT), ubicado en el municipio de Palmira, departamento del Valle del Cauca (Colombia) entre los 3° 30’ Norte y 76° 19’ Oeste, a una altura de 965 msnm, con una precipitación anual promedio de 763 mm, humedad relativa de 78% y una temperatura media anual de 24.5 °C.
Material vegetal
Se emplearon inflorescencias inmaduras de cocotero que cronológicamente requerían tres, cuatro y cinco meses para llegar al punto de maduración. Estos estados se reconocieron como -3, -4 y -5, respectivamente, según lo referido por Perera et al. (2007).
Las inflorescencias se colectaron de cultivares híbridos de cocoteros adultos, resultantes de cruzamientos entre cultivares altos y enanos (de aproximadamente veinte años) ubicados en el Centro Internacional de Agricultura Tropical - CIAT.
Desinfección
Para la desinfección exterior de las inflorescencias se utilizó etanol al 70% (v/v), frotando el material vegetal y eliminando residuos por un periodo de cinco minutos. La desinfección de las raquillas se realizó en cámara de flujo laminar mediante inmersiones en hipoclorito de calcio al 2% (v/v) durante 12 minutos, seguido de cuatro enjuagues por un periodo de un minuto cada uno con agua destilada estéril (Perera et al., 2009).
Selección del tipo de explante
Los explantes utilizados fueron ovarios y anteras, provenientes de inflorescencias con estados de desarrollo -3, -4 y -5 (Perera et al., 2007). Las anteras, se diferenciaron en cuatro tipos, según su posición en la raquilla, para un total de cinco tipos de explantes (Figura 1). Los explantes, se colocaron en el medio de cultivo basal CRI 72 (Karunaratne y Periyapperuma, 1989), con sacarosa al 5% (m/v), 0.2% (m/v) de Gelrite y pH 5.8 antes de la esterilización y tres concentraciones (100, 200 y 300 μM) de ácido 2,4-diclorofenoxiacético (2,4-D). La unidad experimental estuvo constituida de tres explantes por placa de Petri. Se establecieron cinco repeticiones por tratamiento para un total de 15 explantes por tratamiento y fue repetido en el tiempo tres veces.
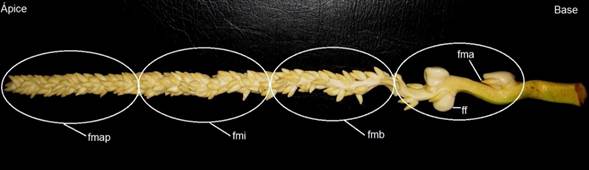
Figura 1. Ubicación de los explantes utilizados a partir de la inflorescencia de Cocos nucifera. Raquilla con flores femeninas (ff), flores masculinas acompañantes (fma), flores masculinas basales (fmb), flores masculinas intermedias (fmi), flores masculinas apicales (fmap).
Formación de callos con estructuras embriogénicas a partir de ovarios en tres medios de cultivo
Para este experimento únicamente se utilizaron los ovarios, procedentes de inflorescencias con estados de desarrollo -3, -4 y -5. Los explantes se colocaron en medio de cultivo basal CRI 72 con variación en las concentraciones de 2,4-D y carbón activado para un total de tres variantes de medios de cultivo (medio de cultivo 1: con 1 g l-1 de carbón activado y 100 μM de 2,4-D; medio de cultivo 2: con 1 g l-1 de carbón activado y 200 μM de 2,4-D y medio de cultivo 3: con 2.5 g l-1 de carbón activado y 300 μM de 2,4-D). La unidad experimental estuvo compuesta por tres explantes colocados en una placa de Petri. Se establecieron siete repeticiones por tratamiento para un total de 21 explantes por tratamiento y fue repetido en el tiempo cinco veces.
Diseño Experimental
Para la selección del tipo de explante se utilizó un diseño completamente al azar, con tres repeticiones y un arreglo factorial conformado por cinco tipos de explantes (ovarios y cuatro tipos de anteras), tres concentraciones de 2,4-D y tres estados diferentes de desarrollo de las inflorescencias, para un total de 45 tratamientos. Para la formación de callos con estructuras embriogénicas a partir de ovarios, se implementó un diseño completamente al azar con cinco repeticiones y un arreglo factorial compuesto por los tres medios de cultivo mencionados anteriormente y ovarios en tres estados de desarrollo diferentes, para un total de nueve tratamientos.
Variables de respuesta
Cada tratamiento se dejó en condiciones de oscuridad total a 26 ± 2 °C por un período de tres meses, en el cual se calculó el porcentaje de formación de callos con estructuras embriogénicas mediante la siguiente fórmula: % Callos con estructuras embriogénicas = (No. de callos con estructuras embriogénicas por tratamiento/ No. total de explantes por tratamiento) * 100.
Análisis estadístico
Para el análisis de los datos se realizó el supuesto de normalidad mediante la prueba de Shapiro Wilk y la homogeneidad de varianza se evaluó teniendo en cuenta la prueba de Levene. Para la identificación del tipo de explante, así como para el de formación de callos con estructuras embriogénicas a partir de ovarios colocados en tres medios de cultivo, se realizó un análisis de varianza (ANOVA) para cada uno de los factores. El análisis estadístico se realizó mediante el paquete SAS versión 7.0 y se hizo comparaciones de medias mediante la prueba de Tukey con un nivel de significancia de 0.05.
RESULTADOS Y DISCUSIÓN
Transcurridos 90 días de haber colocado los explantes en los respectivos medios de cultivo, se observó que en los tratamientos en los que se cultivaron anteras no hubo respuesta para la formación de callos con estructuras embriogénicas. Estos explantes mostraron únicamente necrosis en los tejidos.
Por el contrario, en los tratamientos donde se cultivaron ovarios inmaduros sí hubo formación de callos con estructuras embriogénicas. Además, en este tipo de tejido se observó que, si se dejaba pasar más tiempo, los callos disminuían la capacidad de formar estructuras embriogénicas. Atendiendo a ello, se seleccionaron los ovarios como tipo de explante para continuar los estudios.
Las características morfológicas de los callos se correspondieron con lo descrito previamente en la literatura científica. En este sentido, en C. nucifera, los callos con estructuras embriogénicas se caracterizan por ser masas celulares densas, brillantes, de color blanco perla, con estructuras globulares bien organizadas que dan lugar a embriones somáticos (Figura 2 A), mientras que los callos no embriogénicos (Figura 2 B) son de color amarillo o marrón, fibrosos y opacos con crecimiento desorganizado de células (Nascimento-Gavioli et al., 2017).

Figura 2. Callos a partir de inflorescencias inmaduras en Cocos nucifera. A. Callo con estructuras embriogénicas. B. Callo sin estructuras embriogénicas con signos de necrosis. barra = 1cm.
Los resultados del presente estudio apoyan lo referido porViñas y Jiménez (2011), quienes informaron que en individuos de una misma especie de palma pueden existir variaciones en la respuesta a la embriogénesis, lo cual depende del tipo de tejido utilizado. Un ejemplo, son los resultados descritos por Badawy et al. (2005) en palma de dátil Phoenix dactylifera L. (Arecaceae), quienes usaron como explantes ápices, yemas axilares y primordios foliares, en donde se observó respuesta diferencial en la formación de callos con estructuras embriogénicas entre los diferentes tejidos.
Según el análisis de varianza, no se encontraron diferencias significativas entre el porcentaje de formación de callos con estructuras embriogénicas respecto al estado de desarrollo de la inflorescencia. Además, no se observó interacción entre el estado de desarrollo de la inflorescencia y la concentración de 2,4-D en el medio de cultivo.
Los resultados evidenciaron que la formación de callos con estructuras embriogénicas estuvo influenciada por la concentración de 2,4-D en el medio de cultivo. Con la menor concentración de 2,4-D, el porcentaje de formación de callos embriogénicos fluctuó entre 17.2 y 37.8, en tanto que para la concentración de 200 μM los porcentajes fueron menores. Además, se observó que en el medio de cultivo con la mayor concentración de 2,4-D no hubo respuesta de los explantes (Tabla 1) y se necrosaron.
Tabla 1. Porcentaje de formación de callos con estructuras embriogénicas en cultivares híbridos de Cocos nucifera, a partir de ovarios obtenidos de inflorescencias inmaduras con diferentes estados de desarrollo.
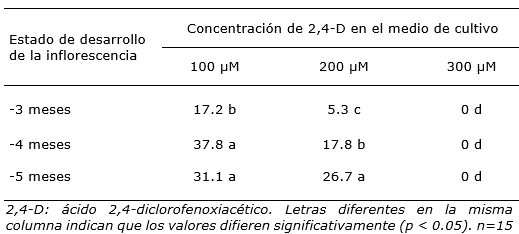
Es importante resaltar que el medio de cultivo con menor concentración de 2,4-D (100 μM) presentó mejor respuesta de formación de callos con estructuras embriogénicas, con porcentajes hasta del 37.8% (Tabla 1). Los resultados concuerdan con lo descrito por Silveira et al. (2013), quienes informaron que la concentración de 2,4-D en el medio de cultivo es esencial en la reprogramación genética de células somáticas durante la embriogénesis temprana, lo cual es necesario para la indiferenciación celular y para adquirir la condición embriogénica. Sin embargo, con la mayor concentración de 2,4-D no se formaron callos en los tres tipos de explantes. Esta información confirma lo descrito por Abdolvand et al. (2014), quienes indicaron que el uso de 2,4-D en palmas induce la formación de callos embriogénicos, aunque si la concentración de este regulador de crecimiento en el medio de cultivo es demasiado alta, el resultado es negativo.
También se observó que independientemente del estado de desarrollo de los ovarios, hubo formación de callos con estructuras embriogénicas cuando fueron establecidos en medios de cultivo con 100 y 200 µM de 2,4-D. De acuerdo con Nguyen et al. (2015), la concentración de 2,4-D en el medio de cultivo es importante para la formación de callos con estructuras embriogénicas en C. nucifera y difiere según el cultivar utilizado.
Por otra parte, después de 12 semanas de colocar los ovarios en los diferentes medios de cultivo, se observó la formación de callos con estructuras embriogénicas. Los porcentajes de respuesta variaron significativamente entre tratamientos, de acuerdo con el estado de desarrollo de los ovarios, excepto para -3 meses donde los porcentajes en los tres medios de cultivo fueron muy bajos (Tabla 2).
Tabla 2 Porcentaje de formación de callos con estructuras embriogénicas de Cocos nucifera, a partir de ovarios procedentes de inflorescencias inmaduras, en diferentes medios de cultivo.
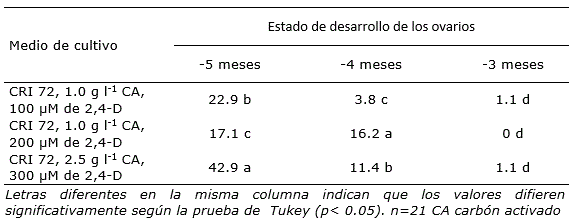
En el estado de desarrollo -5 meses, el porcentaje de formación de callos con estructuras embriogénicas fluctuó entre 17.1 y 42.9, mientras que en -4 meses, fue entre 3.8 y 16.2 (Tabla 2). Los resultados de esta investigación contrastan con lo informado por Perera et al. (2007), debido a que en sus investigaciones con cultivares altos de cocotero, los ovarios con un estado de desarrollo más avanzado presentaron mayor respuesta de formación de callos con estructuras embriogénicas cuando fueron colocados en medio de cultivo con altas concentraciones de 2,4-D.
Es importante mencionar que, la adición de carbón activado en el medio de cultivo con 300 µM de 2,4-D favoreció la formación de callos con estructuras embriogénicas, respecto a los tratamientos con esta misma concentración de auxina durante la etapa de selección del tipo de explante donde no hubo formación de callos debido a la oxidación de tejidos. Según Steinmacher et al. (2007) un problema recurrente en cocotero es la oxidación de tejidos cuando los explantes se cultivan in vitro, lo que podría ser una de las principales limitantes para establecer un protocolo eficiente de regeneración vegetativa en esta especie. Para disminuir los problemas de oxidación in vitro, frecuentemente se adiciona carbón activado al medio de cultivo, con el fin de reducir o eliminar compuestos indeseables y mejorar las respuestas morfogénicas de los explantes. De acuerdo con Viñas y Jiménez (2011), el uso de carbón activado proporciona muchas ventajas, incluida la promoción de la embriogénesis. Sin embargo, el uso de este antioxidante también puede llegar a adsorber hasta en un 99% de los componentes importantes del medio de cultivo como vitaminas y reguladores de crecimiento vegetal entre las que se encuentran auxinas como el 2,4-D (Bandupriya et al., 2016). Según Lédo et al. (2019), debido a este tipo de dificultades técnicas, el desarrollo de protocolos de propagación en C. nucifera ha progresado lentamente, por lo que se debe seguir investigando en la generación y optimización de un protocolo eficiente de multiplicación clonal de cocotero in vitro, especialmente en cultivares seleccionados. Los resultados de este trabajo constituyen un punto de partida para el desarrollo de protocolos de propagación in vitro de los cultivares híbridos de cocotero.
CONCLUSIONES
Los ovarios obtenidos de inflorescencias inmaduras de cultivares híbridos de cocotero tienen potencial para la propagación clonal a diferencia de las anteras que son un explante no apto para la formación de callos bajo las condiciones experimentales ensayadas. En este contexto, la adición de 100 μM de 2,4-D en el medio de cultivo CRI 72 favorece la formación de callos con estructuras embriogénicas. Los resultados del presente trabajo son un primer avance en el desarrollo de un protocolo de propagación clonal en cultivares híbridos de cocotero, por lo que se debe seguir investigando en el perfeccionamiento de una metodología eficiente de multiplicación en este tipo de materiales vegetales, lo cual es una necesidad inherente para la industria en Colombia.














