INTRODUCCIÓN
El jengibre (Zingiber officinale Roscoe) es una planta rizomatosa, perenne y es ampliamente usada como especia en alimentos y bebidas. Se usa especialmente en la mayoría de los países asiáticos (Morales, 2007). En los últimos años ha crecido su producción debido al incremento de su uso en la medicina, como materia prima para la industria farmacéutica y en la vida cotidiana (Jyotsna et al., 2017).
En medicina se ha estudiado como anticancerígeno y antimicrobiano. Se han identificado metabolitos secundarios de interés comercial tales como flavonoides y fenoles, así como el shogaol y el gingerol como los principales compuestos bioactivos (Garace et al., 2017).
Los mercados internacionales han establecido como requisito, cultivos con un uso reducido de insumos químicos, con tecnologías limpias y amigables con el ambiente. Al respecto la producción masiva de jengibre por métodos de laboratorio garantiza un uso regulado de agroquímicos con la producción de plantas libres de enfermedades y plagas (Palma y Matarrita, 1992).
Los estudios que se han realizado en Costa Rica incorporando biotecnología al cultivo de jengibre son limitados. Sin embargo, se han hecho esfuerzos significativos en otros países donde también se siembra. La literatura científica disponible se concentra principalmente en la micropropagación vía organogénesis a partir de yemas de rizoma utilizados como explante inicial en medios de cultivo semisólidos.
La primera publicación sobre propagación in vitro de jengibre corresponde a Hosoki y Sagawa (1977). Posteriormente, De Lange et al. (1987) micropropagaron jengibre con el fin de eliminar los nematodos Meloidogyne incognita y M. javanica en el sur de África. Un año después, Bhagyalakshmi y Singh (1988) utilizaron las técnicas in vitro para clonar una variedad de jengibre con altas concentraciones de oleorresinas.
Además, la propagación in vitro vía organogénesis en esta especie se ha informada por Noguchi y Yamakawa (1988), Ikeda y Tanabe (1989), Palma y Matarrita (1992), Khatun et al. (2003) y Kavyashree (2009). De igual forma, la propagación vía callo y embriogénesis somática se evidencia en las publicaciones de Babu et al. (1992) y Kackar et al. (1993). También Dekkers et al. (1991) utilizaron las técnicas in vitro para conservar germoplasma de jengibre así como Sharma y Singh (1997) para eliminar agentes causales de enfermedades.
La propagación in vitro de plantas puede realizarse tanto en medios de cultivo semisólidos como en medios de cultivo líquidos a través de Sistemas de Inmersión Temporal (SIT). El SIT reduce los costos de producción y permite la semi-automatización del proceso. Además, facilita la toma de los nutrientes por los explantes ya que los medios de cultivo semisólidos hacen más lenta la difusión de los nutrientes a través del agar, las condiciones de cultivo son uniformes, permite obtener elevados coeficientes de multiplicación, se sustituyen fácilmente los medios de cultivo sin cambio de recipiente de cultivo y finalmente se reduce el tiempo de transferencia (Etienne y Berthouly, 2002). El medio de cultivo líquido en SIT permite la absorción rápida y eficiente de nutrientes por toda la superficie del tejido e influye en el desarrollo y estructura de estos (Preil, 2005).
En el cantón de Guatuso, Costa Rica, los productores han realizado selecciones de plantas de jengibre cv. ‘Gran Caimán’ durante más de 7 años. Sin embargo, no se dispone de una metodología para su propagación in vitro que les garantice contar con un elevado número de plantas con calidad genética y fitosanitaria para iniciar con éxito una plantación. Por otra parte, a pesar de las ventajas del empleo de los SIT para la propagación in vitro de plantas, hasta el presente no se ha informado de su aplicación en el cultivo de jengibre. Considerando estos antecedentes, la investigación tuvo como objetivo multiplicar Zingiber officinale Roscoe. en SIT.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron yemas de rizomas de jengibre cv. ‘Gran caimán’ de las cuales se obtuvieron los brotes según protocolo propuesto por Palma y Matarrita (1992). Este mismo protocolo fue utilizado en SIT.
Para determinar la respuesta de jengibre a la multiplicación in vitro en SIT , se ejecutaron cuatro experimentos con los que se seleccionaron el tiempo de inmersión, la frecuencia de inmersión, el volumen de medio de cultivo por explante y una comparación del sistema SIT, con el método convencional de propagación en medio de cultivo semisólido.
Tiempo de inmersión
Se ensayaron tres tiempos de inmersión (5, 10 y 15 minutos) y se utilizó como constante el volumen de medio de cultivo (400 ml por unidad experimental, 40 ml por explante). En cada recipiente se colocaron 10 explantes. La frecuencia de inmersión fue de 12 horas y se consideró como constante para cada tiempo de inmersión.
Frecuencia de inmersión
Se evaluaron tres frecuencias de inmersión: cuatro inmersiones cada tres horas, dos inmersiones cada 12 horas y una inmersión cada 24 horas. Se utilizó el mejor tiempo de inmersión del experimento anterior y también como constante el volumen de 40 ml/explante con 10 explantes como unidad experimental lo que requirió un volumen total de 400 ml por frasco.
Volumen de medio de cultivo
En este ensayo se evaluaron tres volúmenes de medio 30, 40 y 50 ml por explante. Cada 10 explantes se conformó una unidad experimental, de tal modo que por cada tratamiento se dispensaron 300, 400 y 500 ml por unidad SIT. El tiempo y la frecuencia de inmersión se seleccionaron de los ensayos anteriores.
Finalmente los mejores resultados en cuanto a coeficiente de multiplicación de brotes de jengibre como respuesta al tiempo de inmersión, la frecuencia de inmersión y el volumen de medio de cultivo en SIT, se compararon en un ensayo con la multiplicación de los explantes en medio de cultivo de cultivo semisólido (solidificado con agar).
En cada ensayo los explantes se mantuvieron en el medio de cultivo durante cuatro semanas.
Variables evaluadas
Las variables evaluadas en los SIT fueron las siguientes: longitud de brotes (cm), número de raíces (u) y coeficiente de multiplicación (u). Para la variable longitud se utilizó una regla graduada en mm. El coeficiente de multiplicación se determinó mediante las diferencias entre el número de brotes final y el número de brotes inicial. En el ensayo donde se compararon los resultados en SIT y medio de cultivo semisólido se evaluaron las variables anteriores y se adicionaron número de brotes/explante, No. hojas/ explante, longitud de la lámina foliar (cm), ancho lámina foliar (cm), número de raíces/explante, número de raíces/explante, longitud de raíces (cm) y relación parte aérea/raíz.
Diseño experimental y análisis estadístico
Se realizaron cuatro experimentos, con un diseño completamente al azar, con cuatro repeticiones por tratamiento y 10 plántulas de jengibre por unidad experimental. Los tratamientos consistieron en el tiempo de inmersión, la frecuencia de inmersión y el volumen de medio de cultivo por SIT, cada tratamiento estuvo conformado por tres niveles del factor. Cada uno de los tratamientos se evaluó individualmente.
Para los cuatro experimentos, se realizó un análisis de varianza mediante el programa Statistical Analysis System (SAS) previa comprobación de la normalidad de los datos y la homogeneidad de varianzas. De resultar significativo o altamente significativo, los promedios de resultado de cada tratamiento se ajustaron a un modelo de regresión con el fin de explorar y cuantificar la relación de dependencia entre las variables de respuesta o variables cuantitativas y las variables independientes en este caso el tiempo, frecuencia y volumen de medio de cultivo.
Una vez seleccionados los tratamientos de mejores resultados (tiempo de inmersión, frecuencia de inmersión y volumen de medio de cultivo) en los SIT, se compararon por medio de la prueba t de Student (p<0.05), los resultados en SIT y en medio de cultivo semisólido.
RESULTADOS Y DISCUSIÓN
El análisis de varianza no mostró diferencias significativas para las variables consideradas en este estudio, como respuesta a los tres tiempos de inmersión evaluados durante cuatro semanas después de iniciado el estudio. A cada especie, cultivar y método de propagación se le debe ajustarse la duración del tiempo de inmersión, ya que una de las respuestas que deben evitar es la hiperhidricidad, lo cual se ha demostrado, limita el desarrollo de esquejes, por ejemplo, en la micropropagación de Coffea arabica L. y se correlaciona con los tejidos y su prolongado tiempo de inmersión (Etienne y Berthouly, 2002). El análisis del tiempo de inmersión en otros cultivos tropicales como el banano cv. ‘Grande naine’ (Musa AAA) ha demostrado que presenta también influencia sobre los coeficientes de multiplicación (Colmenares y Giménez, 2003).
Los brotes que se formaron en este ensayo no mostraron síntomas de hiperhidricidad. No obstante, se consideró el menor tiempo de inmersión (5 minutos) como el recomendable para la micropropagación del jengibre mediante SIT para así prevenirla. Los tiempos de inmersión además de afectar el desarrollo del material vegetal por causa de un incremento en la hiperhidricidad provocan daños por el estrés oxidativo lo cual ha sido documentado previamente (Martre et al., 2001).
Con un tiempo de inmersión de 5 min, 40 ml de medio de cultivo por explante y tres frecuencias de inmersión, la presencia de brotes fue evidente a partir de la segunda semana de cultivo. La mayoría de estos brotes no superaban 5 mm de longitud. A partir de la tercera semana, emergieron más brotes y raíces. Ya a las cuatro semanas de cultivo se encontraron diferencias significativas cuando se evaluaron la longitud de brotes, el número de raíces y el coeficiente de multiplicación (Tabla 1).
Con inmersiones cada seis horas (cuatro inmersiones al día) se obtuvo el mayor coeficiente de multiplicación (2.9). Esta respuesta de formación de brotes en relación con la frecuencia de inmersión, se ajustó a una ecuación de regresión lineal decreciente (R2= 0.60). La importancia de considerar la frecuencia de inmersión, se acentúa si se toma en cuenta la fase de cultivo en la que deben satisfacerse oportunamente los requerimientos nutricionales del material vegetal (Escalona, 2006) o el tipo de cultivo. Tal es el caso del ñame (Dioscorea alata L.) donde las frecuencias de inmersión de cada 12 y 24 horas, mostraron menos posibilidades para asimilar nutrientes y acumular sustancias de reserva, comparadas con el tratamiento de cuatro inmersiones al día con el que los microtubérculos alcanzaron los mayores porcentajes de materia seca (Cabrera, 2009).
La frecuencia de inmersión del medio de cultivo tuvo influencia también sobre la longitud de los brotes y el número de raíces, de tal manera que los mayores valores se obtuvieron cuando la inmersión del medio de cultivo se realizó cada seis horas (Tabla 1). El medio de cultivo empleado (3 mg l-1 de Benciladenina y 1 mg l-1 de ácido naftalenacético) promovió el enraizamiento de las plantas in vitro de jengibre lo cual permitió contar simultáneamente con brotes y raíces. Estos resultados coincidieron con los obtenidos por Palma y Matarrita (1992) cuando utilizaron el mismo medio de cultivo pero solidificado con agar. En relación con la formación de raíces y brotes se demostró por Aragón et al. (2006) el efecto que tiene la adición de auxina exógena en medios de cultivos en SIT que aumentó el vigor de los explantes en plátano (Musa spp., CEMSA 3/4) y esta respuesta permitió el manejo posterior de las plántulas obtenidas, ya sea para el subcultivo y producción de brotes de buena calidad, o para la aclimatización de ese material vegetal. A partir de los resultados se seleccionó la frecuencia de inmersión cada 6 h.
De igual forma, el volumen de medio de cultivo (con tiempo de inmersión de 5 min y frecuencia de inmersión cada 6 h) influyó significativamente sobre el coeficiente de multiplicación. A la cuarta semana de cultivo se encontraron diferencias significativas entre tratamientos con el mayor valor para 60 ml (Figura 1). En relación con lo anterior, Berthouly y Etienne (2005) han demostrado que al evaluar un sistema de inmersión temporal, uno de los factores más importantes es el volumen de medio de cultivo utilizado y así lograr un sistema eficiente, lo cual se evidencia en los resultados del presente trabajo para la multiplicación in vitro de jengibre.
En el tratamiento con 20 ml de medio de cultivo por explante, se observaron plántulas cloróticas, situación que no se manifestó en los tratamientos de 40 y 60 ml por explante. Atendiendo a los resultados se seleccionó como mejor tratamiento a 40 ml/explante de medio de cultivo. Es necesario proveer a las plantas con suficientes cantidades de nutrientes esenciales, de tal manera que no sean un factor limitante para el desarrollo. Al evaluar el volumen de medio de cultivo, se comprende que existe relación entre la cantidad de explantes que se utilizan por unidad experimental con respecto al volumen de medio de cultivo y el tiempo de subcultivo (Berthouly y Etienne, 2005).
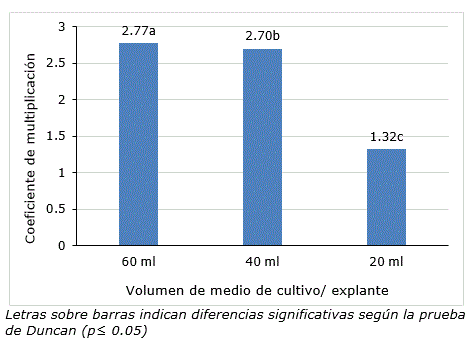
Figura 1. Coeficiente de multiplicación de plantas in vitro de Zingiber officinale en un biorreactor de inmersión temporal después de cuatro semana de cultivo con diferentes volúmenes de medio de cultivo por explante.
La comparación entre la multiplicación in vitro de Z. officinale en medio de cultivo semisólido y SIT (5 min de inmersión, cada seis horas y 40 ml de medio de cultivo por explante) demostró que este último propició mejor crecimiento y desarrollo de las plantas. En ambos sistemas de propagación se obtuvieron brotes y raíces. Las plantas mostraron características fenotípicas similares (Figura 2).

Figura 2. Multiplicación de Zingiber officinale Roscoe cv. ‘Gran Caimán’ en SIT. A, Unidad SIT usado en este estudio. B, Plántulas in vitro en medio de cultivo semisólido. C, Plántulas de jengibre con formación de raíces. D, Brotes obtenidos en SIT a las 4 semanas de cultivo.
La prueba de contraste de medias (t de Student) evidenció diferencias significativas cuando se comparó el número de brotes por explante en todo el periodo de cultivo (Figura 3).
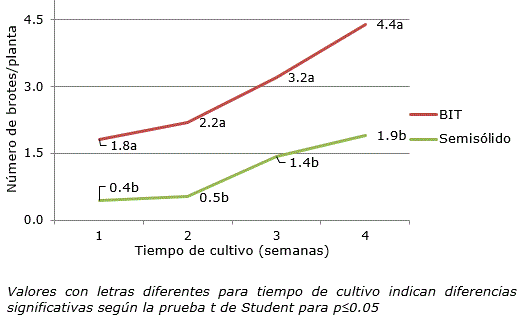
Figura 3. Número de brotes de Zingiber officinale Roscoe cv. ‘Gran Caimán’ cuantificados en un medio de cultivo líquido en SIT y en un medio de cultivo semisólido. Valores con letras diferentes para tiempo de cultivo indican diferencias significativas según la prueba t de Student para p≤0.05.
El número de brotes a las cuatro semanas de cultivo se duplicó cuando los explantes crecieron en el medio de cultivo líquido del SIT (4.40). Estos resultados están en correspondencia con el hecho de que la biomasa se distribuyó eficientemente en la mayor cantidad de brotes con respecto al medio de cultivo semisólido. El medio de cultivo líquido con inmersión temporal facilita que los explantes asimilen rápidamente los nutrientes, lo que genera una mayor respuesta en un corto tiempo (Berthouly y Etienne, 2005). De esta manera en la primera semana de cultivo en SIT los explantes habían alcanzado un número de brotes aproximadamente igual que con cuatro semanas en medio de cultivo semisólido (Figura 2).
Contrario a lo expuesto, los medios de cultivo semisólidos limitan la absorción que se realiza a través de difusión en el medio de cultivo. El paso a través de una matriz en un medio de cultivo solidificado dificulta la rapidez y como consecuencia el crecimiento es menor cuando se compara con los medios de cultivo líquidos (Lorenzo et al., 1998). Los resultados demostraron que el uso de SIT incrementó la eficiencia en la propagación in vitro de jengibre con respecto al método convencional informado por Palma y Matarrita (1992).
Además del número de brotes por explante, a las cuatro semanas de cultivo las variables longitud de raíces y relación parte aérea/raíz fueron superiores cuando los explantes crecieron en los sistemas de inmersión temporal (Tabla 2). Resultados similares obtuvieron Albany et al. (2015) cuando compararon el medio de cultivo líquido con el medio de cultivo semisólido en las diferentes fases de la micropropagación de sábila (Aloe barbadensis Mill).
Un aspecto que se destacó en el estudio fue que el uso de los SIT permitió una mayor concentración de biomasa en la parte aérea y superó tres veces el obtenido en el medio de cultivo semisólido. Estos resultados son favorables para los medios de cultivo líquidos por cuanto lo que se busca en estas etapas, mayor concentración de brotes, que se respalda por una mayor concentración de biomasa obtenida en los SIT.
Tabla 2. Indicadores de crecimiento de Zingiber officinale Roscoe cv. ‘Gran Caimán’ en un medio de cultivo líquido en SIT y en un medio de cultivo semisólido.
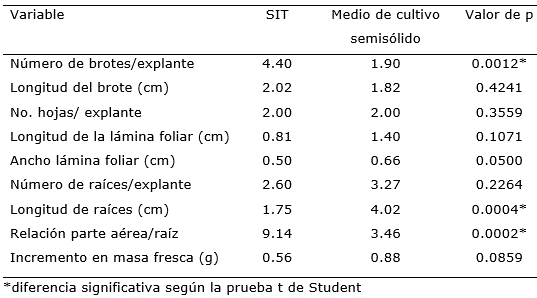
En relación con la variable longitud de raíces, se observó una mejor respuesta cuando las plántulas de jengibre crecieron en un medio de cultivo semisólido, con un valor de 4.02 cm de longitud, comparado con los brotes que crecieron en los sistemas de inmersión temporal (Tabla 2). Esta condición de biomasa radical no es conveniente por cuanto lo que se busca es aumentar el coeficiente de multiplicación de brotes. Siguiendo lo establecido por Skoog y Miller (1957) quienes determinaron que el balance auxina/citocinina en el medio de cultivo puede controlar la morfogénesis in vitro, la formación de raíces en un brote se ve favorecida cuando la disponibilidad de nutrientes por difusión es lenta tal y como se observó en el presente estudio, cuando los brotes crecieron en medios de cultivo semisólidos. En esta condición se limita la absorción de los nutrientes, ya que estos pasan a formar parte de la matriz del gel y los explantes requieren mayor tiempo para manifestar crecimiento y los obliga a formar mayor cantidad de raíces (Lorenzo et al., 1998).
De forma general, los experimentos desarrollados permitieron establecer una metodología que incrementa de forma significativa el coeficiente de multiplicación en jengibre, basada en el empleo de sistemas de inmersión temporal.
En este estudio se comprobó que el tipo de explante usado (yema del rizoma) fue apropiado y la combinación de 3 mg l-1 de BA y 1 mg l-1 de ANA en el medio de cultivo propuesto por Palma y Matarrita (1992) permitió la propagación in vitro del cultivar ‘Gran Caimán’ que fue seleccionado por productores del cantón de Guatuso, Alajuela, Costa Rica durante 7 años. La utilización de SIT con un tiempo de inmersión de 5 minutos, una frecuencia de inmersión cada 6 horas y un volumen de medio de cultivo de 40 ml/explante, superó la respuesta obtenida de brotes de jengibre cultivados en medio de cultivo semisólido.
CONCLUSIONES
El empleo de SIT para la multiplicación in vitro de Zingiber officinale Roscoe cv. ‘Gran Caimán’ incrementa el coeficiente de multiplicación y mejora las características de las plantas obtenidas. Se recomienda su uso como alternativa para propagar este cultivar seleccionado por productores del cantón de Guatuso, Alajuela, Costa Rica.















