INTRODUCCIÓN
El incremento de la población mundial y el deterioro acelerado de los agroecosistemas en las últimas décadas, impone al sector agroindustrial la búsqueda y formulación de nuevos y mejores productos que permitan obtener producciones agrícolas sostenibles y alimentos más saludables. Una de las áreas prometedoras en la agricultura moderna es el uso racional de bioproductos con actividad estimulante del crecimiento de plantas, obtenidos de materias primas locales (Calvo et al., 2014; El Boukhari et al., 2020); Rouphael y Colla, 2020).
Los bioestimulantes agrícolas se definen como cualquier sustancia natural y/o microorganismo, aplicados a las plantas, semillas o rizosfera, con el objetivo de aumentar el crecimiento vegetal, el uso eficiente de nutrientes, la tolerancia al estrés y los parámetros de calidad de las cosechas (du Jardin, 2015; Van Oosten et al., 2017). Se clasifican por sus fuentes primarias de producción, incluidos los ácidos húmicos y fúlvicos, hidrolizados de proteínas, biopolímeros, extractos de algas y botánicos, hongos y bacterias benéficas, entre otros (du Jardin, 2015; Rouphael y Colla, 2020).
Los extractos de algas marinas (EAM) han sido producidos comercialmente desde 1980 (Craigie, 2011) y ya representan más del 33% del mercado global de bioestimulantes vegetal (El Boukhari et al., 2020). Poseen amplia aceptación en la agricultura pues son considerados insumos ecológicos, biodegradables, no tóxicos y seguros para la salud animal y humana (Khan et al., 2009; Calvo et al., 2014; Arioli et al., 2015). Se obtienen a partir de la biomasa de algas marinas cosechada directamente en las costas o cultivadas en mar abierto.
Existen aproximadamente 10 000 especies de macroalgas (El Boukhari et al., 2020), las cuales se agrupan según su pigmentación en tres categorías o phyla: algas pardas (phylum Hetrokontophyta, clase Phaeohyceae), rojas (phylum Rhodophyta) o verdes (phylum Chlorophyta) (Suárez et al., 2015). El alga parda Ascophyllum nodosum (L.) Le Jolis es la especie más usada por las industrias en la fabricación de productos comerciales con fines agrícolas y su extracto es el mejor caracterizado hasta la fecha (Khan et al., 2009; Sharma et al., 2014; Shukla et al., 2019).
Evidencias científicas corroboran la acción estimulante de los EAM en la germinación de las semillas, el vigor de las plántulas, el crecimiento y morfología de las raíces, la floración temprana, el retardo de la senescencia, la maduración de los frutos, el rendimiento de los cultivos y la calidad nutricional del producto comestible (Khan et al., 2009; Craigie, 2011; Sharma et al., 2014; Nabti et al., 2017). Además, las aplicaciones de diferentes tipos de extractos promovieron la actividad de microorganismos benéficos en la rizosfera (Kuwada et al., 2006; Alam et al., 2014; Renaut et al., 2019; González-González et al., 2020), la tolerancia de las plantas a distintas condiciones de estrés abiótico (Van Oosten et al., 2017; Di Stasio et al., 2018; Sharma et al., 2019) y la protección frente a plagas y enfermedades (Vera et al., 2011; Pérez et al., 2016; Hamed et al., 2018).
Sin embargo, los mecanismos de acción de los bioestimulantes obtenidos de algas marinas en las plantas no están totalmente esclarecidos, debido al complejo conjunto de compuestos bioactivos y sus proporciones en las algas (Wally et al., 2013; Kocira et al., 2019). Por ende, los EAM pueden tener efectos tanto negativos como positivos, dependiendo de sus dosis de aplicación en el sistema planta-suelo (Hernández-Herrera et al., 2014a; Hernández-Herrera et al., 2016; Ghaderiardakani et al., 2019). En este escenario, deben impulsarse nuevas investigaciones que profundicen en la actividad de los componentes extraídos de las algas de forma individual o combinados y, que esclarezcan sus modos de acción en las plantas, en función de optimizar el uso de los EAM en la producción agraria.
Aunque las macroalgas son un recurso local abundante en las costas cubanas, no existen antecedentes de su empleo como materia prima para la formulación de bioproductos de uso agrícola. Por estas razones, el objetivo de esta investigación fue analizar las perspectivas de las algas marinas como fuente de extractos bioactivos para la promoción del crecimiento vegetal y la protección de los cultivos.
Moléculas bioactivas en los EAM
Las macroalgas marinas, al igual que las plantas terrestres, transitan por diversos eventos morfogénicos durante su ciclo vital (ramificación, reproducción, senescencia) y están expuestas a diferentes tensiones ambientales de tipo biótico y abiótico. Por ende, sintetizan cientos de metabolitos con actividades específicas que regulan estos procesos morfofisiológicos y actúan como mecanismos de defensa química ante situaciones de estrés (Tarakhovskaya et al., 2007; Stirk et al., 2009).
El interés en las algas marinas aumenta continuamente en el sector de la agricultura como resultado de su composición química única (Salehi et al., 2019; El Boukhari et al., 2020) y del amplio espectro de respuestas positivas promovidas en las plantas (Khan et al., 2009; Calvo et al., 2014; Nabti et al., 2017).
Muchos de los productos agrícolas se obtienen de algas pardas debido a su contenido relativamente alto de compuestos bioactivos, su abundancia y accesibilidad constante durante todo el año (Sharma et al., 2014; Shukla et al., 2019). Por ende, es necesario evaluar especies de algas aun inexploradas con posibilidades de aprovechamiento mediante el cultivo in situ o ex situ.
La mayoría de los autores concuerdan en que el efecto bioestimulante de los extractos de algas marinas se debe a la acción combinada de todos los componentes presentes en estas formulaciones. Entre ellos, los reguladores de crecimiento de plantas son uno de los grupos con mayor actividad biológica. Se han identificado citocininas, auxinas, ácido abscísico, giberelinas, ácido salicílico, poliaminas y etileno (Crouch y van Staden, 1993; Tarakhovskaya et al., 2007; Yokoya et al., 2010; Craigie, 2011; Yalçin et al., 2019). Las más relevantes en cuanto a cantidad y actividad son las citocininas y auxinas (Stirk y van Staden, 1997; Wally et al., 2013). Otros compuestos identificados en los EAM que pueden regular el crecimiento de las plantas son rodomorfina (Tarakhovskaya et al., 2007), jasmonatos (Craigie, 2011), brasinoesteroides (Stirk et al., 2014), estrigolactonas (Arioli et al., 2015) y betaínas (Khan et al., 2009; Sharma et al., 2014).
Los carbohidratos y los compuestos de bajo peso molecular extraídos con disolventes orgánicos son los únicos componentes de las macroalgas probados independientemente como bioestimulantes de plantas. Los polisacáridos son polímeros complejos y únicos, que constituyen las paredes celulares de las algas o poseen función de reserva (Sharma et al., 2014; Salehi et al., 2019). Los principales polisacáridos en las algas verdes son los ulvanos, en las algas rojas son los agaranos y carragenanos, mientras que las algas pardas poseen alginatos y fucoidanos (Vera et al., 2011; Nabti et al., 2017). Las propiedades quelantes y gelificantes de los polisacáridos obtenidos de las algas los convierten en compuestos muy importantes para la agricultura (Khan et al., 2009; Calvo et al., 2014; du Jardin, 2015). Pueden afectar directamente procesos fisiológicos de las plantas relacionados con el crecimiento y el desarrollo (Castro et al., 2012; Hernández-Herrera et al., 2016; Shukla et al., 2016; Ertani et al., 2018), la inmunidad frente a organismos patógenos (Klarzynski et al., 2003; Vera et al., 2011; Stadnik y de Freitas, 2014) y la tolerancia a una variedad de condiciones de estrés abiótico (Van Oosten et al., 2017; Zou et al., 2019).
Los extractos de algas además de los reguladores del crecimiento y los polisacáridos, poseen otros compuestos bioactivos que pueden inducir mecanismos de defensa en las plantas y promover el crecimiento vegetal. Por ejemplo, ácidos grasos poliinsaturados (ω-3 y ω-6), aminoácidos (alanina, glicina, valina, aspartato, glutamato, arginina, treonina), vitaminas (B, C, E y K) y esteroles (fucoesterol, ergosterol, colesterol, estigmasterol) (Khan et al., 2009; Nabti et al., 2017; Salehi et al., 2019). Asimismo, se han identificado compuestos osmoprotectores que pueden mejorar la respuesta agronómica de los cultivos bajo condiciones de estrés osmótico, tales como betaínas, prolina, sorbitol y manitol (Sharma et al., 2014; Battacharyya et al., 2015; Di Stasio et al., 2018).
Otros constituyentes abundantes en los EAM son los nutrientes minerales debido a la capacidad de las algas de absorber elementos químicos del ambiente marino y acumularlos en la estructura molecular de quelatos como los polisacáridos sulfatados y los compuestos fenólicos (Sharma et al., 2014; Battacharyya et al., 2015). La composición mineral de diferentes macroalgas marinas detalla la presencia de macrominerales como potasio, nitrógeno, magnesio, calcio y sodio y de microminerales como cobre, hierro, manganeso, zinc, cadmio, cobalto, iodo, molibdeno, boro y níquel (Hernández-Herrera et al., 2014a; Thodhal et al., 2019; Salehi et al., 2019).
También se refiere la presencia de cientos de metabolitos secundarios con propiedades antioxidantes, como son compuestos fenólicos, flavonoides, tocofenoles, carotenoides (α y β-caroteno, luteína, fucoxantina, violaxantina), ácido ascórbico, terpenoides y aminoácidos tipo micosporina (Vidal et al., 2009; Van Oosten et al., 2017; Salehi et al., 2019; Kocira et al., 2020).
Entre los compuestos fenólicos, los florotaninos son polímeros complejos de floroglucionol presentes mayormente en algas pardas de la familia Fucaceae y exhiben una mayor acción antioxidante debido a sus numerosos anillos fenólicos (Craigie, 2011; Gutiérrez et al., 2017; Ummat et al., 2020). El floroglucionol y el eckol son los florotaninos más estudiados por sus efectos positivos en el crecimiento y desarrollo de las plantas, en el cultivo de tejidos vegetales y en la micropropagación de plantas (Aremu et al., 2015; Rengasamy et al., 2015; Rengasamy et al., 2016; Pérez et al., 2016).
La extracción de compuestos biológicamente activos a partir de la biomasa de algas ofrece una nueva oportunidad de productos novedosos y efectivos como bioestimulantes vegetales. Estos pudieran aplicarse de diversas maneras en los cultivos: enmienda al suelo, foliar, imbibición de semillas, solución hidropónica, tratamiento post-cosecha o una combinación de los métodos mencionados.
Métodos de extracción de los principios activos de las macroalgas marinas
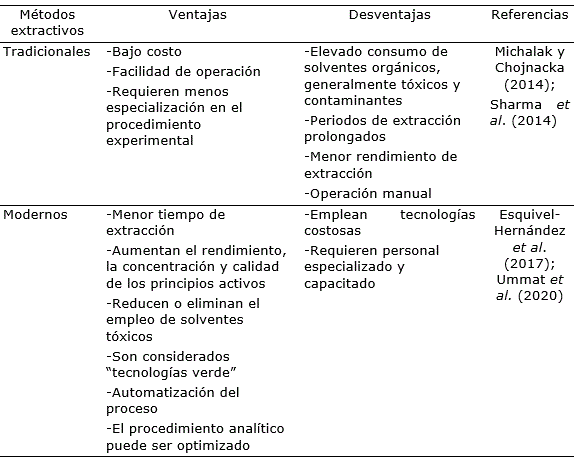
La elección del método de extracción juega un rol importante en la separación de moléculas con actividad biológica a partir de las algas marinas (Sharma et al., 2014). En especial, las consideraciones económicas son frecuentemente un paso crucial en la transferencia del proceso productivo en el laboratorio a escala industrial. Otros criterios de selección consideran la rapidez, reproducibilidad y optimización del método; así como su impacto ecológico y que produzca el mayor rendimiento posible (Michalak y Chojnacka, 2014; El Boukhari et al., 2020).
Diferentes métodos de extracción son citados en la literatura científica a partir de la biomasa de algas marinas fresca o deshidratada (Shukla et al., 2019). En su mayoría estas técnicas deben incluir la lisis celular para liberar al extracto los componentes moleculares de interés y se desarrollan a temperaturas relativamente bajas para no dañar su actividad biológica (Calvo et al., 2014; Battacharyya et al., 2015).
Los productos comerciales y experimentales derivados de macroalgas con fines agrícolas, se basan principalmente en la extracción convencional con disolventes químicos o en una hidrólisis a diferentes pH: neutro (Hernández-Herrera et al., 2014a), alcalino (Hernández-Herrera et al., 2016) o en condiciones ácidas (Castellanos-Barriga et al., 2017). Otras técnicas más avanzadas y novedosas son la extracción de fluido supercrítico, extracción de líquido presurizado, digestión con enzimas y extracción asistida por microondas o por ultrasonidos (Sharma et al., 2014; Michalak y Chojnacka, 2014; Esquivel-Hernández et al., 2017; Shukla et al., 2019). Los métodos de extracción basados en agua parecen ser los más económicos y eficaces en la obtención de formulaciones ricas en compuestos con actividad estimulante del crecimiento de las plantas (Crouch y van Staden, 1993; Michalak y Chojnacka, 2014; Shukla et al., 2019).
Las ventajas y desventajas más relevantes de los distintos procesos extractivos se resumen en la (tabla 1.
Tabla 1. Principales ventajas y desventajas de los métodos tradicionales y modernos de extracción de compuestos bioactivos a partir de algas marinas.
En general, el procedimiento de extracción no debe centrarse en aislar un máximo de compuestos bioactivos, pues las distintas interacciones que pueden ocurrir en el extracto final resultarían en efectos sinérgicos y/o antagónicos. En su lugar, pueden considerar otros aspectos importantes como las características de la biomasa, el modo de aplicación, el tipo de cultivo y las respuestas fisiológicas deseadas en las plantas (El Boukhari et al., 2020).
Hormesis en plantas por compuestos derivados de macroalgas
La hormesis o efecto hormético es un fenómeno ampliamente conocido en toxicología y sucede en todos los organismos como parte de su adaptación al ambiente. Establece que a dosis bajas de un factor estresante se producen efectos beneficiosos (estimulación), mientras que a dosis altas ocurren efectos tóxicos (inhibición), originándose una relación dosis-respuesta bifásica (Mendoza-Morales et al., 2019). Las investigaciones sobre la hormesis en el campo de la ciencia vegetal aumentan rápidamente y tienen diversas implicaciones para la agricultura relacionadas con el manejo del estrés biótico y abiótico, la productividad y el rendimiento de los cultivos y la calidad postcosecha de los productos agrícolas (Agathokleous et al., 2020).
Se ha encontrado que los bioestimulantes vegetales de origen microbiano y no microbiano, inducen respuestas horméticas en las plantas e incrementan su productividad y protección bajo condiciones de estrés (Vargas-Hernández et al., 2017). Sin embargo, poco se conoce acerca de la evaluación de la hormesis en plantas por bioestimulantes de algas marinas (Mendoza-Morales et al., 2019). Los EAM a bajas concentraciones (dilución 1:1000 o más) estimulan respuestas positivas en las plantas tratadas, mientras que concentraciones relativamente altas producen efectos inhibitorios (Crouch y van Staden, 1993, Khan et al., 2009; Hernández-Herrera et al., 2014a; Hernández-Herrera et al., 2016) (Figura 1).
La presencia y concentración de ciertos metabolitos (e.g., fitohormonas, azúcares, aminoácidos, minerales, ácidos fenólicos) en los EAM puede originar efectos alelopáticos negativos que se manifiestan en cualquiera de las etapas del desarrollo vegetal (Hernández-Herrera et al., 2014a; Silva et al., 2019, Ghaderiardakani et al., 2019). En consecuencia, la concentración de estos productos es un factor crítico en su efectividad como bioestimulantes del crecimiento vegetal (Khan et al., 2009; Kocira et al., 2019).

Figura 1. Representación esquemática de los efectos horméticos (estimulación+/inhibición-) de extractos de algas marinas en el sistema planta-suelo.
Por ende, es importante establecer métodos in vitro sencillos para la selección preliminar de extractos mediante estudios de fitotoxicidad y evaluar las aplicaciones potenciales como bioestimulantes, incluida la validación (González-Giro et al., 2018; Agathokleous et al., 2020). Estos estudios pueden realizarse con modelos experimentales que incluyen plantas de importancia económica, de fácil acceso, germinación y crecimiento rápido. En los últimos años se han empleado plantas modelo como lechuga (Lactuca sativa L.), lenteja (Lens esculenta L.), Arabidopsis thaliana (L.) Heynh y frijol mungo (Vigna radiata L.) para evaluar el riesgo y predecir los efectos horméticos de EAM con fines agrícolas (González-Giro et al., 2018; Mendoza-Morales et al., 2019; Ghaderiardakani et al., 2019).
Efecto de los EAM en la germinación de semillas
Las macroalgas y sus extractos son estimulantes naturales que aceleran la germinación de las semillas y aumentan el vigor de las plántulas cuando se emplean en dosis relativamente bajas (Hernández-Herrera et al., 2016; Vijayakumar et al., 2018). Varios estudios describen sus efectos beneficiosos en el porcentaje, índice y tiempo medio de germinación, así como en la longitud de la plúmula y de la radícula (Hernández-Herrera et al., 2014a; Hernández-Herrera et al., 2016; Castellanos-Barriga et al., 2017; Layek et al., 2018; Silva et al., 2019). No obstante, altas dosis de extractos de algas inhibieron la tasa de germinación de semillas de los cultivos frijol mungo (Hernández-Herrera et al., 2016), pimiento (Capsicum annum L.) (Vijayakumar et al., 2018) y lechuga (Silva et al., 2019).
Los resultados favorables de los EAM se atribuyen a la activación de rutas enzimáticas claves para la fisiología de la germinación (Hu et al., 2004; Rengasamy et al., 2015). Por ejemplo, la α-amilasa es una enzima sintetizada en la capa de aleurona y su expresión génica está regulada por el ácido giberélico (AG3). Esta enzima es responsable de la movilización de sustancias de reserva (almidón) desde el endospermo para apoyar el crecimiento y diferenciación del embrión (Nabti et al., 2017). El estudio desarrollado por Rayorath et al. (2008b) comprobó la actividad α-amilasa independiente de giberelinas en semillas de cebada (Hordeum vulgare L.) tratadas con extracto acuoso de A. nodosum y sus fracciones orgánicas (metanol, cloroformo o acetato de etilo). Estos autores sugirieron que los EAM evaluados poseen entidades bioactivas funcionalmente análogas al AG3. Los resultados obtenidos se corresponden con la identificación en los extractos de algas de compuestos orgánicos con actividad tipo giberelina o citocinina que afectan positivamente los parámetros germinativos (Crouch y van Staden, 1993; Stirk et al., 2014; Yalçin et al., 2019). En este sentido, Hu et al. (2004) evaluaron la influencia de diferentes concentraciones de oligosacáridos obtenidos de la hidrólisis del alginato en la germinación de semillas de maíz (Zea mays L.). Las actividades proteasa, α-y β- amilasa mostraron la mayor respuesta a la concentración de 0.75% en relación con el resto de los tratamientos.
Efecto en el desarrollo radical de las plantas y en el microbioma rizosférico
Uno de los usos más generalizados de los EAM comerciales es como promotores del enraizamiento (Khan et al., 2009, Sharma et al., 2014). Su aplicación en distintas especies agrícolas durante experimentos en invernadero, en campo o in vitro aumentó la formación de raíces laterales, la longitud de la raíz principal, la masa fresca y seca del sistema radical (Tabla 1). Estas respuestas morfológicas se atribuyen frecuentemente a la actividad de auxinas y citocininas endógenas estimuladas en las plantas tratadas (Rayorath et al., 2008a; Wally et al., 2013) o exógenas presentes en los extractos (Stirk y van Staden, 1997; Omar et al., 2014; Vinoth et al., 2019). También compuestos extraídos de las algas en forma de entidades químicas puras (florotaninos) o extractos que contienen fracciones de compuestos, tales como polisacáridos, inducen el crecimiento de las raíces de manera similar a las auxinas sintéticas (Rengasamy et al., 2015; Hernández-Herrera et al., 2016, Pérez et al., 2016).
Contrario a estos resultados, se describieron efectos tóxicos en el desarrollo radical de extractos obtenidos de algas empleados a altas concentraciones en cultivos como arroz (Oryza sativa L.) (Layek et al., 2017), arabidopsis (Ghaderiardakani et al., 2019) y cebolla (Allium cepa L.) (Abbas et al., 2020).
Estudios científicos han indicado que los extractos de algas aplicados en el suelo promueven la diversidad y acción de microorganismos beneficiosos en la rizosfera, y favorecen un medio adecuado para el crecimiento y la arquitectura de las raíces (Tabla 2, (Tabla 3). Sin embargo, el conocimiento sobre la interacción de los EAM con la microbiota del suelo y la biología de la rizosfera es reducido (Renaut et al., 2019). La mayoría de las investigaciones se enfocan en los cambios bioquímicos y morfofisiológicos de las plantas y su influencia en las propiedades biológicas del suelo agrícola es escasamente discutida. Este vacío de información puede atribuirse a que la aplicación foliar es el modo más frecuente de utilizar los bioestimulantes basados en algas marinas (Sharma et al., 2014; Battacharyya et al., 2015).
Tabla 2. Efectos beneficiosos de extractos de macroalgas marinas en el desarrollo radical y en el microbioma de la rizosfera de plantas cultivadas en campo** o in vitro***.

De acuerdo con la literatura científica los extractos de algas marinas estimulan el microbioma rizosférico básicamente de tres maneras: (i) mejoran las propiedades del suelo (hidratación, porosidad y estructura) debido a la presencia de moléculas quelantes como alginatos, fucoidanos y compuestos fenólicos (Khan et al., 2009; Battacharyya et al., 2015); (ii) inducen el crecimiento microbiano y su actividad enzimática mediante elicitores presentes en los extractos (Kuwada et al., 2005; 2006; Alam et al., 2014) y/o (iii) activan la expresión génica de moléculas señal involucradas en la simbiosis planta-microorganismo (Khan et al., 2012; González-González et al., 2020).
Tabla 3. Efectos positivos de extractos de macroalgas en la absorción y asimilación de macro y micronutrientes en diversas especies agrícolas cultivadas en invernadero.

Incremento en el rendimiento y la calidad de las cosechas con EAM
Se considera que los EAM pueden estimular el rendimiento agrícola y mejorar la calidad de las cosechas mediante los siguientes mecanismos: (i) estimulan la síntesis y actividad de fitohormonas endógenas; (ii) promueven la absorción, translocación y asimilación de agua y nutrientes en las plantas y/o (iii) mejoran la textura, estructura y materia orgánica del suelo y estimulan la actividad de microorganismos favorables en la rizosfera (Khan et al., 2009; Van Oosten et al., 2017).
Numerosos estudios confirman los efectos positivos de los bioestimulantes de algas en los indicadores del rendimiento y la calidad postcosecha de distintos productos agrícolas. Por ejemplo, Nayak et al. (2020) evaluaron la incidencia de formulaciones comerciales en polvo (Biozyme o Amaze-x) y líquidas (Proventus DS legacy) de algas pardas combinadas con dosis recomendadas de fertilizante (RDF) en el rendimiento del arroz durante la estación lluviosa. La producción máxima de paja (5.94 t ha-1) y granos (3.90 t ha-1) se obtuvo al aplicar 75% RDF, 10 kg ha-1 de Amaze-x y 625 ml ha-1 de Proventus DS legacy. Este tratamiento mostró además el mayor contenido de N (54.12 y 37.33 kg ha-1) y K (27.12 y 163.62 kg ha-1) en el grano y la paja de arroz, respectivamente (Nayak et al., 2020).
El empleo foliar de 0.5% del extracto comercial de A. nodosum aumentó significativamente el diámetro del bulbo y del cuello y el rendimiento por hectáreas en cuatro cultivares de cebolla. Además, mejoró el contenido de sólidos solubles totales, ácido ascórbico, N, K y P (Abbas et al., 2020). Por su parte, Yao et al. (2020) refirieron que la aplicación de 30, 60 y 90 kg hm-2 de extracto de Sargassum horneri (Turner) C. Agardh incrementó de manera significativa el rendimiento neto del tomate (Solanum lycopersicum L.) en 4.6, 6.9 y 4.7%, respectivamente. También, las dosis 60 y 90 kg hm-2 afectaron positivamente la dureza de los frutos y el contenido de azúcares solubles.
Otras investigaciones describieron un aumento en los parámetros agroproductivos y la calidad nutricional de cultivos como soya (Glycine max (L.) Merr.), papa (Solanum tuberosum L.) (Pramanick et al., 2017), caña de azúcar (Saccharum officinarum L.) (Singh et al., 2018), lechuga, espinaca (Spinacia oleracea L.) (Sandepogu et al., 2019) y frijol (Phaseolus vulgaris L.) (Kocira et al., 2020).
Efecto en la absorción y asimilación de nutrientes por las plantas
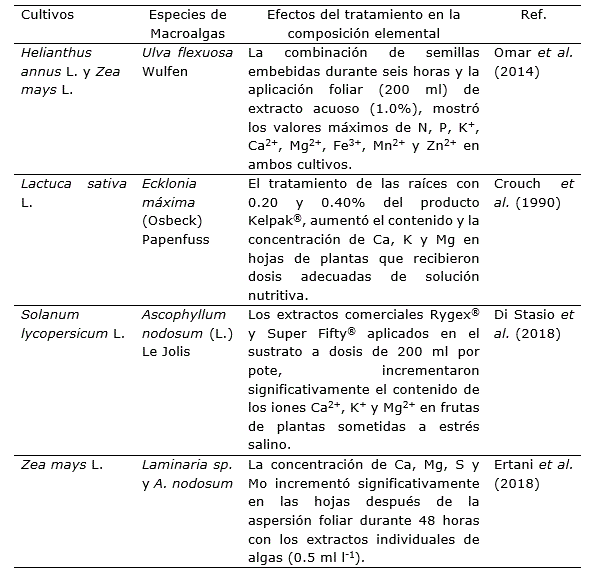
Potenciar el uso eficiente de nutrientes por las plantas mediante el uso de tecnologías sostenibles, es uno de los mayores desafíos para la agricultura moderna. Los EAM representan bioproductos alternativos que mejoraran el estado nutricional de los cultivos, pues promueven la absorción y asimilación de agua y sales minerales en condiciones subóptimas (Sharma et al., 2014; Nabti et al., 2017; El Boukhari et al., 2020). Estos efectos se alcanzan cuando se usan los extractos directamente en el suelo, mediante aspersión foliar o una combinación de ambos modos de aplicación (Tabla 4, Tabla 5). En este último caso se propiciaría una fertilización más eficiente, ecológica y orientada a producir cosechas con mayor calidad, rendimiento y mejor costo-beneficio. La aspersión foliar beneficia la absorción de nutrientes presentes en los extractos de algas a través de los estomas y poros hidrofílicos de la cutícula; mientras que la aplicación en el suelo facilita la retención de la humedad, provee un entorno favorable para el desarrollo radical y estimula actividades microbianas asociadas con la mineralización y movilización de nutrientes (Kuwada et al., 2006; Khan et al., 2009; Battacharyya et al. 2015).
Tabla 4. Efectos positivos de extractos de macroalgas en la absorción y asimilación de macro y micronutrientes en diversas especies agrícolas cultivadas en campo.
Los efectos benéficos de los bioestimulantes obtenidos de algas marinas en la nutrición mineral de las plantas, pueden estar relacionados con la regulación diferencial de genes específicos y/o la estimulación de procesos fisiológicos como la división celular y la ramificación radicular (Ertani et al., 2018; El Boukhari et al., 2020). Por ejemplo, plantas de canola (Brassica napus L.) tratadas con 0.1% AZAL5® (extracto comercial de A. nodosum) mostraron un aumento significativo en la absorción de N y S; asociado a una sobreexpresión de los genes BnNRT1.1; BnNRT2.1 y BnSultr4.1; BnSultr 4.2, responsables de la síntesis de transportadores del nitrógeno y el azufre, respectivamente (Jannin et al., 2013). También Billard et al. (2014) desarrollaron un procedimiento experimental similar y describieron altas concentraciones de Cu y S en B. napus a los 30 días de transcurrido el ensayo. Este resultado estuvo relacionado con un incremento en los niveles de expresión génica de transportadores específicos como COPT2 para el cobre y BnSultr1.1 y BnSultr1.2 para el azufre. Los autores refirieron, además, un aumento en la translocación de Fe y Zn desde las raíces hasta los brotes de conjunto con una sobreexpresión del gen NRAMP3 involucrado en este proceso.
Tabla 5. Efectos positivos de extractos de macroalgas en la absorción y asimilación de macro y micronutrientes en diversas especies agrícolas cultivadas en invernadero.
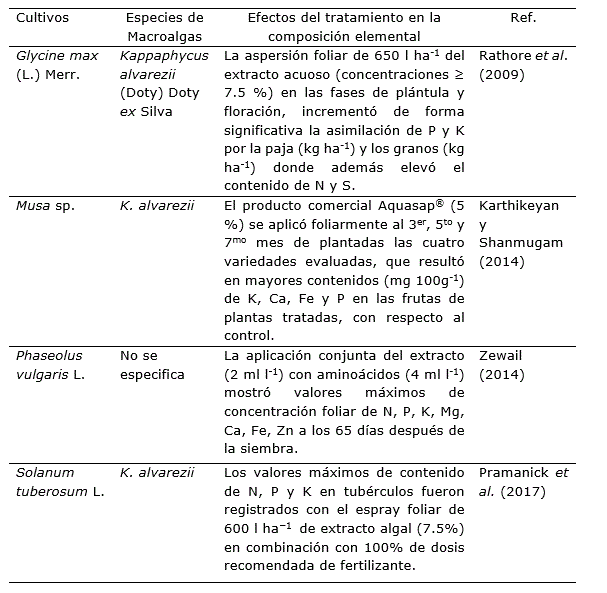
La presencia de kahidrina un derivado de la vitamina K1 se ha identificado en varias formulaciones comerciales de macroalgas. Esta molécula altera la bomba protónica de la membrana plasmática e induce la secreción de iones H+ en el apoplasto, lo que resulta en la acidificación de la rizosfera y en un aumento de la absorción de nutrientes (Battacharyya et al., 2015). Esto se debe a que la acidificación rizosférica modifica el estado redox del suelo y la solubilidad de iones metálicos, y los hace disponibles para las plantas (Ertani et al., 2018).
En general, el uso de EAM puede ser una estrategia económica y ambiental para la biofortificación de los cultivos y la obtención de productos agrícolas con mayor calidad nutricional (Billard et al., 2014). En este sentido, se alcanzan mejores resultados cuando se combinan los extractos obtenidos de algas con otros bioestimulantes vegetales (Zewail, 2014; Sandepogu et al., 2019; González-González et al., 2020) o con fertilizantes convencionales (Pramanick et al., 2017; Layek et al., 2018; Singh et al., 2018).
Efectos en la fisiología y el metabolismo vegetal
Varios trabajos científicos demuestran que los EAM afectan la fisiología de las plantas tratadas mediante cambios en el perfil general del transcriptoma y el metaboloma (Castro et al., 2012; Jannin et al., 2013; Goñi et al., 2016). No obstante, debido a la composición química compleja de los extractos de algas, su potencial como bioestimulante no está totalmente explorado y poco se conoce sobre sus mecanismos específicos de acción en el crecimiento y desarrollo vegetal (Wally et al., 2013; Kocira et al., 2019). Entre otras razones, porque las plantas pueden exhibir diferentes umbrales de sensibilidad a una o más moléculas bioactivas (Van Oosten et al., 2017).
Bioensayos en biología celular, metabolómica y genómica usando organismos modelos y herramientas bioinformáticas, son una excelente vía para esclarecer estas interrogantes (Rayorath et al., 2008a; Ghaderiardakani et al., 2019). Un análisis de la expresión génica desarrollado por Fan et al. (2013) en plantas in vitro de espinaca tratadas con 0.1 g l-1 del preparado comercial Acadian® (obtenido de A. nodosum), extendió la comprensión de los posibles mecanismos que regulan la actividad bioestimulante de estas formulaciones y sus componentes químicos. Los autores describieron una correlación positiva entre el aumento de la biomasa y el contenido de proteínas totales con la sobreexpresión de la enzima glutamina sintetasa citológica, involucrada en la asimilación del nitrógeno. Del mismo modo, las concentraciones incrementadas de flavonoides y fenólicos totales, así como la potenciación de la capacidad antioxidante celular, se asoció con una mayor actividad enzimática chalcona isomerasa y con la expresión regulada de glutatión reductasa, ascorbato peroxidasa tilacoidal y monodihidroascorbato reductasa (Fan et al., 2013).
Análisis de microarreglos del ADN (microarrays) revelaron que la aplicación de extractos obtenidos del alga parda A. nodosum, indujo la expresión diferencial de genes involucrados en el metabolismo general de las plantas, el metabolismo del carbono y la fotosíntesis, el metabolismo del nitrógeno y el azufre, la respuesta al estrés y en procesos del desarrollo vegetal (Jannin et al., 2013; Goñi et al., 2016).
También, los polisacáridos extraídos de la pared celular de las macroalgas y sus oligosacáridos derivados, pueden potenciar el crecimiento vegetal (Calvo et al., 2014; Zou et al., 2019). En este sentido, Castro et al. (2012) asperjaron foliarmente 1 mg ml-1 de oligo-carragenanos en plantas de tabaco (Nicotiana tabacum L.) y describieron un incremento en la altura de la planta, la biomasa foliar, el contenido de clorofilas, así como en la fotosíntesis neta debido a una mayor actividad del fotosistema II. Las plantas tratadas además manifestaron un aumento en la actividad de enzimas oxidorreductasas (RuBisCO) y otras involucradas en el metabolismo primario, tales como glutamato deshidrogenasa, piruvato deshidrogenasa, isocitrato deshidrogenasa y glucosa-6-fosfato deshidrogenasa.
Una de las respuestas fisiológicas comunes cuando se emplean EAM es el aumento en el contenido de clorofilas totales. Este efecto ha sido observado en disímiles cultivos como frijol (Zewail, 2014), pimiento (Vijayakumar et al., 2018), arroz (Layek et al., 2018), rábano (Raphanus sativus L.) (Mahmoud et al., 2019), lechuga, espinaca (Sandepogu et al., 2019), trigo (Triticum aestivum L.) (Zou et al., 2019) y tomate (Yao et al., 2020). Estos resultados se atribuyeron al incremento de la biogénesis de los cloroplastos, a la reducción de la degradación de clorofilas y al retraso de la senescencia; procesos modulados por las citocininas y betaínas presentes en los EAM.
Las citocininas promueven la conversión de etioplastos en cloroplastos mediante la estimulación de la síntesis de clorofilas; mientras que las betaínas reducen la degradación de estos pigmentos y aceleran su formación (Khan et al., 2009; Sharma et al., 2014; Battacharyya et al., 2015). El aumento del contenido de clorofilas en plantas de espinaca tratadas con extracto alcalino de A. nodosum se relacionó con la expresión de enzimas implicadas en la síntesis de betaína glicina (i.e, betaína aldehído deshidrogenasa y colina monooxigenasa) (Fan et al., 2013). Por otro lado, Yao et al. (2020) refirieron que el incremento significativo del contenido de clorofilas y la tasa fotosintética neta retarda la senescencia en las hojas de plantas de tomate tratadas con dosis distintas del extracto de Sargassum horneri.
La aplicación de los bioestimulantes de algas marinas afecta positivamente la producción de biomasa vegetal (i.e. materia seca acumulada) (Pramanick et al., 2017; Vijayakumar et al., 2018; Singh et al., 2018; Sandepogu et al., 2019). En este sentido, una de las hipótesis más referidas en la literatura científica se basa en el impacto positivo de los EAM en la actividad de enzimas esterasa. Este grupo enzimas se considera un marcador de los procesos de desarrollo en plantas debido a su rol en la organogénesis y funciona como un indicador temprano de la embriogénesis somática (Kocira et al., 2019). Conforme con Aremu et al. (2015) y Ertani et al. (2018), una mayor actividad esterasa en plantas tratadas con extractos de macroalgas, indicó su efecto estimulante en el aumento de la producción de biomasa vegetal.
Los resultados científicos discutidos anteriormente sugieren que la acción beneficiosa de los EAM en el metabolismo y la fisiología de las plantas, corresponde a la presencia de inductores del crecimiento vegetal en los extractos y/o la expresión diferencial de genes involucrados en la síntesis de fitohormonas endógenas y en otras rutas del metabolismo primario (Rayorath et al., 2008a, Wally et al., 2013; Goñi et al., 2016; Ghaderiardakani et al., 2019).
Efectos en la mitigación del estrés abiótico
Los cambios drásticos en las condiciones ambientales representan un serio problema para los sistemas agroproductivos, pues el rendimiento de los cultivos puede disminuir en un 50% o más (Zamani-Babgohari et al., 2019). La sequía, la salinidad, las temperaturas extremas y el déficit de nutrientes, son ejemplos de factores abióticos que inciden en este sentido (Sharma et al., 2014; Battacharyya et al., 2015). El estrés ambiental implica la sobreproducción de especies reactivas del oxígeno (ROS, por sus siglas en inglés) capaces de romper la homeostasis celular y originar un ambiente oxidativo en las células vegetales que resulta en la disminución de los parámetros agroproductivos (Khan et al., 2009; Van Oosten et al., 2017).
Los bioestimulantes basados en macroalgas marinas representan una opción promisoria para reducir el impacto de diferentes presiones ambientales en la agricultura y obtener producciones agrícolas sostenibles. Estudios realizados en los últimos años demostraron que plantas tratadas con EAM pueden tolerar diferentes condiciones de estrés abiótico en relación con las plantas no tratadas. Por ejemplo, la aplicación de distintas concentraciones de estos productos mitigó el impacto de altas o bajas temperaturas (Zhang y Ervin, 2008; Zamani-Babgohari et al., 2019), la salinidad (Kasim et al., 2016; Di Stasio et al., 2018), el déficit de nutrientes (Carrasco-Gil et al., 2018) y el estrés hídrico (Sharma et al., 2019).
La imprimación o imbibición de semillas (seed priming) es un tratamiento de pre-acondicionamiento en el que las semillas se hidratan en diferentes soluciones naturales o sintéticas (Mendoza-Morales et al., 2019). Este método estimula los procesos metabólicos pregerminativos, mejora el sistema de defensa antioxidante y la reparación de las membranas celulares en circunstancias de estrés abiótico (Paparella et al., 2015). La imprimación de semillas utilizando EAM podría ser otra alternativa para mitigar el estrés abiótico que afecta los cultivos vegetales durante la fase germinativa y los primeros estadios del crecimiento (Mendoza-Morales et al., 2019; El Boukhari et al., 2020). Por ejemplo, Kasim et al. (2016) embebieron semillas de rábano durante dos horas en extractos acuosos de las macroalgas Codium taylorii Silva o Pterocladia capillacea (S.G. Gmelin) Bornet y las plántulas resultantes fueron expuestas a estrés salino (150 o 200 mM de NaCl). Como resultado, las plántulas procedentes de semillas tratadas con los extractos de algas mostraron mayor contenido foliar de agua, lípidos totales, pigmentos fotosintéticos y mayor longitud de los brotes respecto a las plantas no sometidas al estrés salino.
Los mecanismos de tolerancia al estrés inducidos por los EAM no son totalmente conocidos. Sin embargo, investigaciones sugieren que compuestos bioactivos presentes en estas formulaciones podrían estar involucrados en estos procesos, tales como betaínas (Battacharyya et al., 2015), citocininas (Zhang y Ervin, 2008), polialcoholes (sorbitol y manitol) (Di Stasio et al., 2018) y polisacáridos sulfatados (Zou et al., 2019). Las betaínas alivian el estrés osmótico celular inducido por situaciones de alta salinidad, sequía y elevadas temperaturas (Khan et al., 2009; Sharma et al., 2014). Además, aumentan el contenido de clorofilas en las hojas de plantas tratadas con EAM, lo que sugiere la disminución del proceso degradativo de estos pigmentos (Battacharyya et al., 2015). Por otra parte, el manitol actúa como osmoprotector, secuestrador de ROS, estabilizador de proteínas y de la membrana celular, además de proteger el sistema fotosintético del estrés oxidativo (Seckin et al., 2009). El sorbitol es un osmolito compatible que puede contribuir también a eliminar radicales libres bajo condiciones de estrés ambiental (Di Stasio et al., 2018). Por último, los polisacáridos aislados de las algas pueden potenciar el sistema antioxidante vegetal, aumentar el contenido de clorofilas y modular la concentración de iones intracelulares; resultados que dependen del peso molecular y el grado de sulfatación de estos biopolímeros (Zou et al., 2019).
Los efectos promovidos en las plantas por los EAM pueden variar significativamente, debido a la diversidad química de estas formulaciones y a la variedad de métodos extractivos (Fan et al., 2013; Carrasco-Gil et al., 2018; Di Stasio et al., 2018; Sharma et al., 2019). El aumento de moléculas relacionadas con el estrés (hormonas, antioxidantes, osmoprotectantes, enzimas, etc.) y la inhibición de la peroxidación lipídica, son los mecanismos de defensa más comunes inducidos por los EAM (Figura 2). El uso de herramientas moleculares y genéticas ha permitido un mayor acercamiento a los mecanismos que median la protección frente al estrés ambiental en plantas tratadas con extractos de algas (Kasim et al., 2016; Zamani-Babgohari et al., 2019; Zou et al., 2019). En este sentido, Nair et al. (2012), Fan et al. (2013) y Goñi et al. (2016) describieron la expresión diferencial de numerosos genes involucrados en estas respuestas defensivas.
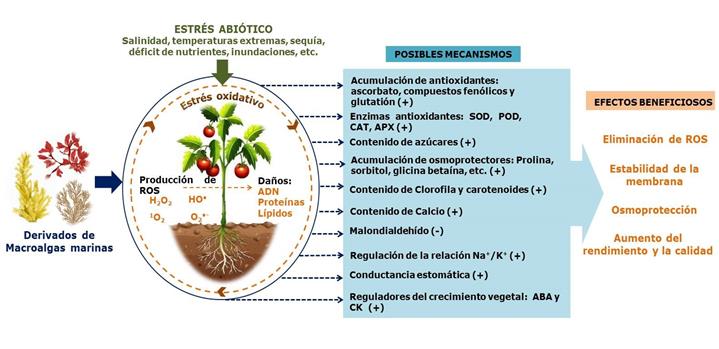
Figura 2. Representación esquemática de los efectos beneficiosos de la aplicación de extractos de macroalgas bajo condiciones de estrés abiótico y sus posibles mecanismos de acción. Especies reactivas del oxígeno (ROS), superóxido dismutasa (SOD), peroxidasa (POD), catalasa (CAT), ascorbato peroxidasa (APX), ácido abscísico (ABA) y citocininas (CK). Adaptado a partir de (El Boukhari et al., 2020).
La relación entre la actividad bioestimulante de los EAM y su composición química, es compleja. Un estudio transcriptómico comparativo de dos extractos comerciales del alga A. nodosum aplicados en plantas in vitro de A. thaliana, mostró que todos los extractos de las algas no son iguales ni promueven las mismas respuestas (Goñi et al., 2016). Por ende, se requieren experimentos más comprensivos que evalúen los efectos de los componentes mayoritarios y minoritarios de los extractos de manera individual o combinados. Además, la especie de planta cultivada es otro aspecto importante a considerar, pues el umbral de respuesta ante un estrés ambiental específico podría cambiar drásticamente entre especies y/o variedades.
Efectos en el control de plagas y enfermedades
Las plantas, especialmente las que crecen al aire libre en condiciones de campo, están constantemente expuestas al ataque de agentes patógenos. No obstante, poseen mecanismos de defensa que van desde barreras físicas (películas de cera en la superficie de sus órganos, paredes celulares rígidas, etc.), hasta potentes mecanismos moleculares de resistencia en cada célula y señales sistémicas provenientes del sitio de la infección (Jibril et al., 2016).
Numerosos estudios indican que los extractos crudos o purificados de algas marinas promueven respuestas inmunes en plantas frente al ataque de organismos patógenos (Khan et al., 2009; Craigie et al., 2011; Nabti et al., 2017; Hamed et al., 2018). Esto se debe a la presencia de compuestos novedosos y diversos con un amplio rango de actividades biológicas. Entre ellas, propiedades antibacterianas (Kulik, 1995; Jiménez et al., 2011; Cook et al., 2018), antifúngicas (Kulik, 1995; Abbassy et al., 2014; Hernández-Herrera et al., 2014b; Ammara et al., 2017), antivirales (Klarzynski et al., 2003; Pardee et al., 2004; Jiménez et al., 2011), nematicidas (Featonby-Smith y van Staden, 1983; Crouch y van Staden, 1993; Ngala et al., 2016) e insecticidas (Asharaja y Sahayaraj, 2013; Holden y Ross, 2013; Abbassy et al., 2014; González-Castro et al., 2019). Estas propiedades dependen de diversos factores ambientales y cambios fisicoquímicos del lugar donde se desarrollan las especies de algas (Pérez et al., 2016).
La acción biocida de los EAM es atribuida a la presencia de alcaloides, policétidos, péptidos cíclicos, lectinas, compuestos fenólicos, terpenos, esteroles, quinonas, polisacáridos, carotenoides y ácidos grasos poliinsaturados (Pérez et al., 2016; Hamed et al., 2018). Debido a la diversidad química de estos compuestos, el empleo de diferentes métodos extractivos ha permitido evaluar de manera específica algunos componentes aislados de las algas en el control de organismos patógenos y esclarecer sus mecanismos de acción en la inmunidad vegetal (Pérez et al., 2016; Cook et al., 2018).
En este sentido, los polisacáridos sulfatados extraídos de la pared celular de macroalgas verdes (ulvanos), pardas (fucanos y laminaranos) y rojas (carragenanos) son los más estudiados por su amplia variedad y composición química única (Hernández-Herrera et al., 2014b; Pérez et al., 2016; Cook et al., 2018). Su actividad biológica depende de algunos factores como su distribución, peso molecular, densidad de cargas, contenido de sulfato, estructura química y conformación (Stadnik y de Freitas, 2014). También, los oligosacáridos obtenidos por la degradación de estos polisacáridos inducen en las plantas protección contra infecciones por hongos, bacterias y virus patógenos (Klarzynski et al., 2003; Vera et al., 2011; Shukla et al., 2016).
Estas macromoléculas desencadenan un estallido oxidativo inicial a nivel local y la activación de las rutas de señalización del ácido salicílico, jasmonato y/o etileno a nivel sistémico. Como resultado se produce un incremento de la expresión diferencial de genes que codifican para: (i) proteínas relacionadas con la patogénesis, (ii) enzimas de defensa como son fenilalanina amoniaco liasa (PAL) y lipooxigenasa (LOX), las cuales determinan la formación de fenilpropanoides y oxilipinas y (iii) enzimas involucradas en la síntesis de terpenos, terpenoides y/o alcaloides. La acumulación de estos compuestos con acción antimicrobiana juega un rol central en la inmunidad en plantas (Vera et al., 2011; Cook et al., 2018). Otras respuestas de defensa comunes inducidas por los polisacáridos y los oligosacáridos algales, comprenden la acumulación de peróxido de hidrógeno (H2O2), la alcalinización del medio extracelular, el eflujo de Ca2+ y la producción de fitoalexinas (Stadnik y de Freitas, 2014; Sharma et al., 2014).
Varios procedimientos son ampliamente usados para evaluar la actividad biocida de los extractos crudos de macroalgas y sus componentes puros o fraccionados. La mayoría de las investigaciones publicadas en la literatura científica se limitan únicamente a ensayos in vitro o in vivo, siendo estos últimos los menos frecuentes. En algunos casos, se realizan inicialmente evaluaciones in vitro seguidas por estudios in vivo en condiciones controladas. Sin embargo, se conoce poco sobre los mecanismos moleculares que median las respuestas inmunes en las plantas tratadas con EAM.
Se necesitan nuevas investigaciones en transcriptómica y metabolómica que generen un mayor entendimiento de los mecanismos de acción de estas formulaciones frente a cada tipo de estrés biótico y en la inducción de resistencia sistémica. Diseños experimentales en condiciones de campo son requeridos para validar los efectos de los EAM en las respuestas fenotípicas de los cultivos frente a distintos agentes patógenos. Otros estudios podrían orientarse hacia la identificación en las algas de compuestos bioactivos noveles con interés biotecnológico para el manejo integrado de plagas y enfermedades, tales como microbicidas, nematicidas, plaguicidas y acaricidas. Finalmente, la optimización de los métodos de extracción es un aspecto a considerar en estudios futuros, pues de esta fase depende el rendimiento de compuestos bioactivos en el extracto final y, por consiguiente, su efectividad en el control biológico.
Macroalgas cubanas como fuente de compuestos bioactivos
Las macroalgas marinas constituyen un recurso local abundante en la plataforma insular cubana, incluidas las zonas costeras y las bahías. Su diversidad se estima en 579 especies, donde las macroalgas rojas son las predominantes (299), seguidas por las verdes (205) y las pardas (75) (Torres y Martínez-Daranas, 2019). En el caso de las macroalgas cubanas no es posible hablar de endemismos, pues la distribución de las especies responde a un nivel regional, en el Mar Caribe y el Golfo de México. Las zonas más estudiadas del archipiélago cubano en relación con la composición florística son la suroccidental, norte-occidental y norte-central (Suárez et al., 2015).
Cuba posee un amplio perímetro de litoral donde se acumulan ocasionalmente por el efecto del oleaje y las corrientes, grandes cantidades de biomasa pertenecientes a los tres grupos de macroalgas. Estas aglomeraciones o arribazones de algas, a menudo en cantidades comerciales, se han calificado como basura playera y no son utilizadas por la industria local. Con frecuencia, solo la integran especies de algas pardas del género Sargassum, provenientes de una extensa masa flotante ubicada en el Atlántico Central Tropical conocida como el Mar de los Sargazos (Torres-Conde y Martínez-Daranas, 2020). Las mayores afluencias de sargazo se alcanzan durante el invierno en la costa norte y en verano en la costa sur, con biomasas estimadas en toneladas de alga fresca (Moreira et al., 2006; Torres-Conde y Martínez-Daranas, 2020). Otras especies presentes en las arribazones con posibilidades de aprovechamiento son las algas pardas Stypopodium zonale (J. V. Lamouroux) Papenfuss, Dictyota ciliolata Sonder ex Kützing, Turbinaria sp. y Padina gymnospora. También, las algas rojas Digenea simplex (Wulfen) C. Agardh, Gracilaria mammillaris (Montagne) Howe y Jania adhaerens J. V. Lamouroux; así como las verdes Cladophoropsis membranacea (Hofman Bang ex C. Agardh) Borgesen, Halimeda discoidea Decaisne y U. lactuca (Moreira et al., 2006; Torres y Martínez-Daranas, 2019).
El cultivo en tierra o en mar es otra vía sostenible para la cosecha de biomasa de algas con fines industriales. Existen varias experiencias, con resultados promisorios, en el cultivo a diferentes escalas de especies cubanas como Bryothamnion triquetrum Kützing, K. alvarezii, Gracilaria sp. y U. lactuca (Suárez et al., 2015). Por ende, las afluencias masivas de biomasa en las costas y el cultivo de macroalgas, constituyen alternativas de aprovechamiento de estos recursos marinos para evitar la explotación directa de sus bancos naturales (Moreira et al., 2006).
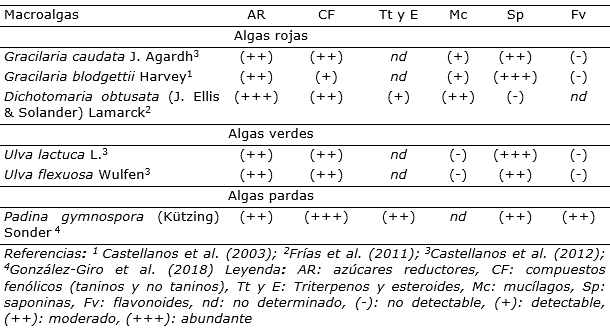
Estudios fitoquímicos demuestran la amplia gama de metabolitos con funciones específicas existentes en los extractos de macroalgas cubanas (Tabla 6). La presencia y abundancia de estos compuestos depende de la especie, el hábitat, la influencia estacional, la etapa del ciclo de vida y de las condiciones ambientales (Castellanos et al., 2012). La biodiversidad de algas marinas, junto a la diversidad química encontrada en cada especie, constituye un recurso prácticamente ilimitado que puede ser utilizado de forma beneficiosa en el desarrollo de formulaciones para uso agrícola.
Entre los metabolitos secundarios más abundantes en macroalgas marinas del litoral cubano, se encuentran los de naturaleza fenólica (Vidal et al., 2009; Castellanos et al., 2012; Gutiérrez et al., 2017; González-Giro et al., 2018). Los mayores contenidos de compuestos fenólicos se han descrito en las algas pardas (Gutiérrez et al., 2017). Estos poseen una importante actividad antioxidante que pudiera explicarse por su capacidad para secuestrar radicales libres y/o inhibir la peroxidación lipídica (Vidal et al., 2009). También, manifiestan otras propiedades biológicas como son actividad promotora del crecimiento vegetal (Posada-Pérez et al., 2015) y acción antiviral (Rojas et al., 2016).
En un estudio realizado por Vidal et al. (2009) se identificaron y cuantificaron en diferentes fracciones polares de las algas verdes Halimeda opuntia (L.) Lamouroux y Halimeda monile (Ellis & Solander) Lamouroux siete ácidos fenólicos (ácido salicílico, ferúlico, cumárico, gálico, pirogálico, caféico, sinápico) y el ácido cinámico. El componente mayoritario en todas las fracciones hidrofílicas de los extractos de H. opuntia y H. monile fue el ácido salicílico con 25.45 y 22.21 g mg-1 de alga seca, respectivamente (Vidal et al., 2009). En su mayoría, los ácidos fenólicos identificados en este estudio actúan como reguladores no hormonales del crecimiento vegetal (Ertani et al., 2018). Además, el ácido salicílico interviene en los mecanismos de defensa de las plantas contra el ataque de organismos patógenos y la tolerancia al estrés abiótico (Craigie, 2011). Asimismo, Gutiérrez et al. (2017) proponen un procedimiento para optimizar la extracción de fenoles totales a partir del alga parda Sargassum fluitans Borgesen (Borgesen) y obtener extractos ricos en estos metabolitos bioactivos.
Otro grupo de compuestos abundantes en los EAM son los polisacáridos sulfatados y sus productos de degradación. La investigación desarrollada por Díaz-Pifferrer (1961) evidenció que las algas rojas cubanas son una fuente promisoria de agar, representadas por 27 especies productoras de este ficocoloide. Las especies más prometedoras según su distribución general, su abundancia la mayor parte del año y por el tipo, rendimiento y calidad del agar que producen son Bryothamnion triquetrum, Digenia simplex, Gelidiella acerosa (Forsskal) J. Feldmann & G. Hamel, Hypnea musciformis (Wulfen) J.V. Lamouroux y Gracilaria sp. Otro estudio informó la obtención de agar a nivel de laboratorio a partir del alga roja Gracilaria blodgettii (Castellanos et al., 2003). El rendimiento promedio del agar extraído en este ensayo varió significativamente entre la época de seca y la época de lluvia, y se evidenció una respuesta estacional.
La carragenina es otro polisacárido sulfatado aislado de algas rojas presentes en la plataforma insular cubana como son las especies H. musciformis, K. alvarezii, Heterosiphonia gibbesii (Harvey) Falkenberg, Chondria sp. y Laurencia sp. (Corona et al., 2007; Suárez et al., 2015). También, resulta posible la extracción de alginatos y fucoidanos a partir de algas pardas pertenecientes a los géneros Sargassum, Turbinaria y Stypopodium (Suárez et al., 2015; Valdés-Iglesias et al., 2018).
Los efectos favorables de los bioproductos basados en macroalgas marinas van más allá del suministro de nutrientes útiles para las plantas. El uso de compuestos aislados de la biomasa de algas en forma de entidades químicas puras o extractos enriquecidos en polisacáridos y sus oligosacáridos derivados, representa una alternativa natural que permitiría reducir el empleo de productos agroquímicos en los sistemas agroproductivos cubanos. Su aplicación como bioestimulantes permitiría mejorar la respuesta agronómica de diferentes cultivos, estimular la calidad y el contenido nutricional del producto agrícola y aumentar la vida útil de los productos postcosecha. Sin embargo, el elevado contenido de sales minerales (Na+, Cl-, K+ y Ca2+) en las macroalgas y la variación estacional de su composición química, son elementos a considerar en investigaciones futuras en función de optimizar la aplicación eficiente de estas formulaciones (Castellanos et al., 2003).
CONCLUSIONES
El número significativo de trabajos científicos publicados hasta la fecha, evidencian el interés creciente en las macroalgas marinas como fertilizantes, bioestimulantes, en el acondicionamiento del suelo y en la protección de las plantas. Aunque sus modos de acción no son totalmente conocidos, la aplicación de técnicas avanzadas en biología molecular, metabólica y genómica, está proporcionando un nuevo acercamiento a sus efectos en la expresión génica, rutas bioquímicas y procesos fisiológicos de las plantas. Para optimizar el uso de los EAM como bioestimulantes en la producción agrícola, se requieren investigaciones cultivo-específicas que profundicen en algunos aspectos como: (i) la duración del efecto una vez aplicado el extracto, (ii) sus mecanismos de acción en cada respuesta fenotípica de las plantas, (iii) la(s) fase(s) del cultivo más apropiada(s) para aplicar los extractos algales y obtener beneficios máximos, y (iv) la posibilidad de lograr efectos sinérgicos combinando extractos logrados de diferentes macroalgas y a diferentes concentraciones, o combinando distintas dosis de EAM con otros bioestimulantes vegetales.