INTRODUCCIÓN
Desde el origen del ser humano, este ha mantenido un contacto íntimo con las plantas ya que de ellas depende parte de su subsistencia. A nivel mundial, las plantas son utilizadas por el 80% de la población para satisfacer y/o complementar sus necesidades médicas de acuerdo con estadísticas de la OMS. En México existen aproximadamente 4000 especies de plantas con flores que tienen atributos medicinales, cantidad que representa aproximadamente el 15% de la flora total; pero se estima que el estudio y la validación de los principios activos que contienen sólo se ha realizado en 5% de las especies (Ocegueda et al., 2005).
En el estado de Puebla, México, se localiza una planta con nombre común “siridonia” (Euphorbia nutans Lag.). Esta especie pertenece a la familia Euphorbiaceae, y es una de las plantas endémicas del país. Se caracteriza por poblar zonas tropicales, aunque también se puede hallar en otras zonas (Rzedowski y Rzedowski, 2001). En la Mixteca Poblana (Izúcar de Matamoros, Atlixco, Tehuitzingo, Acatlán de Osorio, Tecomatlán, etcétera), ésta planta se encuentra de forma ruderal y arvense. Sin embargo, sólo es considerada como maleza en los terrenos de cultivo y caminos, donde se elimina de forma mecánica o con aplicación de herbicidas sin mostrar algún interés para aprovecharla. Posiblemente como su empleo medicinal para tratar problemas de gastritis y cicatrizar heridas sólo es conocido de forma empírica por pocas personas de la región de Izúcar de Matamoros y no existe algún estudio científico sobre su propagación y/o aprovechamiento, hay poco interés en esta especie. A tal efecto, Martínez et al. (2006) mencionan haber realizado un estudio de plantas medicinales en cuatro mercados del estado de Puebla (Atlixco, Tepeaca, Tecamachalco y mercado Hidalgo), y registraron 62 especies sin encontrarse a E. nutans. De igual forma, Martínez-Moreno et al. (2016) no la informan en un estudio de plantas medicinales en los mercados de Izúcar de Matamoros y de Acatlán de Osorio, Puebla. En este contexto, se considera a E. nutans como recurso fitogenético valioso, y por ello, es fundamental contar con un protocolo para su propagación in vitro. Estas técnicas de propagación, aseguran material vegetal de calidad no sólo para multiplicación vegetal masiva (Pierik, 1990; Hurtado y Merino, 2000), sino también, para la obtención de metabolitos secundarios de interés biotecnológico, agrícola y/o farmacológico, como ya se ha demostrado en otras plantas como por ejemplo Stevia rebaudiana Bertoni (Magangana et al., 2018; Aguilar-Jiménez et al., 2019), y poder realizar otros estudios posteriores.
Sin embargo, en varios intentos previos para establecer bajo condiciones in vitro E. nutans, con explantes de tejidos de hoja, segmentos nodales y semillas en medio de cultivo MS en diferentes concentraciones, con antioxidantes y reguladores de crecimiento no se obtuvieron resultados satisfactorios durante 12 meses. En las pocas semillas que lograban germinar se observaban características parecidas a la respuesta a altas concentraciones de etileno tales como raíces e hipocótilos cortos, engrosamiento del hipocótilo y curvatura de la plúmula (Taiz y Zeiger, 2006). Además, las plántulas presentaban un color púrpura con abscisión de hojas y la consecuente muerte. Casos similares por problemas de oxidación, fueron referidos por Perales et al. (2016) en Psidium guajava L.
Informes de autores como Tagelsir et al. (2006) dieron a conocer que combinando carbón activado 1.5% con 1 mg l-1 de nitrato de plata, así como por Ross et al. (2017) en Ilex paraguariensis A. St.-Hil. adicionando nitrato de plata 1 o 2 mg l-1, lograron reducir la oxidación de los explantes. Por ello, al conocer de la existencia de especies vegetales recalcitrantes, que presentan problemas para trabajarse in vitro por ser productoras de etileno, regulador de crecimiento que afecta la obtención de respuestas morfogénicas (Kumar et al., 1998) al acoplarse a receptores de membrana mediante un ion cobre como ligando, como sucede en Capsicum spp. (Santana-Buzzy et al., 2006; Ochoa-Alejo y Ramírez-Malangón, 2001; Santana-Buzzy et al., 2012), se optó por evaluar el efecto de una de las sustancias que inhiben a la función del etileno (ion plata) (Taiz y Zeiger, 2006) sobre la muerte de los explantes y los problemas de germinación, así como la respuesta in vitro. En este sentido, Santana-Buzzy et al. (2006), mencionan el empleo de nitrato de plata (AgNO3) para dicho fin en Capsicum chinense Jacq.
Por otra parte, existen algunos trabajos publicados con plantas de la familia Euphorbiaceae por Rambabu et al. (2005) y Kamatham et al. (2012) en Givotia rottleriformis Griff, Rambabu et al. (2006) en Givotia rottleriformis (var. Tel. Thella Poniki), Sri-Rama y Chandrasekhara (2014) en Drypetes roxburghii (Wall.) Hurursawa, que sugieren, que los reguladores de crecimiento y su concentración inducen diferentes respuestas morfogénicas en esta familia dependiendo del género, la especie y el tipo de explante. Posiblemente, en E. nutans las respuestas morfogénicas también varíen no sólo por la presencia de nitrato de plata. Atendiendo a lo anterior, el objetivo del presente trabajo fue determinar el efecto del nitrato de plata (AgNO3) en la germinación in vitro de semillas de E. nutans en combinación con factores como la posición de semillas en el medio de cultivo, las condiciones de iluminación y el uso de reguladores del crecimiento. Este es el primer trabajo de investigación que aporta datos científicos sobre el manejo in vitro de Euphorbia nutans Lag., planta de uso medicinal para tratar problemas gástricos y auxiliar en cicatrizar heridas.
MATERIALES Y MÉTODOS
Material vegetal
Semillas de E. nutans fueron colectadas en Izúcar de Matamoros, Puebla, México, y llevadas al Laboratorio de Cultivo de Tejidos Vegetales del Departamento de Fitotecnia de la Universidad Autónoma Chapingo, México.
Desinfección de semillas
Para el establecimiento in vitro de las semillas, se compararon dos métodos de desinfección. El primero consistió en lavar las semillas con agua y detergente por 1 a 2 minutos, se enjuagaron con agua potable, después se colocaron en etanol 70% (v/v) durante 1 minuto. Pasado ese tiempo se decantó el etanol, se enjuagaron con agua estéril y se sumergieron en una solución de hipoclorito de sodio comercial (Cloralex®) diluido al 15% (v/v) (aproximadamente 1.0% cloro activo) por 15 minutos y se enjuagaron tres veces con agua destilada estéril en campana de flujo laminar de aire para colocar cinco semillas por frasco de cultivo.
El segundo método consistió en lavar las semillas con agua y detergente por 1 a 2 minutos, se enjuagaron con agua potable y se colocaron en peróxido de hidrógeno (H2O2) durante 2 horas en agitación. Pasado ese tiempo, también cinco semillas fueron colocadas directamente en frascos de cultivo. En ambos métodos se emplearon cinco frascos con cinco semillas cada uno. Después de una semana, se observaron para verificar si había presencia de microorganismos contaminantes.
Medio de cultivo básico
Se utilizó un medio de cultivo básico con las sales inorgánicas de Murashige y Skoog (1962) al 100% de su concentración. Se adicionaron 0.4 mg l-1 de tiamina, 100 mg l-1 de mio-inositol, 30 g l-1 de sacarosa y como agente gelificante se emplearon 7 g l-1 de Agar-agar. Antes de la esterilización en autoclave durante 20 min a 1.05 kg cm-2, el pH fue ajustado a 5.7±0.01 con NaOH o HCl 1 N.
Efecto de la posición de semillas en medio de cultivo con nitrato de plata
Se empleó el medio de cultivo descrito anteriormente. Se aproximó al volumen final y se dividió en dos partes iguales para agregar, a una de ellas, 3 mg l-1 de nitrato de plata (AgNO3). Ambos tratamientos se aforaron al volumen final por separado y se les ajustó pH a 5.7 ± 0.01 antes de fundir el agar y esterilizar en autoclave. Se vertieron 20 ml por frasco de cultivo.
Posteriormente, las semillas de E. nutans se desinfectaron como se describió previamente y se colocaron en ambos tratamientos (cinco semillas por frasco) en tres profundidades de siembra: a) superficialmente en el medio de cultivo, b) ligeramente adentro del medio de cultivo y c) completamente adentro del medio de cultivo. Se consideraron cinco repeticiones por tratamiento y a cada frasco con cinco semillas como unidad experimental. Los datos para calcular el porcentaje de germinación, se tomaron cada semana durante nueve semanas en el área de incubación a 26 ± 2 °C con un fotoperiodo de 16/8 h (33.78 µmol m-2 s-1). Como criterio de germinación, se tomó la emisión de la radícula y/o la plúmula a partir del rompimiento de la testa.
Efecto de las condiciones de cultivo
Para evaluar el efecto de las condiciones de cultivo sobre la germinación, se estableció un experimento completamente aleatorizado, donde se probó el medio de cultivo anteriormente expuesto y las condiciones de iluminación de fotoperiodo de 16/8 h (33.78 µmol m-2 s-1) y oscuridad. Se aproximó al volumen final el medio de cultivo básico MS y se dividió en dos partes iguales para agregar, a una de ellas, 3 mg l-1 de nitrato de plata (AgNO3). Ambos tratamientos se aforaron por separado y se les ajustó pH a 5.7 ± 0.01 antes de fundir el agar y esterilizar en autoclave. Se distribuyeron de forma individual 20 ml de medio nutritivo en cada recipiente.
Posteriormente, las semillas de E. nutans se desinfectaron como se describió previamente y se colocaron en ambos tratamientos (cinco semillas por recipiente) de forma superficial en el medio de cultivo. Se emplearon diez repeticiones por tratamiento y se consideró a cada frasco con cinco semillas como unidad experimental. Se registraron datos de germinación cada semana en el área de incubación donde se colocaron durante nueve semanas a 26 ± 2 °C.
Efecto de reguladores de crecimiento
Se emplearon semillas de E. nutans para establecer un experimento completamente aleatorizado, con ocho tratamientos con las sales inorgánicas MS 100% como medio de cultivo básico. Se adicionó en cada tratamiento por separado 1.0 mg l-1 de ácido indol acético (AIA), ácido giberélico (AG3) y benciladenina (BA) más el tratamiento control (MS 100%), con (3.0 mg l-1) y sin nitrato de plata. Se ajustó pH a 5.7 ± 0.01 a cada tratamiento antes de fundir el agar y esterilizar en autoclave. Se distribuyeron individualmente 10 ml en tubos de ensayo de 15x2.3 cm (KIMAX). A continuación, las semillas de E. nutans fueron desinfectadas como se describió anteriormente y se colocaron (una semilla por recipiente) de forma superficial en cada tratamiento, para completar quince repeticiones por tratamiento. Se consideró a cada recipiente de cultivo con una semilla como unidad experimental. Los datos para calcular el porcentaje de germinación se tomaron cada semana de cultivo en incubación durante nueve semanas. Los datos para formación y longitud de brotes y raíz (cm) se tomaron a las seis semanas de cultivo en el área de incubación a 26 ± 2 °C y un fotoperiodo de 16/8 h (33.78 µmol m-2 s-1).
Análisis de datos
Para el análisis de las variables asociadas a la germinación de semillas, se utilizó Microsoft Excel para expresar el porcentaje de germinación de cada tratamiento. Para la longitud de plántula y de raíces, los datos se sometieron a análisis de varianza. Se aplicó la prueba de Tukey (p = 0.05) para definir si había diferencia significativa entre los efectos medios de los tratamientos. El paquete estadístico utilizado fue Minitab 17.
RESULTADOS Y DISCUSIÓN
La desinfección de las semillas con etanol 70% (v/v) durante 1 minuto más Cloralex® diluido al 15% (v/v) durante 15 minutos y con H2O2 en agitación por dos horas, resultaron adecuados para evitar la presencia tanto de hongos como bacterias en el medio de cultivo, y poder establecer in vitro las semillas. Estos resultados estuvieron en correspondencia con lo mencionado por Kondamudi et al. (2009), quienes refirieron que el éxito en el cultivo in vitro va dirigido hacia el control y erradicación de microorganismos nocivos que limiten o afecten las respuestas morfogénicas in vitro y en su defecto, cualquier estudio o proyecto de cultivo de tejidos vegetales in vitro.
En este sentido, el empleo del etanol e hipoclorito de sodio ha sido informado ampliamente en procesos efectivos de desinfección por varios autores. Por ejemplo, el hipoclorito de sodio se ha utilizado para lograr el establecimiento in vitro de compuestas nativas silvestres a partir de semillas como informaron Pérez-Martínez y Castañeda-Garzón (2017).
Autores como Asma et al. (2008) refirieron además, adicionar Tween-20 como un agente tensioactivo. Aun así, en este trabajo fue suficiente el empleo de etanol más hipoclorito de sodio o peróxido de hidrógeno sin la adición de otro coadyuvante para la desinfección. Este resultado coincidió con lo informado por Bidarigh y Azarpour (2013), quienes describieron el empleo de etanol al 10% (v/v) por 30 segundos e hipoclorito de sodio comercial diluido al 30% (v/v) por 10 minutos para establecer in vitro explantes de Euphorbia pulcherrima Willd. ex Klotzsch. Por otra parte, el empleo de H2O2 no sólo puede eliminar la presencia de microorganismos contaminantes, sino también, favorecer la germinación como señalaron Mayo-Mosqueda et al. (2017) al obtener mayor porcentaje de germinación (84.59%) en semillas de Calyptrogyne ghiesbreghtiana (Linden / H. Wendland). Por lo tanto, este resultado puede indicar que con esos desinfectantes se logró disminuir la carga microbiana de los explantes iniciales.
En adición a lo anterior, para el empleo de H2O2 debe tenerse en cuenta que es una especie reactiva de oxígeno y puede causar daños a las macromoléculas celulares al exceder la capacidad antioxidante celular (Halliwell y Whiteman, 2004). Esto indica que puede ser potencialmente dañino al estar en contacto directo con tejidos vegetales. Por ello, tal vez sólo sea recomendable emplearlo en esta especie como aquí se indica siempre y cuando se trate de semillas cigóticas, donde la testa puede evitar que el embrión sufra daños letales.
En el presente trabajo, ambos métodos fueron favorables y se obtuvo el 100% de semillas de E. nutans establecidas in vitro. Sin embargo, por el tiempo que dura cada método de desinfección, se recomienda el primero (etanol 70% v/v más hipoclorito de sodio comercial Cloralex diluido al 15% v/v). No obstante, existen otros métodos para lograr el establecimiento de explantes in vitro como informan Spinoso-Castillo et al. (2017), los cuales, también podrían valorarse para esta u otras especies.
Efecto de la posición de semillas en medio de cultivo
En el medio de cultivo sin nitrato de plata, se constató que la posición de la semilla en el medio de cultivo influyó en la germinación de E. nutans conforme transcurrió el tiempo. Se observó el 26.7% de semillas germinadas a las nueve semanas de cultivo in vitro. Sin embargo, cuando se encontró presente el nitrato de plata (3 mg l-1) independientemente de la posición de la semilla el porcentaje de germinación se elevó a 70% en la primera semana de cultivo. A partir de la segunda semana se logró el 100% de germinación en dos de las posiciones y el 100% de semillas germinadas a las tres semanas de cultivo in vitro en todas las posiciones (Figura 1). Estos resultados sugieren que las semillas de E. nutans no necesitan de estratificación o escarificación para germinar de forma similar a lo referido por Zurita-Valencia et al. (2014) y Benavides et al. (2016) para otras especies. La germinación de las semillas se vea afectada también posiblemente por la presencia de etileno como indicaron Kende (1993), Kumar et al. (1998), Santana-Buzzy et al. (2005), Santana-Buzzy et al. (2006) y Santana-Buzzy et al. (2012). De ser así, también los problemas de fenolización o necrosis pueden ser por la presencia de etileno como se observó en este trabajo en las plántulas obtenidas de E. nutans in vitro en medio de cultivo sin AgNO3 (Figura 4 A y B). Estos resultados coincidieron con lo publicado por Franck-Duchenne et al. (1998), Steinitz et al. (1999) y Ochoa-Alejo y Ramírez-Malagón (2001) para Capsicum spp., plantas que producen etileno y son recalcitrantes para el establecimiento in vitro. En este contexto, los resultados sugieren que, cuando se presentan problemas de necrosis (oxidación) o tejidos recalcitrantes para su establecimiento in vitro, no importan el tipo, combinación y concentración de antioxidantes empleados para prevenir o subsanar dicho inconveniente (Concepción et al., 2005), si no se atiende el problema de la acumulación de etileno in vitro. Dicha afirmación se basa en lo ya informado por Taiz y Zeiger (2006) de que el nitrato de plata puede inhibir el efecto de etileno, y en los resultados obtenidos por Ross et al. (2017) cuando adicionaron 1 o 2 mg l-1 de nitrato de plata al medio de cultivo, lo cual, redujo la oxidación y obtuvo un 70% de explantes vivos con yemas axilares desarrollados en brotes.
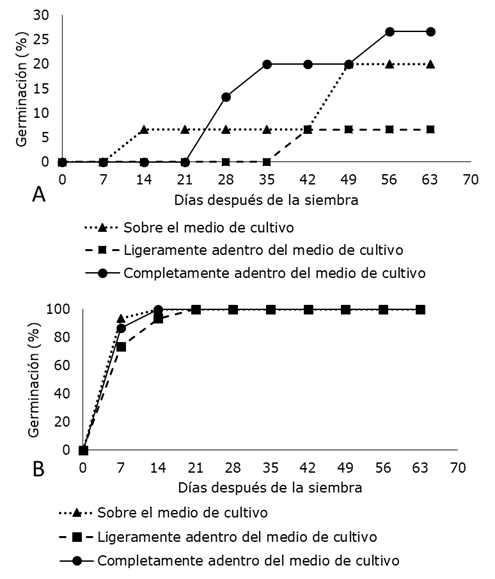
Figura 1. Germinación in vitro de semillas de Euphorbia nutans Lag. en diferente posición en el medio de cultivo. A) Medio de cultivo MS al 100% de su concentración sin AgNO3. B) Medio de cultivo MS al 100% de su concentración con AgNO3 (3.0 mg l-1). Cada punto representa el porcentaje calculado cada semana de incubación.
Efecto de las condiciones de cultivo
En el medio de cultivo MS sin nitrato de plata, los resultados demostraron que en E. nutans , la presencia de luz 16/8 h (33.78 µmol m-2 s-1) estimuló la germinación in vitro de las semillas (22.8%) con respecto a la condición de obscuridad (5%) (Figura 2 A). Resultados parcialmente similares a lo informado por Sunandakumari et al. (2005) en Euphorbia nivulia Buch, donde al parecer, la presencia de luz fue un factor importante para estimular la germinación de semillas y la obtención de respuestas morfogénicas. No obstante, la respuesta a la germinación de semillas expuestas a luz u obscuridad, puede depender también de la especie y de otro constituyente del medio de cultivo, pues Flores et al. (2017) informaron el 90% de germinación de semillas de Vanilla planifolia Jacks. ex Andrews en condiciones de obscuridad sin carbón activado, con carbón activado y en obscuridad, la germinación se vio inhibida. En E. nutans, el porcentaje de germinación no aumentó a partir de las ocho semanas de cultivo, al contrario, las plántulas obtenidas en ambas condiciones de luz y obscuridad, murieron a las catorce semanas bajo condiciones in vitro. Esto parece indicar que, al ser especies silvestres, cuentan con algún mecanismo fisiológico que les permite germinar fácilmente en lugares expuestos.
En este contexto, se está de acuerdo parcialmente con Bello-Bello et al. (2017) en la importancia de la presencia de luz para la obtención de respuestas morfogénicas in vitro; lo cual, puede deberse a los diferentes espectros que la componen. Aunque no son variables consideradas para E. nutans , existen trabajos publicados sobre la importancia de ellos como el espectro de luz azul para estimular la biosíntesis de clorofila, la apertura de estomas, maduración de cloroplastos y la fotosíntesis (Tibbitts et al., 1983), así como el espectro de luz roja para elongar tallo y causar cambios en la anatomía de la planta al incidir en el fitocromo de las células (Schuerger et al., 1997). Sin embargo, de acuerdo con los resultados obtenidos en el presente estudio con E. nutans , la germinación y respuestas morfogénicas in vitro no dependen directamente de la luz u obscuridad, sino de la presencia de AgNO3 en el medio de cultivo (Figura 2 B), el cual, puede inhibir el efecto de la posible presencia de etileno (Taiz y Zeiger, 2006).
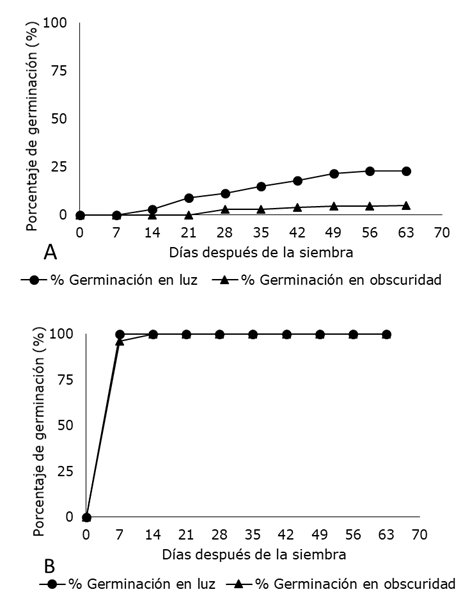
Figura 2. Germinación in vitro de semillas de Euphorbia nutans Lag. bajo condiciones de luz y obscuridad. A) Semillas colocadas en medio de cultivo MS al 100% de su concentración sin nitrato de plata. B) Semillas colocadas en medio de cultivo MS al 100% de su concentración con AgNO3 (3 mg l-1).Cada punto representa el porcentaje calculado cada semana de incubación.
Efecto de reguladores de crecimiento
El porcentaje de germinación in vitro de semillas de E. nutans, en medio de cultivo MS al 100% de su concentración, con la incorporación de reguladores de crecimiento vegetal de forma separada y sin AgNO3, mostró dependencia de AG3 con un 60% de semillas germinadas seguida de AIA con 33.33%.
Aun cuando AG3 favoreció el 13.3% de la germinación a partir de la segunda semana de cultivo in vitro, el 60% de germinación correspondió a la novena semana (Figura 3 A). Con base en el mayor porcentaje de germinación obtenido con AG3, estos resultados coinciden con lo publicado por Rambabu et al. (2005), quienes también emplearon AG3 para promover la germinación de semillas de Givotia rottleriformis Griff (Euphorbiaceae) y alcanzaron 90% de semillas germinadas en comparación con el control con sólo 5%. Aparte, Sri-Rama y Chandrasekhara (2014), emplearon semillas frescas de Drypetes roxburghii (Euphorbiaceae) y AG3 e informaron una germinación de 83.30 ± 0.63% removiendo la testa de las semillas cultivadas en un medio de cultivo MS con 0.5 mg l-1 de AG3 + 0.01% de carbón activado. Igualmente, Fidemann et al. (2016) mencionaron el uso de AG3 para optimizar la germinación de semillas de Capsicum baccatum L. pero en concentración más elevada (1.88 mg l-1) que la empleada en E. nutans. Esto sugiere que se realicen otros experimentos con mayores concentraciones de AG3. La respuesta de germinación en semillas con AG3 se debe a su participación efectiva movilizando reservas nutritivas al activar la síntesis de α-amilasas, enzimas hidrolíticas que van a romper macromoléculas (almidón) y de esta forma pasan al embrión para poder ser utilizadas y así estimular la germinación. Por otra parte, el resultado obtenido con AIA, posiblemente se deba al efecto que tiene este regulador del crecimiento vegetal en la despolimerización de la pared celular y la estimulación radicular, con lo cual, el embrión puede tomar más nutrientes para su activación (Taiz y Zeiger, 2006).
El efecto de BA en la germinación de semillas, tuvo una respuesta similar al tratamiento control. Este resultado difiere de lo informado por Rangel-Estrada et al. (2015) al emplear BA para activar la yema axilar y multiplicar brotes in vitro de Euphorbia pulcherrima y a lo referido por Perales et al. (2016), donde BA favoreció la multiplicación de Psidium guajava L. Esto sugiere, que BA podría actuar en la activación celular de tejidos diferenciados y no en la germinación de semillas cigóticas de E. nutans. Finalmente, los resultados logrados en E. nutans coincidieron con Nikam y Barmukh (2009) al obtener el 80.87% y 46% de germinación en semillas de Santalum album L. tratadas y no tratadas con AG3, respectivamente; y con lo publicado por Pérez-Martínez y Castañeda-Garzón (2017) en semillas de compuestas nativas silvestres, siendo AG3 el regulador del crecimiento que mejor favoreció el porcentaje de germinación comparado con 6-Bencilaminopurina (BAP) y AIA.
Sin embargo, al igual que en el ensayo anterior la mayor eficiencia y porcentaje de germinación in vitro de semillas de E. nutans, dependió directamente de la presencia de AgNO3 y no de reguladores de crecimiento vegetal en el medio de cultivo (Figura 3 B). Por lo tanto, si en estudios posteriores se comprueba la presencia de etileno y la inhibición de su efecto in vitro en E. nutans con la aplicación de AgNO3 como se demostró en chile habanero (Capsicum annum L.) por Santana-Buzzy et al. (2006), Bello-Bello et al. (2010), Yupaporn y Sompong (2012) y Alva y Oropeza (2013), esto puede sugerir que el etileno influye directamente en la biosíntesis o efecto de otros reguladores de crecimiento vegetal en la germinación de semillas de E. nutans.
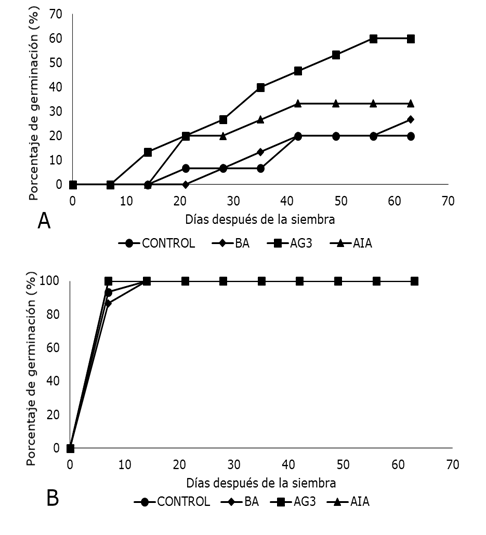
Figura 3. Efecto de tres reguladores de crecimiento vegetal en la germinación in vitro de semillas de Euphorbia nutans Lag. A) Tratamientos sin AgNO3 B) Tratamiento con AgNO3 (3 mg l-1).
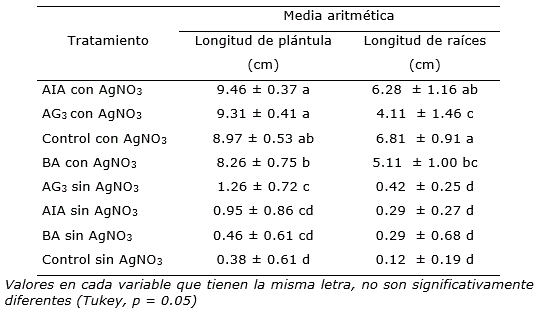
Por otra parte, los datos que corresponden a longitud de plántulas y raíces de semillas de E. nutans germinadas en los diferentes tratamientos con AgNO3, mostraron diferencia significativa (Tukey, p=0.05) con respecto a los tratamientos sin AgNO3. Estos resultados estuvieron en correspondencia con los descritos por Santana-Buzzy et al. (2006) y Bello-Bello et al. (2010) sobre el efecto favorable de AgNO3 in vitro para mitigar daños por efecto de etileno. No obstante, si la presencia de AgNO3 favorece la longitud de plantas y de raíz en E. nutans in vitro, en este trabajo se muestra que esas respuestas morfogénicas van a depender del tipo de regulador de crecimiento empleado, y posiblemente de la concentración y combinación de éstos en el medio de cultivo (Tabla 1).
Tabla 1. Longitud de plántulas y raíz obtenidas de la germinación in vitro de semillas de Euphorbia nutans Lag. con y sin AgNO3.
Así mismo, se observó deformación de raíces y gravitropismo negativo durante la emergencia de plántulas en los tratamientos sin AgNO3. Estos resultados fueron similares a los informados por Rambabu et al. (2006) en plántulas de Givotia rottleriformis obtenidas a partir de semillas germinadas in vitro, las cuales presentaron ciertas anormalidades. En E. nutans, no se observó la formación de callo en ninguno de los tratamientos ni en cualquiera de las condiciones estudiadas para obtener plantas a partir de semillas germinadas in vitro. Sin embargo, las plántulas obtenidas en todos los tratamientos sin AgNO3 presentaron coloración púrpura y características parecidas a la triple respuesta a la presencia de etileno tales como hipocótilos y raíces cortas, curvatura de la plúmula e hipocótilos engrosados (Taiz y Zeiger, 2006) (Figura 4).

Figura 4. Plántulas de Euphorbia nutans Lag. a partir de semillas germinadas in vitro. A y B) Plántulas con posible triple respuesta a etileno C) Plántula con gravitropismo negativo D) Plántula emergida a los 5 días de cultivo con AgNO3, E) Plántula obtenida en medio de cultivo con AgNO3 a las tres semanas in vitro.
CONCLUSIONES
Los protocolos de desinfección con el empleo de etanol 70% (v/v) e hiploclorito de sodio comercial (Cloralex®) diluido al 15% (v/v) y peróxido de hidrógeno permiten el establecimiento in vitro de semillas de E. nutans y evitan la presencia de contaminantes microbianos en el medio de cultivo. Además, la adición de AgNO3 (3 mg l-1) al medio de cultivo favorece la germinación in vitro de semillas a partir de la primera semana de cultivo y su combinación con AIA la longitud de las plántulas y de la raíz. Estos resultados sirven de base para la propagación in vitro de E. nutans.















