Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
CorSalud
versión On-line ISSN 2078-7170
CorSalud vol.10 no.1 Santa Clara ene.-mar. 2018
ARTÍCULO DE REVISIÓN
Cardiotoxicidad inducida por quimioterapia
Cardiotoxicity induced by chemotherapy
Rodolfo A. Morales Yera1, Ludmila Sierra Pérez1, Alexander Triana Díaz2
1. Departamento de Oncología Clínica, Hospital Universitario Celestino Hernández Robau. Villa Clara, Cuba. Correo electrónico: rodolfomy@infomed.sld.cu
2. Servicio de Cardiología, Hospital Universitario Celestino Hernández Robau. Villa Clara, Cuba.
RESUMEN
El cáncer es un problema de salud pública de gran envergadura en el mundo. La quimioterapia está indicada en varias fases del tratamiento antineoplásico ya sea como terapia neoadyuvante, adyuvante o paliativa. Uno de los efectos secundarios más preocupantes generados por la quimioterapia es la cardiotoxicidad, y uno de los principales síntomas es el fallo cardíaco secundario a un daño a nivel del miocardio por la toxicidad directa e indirecta de las terapias antineoplásicas. El objetivo del presente artículo es realizar una revisión del estado del arte de la cardiotoxicidad inducida por quimioterapia, además de hacer una síntesis de los diferentes efectos cardiotóxicos, mecanismos de cardiotoxicidad y métodos que se han desarrollado para su diagnóstico y prevención.
Palabras clave: cardiotoxicidad, quimioterapia, insuficiencia cardíaca.
ABSTRACT
Cancer is a major public health problem in the world. Chemotherapy is indicated in several phases of the antineoplastic treatment, either as neoadjuvant, adjuvant or palliative therapy. One of the most worrisome side effects generated by chemotherapy is cardiotoxicity, and one of the main symptoms is heart failure, secondary to damage to the myocardium due to the direct and indirect toxicity of antineoplastic therapies. The objective of this article is to review the state of the art of the chemotherapy-induced cardiotoxicity, as well as to synthesize the different cardiotoxic effects, cardiotoxic mechanisms and methods that have been developed for its diagnosis and prevention.
Keywords: cardiotoxicity, chemotherapy, heart failure.
INTRODUCCIÓN
El cáncer es un problema de salud pública de gran envergadura en el mundo. Es la segunda causa de mortalidad en los Estados Unidos y se espera que aproximadamente entre los años 2025-2030, sobrepase a las enfermedades cardiovasculares como la principal causa de muerte1.
En América Latina la incidencia por cáncer es menor (tasa estandarizada por edad de 163 por 100000 habitantes) en comparación con Europa (264 por 100000) o con los EE UU (300 por 100000), pero es causa de una alta mortalidad, considerada en esta parte del continente como la tercera causa de muerte. En Cuba, se registraron durante los años 2015 y 2016 un total de 24646 y 24462 defunciones, respectivamente, por cáncer, segunda causa de mortalidad en el país, únicamente precedida por las enfermedades del corazón2.
Aunque la tasa de incidencia ajustada a la edad ha disminuido en los últimos 10 años, el número total de pacientes que padecen de cáncer continúa creciendo; esto se asocia a una población de mayor edad y al incremento de la sobrevida, gracias a la detección temprana y los avances científico-tecnológicos en el tratamiento3.
La reducción de hasta un 20% de la mortalidad en los pacientes con cáncer y el aumento de la supervivencia en esta enfermedad, ha puesto de manifiesto toxicidades cardiovasculares a las que se prestaba poca atención hace años. Cáncer y corazón comparten múltiples factores de riesgo, pero además el tratamiento del cáncer se comporta como un nuevo factor de riesgo y se asocia a efectos secundarios graves, y al desarrollo de complicaciones cardíacas relacionadas con él4,5.
La quimioterapia (QT) y la radioterapia (RT) se han convertido en dos de los pilares del tratamiento de varios tipos de cáncer. Su uso ha permitido un aumento en la sobrevida de los pacientes con esta enfermedad; no obstante, la frecuencia de su uso para lograr remisión, las dosis y su mecanismo de acción pueden generar efectos secundarios en los pacientes. Dentro de los más preocupantes está la cardiotoxicidad. A pesar de tener muchas manifestaciones, una de las principales son los síntomas de fallo cardíaco, secundarios a un daño a nivel del miocardio por la toxicidad directa e indirecta de las terapias antineoplásicas6,7. Debido a esto, la función cardíaca es una de las variables de dosis limitantes durante el tratamiento oncológico, ya que contribuye a la morbilidad y mortalidad de la población expuesta.
El término cardiotoxicidad engloba diversas manifestaciones patológicas a nivel cardiovascular producto del tratamiento oncológico, la más frecuente es la insuficiencia cardíaca, que en algunos casos puede ser de grado avanzado y con alta mortalidad, como sucede por el uso de antraciclínicos8,9. Los informes registran una mortalidad 3,5 veces mayor en comparación con la producida por miocardiopatías idiopáticas10.
En el estudio prospectivo de corte transversal de Wise con 1853 adultos sobrevivientes de cáncer en la infancia, se expone un aumento de la prevalencia de afecciones cardíacas en 3-24% en los sobrevivientes de 30-39 años, y 10-37% en los mayores de 40 años11.
La evaluación cardiovascular de los pacientes expuestos a QT, el análisis del riesgo, la prevención y la mitigación de la lesión cardíaca, el monitoreo de la función del corazón durante y después de la terapia, el avance en los medicamentos utilizados, la prevención y el tratamiento de la cardiotoxicidad, son medidas que se deben tomar de forma interdisciplinaria para lograr un enfoque global del paciente y facilitar una evolución adecuada; es por esto que la Cardio-Oncología surge como una disciplina necesaria para el enfoque y tratamiento integral de estos pacientes12.
Como subespecialidad tiene el objetivo de facilitar el tratamiento del cáncer, de modo que los pacientes puedan recibir el tratamiento indicado, con el menor número de efectos secundarios o interrupciones posibles, que sin duda penalizan su pronóstico vital13.
CARDIOTOXICIDAD Y QUIMIOTERAPIA
La cardiotoxicidad se define como la afección miocárdica generada por la exposición a agentes quimioterapeúticos4. El desafío consiste en cómo identificar los cambios a nivel de los miocitos14.
El Comité de Evaluación y Revisión Cardíaca (Cardiac Review and Evaluation Committee) vincula la definición de cardiotoxicidad en pacientes que han recibido QT, con la presencia de uno o más de los siguientes criterios:
- Miocardiopatía con compromiso en la función del ventrículo izquierdo.
- Síntomas o signos de falla cardíaca unidos a la presencia de tercer ruido, taquicardia o ambos.
- Disminución de al menos el 5% en la fracción de eyección con valores menores del 55% y signos o síntomas presentes, o una disminución del 10% ante valores menores del 55% en la fracción de eyección, sin presencia de signos o síntomas12,13.
Según la American Society of Echocardiography (ASECHO), la cardiotoxicidad por insuficiencia cardíaca es una disminución de la fracción de eyección del ventrículo izquierdo (FEVI) >10 puntos porcentuales respecto al valor basal o a un valor <53% (valor normal de referencia para ecocardiografía bidimensional)14.
La QT está indicada en varias fases del tratamiento antineoplásico ya sea como terapia neoadyuvante, adyuvante o paliativa, por tal motivo, los pacientes pueden presentar en cualquiera de estas fases un evento cardiotóxico, de forma temprana durante el tratamiento, o hasta 40 años después de finalizada la terapia.
Clasificación del daño miocárdico atendiendo a la variable tiempo
Agudo o subagudo: cuando se desarrolla desde el inicio del tratamiento hasta dos semanas después de terminado.
Crónico: cuando la toxicidad aparece posterior a un año de completar la terapia, a su vez la cardiotoxicidad crónica se divide en dos estados: temprana, durante el primer año posterior a la terapia; y tardía, la que ocurre años después de la finalización de esta (Figura 1)12,15.
Clasificación de los fármacos antineoplásicos según el grado de riesgo para cardiotoxicidad
· Riesgo alto: antraciclinas, ciclofosfamida y trastuzumab.
· Riesgo moderado: docetaxel, pertuzumab, sunitinib, sorafenib.
· Riesgo bajo: bevacizumab, dasatinib, imatinib, y lapatinib16,17.
Entre las manifestaciones cardiovasculares de origen tóxico están: fallo cardíaco con disfunción sistólica ventricular (antraciclinas, trastuzumab, inhibidores de tirosinquinasa, ciclofosfamida, bevacizumab), hipertensión arterial (bevacizumab), arritmias (antraciclinas y taxanos), hipotensión arterial (etopóxido, alemtuzumab, cetuzumab, rituximab e interleuquina 2), isquemia miocárdica (5-fluoracilo, capecitabina, taxanos, alcaloides, bevacizumab), fenómenos tromboembólicos y pericarditis12,17.
Mecanismos generales y específicos de cardiotoxicidad
Generalmente, la cardiotoxicidad inducida por QT se debe a mecanismos multifactoriales entre los que se encuentran:
1. La producción de radicales libres (ROS).
2. Los defectos en la estructura y función mitocondrial.
3. La alteración en la homeostasis del calcio y el hierro.
4. La alteración en la expresión genética18.
La consecuencia final es la muerte miocárdica celular, producida por la inducción de apoptosis17, asociada a la deprivación del crecimiento y supresión de la angiogénesis, lo que trae por consiguiente que se comprometa la capacidad de reparación12,18.
Tipos de agentes antineoplásicos con riesgo de producir cardiotoxicidad
- Tipo I: la cardiotoxicidad con mecanismo similar a las antraciclinas "efecto antraciclina". Su toxicidad cardíaca es dosis dependiente y llega a producir un daño cardíaco irreversible.
- Tipo II: la cardiotoxicidad con mecanismo similar al trastuzumab "efecto trastuzumab", relacionado con un daño cardíaco reversible que permite una recuperación de la funcionalidad y un reinicio del régimen si está indicado. Esto se logra, debido a que no hay cambios ultraestructurales en los miocitos13-17.
Cardiotoxicidad tipo 1: Antraciclinas
Su mecanismo se relaciona con el daño producido por los radicales libres en el cual la reducción del grupo quinona en el anillo B de los antracíclicos lleva a la formación de un radical semiquinona, el cual se oxida y genera radicales libres como el superóxido con la formación del peróxido de hidrógeno que interactúa con el miocardio y produce un ambiente de desequilibrio entre los mecanismos antioxidantes y las sustancias proinflamatorias, lo que predispone al daño por la reducción de la glutatión peroxidasa, afectada con el uso de estos medicamentos.
La formación de un complejo de hierro férrico con la doxorrubicina cataliza esta reacción y hace que aumenten los ROS, los cuales contribuyen a la conversión de hierro ferroso en férrico, y destruyen las membranas celulares y el retículo endoplasmático, lo que produce un descenso en el calcio intracelular y una disminución en la contractibilidad. A su vez, las citoquinas inflamatorias inducen la liberación de histamina, factor de la necrosis tumoral alfa y la interleuquina 2, estas citoquinas inducen la miocardiopatía dilatada y la disfunción beta adrenérgica. A parte del estrés oxidativo, las topoisomerasas también se han implicado en la toxicidad asociada a las antraciclinas, la actividad antitumoral de la doxorrubicina se explica por la formación de un complejo ternario con una de las isoenzimas conocida como Top2a -doxorrubicina-ADN. Estos cambios se han asociado a un aumento en la apoptosis12,19.
Como concepto más importante y práctico se destaca que este grupo genera un daño del miocito que es dosis dependiente (acumulativo) y se asocia, por ende, a disfunción diastólica precoz y sistólica tardía. Dados los efectos cardiotóxicos descritos, el Instituto Nacional Americano del Corazón define la cardiotoxicidad por antraciclinas como una reducción absoluta de la FEVI por debajo del 50% o una caída de 10% de la FEVI en relación al valor inicial, asociado o no a la aparición de síntomas o signos de insuficiencia cardíaca, hecho que motivó la indicación formal de seguimiento clínico-ecocardiográfico en forma seriada y pautada, según la estratificación de riesgo realizada en cada paciente4,6,9,12,15,17.
Cardiotoxicidad tipo 2: Trastuzumab
Inhibe la proliferación de células humanas tumorales que sobreexpresan la proteína HER2. Este actúa uniéndose al dominio extracelular de HER2. Dicho factor de crecimiento epidérmico es un receptor tirosinquinasa transmembrana que actúa como proto-oncogén y se relaciona con la regulación del crecimiento celular, se sobreexpresa en el 25% de los cánceres de mama y se asocia con el mal pronóstico; en el corazón se asocia con la neuregulina (ligando peptídico de HER3 y HER4), que al unirse con HER4 permite una heterodimerización con HER2 y subsecuente fosforilación y activación de varias vías de señalización que aumentan: el contacto celular y el acoplamiento mecánico, y promueven la sobrevida y la función contráctil, los cuales son necesarios para el desarrollo y la supervivencia de los miocitos cardíacos12,19.
La exposición al trastuzumab, mediante diferentes mecanismos moleculares relacionados con la apoptosis, puede producir disfunción miocárdica12,19. Es importante destacar en primera instancia que el efecto cardiodepresor tiene carácter transitorio y reversible al suspender la medicación, con un tiempo de recuperación de la FEVI de aproximadamente un año, importante diferencia con el tipo 1. Su incidencia es muy variable, y depende de los factores de riesgo asociados, por ejemplo varía desde un 5 a un 30% si se utiliza solo o asociado a antraciclinas. Esta incidencia también aumenta con la edad, la enfermedad cardiovascular previa, y los antecedentes de RT o QT previa, o ambas, principales factores de riesgos asociados a cardiotoxicidad. En este sentido la cardiotoxicidad en este grupo ha disminuido francamente, simplemente con la mejor y más estricta monitorización de los factores de riesgo y la intención de evitar el uso concomitante de antraciclinas4,6,9,12,15,17.
Otros fármacos citotóxicos que han sido asociados a cardiotoxicidad
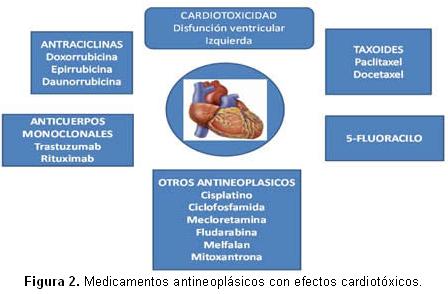
El 5-fluorouracilo, busulfan, capecitabina, ciclofosfamida, cisplatino, dacarbamazina, fludarabina, mecloretamina, melfalan, mitoxantrona, mitomicina, taxoides como paclitaxel y docetaxel, además de anticuerpos monoclonales como: el trastuzumab y el rituximab, entre otros, han sido asociados a cardiotoxicidad15 (Figura 2).
Taxoides
Los taxoides, como el paclitaxel y el docetaxel, también producen diversos efectos cardiotóxicos tras su administración. En el caso del paclitaxel, combinado o no con cisplatino, desencadena en algunos pacientes trastornos cardíacos consistentes en bradi o taquiarritmias, bloqueos aurículo-ventriculares y de rama, isquemia cardíaca e hipotensión, secundario a un efecto cronotrópico directo en el sistema de Purkinje, al presentar una incidencia de 0,5%12.
La formulación de paclitaxel usada clínicamente es una mezcla que contiene el adyuvante cremofor EL, el cual también se asocia con cardiotoxicidad, nefrotoxicidad y reacciones de hipersensibilidad19. Los factores de riesgo que predisponen a toxicidad cardíaca comprenden la angina inestable, enfermedades coronarias graves, insuficiencia cardíaca congestiva y fibrilación auricular12,20.
Fluorouracilo
El 5-fluorouracilo es el segundo fármaco cardiotóxico en frecuencia, después de las antraciclinas21. Se estima que del 1 al 18% de los pacientes tratados con 5-FU, un antimetabolito de uridina, presentan cardiotoxicidad, la cual es más frecuente cuando se administra en infusión continua. Estos pacientes muestran arritmias cardíacas, isquemia miocárdica, angina, insuficiencia cardíaca congestiva y muerte súbita; en el caso de la angina es el síntoma más frecuente durante las primeras horas del inicio de la terapia, secundaria a un espasmo coronario22.
Con la forma oral del 5-FU, la capecitabina, también se registra una alta tasa de toxicidad a pesar de que el medicamento actúa selectivamente sobre el tumor. La tasa de mortalidad del 2,2 al 13% durante el seguimiento del tratamiento con altas dosis de 5-FU, demuestra cuán peligroso pueden ser estos efectos adversos22.
Ciclofosfamida
Es un agente alquilante del grupo de las oxazoforinas, que se caracteriza por su capacidad de daño al DNA. Se ha informado que a altas dosis produce efectos agudos como: pericarditis, descompensación cardíaca y miocardiopatía en tan sólo 10 días de haber iniciado su administración, su efecto es dosis dependiente y es más común a cantidades superiores de 200 mg/kg.
Sus efectos fatales se han registrado hasta en 11% de los casos. La miocarditis y menos común el fallo cardíaco, aparecen durante las primeras semanas postratamiento12. También se presenta en algunos pacientes una disminución de la función sistólica y al igual que las antraciclinas, incrementa las concentraciones intracelulares de radicales libres de oxígeno15.
Cisplatino
Se ha informado que algunos pacientes tratados con cisplatino desarrollan infarto agudo de miocardio. En algunos estudios se ha postulado que estos efectos adversos se deben a daños vasculares, activación de la agregación plaquetaria y de la vía del ácido araquidónico, e hipomagnesemia15.
Bevacizumab
Este inhibidor del factor de crecimiento vascular endotelial (VEGF), se asocia a: disfunción miocárdica, hipertensión y sucesos arteriales tromboembólicos con incidencia de 1,6%, debido a una disminución en la producción del óxido nítrico12,19.
Sutinib y Sorafenib
Son inhibidores multiquinasa, al inhibir el receptor VEGF, se asocian a: angina de pecho, disminución de la FEVI y disfunción contráctil, con alteraciones en el electrocardiograma en 18%, 12% y 16%, respectivamente19.
Interferones alfa-2a y alfa-2b
Pueden causar arritmias que van desde una fibrilación atrial hasta una fibrilación ventricular en el 20% de los pacientes; y el uso crónico puede llevar a la miocardiopatía dilatada12,19.
Factores de riesgo para el desarrollo de cardiotoxicidad por quimioterapia
Para que se presente cardiotoxicidad por un fármaco interactúan factores propios del agente y del paciente. En lo que se refiere al fármaco, el tipo de agente, la dosis aplicada durante cada sesión y la dosis acumulada, así como la frecuencia, la vía de administración y otros agentes empleados en combinación, son factores que afectan la forma y el tiempo de presentación de la toxicidad. La edad (niños y mayores a 65 años), cualquier enfermedad cardiovascular previa, la RT previa _principalmente mediastinal_, las alteraciones metabólicas y la hipersensibilidad a los distintos fármacos se consideran entre los factores relacionados con el paciente11,21,23.
Monitoreo y diagnóstico de cardiotoxicidad
Como primer paso, se debe realizar un examen cardiovascular basal que permita detectar los factores de riesgo cardíacos de cada paciente. Es fundamental que antes del inicio de la QT sean tratadas la hipertensión y la dislipidemia, en caso de que existan23.
Se recomienda ampliamente realizar un monitoreo de la función cardíaca antes, durante y una vez finalizada la QT, especialmente si se emplean antraciclinas con el fin de detectar tempranamente cambios subclínicos, aunque no existen a la fecha guías que establezcan el método ni el intervalo de elección para realizar dicho monitoreo21,23.
La evaluación periódica de la función cardíaca por medio de ecocardiografía transtorácica es el método diagnóstico incruento más utilizado en la práctica clínica oncológica para la medición de cardiotoxicidad en pacientes con QT, la cual se evidencia por medio de la disminución de la FEVI23.
Por otra parte, el electrocardiograma de 12 derivaciones que presenta trastornos en la repolarización, disminución del voltaje del complejo QRS (indicativo de miocardiopatía) y prolongación del intervalo QT en aquellos pacientes con extensos tratamientos con antraciclinas, se ha referido como un marcador temprano de disfunción ventricular izquierda; sin embargo, estos métodos diagnósticos subestiman el daño cardíaco, son dependientes del operador y los cambios sugestivos por cardiotoxicidad sólo aparecen cuando ya se ha producido una disfunción miocárdica significativa, lo que limita la intervención farmacológica temprana. Por lo tanto, se han propuesto otros métodos y técnicas para la detección precisa y oportuna de la cardiotoxicidad inducida por QT12,15,21,23.
La Sociedad Europea de Oncología recomienda la medición de la FEVI al comienzo de la terapia antineoplásica en pacientes mayores de 60 años o con factores de riesgo cardiovasculares, luego de la administración de la mitad de la dosis acumulativa total de antraciclinas, antes de las siguientes dosis y a los 3, 6 y 12 meses, respectivamente, después de finalizado el tratamiento quimioterapéutico15. Cuando se presenta una disminución mayor del 10% asociado a un valor absoluto de FEVI menor del 50%, se recomienda la suspensión de la terapia antineoplásica15,23, debido a que diversos estudios han demostrado que la presencia de cambios en la FEVI se asocian con insuficiencia cardíaca crónica 3 años después de finalizada la QT23.
La mayor desventaja de esta técnica, es la incapacidad de detectar pequeños cambios. Afortunadamente, el desarrollo tecnológico permite disponer de nuevas herramientas en ecocardiografía, capaces de evaluar el funcionamiento del miocardio, y detectar cambios que se manifiestan mucho antes que el deterioro de la FEVI, como son el estudio miocárdico tisular, y específicamente, el estudio del porcentaje de cambio de longitud de las fibras miocárdicas longitudinales durante el ciclo cardíaco, en forma global, denominado deformidad (strain) longitudinal global. Técnica esta que ha demostrado ser útil en el diagnóstico subclínico de varias miocardiopatías, pero en particular en ocasión de cardiotoxicidad por agentes antineoplasicos24.
Actualmente, los avances en ecocardiografía tridimensional, doppler tisular, imágenes de velocidad de deformación miocárdica y resonancia magnética cardíaca parecen ser prometedores también en la detección de cambios subclínicos23,25.
La biopsia endomiocárdica se describe en las publicaciones más recientes de la AHA como el método más sensible y específico para el diagnóstico y monitoreo de cardiotoxicidad por antraciclinas, ya que permite medir directamente la presencia y extensión de fibrosis cardíaca producida por la QT, pero su uso es limitado por ser un método cruento15,21,23.
Un punto controversial respecto al monitoreo cardíaco de los pacientes que van a recibir QT es si debe determinarse la FEVI a todos antes de iniciar el tratamiento. Muchos autores sugieren que no se realice estimación inicial de la FEVI si el paciente no tiene factores de riesgo cardiovascular, si va a recibir menos de 300 mg/m2 de doxorrubicina, no empleará trastuzumab de forma concomitante, o si es mujer menor de 65 años de edad sin factores de riesgo, pero algunos autores no aceptan estas recomendaciones23.
La medición de biomarcadores séricos específicos de lesión miocárdica ha sido propuesta como una estrategia atractiva, válida y novedosa en la identificación y monitoreo de cardiotoxicidad en pacientes tratados con QT, debido a su relativa facilidad de uso, capacidad de predicción, precisión y exactitud15. Los principales marcadores séricos son la troponina, el BNP y el NT-proBNP17.
El uso de biomarcadores, en especial la troponina con su alto valor predictivo negativo, permite estratificar a los pacientes que no requieren de un seguimiento estricto de cardiotoxicidad, lo que disminuye el uso de métodos diagnósticos innecesarios, y los costos para el sistema de salud y para los pacientes15.
Otras formas de cardiotoxicidad inducida por QT, como isquemia, arritmias y enfermedad pericárdica, pueden identificarse mediante los mismos protocolos y métodos diagnósticos que se emplean en los pacientes con estas manifestaciones y que no reciben QT23.
Aunque se ha enfatizado en estrategias para prevenir la cardiotoxicidad, no existe un consenso acerca de cuál es la manera más efectiva para abordar a estos pacientes. Es por esto que se requiere de nuevos estudios prospectivos que incluyan grandes cohortes de pacientes, y que utilicen métodos validados y comercialmente disponibles para la tamización, con biomarcadores que permitan hacer una mejor clasificación y estratificación del riesgo de cardiotoxicidad; además de diseñar herramientas para su tratamiento oportuno15.
Tratamiento y prevención de la cardiotoxicidad por QT
En marzo de 2017, la American Society of Clinical Oncology (ASCO) publicó la guía para la prevención y supervisión de la disfunción cardíaca en los pacientes adultos sobrevivientes de cáncer. El propósito de esta guía es desarrollar recomendaciones para la prevención y supervisión de la función cardíaca en dichos pacientes.
La guía se basó en los resultados de una revisión sistemática que compiló 104 estudios clínicos útiles publicados entre 1996-2016, los cuales fueron evaluados por el comité de guías de la ASCO para la emisión de las recomendaciones26. Se basa en cinco elementos:
1. Identificar a los pacientes que están en riesgo de desarrollar una disfunción cardíaca: valorar la exposición a antraciclinas y RT, el uso de inhibidores tirosinaquinasa y los posibles factores de riesgo cardiovasculares (tabaquismo, hipertensión, diabetes, dislipidemia y obesidad).
2. Estrategias para prevenir o minimizar el riesgo antes de iniciar la terapia: al realizar al paciente una evaluación clínica exhaustiva; descartar los posibles factores de riesgo cardiovasculares, y evitar o minimizar el uso de terapias cardiotóxicas.
3. Medidas para minimizar el riesgo durante la administración de la terapia: modificar y tratar los factores de riesgo cardiovasculares (tabaquismo, hipertensión, diabetes, dislipidemia, obesidad); incorporar cardioprotectores al tratamiento (dexrazoxano), al administrar una infusión continua o liposomal de antraciclinas; valorar la dosis, los campos a tratar y la tecnología a utilizar en los pacientes que reciben RT mediastinal.
4. Supervisión de los pacientes durante el tratamiento: mediante el seguimiento clínico, estudios de imagen (ecografía cardíaca, medicina nuclear, resonancia magnética), medición de biomarcadores séricos (troponinas, péptido natriurético) y su remisión al cardiólogo.
5. Supervisión de los pacientes con riesgo de disfunción cardíaca después del tratamiento, esta evaluación requiere de una cuidadosa historia clínica y examen físico, así como la identificación temprana de los signos y síntomas relacionados con la cardiotoxicidad.
Para prevenir el daño miocárdico sin disminuir la eficacia terapéutica en el tratamiento oncológico, se deben tener en cuenta: los factores independientes de riesgo para desarrollar la cardiotoxicidad. La dosis acumulada de antraciclinas, la raza africano-americano, las edades extremas, la diabetes, la hipertensión, el sobrepeso o el bajo peso y las comorbilidades graves, indican un riesgo para desarrollar sucesos cardiovasculares, de esta manera se pueden aplicar medidas preventivas como12,21,23:
- Cambios en los esquemas terapéuticos al preferir la aplicación en infusión prolongadas a los bolos, con esquemas que van desde 6 hasta 96 horas, ya que hay un riesgo 4,13 veces mayor de desarrollar la cardiotoxicidad con la aplicación en bolos.
- El uso de las antraciclinas con recubrimiento liposomal, las cuales evitan la entrada al miocardio sin afectar la penetrancia tumoral con una disminución de la cardiotoxicidad hasta en un 80%, comparada con formas convencionales.
- - El uso de análogos de las antraciclinas, como la epirrubicina y la mitoxantrona, que a pesar de su disminución en la eficacia terapéutica, presentan una menor cardiotoxicidad.
- La utilización del agente quelante de hierro, el dexrazoxane, el cual inhibe la peroxidación de las membranas lipídicas con disminución de la cardiotoxicidad en las antraciclinas. Se usa al mismo tiempo que estos medicamentos, o la primera dosis al inicio y la segunda dosis al llegar a dosis acumulada de 300 mg/m2.
- El uso individual de cada agente cardiotóxico y la disminución de tiempos terapéuticos de medicamentos como el trastuzumab.
- El estudio OVERCOME recomienda el uso de agentes inhibidores del eje neurohormonal como: los inhibidores de la enzima convertidora de angiotensina y el carvedilol, los cuales logran una protección sobre los efectos cardiotóxicos al ser usados durante la terapia oncológica, debido a sus efectos antioxidantes.
Cuando a pesar de usar terapia preventiva, la cardiotoxicidad se detecta bajo los parámetros establecidos ya revisados por la ecocardiografía u otros métodos diagnósticos, se debe suspender el medicamento agresor e instaurar un tratamiento adecuado, aun en aquellos pacientes que asintomáticos tienen disfunción ventricular izquierda22.
La sugerencia del tratamiento se basa en los inhibidores de la enzima convertidora de angiotensina y los betabloqueadores, al presentarse síntomas y estados francos de fallo cardíaco, se debe instaurar un tratamiento adecuado que integre: los diuréticos, los antagonistas de la aldosterona, los nitratos y aunque controvertido, la digoxina en casos muy sintomáticos o en presencia de trastornos del ritmo. De acuerdo a la evolución y respuesta clínica se planteará la pertinencia de reiniciar o cambiar el régimen quimioterapéutico9,12,21,23.
CONCLUSIONES
La QT sigue siendo uno de los pilares fundamentales en el tratamiento de varios tipos de cáncer, esta constituye la primera línea de tratamiento para múltiples localizaciones, ya sea usada como tratamiento exclusivo o combinado a otros procedimientos terapéuticos. Su uso ha permitido un aumento en la sobrevida de los pacientes con cáncer; no obstante, la frecuencia de su uso para lograr remisión, las dosis y su mecanismo de acción ha generado efectos secundarios en los pacientes. Uno de los más preocupantes es generado por la cardiotoxicidad. Aunque se ha enfatizado en estrategias para prevenirla, no existe un consenso acerca de cuál es la manera más efectiva para tratar a estos pacientes. Su prevención y tratamiento son medidas que se deben tomar de forma interdisciplinaria para lograr un enfoque global del paciente y facilitar una evolución adecuada, de modo que los pacientes puedan recibir el tratamiento indicado, con el menor número de efectos secundarios o interrupciones, que sin duda penalizan su pronóstico vital.
CONFLICTOS DE INTERESES
Los autores declaran que no existen conflictos de intereses.
BIBLIOGRAFÍA
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015;65(1):5-29.
2. Ministerio de Salud Pública. Anuario Estadístico de Salud 2016. La Habana: Dirección Nacional de Registros Médicos y Estadísticas de Salud; 2017.
3. DeSantis CE, Lin CC, Mariotto AB, Siegel RL, Stein KD, Kramer JL, et al. Cancer treatment and survivorship statistics, 2014. CA Cancer J Clin. 2014;64(4):252-71.
4. Plana JC, Galderisi M, Barac A, Ewer MS, Ky B, Scherrer-Crosbie M, et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2014;27(9):911-39.
5. Lal H, Kolaja KL, Force T. Cancer genetics and the cardiotoxicity of the therapeutics. J Am Coll Cardiol. 2013;61(3):267-74.
6. Yusuf SW, Sami S, Daher IN. Radiation-induced heart disease: A clinical update. Cardiol Res Pract [Internet]. 2011 [citado 15 Oct 2017];2011:317659. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles /PMC3051159/pdf/CRP2011-317659.pdf
7. Carver JR, Shapiro CL, Ng A, Jacobs L, Schwartz C, Virgo KS, et al. American Society of Clinical Oncology clinical evidence review on the ongoing care of adult cancer survivors: Cardiac and pulmonary late effects. J Clin Oncol. 2007;25(25):3991-4008.
8. Ruiz Mori E, Ayala Bustamante L, Burgos Bustamante J. Insuficiencia cardíaca por quimioterapia. Rev Soc Peruana Med Interna. 2016;29(2):59-64.
9. Perrino C, Schiattarella GG, Magliulo F, Ilardi F, Carotenuto G, Gargiulo G, et al. Cardiac side effects of chemotherapy: State of art and strategies for a correct management. Curr Vasc Pharmacol. 2014;12(1):106-16.
10. Bloom M, Hamo CE, Cardinale D, Ky B, Nohria A, Baer L, et al. Cancer Therapy-Related Cardiac Dysfunction and Heart Failure: Part 1: Definitions, Pathophysiology, Risk Factors, and Imaging. Circ Heart Fail [Internet]. 2016 [citado 15 Oct 2017];9(1):e002661. Disponible en: http://circheartfailure.ahajournals.org /content/9/1/e002661.long
11. Wise J. Adult survivors of childhood cancer are at high risk of cardiac abnormalities, study finds. BMJ [Internet]. 2016 [citado 15 Oct 2017];352:h7026. Disponible en: https://search.proquest.com/openview /d6b604e490d36b922a0723b4d3bcebe8/1.pdf?pq-origsite=gscholar&cbl=2043523
12. Velásquez CA, González M, Berrouet MC, Jaramillo N. Cardiotoxicidad inducida por la quimioterapia desde las bases moleculares hasta la perspectiva clínica. Rev Colomb Cardiol. 2016;23(2):104-11.
13. Meza-Cejudo S. Cardiotoxicidad por quimioterapia; implicaciones anestésicas. Rev Mex Anestesiol. 2017;40(Supl 1):S18-S20.
14. Prado A. Miocardiopatía producida por antineoplásicos. Un nuevo desafío para los cardiólogos. Rev Fed Arg Cardiol. 2016;45(4):164-7.
15. Jiménez-Cotes EA, Meyer-Martínez WS, Gallego-González D. Biomarcadores en la detección temprana de cardiotoxicidad inducida por quimioterapia; estado actual. Arch Med (Manizales). 2015;15(1):126-37.
16. López-Fernández T, Martín García A, Santaballa Beltrán A, Montero Luis Á, García Sanz R, Mazón Ramos P, et al. Cardio-Onco-Hematología en la práctica clínica. Documento de consenso y recomendaciones. Rev Esp Cardiol. 2017;70(6):474-86.
17. Navarro-Ulloa OD, Barranco-Camargo LA, Jurado-López SP, Zabala-Carballo CI, Giraldo-Peniche LE. Muerte súbita debida a cardiotoxicidad aguda inducida por antraciclinas. Rev Colomb Cardiol [Internet]. 2018 [citado 02 Ene 2018];25(1):80.e1-7. Disponible en: http://www.elsevier.es/es-revista-revista-colombiana-cardiologia -203-articulo-muerte-subita-debida-cardiotoxicidad-aguda-S0120563317301353
18. Klaassen CD, editor. Casarett and Doull's Toxicology: The basic science of poisons. 8ª ed. New York: McGraw-Hill Education; 2013.
19. Ritter J, Flower R, Henderson G, Rang H. Rang & Dale's Pharmacology. Edinburgh: Churchill Livingstone; 2015. 20. Martins KF, Messias AD, LeiteI FL, Duek E. Preparation and characterization of paclitaxel-loaded PLDLA microspheres. Materials Research. 2014;17(3):650-6.
20. Martins KF, Messias AD, LeiteI FL, Duek E. Preparation and characterization of paclitaxel-loaded PLDLA microspheres. Materials Research. 2014;17(3):650-6.
21. Lax J, Piñeiro D, Falconi M, Agüero R, Barugel M, Bermann A, et al. Consenso de diagnóstico, prevención y tratamiento de la cardiotoxicidad por tratamiento médico del cáncer. Rev Argent Cardiol [Internet]. 2013. [citado 02 Ene 2018];81(Supl. 5):1-64. Disponible en: https://www.sac.org.ar/wp-content/uploads/2014/04 /Consenso-Cardiotoxicidad.pdf
22. Schlitt A, Jordan K, Vordermark D, Schwamborn J, Langer T, Thomssen C. Cardiotoxicity and oncological treatments. Dtsch Arztebl Int. 2014;111(10):161-8.
23. López-Velarde Peña T, López-Velarde Badager P. Prevención y tratamiento de cardiotoxicidad en pacientes con cáncer. An Med (Mex). 2014;59(1):54-60.
24. Reborido N, Parma G, Noria S, Schiavone A, Bonelli A, Lluberas R. Strain bidimensional para detección precoz de disfunción sistólica del ventrículo izquierdo inducida por agentes quimioterápicos. Rev Urug Cardiol. 2016;31(2):266-76.
25. Espinola Zavaleta N, Lupi Herrera E. El papel del ecocardiograma en la valoración de la cardiotoxicidad por quimioterapia. An Med (Mex). 2015;60(3):199-205.
26. Armenian SH, Lacchetti C, Barac A, Carver J, Constine LS, Denduluri N, et al. Prevention and monitoring of cardiac dysfunction in survivors of adult cancers: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol. 2017;35(8):893-911.
Recibido: 10 de noviembre de 2017
Modificado: 04 de enero de 2018
Aceptado: 11 de enero de 2018
Rodolfo A. Morales Yera. Departamento de Oncología Clínica, Hospital Universitario Celestino Hernández Robau. Villa Clara, Cuba. Correo electrónico: rodolfomy@infomed.sld.cu