INTRODUCCIÓN
Las controversias en arritmología, como en cualquier campo del saber, han existido y existirán siempre, algunas vienen desde años atrás (señal de que no están resueltas) y otras son más recientes. Todas permiten el desarrollo, siempre que sean racionales. Ello sucede con las extrasístoles ventriculares (EV) en cuanto a su inocencia o perversidad, su riesgo y la conducta terapéutica adecuada (tratarlas o no).
Aunque se ha transitado por varias etapas sobre su papel en el inicio y mantenimiento de las arritmias ventriculares malignas (AVM), en algún momento se refirió y comprobó que las originadas en el sistema Purkinje y en el tracto de salida del ventrículo derecho (TSVD) podían desencadenar AVM e incluso provocar una muerte súbita1,2. También sucede con las extrasístoles y la taquicardia ventricular (TV) relacionada con el TSVD (TV-TSVD), en cuanto a sus variantes benignas y malignas, y las pistas que pueden ayudar a diferenciarlas. Se abrió un campo promisorio con las técnicas ablativas de las EV de Purkinje y del TSVD, y de la TV-TSVD, que han demostrado su eficacia para evitar recidivas y tormenta eléctrica. Otro asunto muy discutido se refiere al síndrome de Brugada: si se trata de un fenómeno eléctrico funcional genético puro, si existe un factor estructural o coexisten ambos; y, por tanto, si habrá que cambiar el concepto clásico y concebirlo como un trastorno orgánico-funcional. Por ello se discuten estos asuntos.
Sistema Purkinje: Varias preguntas en cuanto a este sistema (algunas con respuesta, otras sin ella)
¿Por qué algunos pacientes con EV de Purkinje no tienen fibrilación ventricular (FV)? ¿Por qué la diferente susceptibilidad? ¿Cuántos que no fibrilan tienen EV de Purkinje y no han sido reconocidas? ¿Por qué un paciente con EV hace FV o no en distintos momentos? ¿Existen factores autonómicos, electrolíticos, metabólicos, iónicos, que determinan todo esto?
Algunas características de las EV de Purkinje
Se caracterizan por un complejo QRS estrecho y pueden ser detonantes de AVM -al participar en su inicio y mantenimiento-, y de fenómenos automáticos, reentrantes y desencadenantes (triggered), en situaciones como la FV idiopática, los síndromes de Brugada y de repolarización precoz, la torsión de puntas y la TV polimórfica catecolaminérgica. Estas extrasístoles presentan intervalos cortos de acoplamiento, pueden originar AVM y ligarse a fenómenos reentrantes y actividad disparada, con posdespolarizaciones tardías más frecuentes1-3. Además, se ha descrito la MEPPC (multifocal ectopic Purkinje premature contractions) con una mutación en el gen SCN5A, que es el mismo que origina los síndromes de Brugada y de QT largo tipo 3, la disfunción sinoauricular, la FV idiopática asociada a la repolarización precoz, la fibrilación auricular y la enfermedad del sistema de conducción. Esta entidad, que suele responder al tratamiento con quinidina4, se relaciona con una ganancia de función de los canales de Na, hiperexcitabilidad del sistema Purkinje, TV no sostenida y eventos de muerte súbita.
Se ha definido un modelo «ping-pong» a nivel del sistema Purkinje, un bigeminismo reciprocante con alternancia repetitiva del eje latido a latido, de ventrículo derecho a ventrículo izquierdo. Es aplicable a la TV bidireccional y polimórfica, y también a otros trastornos eléctricos. Existen diversas posibilidades de este modelo: bloqueo de rama derecha con eje alternante, bloqueo de rama derecha alternante y bloqueo de rama izquierda, y eje de QRS alternante con QRS estrecho. Algunas de las combinaciones posibles se muestran en el recuadro 5,6.
Algo de historia de las células de Purkinje1-3,7-10
1839: Purkinje describió una red gelatinosa de fibras subendocárdicas, luego Tawara precisó su función.
1970: Se consideraron células transicionales Purkinje-miocárdicas, con diferencias histológicas, rápida repolarización en la fase 1 del potencial de acción, que contribuían al bloqueo unidireccional Purkinje-músculo.
1974-78: Se consideró la reentrada en el sistema His-Purkinje con menor duración del potencial de acción y del período refractario, muesca en su porción ascendente, Ito prominente, automatismo potencial (dominado por el ritmo sinusal). Con diferente localización, ultraestructura celular, electrofisiología y fenómeno excitabilidad-contracción.
1998: Se precisó la reentrada unión Purkinje-músculo.
2002: Haissaguerre mapeó y realizó la ablación de EV disparadoras dominantes en un paciente con FV idiopática, actuó sobre el sistema distal de Purkinje, con disminución de las recurrencias y de los episodios de tormenta eléctrica.
2002-2009: Se publicó un estudio multicéntrico de ablación de EV en 38 casos con FV idiopática (sin enfermedad estructural), con recidivas y nuevos focos de arritmia. Se aplicó radiofrecuencia a las EV desencadenantes, con éxito en el 89% de los casos (menos recurrencias). El estudio se basó en 20 informes, comprendió 200 pacientes con y sin cardioversor-desfibrilador automático implantable (recordar que éste previene la muerte, no el evento arrítmico). Las EV se originaron en el sistema Purkinje derecho e izquierdo y en el miocardio (incluidas enfermedades, como los síndromes de Brugada y de QT largo, la TV monomorfa o polimórfica, y la cardiopatía isquémica)1-3,7-10.
La células de Purkinje son grandes, delgadas, con conducción uniforme rápida, resistentes a la hipoxia, con mayor contenido de glucógeno y menos miofibrillas. A nivel del sistema Purkinje, puede existir la reentrada o scroll músculo-Purkinje (antidrómico) o Purkinje-músculo (ortodrómico)1-3.
¿Qué es el sistema Purkinje?
Se trata de una pequeña fracción de masa miocárdica, fibras especializadas aisladas del miocardio ventricular subyacente hasta su arborización en el músculo. Algunas áreas del sistema son más susceptibles que otras para mantener la FV1-3. En las figuras 1 y 2 se presentan ejemplos de extrasístoles ventriculares de Purkinje.

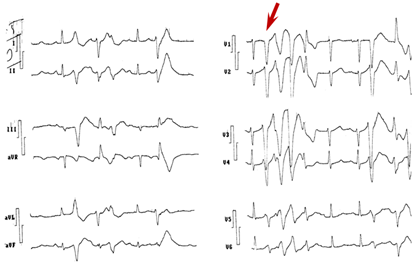
Figura 1 Paciente sin cardiopatía estructural. Extrasístole de Purkinje (flecha) que desencadena evento de torsión de puntas y, en otro momento, fibrilación ventricular. Se implantó cardioversor desfibrilador automático.
Enfermedades del ventrículo derecho, en especial de su tracto de salida
¿Por qué es arritmogénico el TSVD? Se han invocado los siguientes hechos: relativa-alta proporción de células M (en relación con las posdespolarizaciones tardías), miocardio circundante más fino -lo cual disminuye los efectos electrotónicos que inhiben la propagación de la arritmia-, estructura tridimensional única y arquitectura singular de los canales iónicos. Su papel se manifiesta en la FV idiopática, el síndrome de Brugada, la TV polimórfica catecolaminérgica y la torsión de puntas11,12.
Varias preguntas también en cuanto al TSVD (con y sin respuesta)
¿Por qué es más arritmogénico el TSVD si las alteraciones se encuentran en toda la pared ventricular? ¿Qué trascendencia tiene el hecho? ¿Se realiza la ablación de detonantes de la AVM y se resuelven los eventos de tormenta eléctrica?
Existen áreas peculiares de despolarización y repolarización del TSVD, y las extrasístoles de esta zona pueden originar arritmias benignas en sujetos sin cardiopatía estructural, pero también eventos malignos11,12.
El TSVD es sitio preferencial del origen de las arritmias incluso en relación con su embriología. El desarrollo del corazón se imbrica con las taquicardias del tracto de salida, del síndrome de Brugada y de la miocardiopatía arritmogémica de ventrículo derecho (en menor grado). El TSVD se forma con un fenotipo de conducción lenta y no expresa el programa genético del miocardio de trabajo. Luego, sus fenotipos son distintos a aquellos de la pared libre de los ventrículos derecho e izquierdo. Las arritmias ventriculares del TSVD, en el adulto, se desarrollan con la evolución posnatal y la edad juega su papel en la progresión de la enfermedad. Las arritmias se favorecen por la conducción lenta y la actividad espontánea, que se desenmascaran luego del nacimiento e incluso aumentan. La edad del corazón descubre la naturaleza arrítmica de una región con remanente del fenotipo embriónico en el miocardio adulto. El corazón crece, se remodela, madura y adquiere un papel en la arritmogénesis, con una relación entre el desarrollo del TSVD y las arritmias. En el corazón adulto, el miocardio del TSVD -con un fenotipo miocárdico de trabajo-, tiene más baja expresión que en los ventrículos derecho e izquierdo, lo cual favorece la conducción lenta y la baja excitabilidad13.
A estos hechos en cuanto al TSVD, se pueden sumar otros factores, como la fibrosis, la edad del paciente, el estrés de la pared, el sustrato arrítmico y una posible mutación moduladora, todo lo cual lleva a la arritmogenia.
El TSVD es el sitio de origen del tipo más común de la TV en sujetos sin cardiopatía estructural, esta taquicardia presenta un patrón de bloqueo de rama izquierda (rS en derivación V1) y R alta en derivaciones inferiores (DII, DIII y aVF) y, desde el punto de vista clínico, no existe descompensación hemodinámica. De manera que en un paciente sin enfermedad cardíaca que se aqueja de palpitaciones y presenta extrasístoles del TSVD (E-TSVD), se piensa en una TV sostenida bien tolerada y relacionada con dicha estructura; sin embargo, también es sitio de origen de FV (en el síndrome de Brugada y en la FV idiopática).
Existen las arritmias polimórficas con síncope o paro cardíaco, y EV con intervalo corto de acoplamiento (en el pico de la onda T), y también la TV monomórfica, que es más común, con cuadro de palpitaciones y frecuentes EV con intervalo largo de acoplamiento. Se requiere diferenciar entre la TV monomorfa benigna relacionada con el TSVD y la polimórfica maligna o la FV disparada por E-TSVD. Se trata de una TV-TSVD idiopática o de una TV idiopática maligna. Viskin y Antzelevitch14 hablan de la peor de las pesadillas cuando ocurre una muerte súbita en un sujeto con arritmias ventriculares «benignas», así como el riesgo de estratificar un joven con arritmia benigna que después haga un evento de muerte súbita. Ni el número de las EV, ni su intervalo de acoplamiento permiten diferenciar de modo absoluto entre la TV-TSVD polimórfica de la TV-TSVD monomorfa; no obstante, existen algunas pistas14-16:
El intervalo de acoplamiento de la extrasístole (rama descendente de la T o antes), que apunta a la malignidad, es «intermedio» entre el intervalo más corto de la FV idiopática y el más largo de la TV-TSVD monomorfa benigna.
Un intervalo más corto apunta a arritmia polimórfica y a malignidad, si bien su ausencia no niega la posibilidad de una TV-TSVD polimórfica.
La TV-TSVD polimórfica suele ser más rápida que la monomorfa e iniciada por EV con intervalo corto, lo que puede denominarse «variante de acoplamiento corto TV-TSVD».
Otras pistas pueden ser la duración del QRS de las EV (más anchas que en la FV idiopática y que en las formas benignas), y el intervalo RR más corto14-16.
Las E-TSVD tienen un acoplamiento intermedio entre el más corto de la FV idiopática (ultracorto) y el más largo de la TV idiopática monomorfa, la polimórfica idiopática y las benignas14-16. Existe una variante maligna por E-TSVD (FV idiopática-TV polimórfica) pero se presenta también la TV idiopática benigna por E-TSVD en pacientes sin cardiopatía estructural, que podrían llevar a FV-TV polimórfica e, incluso, a la muerte súbita en ocasiones; ambas pueden someterse a ablación por radiofrecuencia14-16.
Haissaguerre et al10 realizaron la ablación a pacientes con FV idiopática desencadenada por estímulos del sistema Purkinje distal o del TSVD. Así se eliminan éstos y se actúa sobre el sustrato de la FV y de la TV polimórfica (en su origen y alrededores), además del implante de un cardioversor-desfibrilador automático de ser necesario7-10.
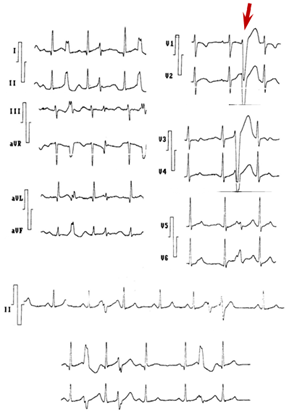
Las EV y la TV-TSVD ofrecen una imagen de bloqueo de rama izquierda (predominio de la negatividad del QRS en V1), con eje inferior (positividad del complejo ventricular en DII, DIII y aVF) e intervalo corto de acoplamiento (no tanto como en la FV idiopática y en la torsión de puntas). Se presenta un bloqueo funcional y retardo de la conducción por un «encendido» rápido disparado o por micro-reentrada (foco único o múltiples próximos). También puede deberse a una conducción fibrilatoria caótica y existir una FV o una TV polimórfica sin zona orgánica de conducción retardada y con cambios en la forma del QRS14-16. En la figura 3 se muestra un ejemplo de E-TSVD.
Visión integradora para evaluar las EV
Una verdad a recordar expresada por Lindsay9: “The frequency and complexity of ventricular ectopy is related to risk, yet it is not an accurate predictor of risk ventricular arrhythmias for individual patients”. En la evaluación de las EV, deben tomarse en cuenta varios factores: en quién se presenta, edad, presencia o no de cardiopatía estructural, repercusión hemodinámica, fracción de eyección del ventrículo izquierdo, causas transitorias (trastornos electrolíticos o metabólicos), enfermedad de otros aparatos y sistemas, frecuencia cardíaca, sitio de origen de la AVM, densidad en 24 horas, intervalo de acoplamiento, morfología uniforme o no, anchura, eventos que desencadenan (respuestas repetitivas ventriculares u otras AVM), intervalo RR, TV sostenida o no, intervalo de la EV (VEQSI, por sus siglas en inglés), intervalo QT, amplitud de la T, evolución de la enfermedad, canalopatía (si existiera) y empleo de fármacos antiarrítmicos17,18.
¿Cómo diferenciar las EV inocentes de las perversas?
Resulta difícil la estratificación de riesgo de las EV, tal como sucede al evaluar los casos con onda J, memoria eléctrica, muescas del QRS y otros signos eléctricos; ninguno absoluto y al mismo tiempo ninguno despreciable.
Haissaguerre, el hombre de las malignidades, describió las EV del sistema Purkinje y del TSVD como detonantes de AVM (primeramente en la FV idiopática), con eventos de muerte súbita. Su mapeo y ablación, evita recurrencias y episodios de tormenta eléctrica. También describió la posibilidad de que la onda J fuera predictor de AVM y de muerte súbita10.
Fisiopatología del síndrome de Brugada: papel del TSVD y de la ablación con radiofrecuencia
El TSVD es una estructura delgada, compleja desde su embriología, con fusión de diversas estructuras, mezcla de propiedades estructurales y fisiológicas, diferentes a las de otras regiones19. En estudios experimentales se observó que la radiofrecuencia aplicada en el epicardio y en el TSVD eliminaba las EV en el síndrome de Brugada. Brugada y Pappone20 plantearon una anormalidad estructural (espigas que indicaban activación ventricular temprana del sistema Purkinje derecho o del TSVD) y electrogramas anormales locales fraccionados, menos amplios. La radiofrecuencia logra que haya menos recidivas, normalización del segmento ST y ausencia de AVM. En el síndrome se concibe un sustrato electroanatómico y una vulnerabilidad arritmogénica; con anormalidades electroanatómicas e histológicas del TSVD, que se suman a la clínica y a la genética, tanto en pacientes sintomáticos como en asintomáticos19-22.
Papel del TSVD en el síndrome de Brugada
Existen varias teorías en cuanto a la fisiopatología del síndrome19,21,22:
Se explican los signos eléctricos y la arritmogenia por un trastorno de repolarización y la dispersión transmural del ventrículo derecho y del TSVD.
Se trata de un trastorno de despolarización, con retraso de la activación subepicárdica del ventrículo derecho-TSVD e infraHis (visto en el electograma de señales promediadas), con potenciales tardíos y fraccionamientos.
Presencia de corrientes electrotónicas. Existe una mezcla de alteraciones estructurales y funcionales con falla de la excitación epicárdica del ventrículo derecho-TSVD (desequilibrio corriente-carga/current-to-load mismatch).
Expresión anormal de la cresta neural en el desarrollo del TSVD (en la embriogénesis, la cresta neural tiene un papel crítico en la morfogénesis del TSVD).
Se ha planteado una reclasificación del síndrome de Brugada, entendiéndolo ahora como una combinación de defectos estructurales y electroanatómicos (Figura 4), con un sustrato arrítmico, y se impondrían cambios en su estratificación y tratamiento (los antiinflamatorios del TSVD reducirían las arritmias), con existencia de un gradiente del sustrato patológico de epicardio a endocardio (inflamación del miocardio: electrocardiograma anormal y AVM). Sería un problema orgánico-funcional con fenotipo tardío (desarrollo del sustrato arrítmico), donde jugarían su papel fenómenos, como la fibrosis y la adiposis19-22. Resulta trascendente que en uno de los trabajos con estos cambios en el concepto del síndrome, uno de los autores sea Ramón Brugada19.
Más y más preguntas sobre la fisiopatología del síndrome de Brugada y el TSVD
¿Existe relación entre la inflamación y el síndrome de Brugada, es su causa? ¿Cuál es la relación entre la prueba genética, las alteraciones electroanatómicas y el sustrato anatomopatológico? ¿Cuál es la causa de que el test diagnóstico pueda ser negativo, habrá otro componente, la grasa por ejemplo? ¿Es un proceso puramente eléctrico, puramente estructural o ambos coexisten? ¿Se suma la inflamación del TSVD a una predisposición genética que resulta en eventos arrítmicos y muerte súbita? ¿Por qué el patrón suele ser variable y puede haber genética sin eventos y electrocardiograma normal? ¿Por qué las áreas de bajo voltaje afectan el TSVD?
Epílogo (sistema Purkinje y TSVD)
Ambos tienen un importante papel en la arritmogénesis (AVM y muerte súbita cardíaca).
Poseen características complejas y singulares en cuanto a su embriología, histología, anatomía, fisiología y fisiopatología.
Participan en la génesis (desencadenantes) y en el mantenimiento de diversas AVM (FV, TV, TV polimórfica, variante maligna de las taquicardias del TSVD y otras).
Existen relaciones entre la genética, el sustrato arrítmico, los factores estructurales, electroanatómicos y funcionales (inflamación, fibrosis), y los eventos clínicos y la vulnerabilidad a las arritmias.
Estos conceptos resultan trascendentes para la estratificación de riesgo y la adopción de medidas terapéuticas, en especial las ablativas (EV de Purkinje, extrasístoles y áreas del TSVD), que logran la curación de algunas de ellas al destruir los desencadenantes y algunas zonas específicas.
Se impone una reclasificación de algunas enfermedades, ahora conocidas como orgánico-funcionales, lo cual implica cambios revolucionarios de conceptos clásicos.