INTRODUCCIÓN
La muerte súbita cardíaca (MSC) es un importante desafío para la cardiología moderna, por su incidencia, forma de presentación e implicaciones socioeconómicas. Representa el 90% de todas muertes súbitas y del 10-30% de todas las muertes naturales1. Es el debut de la enfermedad de base entre 30-50% de los pacientes y en un 30% de los recuperados recurre el episodio arrítmico2. Aproximadamente el 80% de los eventos se presentan en el contexto de la cardiopatía coronaria y las arritmias ventriculares malignas son responsables de la mayoría de estos3.
El cardiodesfibrilador automático implantable (CDAI) ha demostrado, en los diferentes ensayos en prevención primaria y secundaria, una reducción de la MSC arrítmica. Lo que justifica que, en las últimas décadas, sus indicaciones se hayan extendido, con un número creciente de pacientes con este dispositivo4-9.
La selección de los pacientes debe individualizarse, al considerar la relación efectividad-costo, el acceso a la terapia y la seguridad. Fuera de los ensayos clínicos, existen escasos datos sobre el seguimiento prolongado de los pacientes con CDAI, acerca de la eficacia, supervivencia y vida útil del dispositivo, razón que justificó esta investigación, cuyo objetivo fue describir la evolución en el seguimiento de los pacientes con primoimplante de un CDAI.
MÉTODO
Se realizó un estudio unicentro, observacional, longitudinal, ambispectivo, en pacientes con primoimplante y seguimiento de un CDAI en el departamento de Arritmia y Marcapasos del Hospital Hermanos Ameijeiras, en el período septiembre/2007 - diciembre/2016, con cierre del seguimiento el 31 de diciembre de 2017. En caso de fallecimiento se tomó la fecha de muerte como fecha de cierre del seguimiento. La muestra quedó constituida por 47 pacientes.
Durante el primoimplante se confeccionó y archivó una historia clínica ambulatoria para cada paciente con los datos clínicos y del procedimiento.
Protocolo de implante, programación y seguimiento del CDAI
Los criterios para el implante del CDAI se basaron en las guías internacionales de actuación adaptadas a nuestro país.
La implantación del sistema fue transvenosa, vía subclavia izquierda o sus venas tributarias, y el generador se ubicó en la región pectoral. Se realizó profilaxis antibiótica con cefazolina, 1 gramo durante el procedimiento, a continuar cada 8 horas durante 48 horas. Las mediciones de umbral de estimulación, amplitud de la onda R e impedancias se tomaron en el período intraoperatorio.
La programación del CDAI se realizó atendiendo a: cardiopatía de base, condiciones clínicas, tipo de prevención, características de la arritmia y terapéutica farmacológica. Se programó una zona de detección de fibrilación ventricular (188 a 210 latidos por minuto), con terapia antitaquicardia durante la carga y una zona de detección de taquicardia ventricular 10 latidos por minuto inferior a la taquicardia clínica, con terapia antitaquicardia (de 3 a 6 repeticiones) y choque en caso de fallar la anterior. Se activaron los algoritmos para discriminar las taquicardias supraventriculares.
Se realizaron controles clínicos y del dispositivo a las cuatro semanas de la implantación y después cada 3-6 meses, o según la condición clínica del paciente. En cada seguimiento el CDAI se interrogó y se grabaron los eventos almacenados, que fueron analizados y clasificados, de forma independiente, por dos electrofisiólogos. La historia clínica ambulatoria se actualizó en cada control.
A través de la revisión de la historia clínica individual archivada en el departamento, se obtuvieron las variables de interés.
Análisis estadístico
Las variables con una distribución normal se resumieron como media y desviación estándar, y aquellas con distribución no paramétrica se expresaron en mediana y rango intercuartílico. Las variables nominales se expresaron en frecuencias y porcentajes.
La asociación entre las variables cuantitativas y cualitativas se determinó con la prueba t de Student, y en ausencia de una distribución paramétrica se aplicó la prueba U de Mann-Whitney. La relación entre las variables cualitativas se obtuvo con la prueba Chi cuadrado ((2). La estimación de la supervivencia libre de terapias apropiadas y de mortalidad de causa cardiovascular se determinó con el método de Kaplan-Meier. En todas las pruebas de hipótesis se fijó un nivel de significación de 0,05. El procesamiento estadístico se realizó con el programa SPSS (Chicago Illinois, USA), versión 20.
La investigación fue aprobada por el Comité de Ética institucional y durante toda la ejecución se cumplieron los procedimientos éticos sobre el tratamiento de las fuentes de información.
RESULTADOS
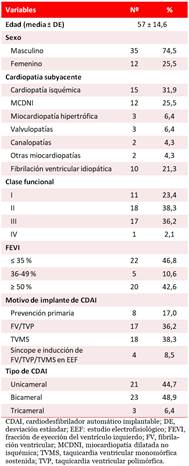
La media de la edad al implante del dispositivo fue de 57±14,6 años, con predominio del sexo masculino (74,5%). La cardiopatía subyacente más frecuente fue la isquémica (31,9%). Un 46,8% de los pacientes tenía FEVI ≤ 35% y el 74,5% se encontraba en clase funcional II-III de la NYHA (New York Heart Association). La taquicardia ventricular monomórfica sostenida (38,3%) fue la arritmia más común y solo en un 17% de los pacientes se indicó el CDAI en prevención primaria. Un 48,9% de los dispositivos implantados fue bicameral (Tabla 1).
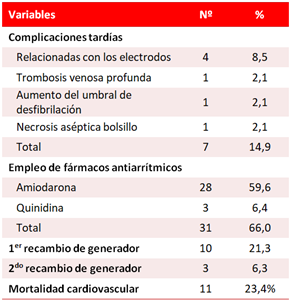
Un 14,9% de los casos presentó complicaciones en el seguimiento y las relacionadas con los electrodos fueron las más comunes (8,5%). En el 66% se emplearon fármacos antiarrítmicos simultáneamente con el dispositivo y la amiodarona fue el más indicado (59,6%). En un 21,3% se realizó un primer recambio del generador y en 6,3% un segundo. La mortalidad cardiovascular fue de 23,4% (Tabla 2).
Las terapias apropiadas ocurrieron en el 57,4% de los pacientes. En un 23,4% se registraron terapias inapropiadas, las arritmias supraventriculares (10,6%) y los fallos de detección (10,6%) fueron las causas más comunes (Tabla 3). Un 12,8% presentó al menos un evento de tormenta arrítmica, también se constataron proarritmia del CDAI (14,9%) y arritmias ventriculares sin intervención del dispositivo (12,8%).
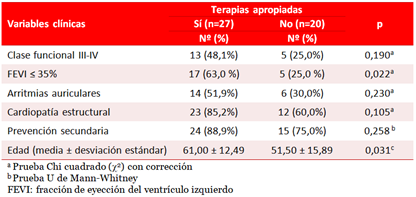
La media de la edad fue significativamente superior en los pacientes con terapias apropiadas (p=0,031), y la FEVI ≤ 35% se asoció estadísticamente (p=0,022) con una mayor frecuencia de terapias apropiadas (Tabla 4).
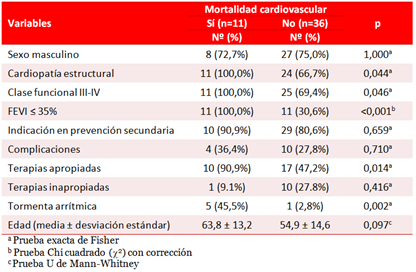
En el análisis univariado (Tabla 5) la mortalidad cardiovascular se relacionó con la presencia de cardiopatía estructural (p=0,044), la FEVI ≤ 35% (p<0,001), la clase funcional III-IV (p=0,046), las terapias apropiadas (p=0,014) y la tormenta arrítmica (p=0,002).
En el 100% de los pacientes con terapias apropiadas estas ocurrieron en los primeros cuatro años posterior al implante, con una mayor densidad de episodios arrítmicos en el primer año (Figura 1). La supervivencia libre de una terapia apropiada fue de 65,6%, 56,1% y 34,7% al primer, segundo y cuarto año del implante, respectivamente.
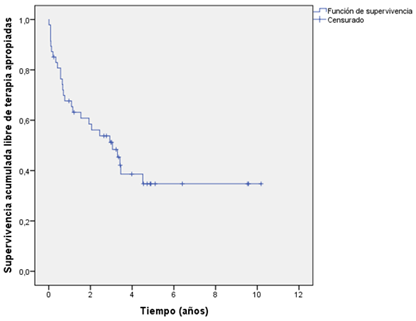
Figura 1 Curva de Kaplan Meier de supervivencia acumulada libre de terapias apropiadas del cardiodesfibrilador.
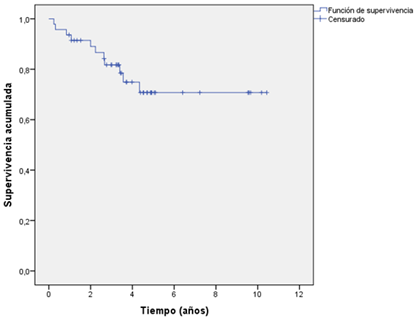
La totalidad de las muertes ocurrieron en los primeros 4 años del seguimiento (Figura 2). La supervivencia libre de mortalidad cardiovascular fue de 91,4%, 81,7% y 70,7%, al primer, tercer y cuarto año, respectivamente.
DISCUSIÓN
Los resultados de la investigación aportan información de interés para nuestro medio, pues son escasos los estudios de este perfil en el país. Si bien el tamaño de la muestra es modesto, un seguimiento prolongado, con un máximo de 10,4 años, lo compensa. El comportamiento demográfico guarda similitudes con investigaciones previas, con predominio de la edad cercana a los 60 años y del sexo masculino10,11.
La isquemia aguda y sus consecuencias, las características de la escara necrótica y la disfunción ventricular, crean un miocardio vulnerable para generar MSC, lo que justifica que aproximadamente el 80% de las MSC se presentan en este contexto. En el Registro Español de CDAI del año 201510, la cardiopatía de base más frecuente fue la isquémica (52,6%) y en el registro ICD-LABOR, el antecedente de cardiopatía isquémica se recoge en el 40% de la muestra11.
Casi la mitad de los pacientes presentaban una disfunción sistólica grave del ventrículo izquierdo, comparable con el Registro Español de CDAI 2015 que informa una FEVI menor del 30% en el 53% de los primoimplantes10. En los estudios en prevención secundaria, AVID4, CIDS5, CAHS6 e ICD-LABOR11, la media de la de la FEVI fue de 32%, 34%, 46% y 38%, respectivamente.
Aproximadamente uno de cada cinco CDAI se indicó en prevención secundaria, resultado distinto al de los registros de Estados Unidos de América y de España, donde el 80% y 58%, respectivamente, se indican en prevención primaria10,12. En cambio, es comparable con estudios latinoamericanos, donde siete de cada diez dispositivos se implantan en prevención secundaria13. La gratuidad de los servicios sanitarios en nuestro medio, solventa las indicaciones clase I de las guías de actuación vigentes, mientas que la indicación en prevención primaria es individualizada y, en su mayoría, es soporte de la terapia de resincronización cardíaca.
En nuestra investigación existió una discreta superioridad de los sistemas bicamerales. A pesar de que los ensayos clínicos fueron realizados mayoritariamente con dispositivos monocamerales, la introducción de sistemas bicamerales garantiza la estimulación aurículo-ventricular sincrónica, solventa la estimulación auricular en la bradicardia sinusal por fármacos y mejora la discriminación de las taquicardias con reducción de las terapias inapropiadas4.
El implante de CDAI tricamerales fue muy modesto en comparación con los países desarrollados, los que informan un 40% de sistemas biventriculares10,12 pero con similitud a estudios latinoamericanos donde estos representan el 9,5%13.
Las complicaciones fueron escasas, y en concordancia con la tasa global de complicaciones que se describe en la literatura, de aproximadamente el 10%14-16. Es llamativa la ausencia de complicaciones infecciosas, lo que atribuimos al número reducido de operadores, al empleo de un protocolo de profilaxis antibiótica y a las condiciones del salón de operaciones.
En el 66% de los pacientes se empleó fármacos antiarrítmicos, con predominio de la amiodarona, dada su mayor seguridad en presencia de cardiopatía estructural. Otras series informan el uso de antiarrítmicos en 40-70% de los pacientes17-19. La asociación del CDAI y los fármacos antiarrítmicos es en ocasiones imprescindible, pero problemática. La terapia mixta es necesaria para el tratamiento de las taquicardias ventriculares frecuentes, las taquicardias supraventriculares y para la mayor eficacia de la estimulación antitaquicardia. Desgraciadamente, la modificación del sustrato arritmogénico es difícilmente controlable y en ocasiones, los fármacos conllevan efectos proarrítmicos19.
La incidencia de terapias apropiadas fue elevada (57,4%) y estas ocurrieron precozmente en el seguimiento; hallazgos que interpretamos como positivo. La decisión de implantar un CDAI en estos pacientes fue correcta, pues de no haberse realizado el desenlace, en muchos casos, hubiera sido letal. Los estudios en prevención secundaria comentan una incidencia de terapias apropiadas de aproximadamente el 54%20.
La probabilidad acumulada de presentar una terapia apropiada fue de 65,3% al cuarto año. La mayor frecuencia de una primera terapia ocurrió en los primeros cuatro años, y a partir de este período no se incrementó dicha probabilidad. Borleffs et al21 comunican una incidencia acumulada de cualquier forma de terapia del CDAI de 52% y 61%, al quinto y décimo año, respectivamente.
La media de la edad fue significativamente superior en el subgrupo con terapias apropiadas. Schaer et al22 informan a la edad como un predictor de terapias apropiadas (RR 1,02 [por año], IC 95%: 1,01-1,04; p=0,001). La disfunción sistólica grave del ventrículo izquierdo se relacionó con una mayor frecuencia de terapias apropiadas, resultado similar al de otras investigaciones22-24. Por su parte, la frecuencia de terapias inapropiadas fue superior a la esperada para un estudio con predominio de indicación en prevención secundaria (23,4% de los casos). Según Dichtl y Wolber20, estas terapias ocurren en 15% de los pacientes con indicación en prevención secundaria y en un 25% en prevención primaria.
Es llamativa la incidencia de terapias inapropiadas por problemas de detección, las que se recogieron en igual proporción a las producidas por arritmias supraventriculares. Las taquicardias supraventriculares están descritas como la principal causa de terapias inapropiadas, mientras que a los fallos de detección les corresponde solo el 20%. La fractura del electrodo ventricular, encontrada en 4 pacientes, puede justificar la elevada incidencia de terapias inapropiadas por fallos de detección.
La incidencia de tormenta eléctrica se encuentra cercana al límite inferior encontrado por los diferentes estudios25-27. Fue elevada la tasa de pacientes con arritmias ventriculares sin intervención del CDAI (12,6%) y en la totalidad de los casos se produjo por la programación de una frecuencia de corte inferior a la de la arritmia clínica actual. El enlentecimiento de la taquicardia inicial por el empleo de fármacos antiarrítmicos y el deterioro de la función cardíaca, pudieron ser la causa de este comportamiento.
La frecuencia de proarritmia inducida por el CDAI fue representativa. En 5 de los 7 pacientes la terapia antitaquicardia aceleró la taquicardia ventricular previa o la degeneró en fibrilación ventricular. Según otros estudios, la incidencia de este fenómeno es de 20% y se relaciona con la disfunción ventricular grave y con la longitud de ciclo de la taquicardia menor de 300-320 ms28. En los restantes 2 pacientes la proarritmia fue generada por el choque; la tasa informada de este fenómeno es inferior a 5%29.
En 10 de los 47 pacientes se realizó un primer recambio del generador y en 3 un segundo recambio, en su totalidad por agotamiento de la batería. Si analizamos que el período máximo de seguimiento fue de 10,4 años, la longevidad de los dispositivos está dentro de lo reconocido en la literatura, con una durabilidad media de 5 años30.
La mortalidad cardiovascular fue de 23,4% y la totalidad de las muertes ocurrieron en los primeros 4 años siguientes al primoimplante. Estos resultados son comparables con los estudios observacionales y con la rama de tratamiento con CDAI de los ensayos clínicos4-9,11,13,31,32.
An et al33, en un estudio en prevención primaria describen una mortalidad de 5%, 15% y 20% al primer, segundo y tercer año, respectivamente. Por su parte, Nambordo et al13, en una investigación con predominio de la indicación en prevención secundaria, encontraron una probabilidad acumulada de supervivencia a los cinco años de 80%.
La presencia de cardiopatía estructural, la FEVI ≤ 35%, la clase funcional III-IV, la terapia apropiada y la tormenta arrítmica se relacionaron con la mortalidad cardiovascular. El estudio ICD-LABOR identificó cuatro variables asociadas a la mortalidad en pacientes con CDAI: FEVI menor a 30%, CF III-IV, edad mayor a 70 años y sexo masculino11; y Lelakowski et al24 encontraron como predictores de mortalidad a la FEVI ≤ 30% (RR 3,0; IC 95%: 1,51- 5,98; p=0,0017) y a la clase funcional III-IV (RR 3,1; IC 95%: 1,48-6,61; p=0,003).
Las múltiples terapias del CDAI generan depresión de la función ventricular, lesión e isquemia miocárdica, hipoperfusión cerebral, proarritmia, disociación electromecánica, agotamiento precoz de la batería y en ocasiones, puede llevar a la muerte. Alba y colaboradores34 informan una fuerte asociación entre la mortalidad y la ocurrencia de choques apropiados o inapropiados en el seguimiento (RR 2,34; IC 95%: 1,59-3,44). Igualmente, Powell et al35 describen un incremento del riesgo de muerte (RR 2,77; IC 95%: 1,7-4,51) en los pacientes con choque por taquicardia ventricular. En un reciente metaanálisis la presencia de tormenta arrítmica se asoció con un riesgo relativo de mortalidad de 2,51 (IC 95% 1,38-4,58)36.
CONCLUSIONES
Las terapias apropiadas del CDAI son frecuentes, ocurren en los primeros años del seguimiento y se relacionan con la disfunción sistólica grave del ventrículo izquierdo y con el incremento de la edad. La supervivencia de los pacientes con un CDAI es buena. La muerte ocurre principalmente en los primeros años posteriores al implante y se relaciona con un mayor deterioro del sistema cardiovascular y con las terapias del dispositivo.