INTRODUCCIÓN
La prevalencia de la fibrilación auricular (FA) se estima entre 1-2% en la población general y más de 15% en personas mayores de 80 años1,2; pero, al tener en cuenta que esta arritmia cardíaca puede ser frecuentemente asintomática, tales cifras pueden estar subestimadas. Su prevalencia se incrementa con la edad, aumenta marcadamente después de los 65 años y es muy baja, casi nula antes de los 25 años de edad3.
Debido al envejecimiento esperado de la población en las próximas décadas a nivel global, es de esperar una epidemia de FA que se hace más evidente cada día en la actualidad; por tanto, es una necesidad urgente investigar y precisar los mecanismos subyacentes de esta arritmia e implementar y aplicar los programas de prevención adecuados.
Respecto a cuestiones genéricas, la FA se clasifica en: paroxística, de reciente comienzo y persistente o permanente. Además, se han sugerido subtipos clínicos de la arritmia, incluida la secundaria a enfermedades cardíacas estructurales subyacentes y la FA en atletas.
La FA es comúnmente causada por la cardiopatía isquémica y la hipertensión arterial, además frecuentemente se asocia con el sobrepeso y la obesidad4. El ejercicio físico (EF), que evita el incremento del peso corporal, así como el desarrollo de hipertensión arterial, se considera una medida que corrige los factores de riesgo cardiovascular y, por tanto, se recomienda frecuentemente como medida de prevención en individuos sanos, también en hipertensos y obesos, así como parte integral de la rehabilitación y prevención secundaria de pacientes con cardiopatía isquémica, incluso después del infarto de miocardio y la aparición de insuficiencia cardíaca5-7.
Ejercicio físico y fibrilación auricular
A pesar de que hay evidencias que indican que el EF puede incrementar el riesgo de FA3,8,9, los beneficios cardiovasculares de la actividad física regular son incuestionables. Desde hace más de 25 años, Sarna et al10 comprobaron un mejor estado de salud y una mayor expectativa de vida en atletas de resistencia, en comparación con un grupo similar que no eran atletas. Sin embargo, el EF extremo o intenso prolongado, al igual que la inactividad física, pueden favorecer el desarrollo de FA, lo que indica un efecto «ambiguo» del ejercicio que protege al corazón en bajas cargas pero que puede ocasionarle daños en cargas elevadas, debido a la activación de mecanismos específicos bioquímicos y neurohormonales2,9.
El debate sobre el EF como un factor de riesgo para FA ha existido por más de dos décadas; sin embargo, en 2016, dos grupos independientes de investigadores describieron una asociación en «forma de U» entre la actividad física y la FA8. Morseth et al11 describieron un fenómeno en «forma de J» en la relación entre actividad física realizada durante momentos de ocio y FA en 20 484 adultos que fueron seguidos y examinados prospectivamente durante 20 años. El riesgo de FA fue mayor, pero no significativo, en individuos que realizaron ejercicios intensos que en los que tuvieron poca actividad, mientras un significativo mayor riesgo fue encontrado sólo cuando se consideró el inicio de una FA permanente.
Calvo et al12) también comprobaron una relación en forma de J entre el tiempo de duración del EF de alta intensidad y la FA, en un estudio caso-control. El menor riesgo de FA correspondió al punto más bajo de la curva en forma de J y fue encontrado en individuos incorporados en un entrenamiento físico regular y limitado en el tiempo, mientras que el mayor riesgo se observó en aquellos que realizaban EF vigoroso como práctica deportiva con más de 2000 horas acumuladas de por vida. Aquellos individuos inactivos mostraron un riesgo intermedio de FA. De manera que la actividad física vigorosa o de alta intensidad, realizada durante mucho tiempo a lo largo de la vida, se señaló como el más fuerte predictor de FA, lo que sugiere que las lesiones o estímulos auriculares repetidos durante mucho tiempo se correlacionaban con un sustrato arrítmico que podrían desarrollar la FA12.
Desde entonces, diversos estudios han investigado la compleja relación existente entre el ejercicio y la FA, y muchos de ellos han confirmado la vinculación entre el EF vigoroso y la FA8. Abdulla y Nielsen13, en un estudio de meta-análisis, demostraron que el ejercicio intenso realizado por atletas fue 5,3 veces más propenso a desarrollar FA que los casos controles. Sin embargo, la hipertensión arterial, que es el factor de riesgo más común de FA, sólo mostró una frecuencia de incremento de la asociación de 1,42 veces, lo cual demuestra la relevancia de la asociación de ejercicio vigoroso con esta arritmia. De aquí que el término de FA aislada debe ser empleado con cautela cuando se trata de individuos que han realizado actividad física intensa durante mucho tiempo.
No obstante, la relación entre EF y FA es menos evidente en sujetos no atletas, debido a la heterogeneidad de los métodos empleados para evaluar la intensidad de los ejercicios, así como del cálculo para determinar la cantidad de horas de ejercicio intenso realizadas durante un prolongado período de tiempo.
Mecanismos desencadenantes de fibrilación auricular relacionada con el ejercicio físico extremo en atletas
El llamado «corazón de atleta» es el corazón que impulsa sangre eficientemente a los potentes músculos de los deportistas que practican competencias fuertes durante mucho tiempo con altas demandas de oxígeno. En ellos pueden observarse cambios funcionales y estructurales del mencionado órgano que pueden predisponer a las arritmias cardíacas9.
Como consecuencia de cumplir los principios fundamentales del entrenamiento físico y sus efectos fisiológicos14, el corazón de un individuo entrenado es capaz de disminuir su frecuencia de contracciones en reposo, mientras la aumenta durante el ejercicio máximo, para suplir así las incrementadas demandas de oxígeno. Hay evidencias que demuestran que los atletas bajo condiciones extremas pueden aumentar el tono vagal exageradamente y reducir el período refractario auricular, lo que facilita el mecanismo de reentrada, al activar además el tono adrenérgico, que -en consecuencia- facilita el inicio de arritmias auriculares o ventriculares15.
Grandes volúmenes de EF realizados durante muchos años, aún en atletas de resistencia entrenados, pueden conducir a alteraciones fisiopatológicas que afectan el sistema nervioso autónomo y a desarrollar remodelación cardíaca9.
El sustrato anatómico puede ser el crecimiento y remodelación auricular, el cual incluye depósito anormal de colágeno e inflamación. De aquí se deriva el reciente concepto sobre que el corazón de atleta puede ser proarrítmico, independientemente de la existencia de anormalidades genéticas estructurales o eléctricas15. Recientemente se ha descrito un nuevo síndrome denominado PAFIYAMA -siglas en inglés de Paroxysmal Atrial Fibrillation In Young And Middle-aged Athletes- que incluye episodios de FA paroxísticas en atletas jóvenes o de mediana edad, que considera al corazón de atleta proclive a la FA.16
Otros mecanismos subyacentes en el desarrollo de FA en atletas incluyen9,16:
Cambios en los canales de iones en las células marcapasos.
Trastornos en las proteínas transportadoras de calcio.
Pérdida de las uniones celulares y depósito de colágeno, presumiblemente desencadenados por el engrosamiento de la pared auricular2
La aldosterona es un mediador de fibrosis y de FA que se incrementa en el plasma después del ejercicio en corredores de resistencia17,18, aun entrenados, con el objetivo de mantener el balance iónico y de fluidos necesario para la competencia. No obstante, todavía se desconoce si la aldosterona contribuye a crear el sustrato proarrítmico en los atletas de resistencia19.
El mecanismo mediante el cual el EF ligero o moderado protege contra la FA también persiste aun impreciso9. No obstante, la reducción del riesgo de FA puede estar asociada a un mejoramiento de la función sistólica y diastólica, así como a una disminución de la rigidez arterial que, con el transcurso de los años, suele presentarse en atletas y en otros individuos.
Está comprobado que el EF produce mejoría de la función cardiorrespiratoria en adultos jóvenes y en la población general20,21, incluidos pacientes con cardiopatía isquémica e infarto de miocardio6,7; además, mejora el perfil de factores de riesgo cardio-metabólico, disminuye el tono simpático y produce cambios favorables en la estructura y función cardíacas. Todo ello puede contribuir a los mecanismos protectores frente a la aparición de FA en individuos que cumplen programas de EF de ligera o moderada intensidad regularmente, no obstante son necesarios nuevos estudios para definir dichos mecanismos.
Ejercicio físico y fibrilación auricular en la insuficiencia cardíaca
La FA y la insuficiencia cardíaca crónica (ICC) están íntimamente relacionados con la edad; ambas incrementan su prevalencia en relación con algunos factores de riesgo, como la hipertensión arterial, la edad avanzada y la obesidad22. Más del 50% de los pacientes con ICC presentan FA y más de la tercera parte de aquellos con FA desarrollan ICC; por otra parte, los casos que combinan ambos padecimientos tienen mayor riesgo de mortalidad que aquellos con uno solo de ellos23.
La actividad física y el EF pueden, además de mejorar los síntomas, tener efectos antiarrítmicos, sobre todo en individuos con FA paroxística, así como proteger contra el desarrollo de esta arritmia24-26.
El estudio HF-ACTION27,28, mayor investigación efectuada hasta nuestros días, que analiza los efectos del entrenamiento físico aeróbico en pacientes estables con ICC y fracción de eyección reducida, demostró que el EF estuvo asociado con incremento de la capacidad física, mejoría de la calidad de vida, y disminución de nuevas hospitalizaciones y mortalidad general. En los análisis primarios de los resultados de esta investigación, la FA fue altamente predictiva de mortalidad general y hospitalización. Al realizar un corte de este estudio, Luo et al29 analizaron la relación entre FA basal y su evolución con el entrenamiento físico (Figura 1), describieron los eventos futuros de estos pacientes y encontraron los importantes hallazgos que se describen en el recuadro.
Recuadro. Resumen de los resultados del estudio HF-ACTION27,28 respecto a los beneficios del ejercicio físico en pacientes con insuficiencia cardíaca con fracción de eyección reducida y fibrilación auricular29.
/
Estudios previos han demostrado que la ICC y la FA muestran peor pronóstico cuando se presentan combinadas en un mismo paciente. En la población del estudio de Framingham se comprobó, en dos análisis ajustados, hasta el doble de riesgo de muerte en aquellos casos que padecían ICC con fracción de eyección reducida en conjunto con FA23,30. También en el análisis primario del citado estudio HF-ACTION, O’Connor et al27 encontraron a la FA en combinación con la ICC como un fuerte predictor de mortalidad y hospitalización. En este mismo estudio se señaló que el EF produjo una mejoría, aunque modesta, en los parámetros relacionados con el ejercicio, por ejemplo un incremento de un 4% de la media del consumo de oxígeno (VO2) pico.
Se debe señalar que aun modestos incrementos del VO2 pico han de ser importantes, pues expresan una medición objetiva de la función cardiorrespiratoria, más aun que otras variables simples relacionadas con la actividad física31. El VO2 pico puede predecir con un alto grado de fiabilidad la presencia y pronóstico de futuras enfermedades cardiovasculares; particularmente es de especial interés en la determinación del pronóstico de pacientes con ICC32.
Hay que señalar que estudios previos, donde se han evaluado programas de entrenamiento físico en pacientes con FA, también han demostrado grandes incrementos de la capacidad de ejercicio, aunque han incluido series con no muchos casos y pocos de ellos con ICC33,34. No obstante, en otros estudios prospectivos recientes, el EF se ha asociado con efectos beneficiosos en pacientes con FA11,24,25,35. Proietti et al35, por ejemplo, en una investigación con 20 000 pacientes adultos, observaron una menor mortalidad general en aquellos casos con FA que informaron la práctica individual de EF regularmente.
Investigadores de la Clínica Mayo, de Rochester36, en un estudio publicado en 2018, donde incluyeron a 12 043 pacientes sin enfermedades cardiovasculares que fueron remitidos para realizarles pruebas de esfuerzo, encontraron -tras un seguimiento clínico medio de 14 años- que 1222 (10,1%) de ellos, desarrollaron FA. Señalaron además que en aquellos que presentaron la arritmia y tenían una capacidad funcional aeróbica basal menor del 75%, el riesgo de morir o tener un accidente cerebrovascular fue significativamente mayor en comparación con aquellos que tuvieron 105% o más. Concluyeron entonces que una mejor condición cardiorrespiratoria está asociada con un menor riesgo de presentar FA, accidente cerebrovascular o muerte. Igualmente señalaron que el riesgo de accidente cerebrovascular y muerte en pacientes con FA está inversamente asociado con la capacidad cardiorrespiratoria, demostrando así, como principal hallazgo de este estudio, que el riesgo de FA incidental, accidente cerebrovascular y mortalidad tiene una relación inversa con la aptitud o capacidad cardiorrespiratoria36.
Programas de rehabilitación cardíaca para pacientes con fibrilación auricular
A pesar de que Myrstad et al37 recientemente han afirmado que no existen pautas para la actividad física y el ejercicio para los pacientes con FA, diversos protocolos han sido publicados y empleados en estos casos, muchos de ellos incluidos en el estudio de Risom et al38. Además, en el caso de los pacientes con ICC con fracción de eyección reducida y FA, el American College of Cardiology en conjunto con la American Heart Association han recomendado, en sus correspondientes guías de práctica clínica, el entrenamiento físico en estos casos39.
Aunque diversos estudios han demostrado beneficios en la mejoría de la capacidad funcional cardiovascular con la práctica de EF en pacientes con FA, así como la consiguiente disminución de la incidencia y recurrencia de episodios de esta arritmia35,40,41, sólo pocos han examinado el impacto de la rehabilitación cardíaca con entrenamiento físico en este tipo de pacientes, sin haber evaluado su verdadero impacto sobre la mortalidad y eventos cardiovasculares adversos42.
Con el objetivo de evaluar el significado de la FA en pacientes con enfermedad cardiovascular incorporados a la rehabilitación cardíaca, Younis et al42 evaluaron a 304 pacientes con FA y 1873 casos controles sin esta arritmia, que participaron en un programa de rehabilitación, todos padecían de una afección cardiovascular confirmada, principalmente después del infarto agudo de miocardio, angioplastia o cirugía coronaria, insuficiencia cardíaca descompensada y sustitución o plastia valvular. Los pacientes participaron en un programa estructurado de rehabilitación cardíaca de 6 meses de duración consistente en sesiones de EF de 60 minutos de duración, dos veces por semana y se empleó un protocolo individualizado de acuerdo al documento de consenso elaborado por la Sociedad Europea de Cardiología43. Se realizó una prueba de esfuerzo máxima, mediante el protocolo de Bruce al inicio del programa, que se repitió 8±5 meses después44.
Los pacientes con FA mostraron menores niveles de aptitud física inicial en comparación con sus pares sin FA; sin embargo, estos pacientes tuvieron mayores incrementos de la capacidad funcional durante el programa de rehabilitación que aquellos sin la arritmia, lo cual había sido antes señalado por Vanhees et al45. Por tanto, de acuerdo a los resultados del trabajo de Younis et al42, la capacidad funcional basal es el predictor más importante de complicaciones cardiovasculares o mortalidad general en pacientes con historia de FA que participan en programas de rehabilitación cardíaca. El análisis de supervivencia (Kaplan‐Mayer) mostró una disminución significativa (p<0,001) de la ocurrencia de eventos a los 5 años en los pacientes donde se demostró mejoría de su estado físico. Además, la rehabilitación cardíaca puede disminuir el riesgo de morbilidad y mortalidad en pacientes con FA, aunque este efecto puede ser relativamente modesto. Los pacientes con riesgo elevado pueden ser fácilmente identificados mediante la realización de una prueba de esfuerzo previa al inicio de la rehabilitación (Figura 2). En ellos puede ser útil la prescripción de un programa de rehabilitación cardíaca supervisada e intensiva con el fin de incrementar su capacidad funcional y, por consiguiente, mejorar su evolución futura.
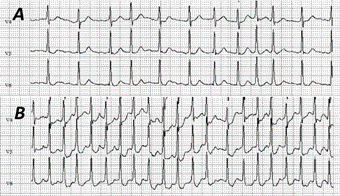
Figura 2 Trazo electrocardiográfico de prueba de esfuerzo evaluativa realizada en una correa sin fin (Ergocid- AT Plus, Combiomed [Cuba]), en una mujer de 49 años de edad con prótesis mitral quirúrgica 3 meses antes (por enfermedad mitral de origen reumática), con el objetivo de incorporarla a un programa de rehabilitación con ejercicios físicos supervisados. Tuvo una frecuencia cardíaca de 120 latidos por minuto en condiciones basales (A) y alcanzó 204 por minuto en el esfuerzo máximo (B).
Como conclusión se reafirma que en los pacientes con FA que participan en programas de rehabilitación cardíaca con EF, el incremento resultante de la función cardiovascular, evaluado mediante una prueba de esfuerzo convencional o con análisis de gases espirados, está asociado con una disminución del riesgo de mortalidad o nuevas hospitalizaciones durante su seguimiento clínico.
Calidad de vida relacionada con la salud
Otros resultados del estudio HF-ACTION también demostraron que el entrenamiento físico proporcionaba un modesto, aunque significativo, incremento del estado de salud determinado mediante el Kansas City Cardiomyopathy Questionnaire28,29. En este análisis, los pacientes con FA tuvieron significativamente menor capacidad funcional y de ejercicios, sin embargo presentaron similar estado de salud relacionado con su enfermedad, comparado con pacientes en ritmo sinusal en condiciones basales. Aunque los pacientes con FA alcanzaron similar ganancia de la reserva cardiopulmonar a corto plazo y del estado funcional con el EF, ellos sólo autoinformaron mejorías mínimas del estado de salud con ejercicios.
Se ha demostrado previamente que el EF incrementa modestamente la calidad de vida y los síntomas en pacientes con FA permanente, pero ello ha sido verificado con el empleo de otros instrumentos evaluadores del estado de salud, por ejemplo con el conocido SF-36 en su forma corta29,46.
En muchos estudios se hace difícil evaluar y comparar el estado de salud de este tipo de población incorporada a entrenamiento físico debido al empleo de diferentes escalas e instrumentos, así como a diversos programas de intervención con EF, lo cual impide con frecuencia arribar a conclusiones definitivas en este sentido.
CONCLUSIONES
La fibrilación auricular en pacientes con insuficiencia cardíaca crónica está asociada con una edad avanzada, capacidad de ejercicio reducida en condiciones basales, así como a una mayor frecuencia de complicaciones en forma de nuevos eventos clínicos; sin embargo, en casos con insuficiencia cardíaca crónica sin fibrilación auricular, no hay diferencia en la respuesta al ejercicio físico relacionada con una satisfactoria evolución clínica o cambios favorables en la capacidad de ejercicios.
Hay evidencias de que la capacidad funcional es inversamente proporcional a la fibrilación auricular y su recurrencia. En el estudio HF-ACTION27-29 el volumen de ejercicios tuvo un rango en el tiempo que osciló entre 3 a 7 MET (equivalentes metabólicos) u horas por semana, lo que se asoció con una reducción de la mortalidad cardiovascular y de nuevas hospitalizaciones por insuficiencia cardíaca crónica de un 30%. Esto no es exactamente las 36 sesiones de ejercicio físico a realizar en 12 semanas que se propone como método para obtener beneficios a largo plazo.
PERSPECTIVAS
La rehabilitación cardíaca es una indicación aprobada actualmente en pacientes con ICC, con FA o en ausencia de ella, la cual está demostrado que incrementa la capacidad funcional y la calidad de vida de los pacientes, así como que reduce la mortalidad general y las hospitalizaciones. Para cumplir estos propósitos deben recomendarse 36 sesiones de EF, como parte de la rehabilitación, durante 12 semanas, con la indicación de continuarlas de manera hospitalaria o domiciliaria, con el objetivo de cumplir 90 minutos de ejercicios por semana en los primeros 3 meses, continuando con 120 minutos después de manera indefinida
















