INTRODUCCIÓN
La diabetes mellitus tipo 2 (DM2) es una enfermedad de elevada prevalencia a nivel mundial y se asocia de forma notable a la presencia de enfermedad cardiovascular (ECV). El tratamiento actual se basa en medidas farmacológicas y no farmacológicas, donde se incluye -como muy importante- la rehabilitación cardiovascular (RCV), una estrategia terapéutica multidisciplinaria que contiene la prevención secundaria, basada fundamentalmente en el control de los factores de riesgo (FR), la prescripción de ejercicio físico (EF) regular, y tiene como objetivo rehabilitar al paciente de forma integral, al considerar los perfiles físico, psíquico, social, sexual y vocacional. La RCV es una ciencia constituida que ha demostrado disminuir la morbilidad y mortalidad total, y por ECV, además de mejorar la calidad de vida de los pacientes con DM21,2.
El objetivo de este artículo es describir algunos elementos importantes sobre estos aspectos terapéuticos en los pacientes con DM2.
Cambios de estilo de vida recomendados en los pacientes con DM2
Se recomienda reducción del peso corporal mediante restricción calórica e incremento de la actividad física1. La dieta debe enfocarse en una mayor ingestión de frutas, vegetales, nueces, fibras y pescado. Consumir menos grasas transaturadas y saturadas, y más mono y poliinsaturadas. Además es importante reducir el sodio, así como la ingestión de comidas procesadas, carbohidratos refinados y bebidas azucaradas. Las dietas mediterránea y DASH (Dietary Approaches to Stop Hypertension) han demostrado ser efectivas en los pacientes con DM2, pues en quienes la consumen se ha observado una disminución significativa de la aparición de eventos cardiovasculares graves y muerte de causa cardiovascular2,3.
La dieta se considera uno de los parámetros fundamentales a lograr entre los cambios de estilo de vida y la educación del paciente es esencial para cumplir este objetivo. Se recomienda una ingestión alta en proteínas (20-30%) y baja en carbohidratos para lograr niveles óptimos de glucemia basal, posprandial y menor resistencia a la insulina2,4. No existe evidencia de que la ingestión de proteínas a menor dosis de las recomendadas diariamente (0,8 g/kg de peso corporal/día) retarde la aparición de la disminución de la tasa del filtrado glomerular5, pero el consumo de carne roja sí ha demostrado incrementar el riesgo cardiovascular y empeorar el control glucémico en los diabéticos3,4.
Evitar el sedentarismo es otra recomendación importante2. Además de la importancia del EF planificado, también es necesario ponerse de pie y realizar alguna caminata u otro tipo de actividad física cada cierto tiempo5. En un estudio publicado en 20165, que incluyó a 5 575 adultos diabéticos americanos, se demostró que la permanencia de largos períodos sentados al día se asoció a mayor mortalidad por cualquier causa.
La realización de EF regular ha demostrado mejorar el control glucémico y lograr reducciones significativas de la media de los valores de hemoglobina glucosilada (HbA1c). La combinación de EF aeróbico y de resistencia logra un mejor control metabólico y una mayor pérdida de peso; además, al igual que la dieta adecuada, ha logrado disminuir la aparición de eventos cardiovasculares y la muerte cardíaca en diabéticos tipo 22,6-9.
En los pacientes con DM2 se deben indicar 150 minutos de EF de intensidad moderada o 75 minutos de actividad vigorosa e intensa cada semana. Es importante realizar actividad física regular, de tres a cinco veces en semana, y aplicar un tratamiento riguroso sobre todos los FR presentes2,10,11.
Control glucémico
En los pacientes diabéticos tipo 2 existe evidencia que el control más riguroso de la glucemia al inicio de la enfermedad reduce las complicaciones cardiovasculares a largo plazo12. En el estudio UK Prospective Diabetes Study Group (UKPDS)13, que persiguió el objetivo de mantener valores de HbA1c en 7%, se redujeron en un 16% los eventos cardiovasculares (infarto agudo de miocardio [IAM] fatal y no fatal, y muerte súbita) a corto plazo con el control intensivo de la glucemia, sin diferencias significativas, a expensas de un mayor riesgo de hipoglucemia; sin embargo, a los diez años de seguimiento hubo disminución significativa de IAM y mortalidad por cualquier causa, fundamentalmente en los pacientes tratados con metformina, sulfunilureas o insulina como terapia de primera línea.
Los estudios ACCORD, ADVANCE y VADT no encontraron disminución significativa de los eventos cardiovasculares con el control intensivo de la glucemia14. En el ensayo ACCORD15, se comparó el control glucémico estricto (HbA1c <6% con fármacos orales y, en caso necesario, insulina) con uno menos estricto (HbA1c entre 7,0-7,9%) en pacientes con DM2 de muchos años de evolución (promedio de 10 años) y presencia de dos FR o ECV. El ensayo se interrumpió prematuramente debido a una mayor mortalidad en el grupo asignado al control glucémico estricto.
La HbA1c es un parámetro importante de valoración del control metabólico y predice el riesgo de morbilidad cardiovascular y muerte por cualquier causa mejor que la glucemia basal16. La incidencia de complicaciones clínicas en los diabéticos tipo 2 depende de los niveles basales de HbA1c y se estima que por cada 1% de incremento de sus valores el riesgo cardiovascular se incrementa en un 18%. Actualmente la American Diabetes Association (ADA) propone que los valores objetivos de este parámetro sean individualizados según las características de la enfermedad y los FR asociados en cada paciente17.
Los valores óptimos de HbA1c recomendados en los pacientes con DM2 se muestran en la tabla 2,17.
TRATAMIENTO FARMACOLÓGICO
El tratamiento hipoglucemiante es vital para el control de la DM2 y la reducción de sus complicaciones17, como lo es la aparición de las ECV. Resulta muy importante que los especialistas conozcan los grupos farmacológicos que se pueden emplear, en dependencia de las características individuales del paciente y el fármaco17-19.
La mayoría de la literatura revisada coincide en sugerir la metformina, según su tolerancia digestiva, como terapia inicial o de primera línea, y está demostrado que previene la aparición de eventos cardiovasculares en los pacientes con DM220-23. Este fármaco disminuye la producción hepática de glucosa e incrementa la sensibilidad periférica a la insulina, por lo que tiene efectos beneficiosos sobre el perfil glucémico y el peso corporal25. Maruthur et al.20, en su metanálisis, encontraron que disminuyó en un 39% la aparición de IAM y en 36% todas las causas de mortalidad.
Es importante conocer que el uso prolongado de este medicamento se asocia a deficiencia de la vitamina B12 por lo que sus niveles deben ser dosificados cada cierto tiempo, fundamentalmente si hay neuropatía periférica o anemia. Además, aumenta levemente el riesgo de sufrir acidosis láctica y está contraindicado en pacientes con tasas de filtración glomerular menores de 30 ml/min/1,73 m2, pero puede mantenerse con precaución entre 30‑45 ml/min/1,73 m2. Se debe suspender en caso de descompensación y hospitalización, sobre todo por síndrome coronario agudo20-24.
Las sulfunilureas pueden considerarse como primera línea en pacientes sin sobrepeso (índice de masa corporal < 25 kg/m2). No se ha demostrado que sean beneficiosas para disminuir las complicaciones macrovasculares y se han asociado a incremento del peso corporal, insuficiencia cardíaca, cáncer de vejiga y fracturas óseas. Debe considerarse iniciar tratamiento con insulina, añadida o no, a un fármaco antidiabético si los niveles de HbA1c son mayores o iguales a 10%, o los niveles basales de glucosa son mayores de 16,7 mmol/L(20,23.
En los pacientes sin ECV establecida, si la monoterapia no logra valores óptimos de HbA1c en tres meses de tratamiento, se debe añadir otro grupo farmacológico, en dependencia de las características del individuo: peso corporal, presencia de nefropatía, efectos adversos, preferencia y costo del medicamento22,23,25.
Algunas investigaciones26-31, han recomendado añadir los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) -canagliflozina, empagliflozina, dapagliflozina- y de los agonistas de los receptores del péptido similar al glucagón tipo 1 (GLP-1), como el liraglutide, en los diabéticos tipo 2 con alto riesgo cardiovascular y en los que tienen ECV establecida, debido a que han demostrado reducir la aparición de eventos cardiovasculares e insuficiencia cardíaca en este grupo de pacientes23.
Los iSGLT2 actúan a nivel tubular proximal donde incrementan la excreción urinaria de glucosa y sodio, por lo que tienen efectos beneficiosos sobre el control glucémico, la presión arterial y el peso corporal25-27. Por su parte, los agonistas GLP-1 incrementan la producción hepática de insulina y glucagón, así como la entrada de glucosa al tejido muscular y adiposo, y disminuyen la producción hepática de glucosa. Han demostrado la reducción de eventos coronarios pero no de insuficiencia cardíaca29-31. Por estas razones, en los pacientes con DM2 asociada a la presencia FR para el desarrollo de ECV es razonable indicar uno de estos dos grupos de medicamentos como prevención primaria de ECV2,17.
La American Diabetes Association (ADA) ha recomendado el uso de empaglifozina o de liraglutide como terapia de segunda línea en los casos con ECV previa y pobre control de los valores de glucemia16,23,27. En el estudio EMPA-REG OUTCOME32, con el uso de empaglifozina, se incluyeron 7 020 diabéticos tipo 2 con más de 10 años de evolución de la enfermedad, el 99% de ellos con ECV establecida, que fueron seguidos durante un promedio de 3,1 años, y se obtuvo una reducción en la incidencia de IAM, accidente vascular encefálico y muerte; así como una reducción significativa en la necesidad de hospitalización por insuficiencia cardíaca y una disminución de la progresión de la enfermedad renal. Además la empaglifozina logró, al final del estudio, una reducción pequeña pero estadísticamente significativa de los valores de HbA1c, de presión arterial sistólica y diastólica de 4-5 mmHg y 2 mmHg, respectivamente; una pérdida de aproximadamente 2 kg de peso e incrementos mínimos de los valores de colesterol unido a lipoproteínas de alta densidad (HDLc), y no se observaron cambios en la frecuencia cardíaca (FC). Por estas razones, el mencionado fármaco se ha convertido en una opción favorable para los pacientes con DM2 y ECV establecida o alto riesgo de padecerla, y desde el 2 de diciembre de 2016 la FDA (Food and Drug Administration) la aprobó para reducir el riego de muerte cardiovascular en diabéticos tipo 2 con ECV22,23.
La canaglifozina puede ser otra opción de tratamiento, pues redujo de forma significativa los valores medios de HbA1c (0,58%), de presión arterial sistólica (3,93 mmHg) y diastólica (1,39 mmHg), y el peso corporal (1,6 kg), e incrementó los de HDLc en 2,05 mg/dL; sin embargo, también aumentó los valores de colesterol unido a lipoproteínas de baja desidad (LDLc) en 4,6 mg/dL. Este medicamento se ha asociado a una disminución de la progresión de la enfermedad renal y de la aparición de insuficiencia cardíaca, y a un incremento relativo del riesgo de fracturas óseas (en un 26%), cetoacidosis diabética, infección genital y amputación de los miembros inferiores22,23,26..
El liraglutide fue investigado en el estudio LEADER (Liraglutide Effect and Action in Diabetes)33, que incluyó a 9 340 diabéticos tipo 2 con alto riesgo de ECV. El 80% de ellos tenían una ECV establecida y un promedio de 12 años de evolución de DM2. El seguimiento promedio fue de 3,8 años y en esta investigación se obtuvo una disminución significativa del total de muertes y por de las producidas por causas cardiovasculares; con diferencias numéricas, no estadísticamente significativas, sobre la aparición de IAM no fatal y accidente vascular encefálico. No se demostró mejoría en la disminución de la hospitalización por insuficiencia cardíaca, pero si disminuyó la progresión de la enfermedad renal. Se considera que este medicamento puede tener mayor impacto y beneficios sobre la enfermedad ateroesclerótica. Desde el 25 de agosto de 2017 fue aprobado por la FDA para reducir el riesgo de eventos cardiovasculares graves en pacientes con DM2 y ECV establecida22,31.
Este fármaco también se ha asociado con un pequeño, pero significativo, incremento de la FC de tres latidos por minuto (lpm), de la presión arterial sistólica (1,2 mmHg), la sistólica (0,6 mmHg), así como a una reducción de 2,3 kg de peso y de 0,4% de la media de los valores de HbA1c33.
El semaglutide, por su parte, en dosis de 0,5 a 1 mg incrementó la FC entre 2-2,5 lpm, respectivamente, con importante reducción de los valores de HbA1c de 0,7 a 1%, respectivamente. La presión arterial sistólica disminuyó de 1,3 a 2,6 mmHg y el peso corporal entre 2,9 a 4,3 kg, respectivamente. No existieron diferencias en los cambios de la presión arterial diastólica con ninguna de las dos dosis utilizadas. El fármaco demostró que logra una disminución significativa en la aparición de accidente vascular encefálico y no significativa en la aparición de IAM no fatal, sin efectos significativos sobre la muerte de origen cardiovascular y total; además, disminuyó la progresión de la enfermedad renal. Desde el 18 de octubre del 2017 la FDA está a favor de la utilización de este medicamento22,30.
El lixisenatide, otro agonista de los receptores GLP-1, demostró una reducción significativa de los valores de HbA1c en un 0,3%, de la presión arterial sistólica (0,8 mmHg) y del peso corporal (0,7 kg), con un ligero incremento de la FC de 0,4 lpm, pero no logró efectos beneficios en la disminución de eventos cardiovasculares31.
El exenatide disminuyó los valores de HbA1c en 0,53%, el peso corporal en 1,3 kg/m2, la presión arterial sistólica en 1,6 mmHg e incrementó la FC en 2,5 lpm. No se demostró la superioridad del exenatide utilizado a dosis de 2 mg a la semana, al compararlo con un grupo placebo. No existieron diferencias significativas entre los dos grupos en cuanto a la aparición de muerte total o cardiovascular, IAM o ictus fatal y no fatal, ni sobre la incidencia de pancreatitis aguda, cáncer pancreático, carcinoma tiroideo medular e hipoglucemia grave29.
El liraglutide y el semaglutide han demostrado efectos beneficiosos superiores al lixisenatide y el exenatide en cuanto a la aparición de eventos cardiovasculares graves23.
El impacto de la reducción de los FR con los inhibidores de la dipeptidil peptidasa 4 (DPP-4) ha sido mínimo, a excepción de la disminución media de 0,3% en los valores de HbA1c23. Algunos estudios34-37) han evaluado la seguridad cardiovascular de estos medicamentos (omarigliptina, saxagliptina, alogliptina, linagliptina) y han encontrado que existen diferencias entre los diversos tipos de los inhibidores de la DPP-4. Saxagliptina y alogliptina incrementaron el riesgo de padecer insuficiencia cardíaca, especialmente en los pacientes con insuficiencia renal, sin efecto sobre otros eventos cardiovasculares graves; por su parte, la linagliptina mostró mayor seguridad en los pacientes con riesgo cardiovascular y daño renal23,34-38.
Es importante señalar que en un estudio publicado en 201839 sobre los efectos de la vildagliptina en la función ventricular de pacientes con DM2 e insuficiencia cardíaca -con una fracción de eyección del ventrículo izquierdo (FEVI) promedio de 30%- se demostró que el medicamento no tuvo mayor efecto sobre la FEVI al compararlo con el placebo, y se incrementaron los volúmenes intraventriculares, por lo que se necesita mayor evidencia acerca del uso de los inhibidores de la DPP-4 en los diabéticos con FEVI reducida.
Otro estudio38, que comparó el uso de este grupo de fármacos con la insulina protamina neutral Hagedorn (NPH) como terapia de tercera línea en pacientes que no estaban controlados con el uso de metformina y sulfunilureas, llegó a la conclusión que los pacientes que usaron inhibidores de la DPP-4 tuvieron mayor adherencia al tratamiento y menor tendencia a la hipoglucemia, por lo que estos medicamentos pueden constituir una buena opción para estos casos.
La pioglitazona ha disminuido el riesgo de hipoglucemia moderada y grave al compararla con las sulfunilureas, pero se ha planteado que su uso puede estar asociado a la aparición de cáncer de vejiga e insuficiencia cardíaca23,40; por lo tanto, en los diabéticos con insuficiencia cardíaca se deben evitar los hipoglucemiantes del tipo de las tiazolidinedionas como la rosiglitazona y la pioglitazona, sobre todo en los casos sintomáticos. Los inhibidores de la DPP-4 y los iSGLT2 son los indicados en estos casos23,40,41.
La ranolazina es un inhibidor selectivo de los canales cardíacos de sodio por lo que disminuye las concentraciones intracelulares de sodio y calcio, lo que favorece la relajación cardíaca, la función diastólica y la perfusión miocárdica. A su vez, tiene efectos sobre los islotes pancreáticos y favorece la secreción de insulina, por lo que actualmente parece ser un fármaco prometedor en los pacientes con angina estable y DM2. Algunos estudios han demostrado su eficacia, pero se requieren aún más evidencia para establecer su uso42.
Todavía se debate sobre qué grupo de medicamento debe añadirse cuando la metformina es insuficiente. Las sulfunilureas son comúnmente utilizadas como terapia de segunda línea. Otros autores consideran el uso de la insulina y de los inhibidores de la DPP-4. En la actualidad se considera que la adición de insulina a la terapia combinada de metformina con sulfunilureas es la estrategia más costo-efectiva, sin embargo el uso de los inhibidores de la DPP-4 es potencialmente costo-efectivo cuando se necesita obtener un menor rango de glucemia23,34-38.
REHABILITACIÓN CARDIOVASCULAR
Según la Organización Mundial de la Salud (OMS)43, la RCV es “el conjunto de actividades necesarias para asegurar a las personas con ECV una condición física, mental y social óptima que les permita ocupar por sus propios medios un lugar tan normal como le sea posible en la sociedad”.
Es una terapéutica multidisciplinaria que incluye la prevención secundaria, basada fundamentalmente en el control de los FR y la prescripción de EF regular; además, tiene como objetivo rehabilitar al paciente en forma integral, al tener en consideración el perfil físico, psíquico, social, sexual y vocacional. Otros objetivos son: educar a los enfermos para que mantengan hábitos saludables, la adherencia a los cambios de estilo de vida y al tratamiento farmacológico; reducir la incapacidad, mejorar la calidad de vida, prevenir los eventos cardiovasculares y reducir la mortalidad cardiovascular y total; así como reducir el estrés, la ansiedad y la depresión. Puede ser supervisada o domiciliaria sin supervisión. El equipo lo conforman cardiólogos, enfermeros, especialistas y técnicos en rehabilitación, cultura física y deporte, psicólogos, nutricionistas y trabajadores sociales43-46.
Con el incremento de la prevalencia de DM2 es importante aplicar, como parte del tratamiento, los cambios en el estilo de vida, la prevención basada en la intervención integral sobre los FR y la utilización del EF para lograr sus efectos favorables; por lo que la RCV se ha convertido en una herramienta indispensable para el control y tratamiento de este tipo de pacientes46-49.
El EF disminuye el riesgo cardiovascular, la mortalidad y la discapacidad prematura, e incrementa la calidad de vida en los diabéticos tipo 247. El ejercicio aeróbico de moderada a alta intensidad se ha asociado de forma significativa a una reducción de la mortalidad; además, controla los valores de glucemia, HbA1c, tensión arterial y mejora la resistencia a la insulina50-52.
El EF regular aeróbico mejora el metabolismo glucolipídico y la respuesta inflamatoria, por lo que disminuye las complicaciones asociadas a la enfermedad, tiene efectos favorables sobre la obesidad (disminuye el peso corporal) y el síndrome metabólico, disminuye los niveles de factores inflamatorios como el factor de necrosis tumoral alfa (TNF-α), la interleucina (IL)-6, la proteína C reactiva y la leptina, e incrementa los niveles de factores antinflamatorios como la IL-4, la IL-10 y la adiponectina53.
El EF también mejora la función endotelial al incrementar la secreción de óxido nítrico, tiene efecto antioxidante y antiestrés, e incrementa la transcripción y expresión del transportador tipo 4 (GLUT-4), a través del cual aumenta el transporte de glucosa mediado por la insulina; efecto que persiste de 3 a 24 horas después de culminado el EF, como mismo dura de 72 horas o más el aumento de la sensibilidad a la insulina. Por eso se he reconocido que el EF regular mejora la utilización de glucosa por la célula y la sensibilidad del organismo a la insulina; además, disminuye la concentración sérica de triglicéridos y colesterol unido a lipoproteínas de baja desidad (LDLc), e incrementa los valores de HDLc48,54.
La DM2 es un FR independiente para la disminución de la fuerza muscular y la capacidad funcional que decrecen de forma progresiva con la enfermedad. El EF de resistencia en estos pacientes mejora la masa y la fuerza muscular, la capacidad funcional, la composición corporal, la densidad mineral ósea, la sensibilidad a la insulina, los valores de tensión arterial, de lípidos sanguíneos, la salud mental del paciente y disminuye los FR cardiovascular55,56.
Los ejercicios de flexibilidad son particularmente útiles para los adultos mayores con DM2, especialmente en ancianos con riesgo de caídas. Se conoce que el yoga mejora el control de la glucemia, los niveles de lípidos y la composición corporal, y que el entrenamiento con taichí puede mejorar el equilibrio, la marcha, los síntomas neuropáticos, el control de la glucemia y algunos parámetros relacionados con la calidad de vida57,58.
El EF se realiza con mayor dificultad en los individuos con DM2 que en los obesos y sedentarios no diabéticos. Se plantea que las mujeres diabéticas posmenopáusicas realizan mayor esfuerzo a la hora de practicar EF y que la percepción subjetiva de su intensidad -aunque sea baja-, de acuerdo a la escala de Borg, es significativamente mayor que en las no diabéticas59,60. Huebschmann et al.56 demostraron que el consumo máximo de oxígeno fue menor en las diabéticas al compararlas con el grupo control, y que las diferencias estadísticas entre las concentraciones de lactato en sangre durante el entrenamiento de baja a moderada intensidad, en las mujeres posmenopáusicas con DM2, fueron significativas menores que en las no diabéticas. Resultados que evidencian la necesidad de realizar EF de forma sistemática en los pacientes con DM2 y especialmente en las mujeres posmenopáusicas.
La percepción subjetiva del EF se encuentra relacionada con la respuesta afectiva al ejercicio y con la actividad física usual del paciente. Estos factores pueden ser un importante predictor de la adaptación y adherencia al EF51,61,62. A pesar que se conocen los efectos beneficiosos de la RCV para los pacientes con DM2, sólo 25-30% de ellos se incorporan a estos programas45,46,61,62. Los pacientes con DM2 suelen realizar menor EF que los no diabéticos y la enfermedad por sí misma es la causa más frecuente, incluso limitan su actividad diaria al notar disminuida su capacidad de ejercitarse54,55,62.
Se ha demostrado que los factores predictores de menor frecuencia y duración del EF en los pacientes con DM2 se relacionan con el índice de masa corporal, la percepción subjetiva de la intensidad del EF y con características demográficas individuales como edad y sexo, estado civil, nivel educacional, profesión y tipo de empleo, que pueden medirse por el índice de comorbilidad de Charlson; razón por la que estos factores deben tenerse en cuenta al prescribir el EF en este tipo de pacientes2,17,62,63.
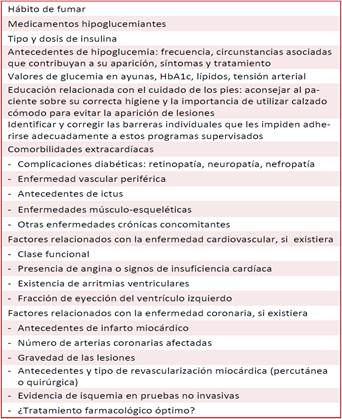
Existen otros parámetros a valorar al momento de iniciar la RCV en los que padecen DM2 (Recuadro)45-47,64. Una importante pregunta suele ser: ¿cuál es la óptima dosis terapéutica de EF en los pacientes con DM2, según tipo, intensidad del ejercicio, frecuencia y ritmo de las sesiones? Actualmente se recomienda que deben realizar ejercicio aeróbico (caminar, trotar, nadar, ciclismo), sumado al ejercicio de resistencia, como mínimo de tres a cinco veces por semana. La intensidad y volumen del EF más adecuado aún no quedan claras45,46,65,66.
El EF en pacientes con DM2 debe respetar los principios del entrenamiento: intensidad, frecuencia, duración, ritmo, individualización y tipo de ejercicio. Existen diferentes modalidades de entrenamiento físico que se han utilizado en los diversos estudios que incluyen pacientes con DM2, por lo que aún no existe un consenso sobre qué tipo preciso de ejercicio, dosis, duración e intensidad deben utilizarse en estos pacientes, lo que sí está claro es que las estrategias de EF deben ser adaptadas de forma individual, basadas en las comorbilidades y las contraindicaciones para cada caso, entre otros aspectos (Recuadro)45,46,64-67.
La frecuencia mínima para realizar EF debe ser de tres veces en semana con una duración inicial de 20 minutos de las sesiones hasta alcanzar 45 a 60 minutos. Antes de iniciar el entrenamiento es necesario indicarle al paciente una ergometría convencional o con gases espirados (ergoespirometría), pruebas que aportarán las variables necesarias para calcular la intensidad del EF que debe realizar el enfermo: FC de entrenamiento, capacidad funcional, comportamiento de la tensión arterial, doble producto, índice de competencia cronotrópica, tasa de recuperación cardíaca y presencia de arritmias asociadas al EF45,46.
En los diabéticos tipo 2 sin ECV establecida el protocolo de Bruce descarta la presencia de obstrucción coronaria significativa e isquemia miocárdica asintomática o no; mientras que en los pacientes con DM2 y ECV conocida, la prueba submáxima o limitada por síntomas determina el pronóstico de la enfermedad y estratifica al paciente según el riesgo de padecer complicaciones cardiovasculares, aspecto importante para indicar el entrenamiento físico. La ergoespirometría es especialmente útil para determinar la capacidad funcional aeróbica, consumo máximo de oxígeno y umbral aeróbico, variables ideales para determinar con exactitud la intensidad del EF, principalmente en los diabéticos con FEVI disminuida45,46.
Dicha intensidad se puede determinar de manera directa, con las variables obtenidas en la ergoespirometría; o indirecta, a partir de la ergometría convencional, mediante la fórmula de Karvonen45,46:
EF, ejercicio físico; FC, frecuencia cardíaca
También se calcula a través de la percepción subjetiva de esfuerzo, para lo cual existen diversas escalas, y la más utilizada es la de Borg45,46,68,69. Se puede utilizar la FC o la carga de EF en el momento de alcanzar entre 50-80% del consumo máximo de oxígeno -40% en caso de pacientes muy desentrenados- o la FC en el momento del alcanzar umbral anaeróbico. Esta última variable es menos influenciada por la variabilidad individual del esfuerzo máximo realizado, que depende de la capacidad de tolerancia al esfuerzo del enfermo y de la motivación por parte del facultativo45,46,69.
La FC de entrenamiento se debe calcular con el empleo de un porcentaje de intensidad del EF entre 60-85% de la FC máxima alcanzada en la prueba ergomética, o entre 40-80% de la FC de reserva en pacientes muy desentrenados.
Si la prueba de esfuerzo es positiva, es decir, si aparecen cambios eléctricos que sugieran isquemia, la FC de entrenamiento será del 75-85% de la FC al momento de iniciarse la positividad (clínica o eléctrica): aproximadamente 10 latidos menos que la FC en el momento de la angina o el descenso del ST. En caso de desfibriladores implantados, la FC máxima no debe sobrepasar la de activación del dispositivo, por lo se establecerá a 10-20 latidos por debajo45,46. Si se utiliza la percepción subjetiva del paciente al esfuerzo físico, es necesario que los pacientes alcancen percepciones entre 12 y 16, según la escala de Borg68.
En general se recomienda que los diabéticos tipo 2 deben realizar EF aeróbico de moderada a alta intensidad de tres a cinco días en la semana, preferiblemente combinados con ejercicio de resistencia que se debe incrementar progresivamente. El ejercicio aeróbico de moderada intensidad por un mínimo de 30 minutos cinco veces en semana (150 minutos/semana) ha demostrado ser eficaz en la disminución del deterioro que tiende a producir la DM2 sobre la función cognitiva y la tendencia a la depresión y la demencia en estos pacientes. La excusa para no hacerlo, generalmente es la falta de tiempo, por lo que se ha incrementado la práctica de ejercicios de tipo tiempo-eficiente como el ejercicio interválico de alta intensidad45,46,66,70. Para ello se recomienda que el paciente realice EF seguido de una pausa de recuperación que generalmente es pasiva y corta (de dos a tres minutos de duración) y luego continúa con el EF, de forma tal que desarrolle la sesión a intervalos45,46,70.
El entrenamiento físico de alta intensidad mantenido puede ocasionar hipoglucemia y muerte en los diabéticos; sin embargo, el entrenamiento interválico de alta intensidad -que incluye la realización de EF a un consumo de oxígeno del miocardio (MVO2) ≥90% entre 15 segundos y cuatro minutos, seguido por un período de recuperación a un MVO2 de 40-50% de igual duración que el intervalo de trabajo- mejora el funcionamiento de los marcadores enzimáticos asociados a la glucólisis, la función mitocondrial, el metabolismo aeróbico y la betaoxidación66,70. Además, mejora la capacidad oxidativa del músculo esquelético, la sensibilidad a la insulina y los valores de glucemia. Los beneficios del ejercicio interválico han sido demostrados con la mejoría de parámetros metabólicos como la HbA1c, la composición corporal, la presión sanguínea y la condición física. Estos cambios se inician a nivel mitocondrial con el aumento de la densidad mitocondrial y los transportadores de glucosa GLUT-4. También reduce los niveles de grasa corporal por sus mecanismos de acción adrenérgica durante y posterior al EF, mejora la capacidad funcional y los parámetros relacionados con la calidad de vida del paciente66,70.
El ejercicio aeróbico interválico de alta intensidad conlleva a la mejoría de la neuropatía autonómica cardiovascular de los diabéticos, enfermedad que incrementa 3,4 veces la mortalidad en estos pacientes. La reducción de la variabilidad de la FC es, con frecuencia, el síntoma inicial de esta neuropatía, que suele asociarse a disminución de la actividad de los barorreceptores. El EF ha demostrado ser un medio efectivo en la mejoría de la variabilidad de la FC y de la sensibilidad de los baroreceptores. Esta modalidad de EF incrementa la concentración de los mediadores antinflamatorios y antioxidantes endógenos, lo que mejora el control autonómico en el sistema cardiovascular51,52.
Algunos autores47,50-52 han planteado que el ejercicio interválico de alta intensidad es más efectivo que el EF de moderada intensidad en reducir los FR cardiovascular y el remodelado del ventrículo izquierdo después de un IAM con signos de insuficiencia cardíaca en los pacientes diabéticos, su intensidad es un factor importante que influye sobre los cambios de la función cardíaca en las etapas tempranas o iniciales de la DM2. Otros, por su parte, han recomendado el ejercicio aeróbico de baja intensidad pero de larga duración: de 45 a 60 minutos la sesión de entrenamiento con un mínimo de cinco veces por semana45,46.
Se conoce que los diabéticos tipo 2 están más expuestos que la población general a la aparición de daños y eventos agudos adversos durante la realización de EF, por lo que su prescripción en esta población debe incluir recomendaciones para la prevención y control de situaciones como el pie diabético, la retinopatía, nefropatía, hipo o hiperglucemia, deshidratación y las interacciones entre el tratamiento farmacológico y el EF10,45,46.
La prescripción de sesiones de EF en los pacientes con DM2 es eficaz cuando se indica por profesionales calificados como los cardiólogos rehabilitadores y se supervisa en el gimnasio de RCV por las licenciadas capacitadas. Es necesaria la realización de la consulta inicial de RCV para estratificar y clasificar al paciente según el riesgo coronario, sobre todo en los diabéticos tipo 2 con ECV establecida, esta consulta incluye la evaluación clínica antes de indicar el EF, una adecuada anamnesis y examen físico, así como la indicación e interpretación de un electrocardiograma basal de 12 derivaciones.
Se debe considerar la indicación individualizada de otros complementarios útiles: ecocardiograma transtorácico, ergometría diagnóstica o valorativa, prueba de la marcha de seis minutos, análisis de laboratorio para conocer valores de glucemia, HbA1c, lípidos, enzimas hepáticas, función renal y hemoglobina. Además esta consulta evalúa los perfiles psicológico, sexual y social del paciente, el tipo de trabajo, y permite detectar y controlar los FR coronario44,46.
Los componentes de las sesiones de EF son: etapa inicial de entrar en calor, calistenia o entrenamiento propiamente dicho y la etapa final para volver a la calma. Durante las primeras sesiones la primera y la última etapa suelen ser más prolongadas, duran de 10 a 20 minutos y se integran con ejercicios de estiramiento o flexibilidad e incluso con prácticas de yoga; la sesión de entrenamiento, al inicio, es más corta y dura aproximadamente 15 a 20 minutos. Todos los componentes se van incrementando progresivamente en el tiempo de duración, preferiblemente semanalmente, según la evolución de los pacientes durante las sesiones45,46.
En el entrenamiento se suele utilizar estera, bicicleta, remo, escalador, y se indican caminatas, trotes, natación y baile; mientras que se deben evitar deportes donde el paciente no pueda ser supervisado (buceo, alpinismo), así como los ejercicios físicos intensos en los casos de neuropatía autonómica y retinopatía proliferativa; y se debe mantener el mayor tiempo posible de ejercicio en el rango de la FC de entrenamiento44-46. El EF de resistencia se debe comenzar con ejercicios que envuelvan las mayores masas musculares, entre una a cuatro sesiones. Iniciar con la indicación de 8 a 10 repeticiones que sean suficientes para causar fatiga en las últimas tres, con el empleo del 50-69% del índice de contractilidad muscular máxima. Estos se pueden ir incrementando de forma consecutiva y progresiva durante el entrenamiento44-47.
No existe consenso en relación con la frecuencia ni la indicación de monitoreo de glucosa antes, durante o posterior a la sesión de EF; sin embargo, se conoce que es útil el control glucémico durante las primeras sesiones para conocer la respuesta glucémica al ejercicio, sobre todo en los diabéticos que utilizan insulina, y poder individualizar la actividad de cada paciente. En caso de que fuera necesario el control de la glucosa posterior al ejercicio, debe realizarse 15 minutos después. Es importante que los pacientes que usan insulina o hipoglucemiantes orales que pueden generar hipoglucemias, mantengan una glucemia previa al ejercicio mayor de 100 mg/dL46.
En pacientes con ECV establecida y alto riesgo coronario se usa la telemetría durante las sesiones de EF. Estas medidas garantizan la seguridad del entrenamiento en los diabéticos10,44,45. En general, las prescripciones del EF en pacientes con DM2 no difieren mucho de las características del EF indicado a la población general. A largo plazo, la duración y la frecuencia de las sesiones de EF parecen mejorar más el control glucémico que la intensidad y el tipo de ejercicio realizado44-46,54.
Es importante el tratamiento de todos los perfiles de la RCV en los pacientes con DM2, para lo cual se cuenta con el apoyo de los psicológos, nutriólogos y resto del equipo rehabilitador. La disfunción sexual eréctil afecta aproximadamente al 35-45% de los hombres con DM2. Se relaciona fundamentalmente con la edad avanzada, un control glucémico inadecuado, hábito tabáquico, la presencia de dislipidemia, hipertensión arterial y ECV asociada, factores psicológicos del individuo y fármacos prescritos. Existe evidencia sólida de que los inhibidores de la fosfodiesterasa 5 (sildenafilo, tadalafilo y vardenafilo) son fármacos de elección y muy eficaces para estos casos, fundamentalmente cuando se asocia a psicoterapia. Están contraindicados en los pacientes que toman nitratos para la angina44-46.
CONCLUSIONES
Los fármacos antidiabéticos y el tratamiento no farmacológico, basado en los cambios del estilo de vida y la rehabilitación cardiovascular, constituyen aspectos esenciales en la estrategia terapéutica de los pacientes con diabetes mellitus tipo 2. La rehabilitación cardiovascular incluye el control y tratamiento de perfiles esenciales como la prevención secundaria, el estado sexual, psicológico y socio-laboral del paciente, que garantizan mejorar su calidad de vida; así como la indicación adecuada de ejercicio físico, según sus principios y tipo de entrenamiento ideal en cada caso. Es una estrategia terapéutica eficaz en el tratamiento de esta enfermedad, con una visión integral y un enfoque multi e interdisciplinario.