Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cuban Journal of Agricultural Science
versión On-line ISSN 2079-3480
Cuban J. Agric. Sci. vol.51 no.4 Mayabeque oct.-dic. 2017
Ciencia Animal
Capacidad de crecimiento, actividad antimicrobiana y susceptibilidad a antimicrobianos de dos cepas de Pediococcus pentosaceus, candidatas a probiótico
1Instituto de Ciencia Animal, Apartado Postal 24, San José de las Lajas, Mayabeque, Cuba
2Facultad de Veterinaria, Universidad de Zaragoza, Zaragoza, España
3Instituto de Ciência Biológica (ICB), Universidade Federal de Minas Gerais (UFMG), Belo Horzote, Minas Gerais, Brasil
El objetivo de este trabajo fue evaluar la capacidad de crecimiento, actividad antimicrobiana y susceptibilidad a antimicrobianos de dos cepas de Pediococcus pentosaceus (LB-12 y LB-25) candidatas a probiótico. Se realizaron cuatro ensayos con diseños aleatorizados y tres repeticiones. El crecimiento de las cepas en caldo MRS a 37 ºC tuvo un comportamiento similar y a partir de las 6 h de cultivo alcanzaron la fase estacionaria. Sus velocidades de crecimiento fueron aproximadamente de 0.5 h-1 y los tiempos de duplicación de 1,3 h. Ambas fueron capaces de crecer y disminuir el pH de un medio de cultivo donde se empleó fructanos de Agave fourcroydes como fuente energética, aunque su concentración disminuyó con respecto al medio MRS. También, las cepas inhibieron el crecimiento de las bacterias patógenas evaluadas, con mayor acción antimicrobiana de LB-25 frente Salmonella enterica subsp. enterica serovar Typhimurium ATCC 14028 y Listeria monocytogenes ATCC 1531. Las candidatas a probiótico fueron sensibles a penicilina G, florfenicol, cloranfenicol, amoxicilina ácido clavulánico y doxiciclina. A su vez, fueron resistentes al trimetoprina-sulfametoxazol, cefalexina, tetraciclina, vancomicina, ácido nalidíxico, ácido oxalínico, enrofloxacina y flumequine, estreptomicina, kanamicina y gentamicina. Se concluye que P. pentosaceus LB-12 y LB-25, in vitro, ejercen actividad antimicrobiana contra patógenos, son susceptibles a antimicrobianos y poseen adecuada capacidad de crecimiento en medio MRS y cuando se emplean fructanos como fuente energética, lo que posibilitaría su inclusión en formulaciones probióticas y simbióticas para la producción animal.
Palabras-clave: bacterias lácticas; aditivos; crecimiento microbiano
Las bacterias ácido lácticas, fundamentalmente las del género Lactobacillus, se encuentran entre los microorganismos que más se estudian y utilizan como candidatos probióticos o se incluyen en productos probióticos y alimentos funcionales (Saura-Calixto y Goñi 2005 y Boyle et al. 2006). También se emplean cepas de Streptococcus, Enterococcus, Pediococcus, Leuconostoc, Bacillus, Bifidobacterium, Propionibacterium, Escherichia coli (cepas no patógenas), Aspergillus y levaduras (Bajagai et al. 2016).
García-Hernández et al. (2016) aislaron, identificaron y caracterizaron bacterias lácticas, de origen aviar, como candidatas a probiótico. Estos autores encontraron que Lactobacillus pentosus LB-31 fue la cepa más promisoria y evaluaron sus potencialidades en un ensayo con pollos de ceba. Sin embargo, otras cepas identificadas en el estudio, como Pediococcus pentosaceus (LB-12 y LB-25), se pudieran evaluar o incluir en probióticos multiespecies, que potencien los efectos benéficos de cultivos de cepas individuales, así como en formulaciones simbióticas (Bomba et al. 2002 y Bajagai et al. 2016).
Las bacterias del género Pediococcus se presentan en forma de cocos (tétradas) y son anaerobias Gram positivas, no móviles, no esporuladas, catalasa negativa y facultativas (Porto et al. 2017). Según estos autores, Pediococcus pentosaceus y Pediococcus acidilactici son las principales especies utilizadas en suplementos probióticos para animales y humanos, así como en la producción de bacteriocinas (pediocina) e inóculo en los procesos fermentativos para evitar contaminaciones. No obstante, para ser considerados como probióticos deben cumplir con los requisitos publicados por FAO y WHO (2002), así como demostrar su eficacia, que depende de la cepa o cepas que se empleen, entre otros factores (Yang et al. 2009 y Endo y Gueimonde 2016).
Entre las características in vitro que se evalúan, generalmente, para seleccionar cepas probióticas se encuentran la tolerancia a bajos pH, altas concentraciones de sales biliares, capacidad de crecimiento de los candidatos, actividad antimicrobiana y susceptibilidad a antimicrobianos. La determinación de estas últimas características constituye el objetivo de este trabajo al estudiar dos cepas de Pediococcus pentosaceus (LB-12 y LB-25) y evaluar su capacidad de crecimiento con la utilización de fructanos de Agave fourcroydes (García-Curbelo et al. 2015a, 2015b) como fuente de energía en un medio de cultivo, que posibilitaría la generación de futuros simbióticos.
Materiales y Métodos
Se realizaron cuatro ensayos para estudiar la dinámica de crecimiento de las cepas de bacterias lácticas en el medio MRS (Man, Rogosa y Sharpe), su capacidad de crecimiento en presencia de fructanos de Agave fourcroydes (FRUCTOICA) como fuente energética del medio de cultivo y su actividad antimicrobiana y susceptibilidad a antimicrobianos.
Características de las bacterias. Las cepas utilizadas fueron Pediococcus pentosaceus LB-12 y LB-25, de origen aviar, pertenecientes al Banco de Microorganismos para la Producción Animal (BAMIPA) del Instituto de Ciencia Animal (Mayabeque, Cuba). Estas cepas se identificaron por secuenciación del gen 16S ARN ribosomal y sus secuencias se encuentran depositadas en el GenBank (números de acceso: FR717460 y FR717465). Además, se caracterizaron previamente como candidatas a probiótico según su capacidad de crecimiento a las 24 h, producción de ácido láctico y tolerancia a pH ácidos y altas concentraciones de sales biliares (García-Hernández et al. 2016). En este estudio, ambas cepas de bacterias lácticas, conservadas en caldo MRS con glicerol al 15 % (v/v) y congelación a -80 ºC, se activaron con dos sub-cultivos en caldo MRS (Oxoid,UK) a 37 ºC de 18-24 h. A partir del cultivo activo, se preparó una suspensión de cada cepa (LB-12 y LB-25) en caldo MRS (pH 6.20±0.2) con densidad óptica (DO) a 600 nm de 0.125 equivalente a 107 ufc•mL-1. La concentración de los inóculos se comprobó mediante la siembra en placas de agar MRS (Oxoid, UK).
Dinámica de crecimiento de P. pentosaceus en medio MRS. Se inocularon 20 µL de cada suspensión en celdas de una microplaca, que contenían caldo MRS (1/10, v/v). El crecimiento se monitoreó en un Microplate Spectrophotometer System SpectraMax 340 (Molecular Devices, USA). Cada celda se consideró una unidad experimental. La densidad óptica (DO) a 600 nm se midió cada 30 min. por 12 h de incubación a 37 ºC. Se constató el no cumplimiento del supuesto de normalidad por la dócima Shapiro y Wilk (1965) para esta variable, cuya distribución se ajustó a la Gamma. Por esto se empleó un modelo lineal generalizado mixto mediante el procedimiento GLIMMIX del paquete estadístico SAS version 9.3 (SAS Institute Inc. 2013) y función de enlace Log para el análisis de varianza según diseño con medidas repetidas en el tiempo. El modelo consideró el tiempo como efecto fijo, el intercepto como aleatorio y las repeticiones como “subject”. La estructura de varianza-covarianza de mejor ajuste fue la de componentes de la varianza (CV). Se utilizó para la comparación de medias a P < 0.05 la dócima de rango fijo Tukey- Kramer (Kramer 1956). A partir de los resultados de DO en la fase exponencial del cultivo, en cada repetición, se calculó el ln DO. Con estos valores se determinaron las velocidades máximas de crecimiento de las cepas por regresión lineal y se calculó el tiempo de duplicación (td) según la ecuación t_(d )=ln2/μ (Prescott et al. 2003). A estos datos se les determinaron los estadígrafos media y desviación estándar.
Crecimiento de P. pentosaceus en un medio de cultivo con FRUCTOICA como fuente energética. Se utilizó un diseño completamente aleatoriazado con arreglo factorial 2 x 2 y tres repeticiones por tratamiento. Los factores fueron las cepas lácticas (LB-12 y B-25) y los medios de cultivo (2). Se utilizó caldo MRS (Oxoid, UK, pH 6.31 ± 0.02) como medio de cultivo control y caldo MRS. Se sustituyó la glucosa por el prebiótico FRUCTOICA (pH 5.74 ± 0.02). Este se esterilizó por filtración y se adicionó posterior a la esterilización de los medios de cultivo, a concentración de 20 g•L-1. Como unidades experimentales se utilizaron tubos con los medios de cultivo según los tratamientos experimentales. Estos se inocularon con las suspensiones bacterianas a razón de 1/10 (v/v) para obtener una concentración inicial de 106 ufc•mL-1, que se comprobó mediante la siembra en placas de agar MRS. Los tubos se incubaron a 37 ºC durante 24 h. Después de este tiempo, se tomó 1 mL de cada repetición para determinar la capacidad de crecimiento (ufc•mL-1) y se midió el pH del cultivo restante en pHmetro digital Sartorius Profesional Meter-PP-25 (precisión ± 0.01 unidades). La concentración de microorganismos viables (ufc•mL-1) se determinó por conteo visual de colonias en agar MRS. Para esto, las muestras se diluyeron de forma seriada en solución salina (0.85 %, p/v) y se sembraron en placas de agar MRS, que posteriormente se incubaron a 37 ºC de 24 a 72 h.
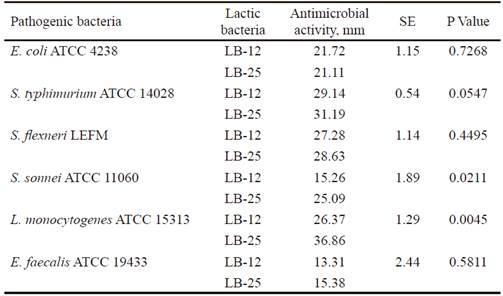
Actividad antimicrobiana. La actividad antimicrobiana de las bacterias lácticas (productoras) se determinó por triplicado, según el método de doble capa (Tagg et al. 1976). Se utilizaron como indicadoras las bacterias patógenas Salmonella enterica subsp. enterica serovar Typhimurium ATCC 14028, Shigella sonnei ATCC 11060, Escherichia coli ATCC 4238, Enterococcus faecalis ATCC 19433, Listeria monocytogenes ATCC 15313 y Shigella flexneri (aislado clínico perteneciente a LEFM/ICB/UFMG). Para el ensayo, se depositaron 5 µL de cada cultivo activo en placas de agar MRS y se incubaron a 37 ºC por 24 h. Después de la incubación, las bacterias productoras se expusieron a cloroformo por 20-30 min. El cloroformo residual se dejó evaporar y las placas se cubrieron con los cultivos patógenos. Estas bacterias indicadoras, también, se activaron con dos subcultivos en 5 mL de caldo BHI (Brain Heart Infusion, Oxoid, UK), incubados a 37 ºC por 24 h. Se adicionaron 10 µL de los cultivos patógenos en tubos con 3,5 mL de BHI semisólido (0,75 % de agar, p/v), se homogenizaron y se vertieron en las placas tratadas con cloroformo. Después de su solidificación, las placas se incubaron a 37 ºC por 24 h y se observó la presencia o no de halos de inhibición. Los halos de inhibición indicaron la actividad antimicrobiana de las cepas y su lectura se realizó con un pie de rey digital (Mitutoyo Corporation, Kawasaki, Japón). Al valor de los halos se le restó el diámetro del cultivo de las bacterias y se determinaron las diferencias entre medias.
Los datos del crecimiento microbiano en un medio con FRUCTOICA y del ensayo de actividad antimicrobiana se procesaron con el paquete estadístico InfoStat versión 2012 (Di Rienzo et al. 2012). La dócima de comparación múltiple de Duncan (1955) y la t-student se utilizaron, en los casos necesarios, para discriminar diferencias entre medias a P ˂ 0.05. En el caso de los conteos de microorganismos, los datos no siguieron la distribución normal por lo que se transformaron según logX.
Susceptibilidad a antimicrobianos. La susceptibilidad se determinó por el método de difusión en agar con el uso de discos de antimicrobianos, según la guía del Clinical and Laboratory Standards Institute (CLSI 2012). Se evaluaron los antimicrobianos Ampicilina (10 μg), Cloranfenicol (30 μg), Clindamicina (2 μg), Eritromicina (15 μg), Gentamicina (10 μg), Kanamicina (30 μg), Ácido Nalidíxico (30 μg), Estreptomicina (10 μg), Tetraciclina (30 μg), Trimetoprim-sulfametoxazol (1,25/23,75 μg) y Vancomicina (30 μg), que se seleccionaron de acuerdo con las recomendaciones de European Food Safety Authority (FEEDAP 2012). Las cepas activas se cultivaron en caldo MRS incubados a 37 ºC de 18 a 24 h. El ensayo se realizó por duplicado y otras bacterias lácticas de los géneros Lactococcus y Lactobacillus, aisladas y caracterizadas previamente se utilizaron como controles (Pérez-Sánchez et al. 2011 y García-Hernández et al. 2016). La presencia o ausencia de halos de inhibición se consideró como sensibilidad o resistencia, respectivamente.
Resultados y Discusión
Las dinámicas de crecimiento de P. pentosaceus (LB-12 y LB-25) en caldo MRS a 37 ºC se muestran en la figura 1. Ambas cepas tuvieron un comportamiento similar y al parecer sus fases de adaptación son inferiores a 0.5 h. A partir de este tiempo hasta aproximadamente las 4.0 h se observó la fase exponencial, posteriormente una fase de desaceleración y después de las 6 h de cultivo alcanzaron la fase estacionaria. Las características del crecimiento de las bacterias se presentan en la tabla 1. Las velocidades máximas de crecimiento de las cepas fueron de 0.5 h-1 y los tiempos de duplicación de 1.3 h, lo que está en correspondencia con lo informado para las bacterias lácticas (Schepers et al. 2002).
Table 1 Growth characteristics of strains LB-12 and LB-25 in MRS medium at 37 ºC.
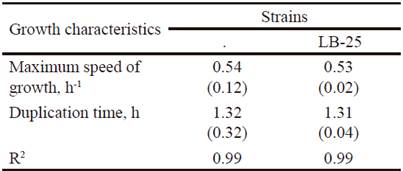
( ) Standard deviation values
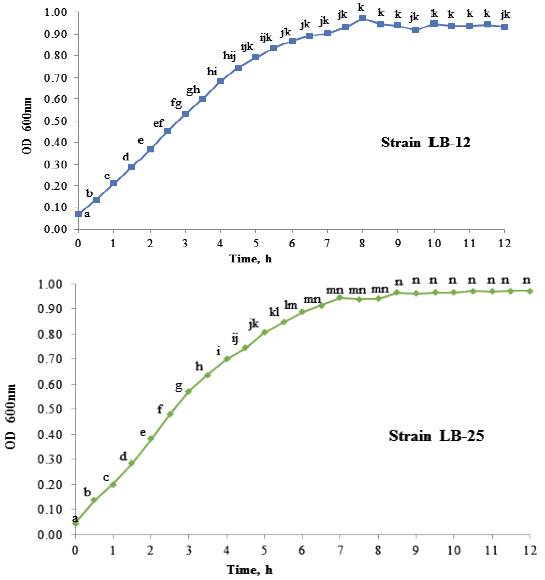 a,b,c,d,e,f,g,h,i,j,k,l,m,n Means with different letters in each time differ at P < 0.05 (Kramer 1956)
a,b,c,d,e,f,g,h,i,j,k,l,m,n Means with different letters in each time differ at P < 0.05 (Kramer 1956)Figure 1 Growth dynamics of P. pentosaceus, strains LB-12 (A) and LB-25 (B), in MRS medium at 37 ºC.
En la tabla 2 se presenta la concentración microbiana y los valores de pH a las 24 h de fermentación a 37 ºC en los medios MRS y MRS con FRUCTOICA (MRS-F) como fuente energética. Hubo interacción para estos dos indicadores y se observa que las dos cepas crecieron en el medio de cultivo donde se sustituyó la glucosa por fructanos de A. fourcroydes hasta concentraciones de 107 y 108 ufc•mL-1, con valores inferiores al control. La menor concentración se obtuvo para la cepa LB-25 en el medio con fructanos. Al parecer ambas cepas son capaces de sintetizar el complejo enzimático fructosiltransferasa, lo que le permite utilizar la fuente energética, aunque presentaron comportamientos diferentes en presencia de los fructanos. Estas variaciones pudieran estar asociadas a las características fisiológicas de cada cepa en estudio a pesar de ser de la misma especie microbiana. Además, se debe tener en cuenta que estos fructanos tienen estructuras complejas (García-Curbelo et al. 2015b) que son más difíciles de degradar, por lo que quizás los pediococos necesitarían mejores condiciones de fermentación para alcanzar los resultados obtenidos con el medio control, especialmente la cepa LB-25. Estos aspectos se deben corroborar en estudios posteriores.
Table 2 Microbial concentration and pH values at 24 h of fermentation at 37 ºC in MRS medium and MRS with FRUCTOICA (MRS-F)
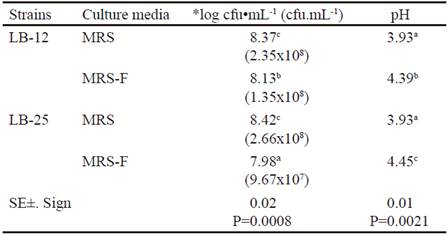
a,b,c,d Means with different letters in each column differ at P < 0.05 (Duncan 1955) *Data were transformed according to log10 (X) because they do not follow a normal distribution
( ) means of the colony forming units per milliliters (cfu•mL-1)
En la tabla 2 se observa que ambas cepas de Pediococcus disminuyeron en más de dos unidades el pH del caldo MRS, sin diferencias entre cepas. Sin embargo, en el medio con fructanos la disminución fue menor, a pesar de que el valor de pH de este medio antes de la inoculación (5.74 ± 0.02) era inferior al medio control (6.31 ± 0.02). Este comportamiento dependió de la cepa, pues LB-25 varió menos el pH, lo que debe estar relacionado con su capacidad de crecimiento en este medio con fructanos y la concentración de metabolitos de la fermentación. Además, se conoce que el perfil metabólico de las bacterias ácido lácticas puede variar cuando se emplean diferentes fuentes de nutrientes o condiciones de cultivo (Papagianni 2012).
No obstante a lo anterior, se debe resaltar que el hecho de que ambos Pediococcus crezcan y produzcan metabolitos de interés, cuando se empleen los fructanos de A. fourcroydes, se posibilitaría su inclusión en formulaciones simbióticas. A su vez, los simbióticos al adicionarlos en la dieta pueden ejercer efectos sinérgicos al mejorar la supervivencia, implantación y persistencia de los candidatos probióticos en el tracto gastrointestinal (Anadón et al. 2016) y, consecuentemente, disminuir las poblaciones de patógenos.
La actividad inhibitoria de las cepas candidatas a probióticos desempeña una función importante en la competencia con otros microorganismos en el tracto gastrointestinal para su protección frente a patógenos (Abbasiliasi et al. 2017). En la tabla 3 se muestra que P. pentosaceus (LB-12 y LB-25) inhibió el crecimiento de las poblaciones de las bacterias patógenas empleadas como indicadoras (E. coli, S. enterica subsp. enterica serovar Typhimurium, S. flexneri, E. faecalis S. sonnei y L. monocytogenes). La actividad frente a estos dos últimos patógenos difirió entre cepas y fue mayor con LB-25. En todos los casos, excepto para LB-12 frente E. faecalis, los halos de inhibición fueron mayores a 15 mm. Los resultados indican que la inhibición o supresión de microorganismos patógenos podría ser uno de los mecanismos de acción de las candidatas en estudio. Esto, a su vez, pudiera estar relacionado con su capacidad para producir ácido láctico (13,35 y 11,83 g•L-1, respectivamente), previamente determinada por García-Hernández et al. (2016), lo que consecuentemente contribuiría a la mejora de la salud intestinal del hospedero. Además, se conoce que varias cepas de esta especie producen sustancias antimicrobianas que pudieran inhibir el crecimiento de las bacterias patógenas (Martino et al. 2013 y Yasutake et al. 2016). Este tema será objeto de investigaciones futuras con las cepas LB-12 y LB-25.
Las bacterias candidatas a probiótico fueron sensibles a penicilina G, florfenicol, cloranfenicol, amoxicilina ácido clavulánico y doxiciclina. A su vez, fueron resistentes al Trimetoprina-Sulfametoxazol, Cefalexina, Tetraciclina, Vancomicina y a los antibióticos evaluados del grupo de las quinolonas (Acido nalidíxico, Acido oxalínico, Enrofloxacina y Flumequine) y los aminoglucósidos (Estreptomicina, Kanamicina y Gentamicina). Este estudio se considera de gran importancia según Ocaña et al. (2006) y se recomienda ampliarlo para hallar genes de resistencia (FAO y WHO 2002). Además, debido a la importancia de garantizar la seguridad del uso de cepas de Pediococcus en formulaciones probióticas se deben realizar investigacones que demuestren su estatus de inocuidad, ausencia de resistencia a antibióticos adquirida y factores de virulencia, así como la viabilidad celular en los productos (Porto et al. 2017). Estos aspectos también se tendrán en cuenta en investigaciones posteriores.
Se concluye que las cepas P. pentosaceus (LB-12 y LB-25) presentan, in vitro, potencialidades como candidatas a probiótico para su uso en formulaciones probióticas y simbióticas destinadas a la producción animal.
Agradecimientos
Se agradece el financiamiento del Ministerio de Ciencia, Tecnología y Medio Ambiente (CITMA) y Ministerio de Educación Superior (MES) de Cuba. También a la Agencia Española de Cooperación Internacional para el Desarrollo (AECID) y a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES No. 664/2008). Se expresa gratitud a la asistencia técnica de Nereyda Albelo, Odalys Núñez y MC Uriel y la colaboración del Grupo de Matemática del ICA en el procesamiento de los datos experimentales.
REFERENCIAS
Abbasiliasi, S., Tan, J. S., Bashokouh, F., Ibrahim, T. A. T., Mustafa, S., Vakhshiteh, F., Sivasamboo, S. & Ariff, A. B. 2017. “In vitro assessment of Pediococcus acidilactici Kp10 for its potential use in the food industry”. BMC Microbiology, 17: 121-131, ISSN: 1471-2180, DOI: 10.1186/s12866-017-1000-z, Available: Available: https://doi.org/10.1186/s12866-017-1000-z , [Consulted: January 15, 2018]. [ Links ]
Anadón, A., Martínez-Larrañaga, M. R., Arés, I. & Martínez, M. A. 2016. “Prebiotics and Probiotics: An Assessment of Their Safety and Health Benefits”. In: Watson, R. R. & Preedy, V. R. (eds.), Probiotics, Prebiotics, and Synbiotics, Academic Press, pp. 3-23, ISBN: 978-0-12-802189-7, DOI: 10.1016/B978-0-12-802189-7.00001-0, Available: Available: https://www.sciencedirect.com/science/article/pii/B9780128021897000010 , [Consulted: January 15, 2018]. [ Links ]
Bajagai, Y. S., Klieve, A. V., Dart, P. J. & Bryden, W. L. 2016. Probiotics in animal nutrition - Production, impact and regulation. Makkar, H. P. S. (ed.), Rome, Italy: FAO, 179 p., ISBN: 978-92-5-109333-7, Available: Available: http://www.fao.org/3/a-i5933e.pdf , [Consulted: January 15, 2018]. [ Links ]
Bomba, A., Nemcová, R., Mudroňová, D. & Guba, P. 2002. “The possibilities of potentiating the efficacy of probiotics”. Trends in Food Science & Technology, 13(4): 121-126, ISSN: 0924-2244, DOI: 10.1016/S0924-2244(02)00129-2, Available: Available: http://www.sciencedirect.com/science/article/pii/ S0924224402001292 , [Consulted: January 15, 2018]. [ Links ]
Boyle, R. J., Robins-Browne, R. M. & Tang, M. L. 2006. “Probiotic use in clinical practice: what are the risks?”. The American Journal of Clinical Nutrition, 83(6): 1256-1264, ISSN: 0002-9165, 1938-3207, Available: Available: http://ajcn.nutrition.org/content/83/6/1256 , [Consulted: January 15, 2018]. [ Links ]
CLSI (Clinical and Laboratory Standards Institute) 2012. Performance standards for antimicrobial susceptibility testing. Twenty-Second Informational Supplement. (ser. CLSI Document, no. ser. M100- MS19), Wayne, PA: CLSI, Available: Available: http://www.facm.ucl.ac.be/intranet/CLSI/CLSI-M100S22- susceptibility%20testing-2012-original.pdf , [Consulted: January 15, 2018]. [ Links ]
Di Rienzo, J. A., Balzarini, M. G., Casanoves, F., González, L. & Robledo, C. W. 2012. InfoStat. Version 2012, [Windows], Córdoba, Argentina: Grupo InfoStat, Available: http://www.infostat.com.ar/ . [ Links ]
Duncan, D. B. 1955. “Multiple Range and Multiple F Tests”. Biometrics, 11(1): 1-42, ISSN: 0006-341X, DOI: 10.2307/3001478, Available: Available: http://www.jstor.org/stable/3001478 , [Consulted: April 4, 2015]. [ Links ]
Endo, A. & Gueimonde, M. 2016. “Isolation, identification and characterisation of potential new probiotics”. In: Foerst, P. & Santivarangkna, C. (eds.), Advances in Probiotic Technology, Boca Raton, FL, USA: CRC Press, pp. 3-25, ISBN: 978-1-4987-3453-0. [ Links ]
FAO (Food and Agriculture Organization of the United Nations) & WHO (World Health Organization) 2002. Guidelines for the Evaluation of Probiotics in Food. Ontario, Canada: FAO - WHO, 11 p., Available: Available: http://www.who.int/foodsafety/fs_management/en/probiotic_guidelines.pdf , [Consulted: January 25, 2009]. [ Links ]
FEEDAP (EFSA Panel on Additives and Products or Substances used in Animal Feed) 2012. “Guidance on the assessment of bacterial susceptibility to antimicrobials of human and veterinary importance”. EFSA Journal, 10(6): 1-10, ISSN: 1831-4732, Available: Available: http://www.efsa.europa.eu/sites/default/files/consultation/120323.pdf , [Consulted: January 15, 2018]. [ Links ]
García-Curbelo, Y., Bocourt, R., Savón, L. L., García-Vieyra, M. I. & López, M. G. 2015a. “Prebiotic effect of Agave fourcroydes fructans: an animal model”. Food & Function, 6(9): 3177-3182, ISSN: 2042-650X, DOI: 10.1039/C5FO00653H, Available: Available: http://pubs.rsc.org/en/content/articlelanding/2015/fo/c5fo00653h , [Consulted: January 15, 2018]. [ Links ]
García-Curbelo, Y., López, M. G., Bocourt, R., Collado, E., Albelo, N. & Nuñez, O. 2015b. “Structural characterization of fructans from Agave fourcroydes (Lem.) with potential as prebiotic”. Cuban Journal of Agricultural Science, 49(1): 75-80, ISSN: 2079-3480, Available: Available: http://www.cjascience.com/index. php/CJAS/article/view/551 , [Consulted: January 15, 2018]. [ Links ]
García-Hernández, Y., Pérez-Sánchez, T., Boucourt, R., Balcázar, J. L., Nicoli, J. R., Moreira-Silva, J., Rodríguez, Z., Fuertes, H., Nuñez, O., Albelo, N. & Halaihel, N. 2016. “Isolation, characterization and evaluation of probiotic lactic acid bacteria for potential use in animal production”. Research in Veterinary Science, 108: 125-132, ISSN: 0034-5288, DOI: 10.1016/j.rvsc.2016.08.009, Available: Available: http://www.sciencedirect.com/science/article/pii/S0034528816302211 , [Consulted: January 15, 2018]. [ Links ]
Kramer, C. Y. 1956. “Extension of Multiple Range Tests to Group Means with Unequal Numbers of Replications”. Biometrics , 12(3): 307-310, ISSN: 0006-341X, DOI: 10.2307/3001469, Available: Available: http://www.jstor.org/stable/3001469 , [Consulted: December 24, 2017]. [ Links ]
Martino, M. E., Maifreni, M., Marino, M., Bartolomeoli, I., Carraro, L., Fasolato, L. & Cardazzo, B. 2013. “Genotypic and phenotypic diversity of Pediococcus pentosaceus strains isolated from food matrices and characterisation of the penocin operon”. Antonie van Leeuwenhoek, 103(5): 1149-1163, ISSN: 0003-6072, 1572-9699, DOI: 10.1007/s10482-013-9897-1, Available: Available: https://link.springer.com/article/10.1007/s10482-013-9897-1 , [Consulted: January 15, 2018]. [ Links ]
Ocaña, V., Silva, C. & Nader-Macías, M. E. 2006. “Antibiotic Susceptibility of Potentially Probiotic Vaginal Lactobacilli”. Infectious Diseases in Obstetrics and Gynecology, 2006: 1-6, ISSN: 1064-7449, 1098-0997, DOI: 10.1155/IDOG/2006/18182, Available: Available: http://www.hindawi.com/journals/idog/2006/018182/abs/ , [Consulted: January 15, 2018]. [ Links ]
Papagianni, M. 2012. “Metabolic engineering of lactic acid bacteria for the production of industrially important compounds”. Computational and Structural Biotechnology Journal, 3(4): e201210003, ISSN: 2001-0370, DOI: 10.5936/csbj.201210003, Available: Available: http://linkinghub.elsevier.com/retrieve/pii/S2001037014600593 , [Consulted: January 15, 2018]. [ Links ]
Pérez-Sánchez, T., Balcázar, J. L., García, Y., Halaihel, N., Vendrell, D., de Blas, I., Merrifield, D. L. & Ruiz-Zarzuela, I. 2011. “Identification and characterization of lactic acid bacteria isolated from rainbow trout, Oncorhynchus mykiss (Walbaum), with inhibitory activity against Lactococcus garvieae”. Journal of Fish Diseases, 34(7): 499-507, ISSN: 1365-2761, DOI: 10.1111/j.1365-2761.2011.01260.x, Available: Available: http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2761.2011.01260.x/abstract , [Consulted: January 15, 2018]. [ Links ]
Porto, M. C. W., Kuniyoshi, T. M., Azevedo, P. O. S., Vitolo, M. & Oliveira, R. P. S. 2017. “Pediococcus spp.: An important genus of lactic acid bacteria and pediocin producers”. Biotechnology Advances, 35(3): 361-374, ISSN: 0734-9750, DOI: 10.1016/j.biotechadv.2017.03.004, Available: Available: http://www.sciencedirect.com/science/article/pii/S0734975017300228 , [Consulted: January 15, 2018]. [ Links ]
Prescott, L. M., Harley, J. P. & Klein, D. A. 2003. Microbiología. 4th ed., Madrid, España: McGraw-Hill, Interamericana, ISBN: 978-84-486-0261-1. [ Links ]
SAS Institute Inc. 2013. Statistical Analysis Software SAS/STAT®. version 9.1.3, Cary, N.C., USA, Available: http://www.sas.com/en_us/software/analytics/stat.html# . [ Links ]
Saura-Calixto, F. & Goñi, I. 2005. “Fibra dietética y antioxidantes en la dieta española y en alimentos funcionales”. In: Juárez, I. M., Olano, A. & Morais, F.-S. F., Alimentos funcionales, Madrid, España: Fundación Española para la Ciencia y la Tecnología, p. 310, ISBN: 978-84-689-4204-9. [ Links ]
Schepers, A., Thibault, J. & Lacroix, C. 2002. “Lactobacillus helveticus growth and lactic acid production during pH-controlled batch cultures in whey permeate/yeast extract medium. Part I. multiple factor kinetic analysis”. Enzyme and Microbial Technology, 30(2): 176-186, ISSN: 0141-0229, DOI: 10.1016/S0141-0229(01)00465-3, Available: Available: http://www.sciencedirect.com/science/article/pii/S0141022901004653 , [Consulted: January 15, 2018]. [ Links ]
Shapiro, S. S. & Wilk, M. B. 1965. “An Analysis of Variance Test for Normality (Complete Samples)”. Biometrika, 52(3/4): 591-611, ISSN: 0006-3444, DOI: 10.2307/2333709, Available: Available: http://www.jstor.org/stable/2333709 , [Consulted: January 15, 2018]. [ Links ]
Tagg, J. R., Dajani, A. S. & Wannamaker, L. W. 1976. “Bacteriocins of gram-positive bacteria”. Bacteriological Reviews, 40(3): 722-756, ISSN: 0005-3678, Available: Available: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC413978/ , [Consulted: January 15, 2018]. [ Links ]
Yang, Y., Iji, P. A. & Choct, M. 2009. “Dietary modulation of gut microflora in broiler chickens: a review of the role of six kinds of alternatives to in-feed antibiotics”. World´s Poultry Science Journal, 65(1): 97-114, ISSN: 1743-4777, 0043-9339, DOI: 10.1017/S0043933909000087, Available: Available: https://www.cambridge.org/core/journals/world-s-poultry-science-journal/article/dietary-modulation-of-gut-microflora-in-broiler-chickens-a-review-of-the-role-of-six-kinds-of-alternatives-to-in-feed- antibiotics/7B00044BC5510B50273DCD20ABE16661 , [Consulted: January 15, 2018]. [ Links ]
Yasutake, T., Kumagai, T., Inoue, A., Kobayashi, K., Noda, M., Orikawa, A., Matoba, Y. & Sugiyama, M. 2016. “Characterization of the LP28 strain-specific exopolysaccharide biosynthetic gene cluster found in the whole circular genome of Pediococcus pentosaceus”. Biochemistry and Biophysics Reports, 5: 266-271, ISSN: 2405-5808, DOI: 10.1016/j.bbrep.2016.01.004, Available: Available: http://www.sciencedirect.com/science/article/pii/S2405580816000054 , [Consulted: January 15, 2018]. [ Links ]
Recibido: 11 de Octubre de 2017; Aprobado: 03 de Febrero de 2018











 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI