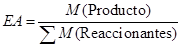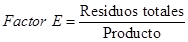INTRODUCCION
La contaminación por metales pesados ha venido en ascenso en las últimas décadas. Esto ocurre especialmente donde existe gran actividad industrial, tales como industrias sideromecánicas, minerías, fábricas de cemento y en general todas aquellas que sus residuales contengan iones metálicos, contribuyendo así, negativamente a la degradación de todos los ecosistemas. En nuestro país, fundamentalmente en la provincia Santiago de Cuba, se evidencia significativamente este hecho en las minas de “El Cobre” localizadas en el municipio cabecera, ya que debido a la misma explotación del subsuelo ha provocado la entrada de iones cobre (II) en aguas subterráneas, formándose, en teoría, la llamada Laguna Azul, cuyo color característico se puede deber potencialmente a la presencia de estos cationes. Los ríos y fuentes aledañas a la misma podrían estar contaminados, aun cuando existe un proceso de filtración y limpieza natural a través del manto freático, por lo que resulta importante monitorear los niveles de este catión. Un exceso de cobre en el organismo podría producir afecciones letales como la enfermedad de Wilson, de origen genético pero que se ve acentuada por una alimentación rica en este metal (Vallet, 2003), (Espinó, 2020)
Para conocer los niveles de contaminación en distintos receptores asociados a estas industrias, ya sean ríos, bahías, embalses, se emplean diversas técnicas de detección y/o cuantificación tales como Plasma de Inducción Acoplada (ICP), Absorción Atómica y Sensores Electrométricos, más conocidos como Electrodos Selectivos a Iones (ESI) (Arada, 2003). Todas estas técnicas resultan, en general, muy caras y no permiten tener un monitoreo constante de estos sitios contaminados debido al costo que los mismos requieren.
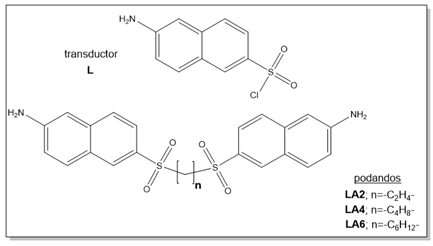
Otra alternativa para el reconocimiento e identificación de estos compuestos lo constituyen los kits de reconocimiento; los mismos son sensores (Hulanicki, Glab, Ingman, 1991) que permiten la detección de ciertos iones a través de reacciones con cambios de coloración apreciables, aparición o desaparición de fluorescencia o formación de un precipitado. Generalmente son reacciones que constituyen un método de identificación rápido, barato y sencillo, y que además se puede realizar tanto en el campo de estudio como en el laboratorio. Este procedimiento se puede aplicar para el monitoreo de la contaminación por metales pesados de cualquier cuerpo receptor, por lo que el grupo de investigación de “Compuestos Bioactivos y Química Sostenible” de la Facultad de Ciencias Naturales y Exactas de la Universidad de Oriente optó por diseñar y sintetizar nuevos sensores que pudieran constituir componentes principales de un kit de reconocimiento para este metal (Figura 1). Este diseño se basó en la estructura típica de sensores descrita en la literatura (Steed, 2009), que consta de un transductor y un receptor (Figura 2). El uso de sulfonamidas es debido a que las mismas reaccionan de manera evidente frente a iones Cu(II), lo que sumado a la forma bipodal diseñada resultaría un buen sensor.
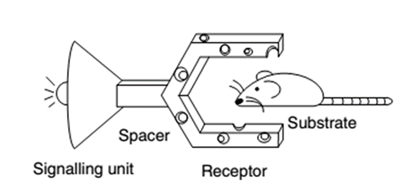
Fig. 2 Dibujo animado como modelo de sensor: transductor (unidad de señal) y receptor. (Extraído de Steed, 2009).
METODOLOGÍA
Técnicas de síntesis.
Las técnicas de síntesis de los ligandos y complejos sintetizados no se encontraban reportadas en la literatura, razón por la cual se elaboró un nuevo procedimiento, apoyado en las generalidades existentes en la misma acerca de la sulfonación de anillos aromáticos condensados y formación de sulfonamidas. La síntesis de cada uno de los podandos objeto de estudio, se llevó a cabo en dos etapas. En la primera se obtuvo el fragmento transductor, cloruro de 6-aminonaftaleno-2-sulfonilo (L); en la segunda etapa se acoplaron tres diaminas alifáticas diferentes, obteniéndose los compuestos sulfonamídicos (podandos) (ver figura 1).
Procedimiento de obtención del cloruro de 6-aminonaftaleno-2-sulfonilo (L).
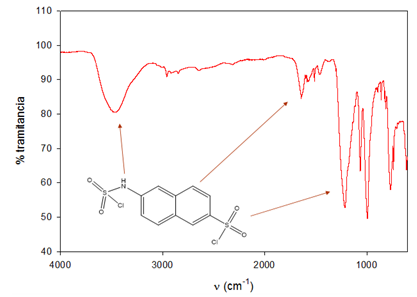
Se disuelven 10 g de naftilamina en 80mL de metanol, y se colocan en un embudo de adición y se añade gota a gota, con un intervalo de tiempo entre ellas de 30 segundos, a un balón con 9.5 mL de ácido clorosulfónico. Al cabo de 30 minutos se neutraliza con Na2CO3 (pH=8) y se extrae con acetato de etilo. Se obtienen dos compuestos con aspecto físico diferente (sólido blanco y sólido marrón) que son separados con 2-propanol debido a la solubilidad de uno de ellos en ese disolvente, con 15.75% y 83.33% de rendimiento respectivamente. Señales principales en FT-IR (expresados en cm-1): 3330-3250 עNH (asoc.), 3100 עCH (arom), 1305 עas SO2 ,1098 עs SO2. (Pretsch, 1998).
Procedimiento de obtención de las sulfonamidas bipodales.
LA2 (6,6'-(etilendisulfonil) bis(naftalen-2-amina))
En un balón se coloca una disolución de 1g de L2 disuelto en 60 mL de metanol. Se añaden 0.2 mL de etilendiamina disueltos en una disolución de NaOH al 10%. Se agita y calienta durante 20 minutos. Se concentra la disolución y se enfría hasta la aparición de un sólido. Se obtiene un sólido blanco con un 54.9% de rendimiento. Señales principales en FT-IR (expresados en cm-1): 3330-3270 עNH (asoc.), 3105 עCH (arom), 2928 עCH2, 1600-1489 δCH(arom), 1308 עas SO2 ,1088 עs SO2.
LA4 (6,6'-(butilendisulfonil) bis(naftalen-2-amina)).
En un balón se coloca una disolución de 1g de L2 disuelto en 60 mL de metanol. Se añaden 0.2 g de hidrocloruro de 1,4-butanodiamina disueltos en una disolución de NaOH al 10%. Se agita y calienta durante 20 minutos. Se concentra la disolución y se enfría hasta la aparición de un sólido. Se obtiene un sólido rosado con un 30.3% de rendimiento. Señales principales en FT-IR (expresados en cm-1): 3333-3260 עNH (asoc.), 3100 עCH (arom), 2923 עCH2, 1600-1489 δCH(arom), 1305 עas SO2 ,1098 עs SO2.
LA6 (6,6'-(hexametilendisulfonil) bis(naftalen-2-amina)).
En un balón se coloca una disolución de 1g de L2 disuelto en 60 mL de metanol. Se añaden 0.3 g de hexametilendiamina disueltos en una disolución de NaOH al 10%. Se agita y calienta durante 20 minutos. Se concentra la disolución y se enfría hasta la aparición de un sólido. Se obtiene un sólido de color blanco con partes de color marrón con un 44.2% de rendimiento. Señales principales en FT-IR (expresados en cm-1): 3329-3250 עNH (asoc.), 3103 עCH (arom), 2925 עCH2, 1600-1500 δCH(arom), 1305 עas SO2 ,1098 עs SO2.
Caracterización espectroscópica de las especies complejas.
Los espectros FT-IR se tomaron desde los 4000 hasta los 500 cm-1 en un equipo Shimadzu (Japón) del Centro de Estudios Avanzados de Cuba, utilizando ATR (Attenuated Total Reflectance) permitiendo el uso de las muestras en su estado original.
Los espectros UV-Visible fueron registrados desde 200 hasta 900 nm en un equipo UV-2601 marca GENESYS 10S UV-Vis usando soluciones de aproximadamente 10-3 mol·dm-3 de los compuestos de interés en los disolventes adecuados.
Determinación de constantes de estabilidad mediante titraciones potenciométricas.
Los estudios de estabilidad se llevaron a cabo mediante valoraciones potenciométricas empleando un Sistema Manual de Valoraciones. Este consta de varias partes esenciales: pH-metro MODEL PHSJ-3F y microbureta de 2 mL (± 0.02).
El estudio de equilibrio correspondiente a los ligandos LAX se realizó a 298 K en presencia de NaCl 0.1 mol·dm-3, con el Sistema Manual de Valoraciones Potenciométricas. Para ello, se realizaron valoraciones de los ligandos con NaOH (0.0986 mol·dm-3), partiendo de disoluciones ácidas (pH≈2). Luego se realizaron valoraciones de los ligandos con el ion Cu (II) en relación 1:1 (L:M) en presencia de NaCl 0.1 mol·dm-3.
Los valores de pH obtenidos para las distintas valoraciones se tomaron como datos de partida en el programa HYPERQUAD (Gans, 1996) para determinar las constantes de estabilidad de cada especie formada. En primer lugar, se ajustaron las constantes de protonación de los ligandos. Los valores obtenidos se mantuvieron fijos en el programa para el ajuste de las constantes de formación de los complejos de Cu (II). El programa HYSS se empleó para la construcción de los diagramas de distribución de especies, utilizando los datos de estabilidad obtenidos mediante el programa HYPERQUAD.
RESULTADOS Y DISCUSIÓN
Síntesis de los transductores y podandos: métricas relacionadas con la Química Verde.
La reacción de clorosulfonación de la β-naftilamina dio como resultado la obtención de un sólido marrón luego de filtrar la disolución. El líquido de color marrón del filtrado solidificó en el Kitasato. Este sólido tenía la peculiaridad de retener el disolvente, por lo que se procedió al lavado del mismo con 2-propanol. Para tener una idea de la presencia de los grupos funcionales esperados se registró el espectro IR del compuesto de color marrón, dando como resultado las señales que evidencian la presencia de grupos NH y el grupo clorosulfónico, así como de anillos aromáticos. Es importante destacar que no fue posible observar vibraciones de valencia de grupos NH2, lo que sugiere que éste ha reaccionado con un exceso de ácido clorosulfónico, quedando un transductor de estructura inesperada probablemente como se muestra en la (Figura 3). Para corroborar lo anterior se realizó la determinación de la masa molar por método crioscópico dando como resultado 342+5 g-mol-1, bastante distante a la esperada de 241.7 g-mol-1.
La tabla 1 muestra los parámetros relacionados con el rendimiento desde el punto de vista de la química sostenible. En este caso no solo se evalúa el rendimiento de la reacción, sino también se incluyen como métricas de la reacción: la economía atómica (EA), el factor E y la eficiencia de masa reaccionante (RME, del inglés Reaction Mass Efficiency) (Constable, 2002). Estos parámetros se calculan según las siguientes ecuaciones.
Tabla 1 Parámetros relacionados con el rendimiento y métricas de Química Sostenible para los ligandos LAX. (X = 2, 4, 6)

Nota: Mc, es masa molar determinada por método crioscópico. M*, masa molar calculada para los compuestos con los grupos aminos clorosulfonados.
Aunque el rendimiento de la obtención del transductor, cloruro de 6-aminonaftaleno-2-sulfonilo, es bajo (15.8 %), se considera que es una reacción viable a realizar y que debe optimizarse su procedimiento para aumentar su eficiencia, previa protección del grupo amino. Sin embargo, la reacción de acoplamiento de las diaminas seleccionadas para formar los podandos esperados superan todas el 44 % de rendimiento, mostrando a su vez una alta economía atómica (mayor a 87 %). Esto indica que la obtención de las sulfonamidas incorpora más de un 87 % de los átomos de los reaccionantes en el producto final, quedando solo como residual menos del 13 %. La Química Verde enfatiza que las reacciones de alta economía atómica son menos contaminantes (Albini, 2016). Sin embargo, es importante mirar la otra cara de la moneda, analizando cuántos residuales pueden producirse. Para ello se valora el Factor E, cuyo resultado sugiere que se forman aproximadamente 0.15 kg de residuales por cada kg de sulfonamida sintetizada, mientras que para el transductor L es mucho mayor la cantidad de subproductos (0.55 kg). El Rendimiento Másico Efectivo (RME) combina tanto la economía atómica como el rendimiento clásico de una reacción, mostrándose también los mejores valores para la obtención de los podandos.
De manera semejante al transductor, se procedió a utilizar la herramienta de la masa molar por método crioscópico para tener una idea más cercana de lo obtenido luego del acoplamiento con las aminas. Los resultados arrojan que la masa molar de los productos corresponde a compuestos que contienen, presumiblemente, grupos clorosulfónicos en las aminas (Tabla 1). No obstante, los resultados de FT-IR indican la presencia de grupos CH2 alifáticos en las estructuras de los podandos. (Pretsch, 1998).
Estudio de protonación de los ligandos LAX (X=2, 4, 6).
Se realizaron las valoraciones potenciométricas de los ligandos LAX (X = 2, 4, 6), obteniéndose una serie de pares de datos correspondientes a volumen de agente valorante (en mL) vs pH, y los cuales fueron procesados en el software profesional HYPERQUAD, conocidas los moles de ligando valorados, logrado las constantes de protonación expresadas en logaritmos que muestra la Tabla 2.
Tabla 2 Logaritmos de las constantes de protonación de los ligandos LAX (X = 2, 4, 6) en NaCl 0.1 mol·dm-3 a 298 K.

Nota: los valores entre paréntesis indican la cifra significativa en la que se encuentra la desviación estándar.
Los ligandos LA2 y LA6 presentan un comportamiento semejante, y a la vez, muy diferente al ligando LA4. En este último solo se ha detectado la constante acumulativa relacionada con la cuarta protonación, debido a que este precipita al acercarse el medio a pH = 6 lo que no permite continuar con el experimento. De esta forma es difícil encontrar mediante titraciones potenciométricas, los valores correspondientes a las protonaciones anteriores. No obstante, el valor de la constante acumulativa de la especie LH4 del ligando LA4 es semejante a los encontrados para sus homólogos.
En el Esquema 2 se muestran los sitios donde ocurrirá la protonación con mayor probabilidad. La estructura del ligando se puede asociar a una simetría C2, que divide la molécula imaginariamente en dos partes iguales, pero existen interacciones intramoleculares que permiten que esta adopte probablemente forma de U (o forma de sección espiral, semejante al ADN) gracias al espaciador flexible que posee, algo descrito por Becerril y colaboradores (2003), permitiendo que la primera y segunda protonaciones se puedan diferenciar y tengan distintos valores de Log K. Sin embargo, la especie LH2 al estar protonada en sus extremos estaría presumiblemente estirada quedando la molécula dividida en dos fragmentos con igual entorno electrónico, sin interacciones intramoleculares. Esto permite la entrada simultánea, observada en otras ocasiones (Salinas, 2014), de dos protones obteniéndose solamente el valor de la constante de la especie LH4 a partir de la LH2. (Tabla 2)
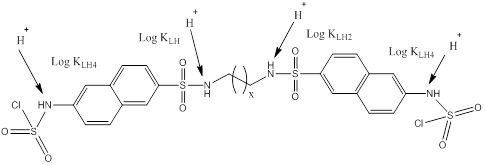
Esquema 2 Posibles sitios de protonación de los ligandos LAX. Protonaciones simultáneas en los ligandos LA2 y LA6.
Svobodobá y colaboradores (2009) encontraron dos casos de disociaciones simultáneas de dos protones tal como ocurre en este caso. En otros estudios de estabilidad realizados por el grupo de “Compuestos Bioactivos y Química Sostenible” de la Universidad de Oriente, se han encontrado también este tipo de protonaciones, pero en tiosemicarbazonas (Salinas, 2014). Esta hipótesis se puede verificar mediante un experimento de Resonancia Magnética Nuclear de Protones (Martí, 2012).
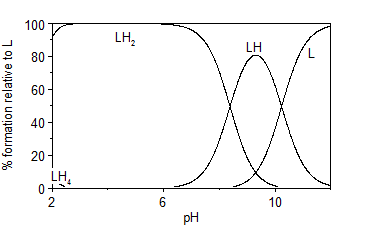
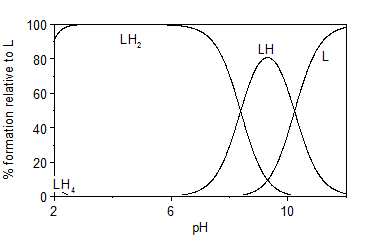
En las figuras 4 y 5 se representan los diagramas de distribución de especies correspondientes a las protonaciones de los ligando LA2 y LA6, construidos a partir de los valores de las constantes acumulativas determinadas. En los mismos es posible observar la existencia del ligando libre a valores de pH>10, indicando su naturaleza básica. A valores de pH entre 2 y 6 aparece la especie LH2 en mayor proporción, con una abundancia relativa de 100 %. Para ambos ligandos es posible notar la desprotonación de dos grupos funcionales a partir de pH = 2.5 (probablemente los grupos sulfonamida) donde desaparece la especie LH4 que permitiría la formación de complejos inclusive en medio ácido.
Estudio de formación de complejos de los ligandos LAX con el ion Cu2+ en disolución en relación molar 1:1.
Una vez determinadas las constantes de protonación de los ligandos, se procedió a la determinación de las constantes de equilibrio de las especies complejas formadas entre el ion Cu (II) y los ligandos a partir del análisis de valoraciones potenciométricas de disoluciones que contenían al metal y al ligando en relaciones molares 1:1 a 298 K en presencia de NaCl 0.1 mol·dm-3. Este procedimiento también se realizó haciendo uso del programa HYPERQUAD mencionado anteriormente.
Teniendo en cuenta el anterior estudio de protonación y los datos de las constantes de los hidroxocomplejos de cobre (II) reportadas en la literatura (Plyasunova, 1997), se propusieron y calcularon las constantes de formación de los complejos.
Luego del ajuste manual y varias refinaciones en el programa se obtuvieron los resultados que se presentan a continuación (Tabla 3). Los complejos de cobre (II) con el ligando LA4 no fueron determinados al no poder calcularse las constantes de protonación del mismo que constituyen un requisito previo para la complejación.
Tabla 3 Logaritmos de las constantes acumulativas de formación de complejos Cu (II) con los ligandos LAX, en relación M:L 1:1, en NaCl 0.1 mol·dm-3 a 298 K

Nota: los valores entre paréntesis indican la cifra significativa en la que se encuentra la desviación estándar.
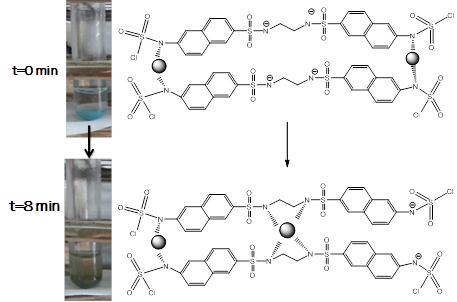
Como se muestra en la tabla 3, para el ligando LA2, se forman solamente dos especies complejas, la primera correspondiente al complejo biprotonado probablemente en los grupos amino unidos a los anillos condensados y teniendo el ion metálico coordinado a los grupos sulfonamida. De esta forma es posible prever la fácil entrada del metal a la parte que contiene los grupos sulfonamídicos manteniendo los grupos amino protonados. La segunda constante de formación de complejos corresponde a un dímero como producto de una migración del metal de un centro de coordinación a otro, obligando a la molécula que cambie su forma plegada y adopte una posición lineal tal como se ilustra en el esquema 3.
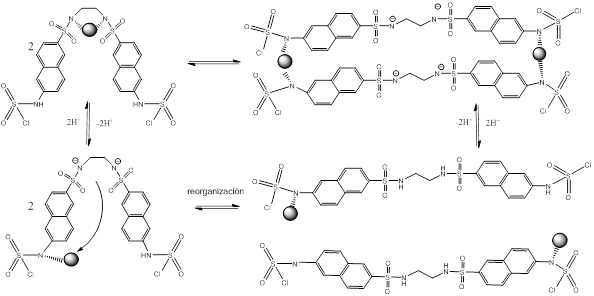
Esquema 3 Propuesta de modelo de equilibrio basado en los complejos encontrados para Cu-LA2 en relación molar 1:1.
En la figura 6 se representa el diagrama de distribución de especies correspondientes al ligando L2A2 en presencia de un equivalente de Cu (II). En este se evidencia la formación de dos especies complejas, mencionadas anteriormente. La especie biprotonada aparece a valores de pH entre 2 y 6, indicando las protonaciones de los grupos amino situados a los extremos de la molécula. Sin embargo, la especie dímera comienza a formarse a pH ≥ 5, alcanzando más del 50 % de abundancia relativa a pH = 5.5, valor en cual comenzó a precipitar durante el experimento realizado de titración potenciométrica. Esta precipitación puede estar relacionada con el aumento de la masa molar brusco de una especie monómera a un dímero.
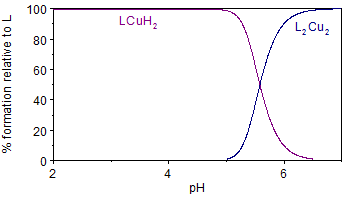
Fig. 6 Diagrama de distribución de especies del ligando LA2 en presencia de un equivalente de Cu (II), en NaCl 0.1 mol·dm-3 a 298 K.
A continuación (figura 7), se muestran los espectros UV-Visible del ligando LA2 libre y con un equivalente de Cu (II). En el espectro de color azul, correspondiente al ligando libre, aparecen bandas significativas de gran intensidad entre los 200 y 300 nm correspondientes a transiciones de tipo π-π* características del anillo naftalénico, con máximos en 201, 221 y 269 nm, entre los 300 y 400nm aparece una banda de poca intensidad con máximo en 327 nm correspondiente a transiciones n-π* características de los grupos sulfonamídicos. Si bien se analiza el espectro de color verde que representa al ligando con un equivalente de Cu (II), se evidencia las bandas características a las transiciones π-π* del anillo naftalénico con mayor intensidad, lo que indica que la coordinación con el metal ocurrió por los grupos amino enlazados a dichos anillos, la banda correspondiente a las transiciones n-π* anteriormente mencionadas no se modifican, demostrando así que los grupos sulfonamídicos se encuentran libres. Entre los 700 y 900 nm aparece una banda ancha con un máximo en los 800 nm aproximadamente, indicando la probabilidad de una geometría bipirámide trigonal al coordinarse la molécula con el Cu2+ (Algarra, 2009), (Massoud, 1999).
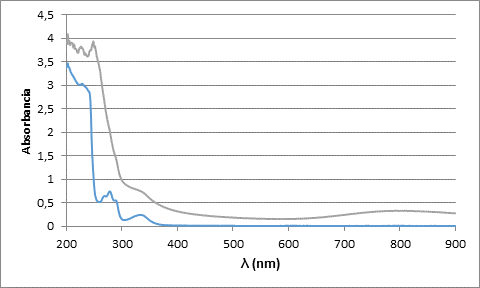
Fig. 7 Espectro UV-visible del ligando LA2 libre (azul) y en presencia de un equivalente de Cu (II) (verde), en NaCl 0.1 mol·dm-3 a 298 K.
En la figura 8 se representan los espectros UV-Visible del ligando LA6 libre y con un equivalente de Cu (II). En el espectro azul, correspondiente al ligando libre, aparecen bandas significativas de gran intensidad entre los 200 y 300 nm, con máximos en los 222 nm y 280 nm aproximadamente, correspondientes a transiciones π-π* presentes en el anillo naftalénico. Entre los 300 y 400 nm aparece una banda de poca intensidad con un máximo en los 326 nm aproximadamente, correspondiente a transiciones n-π* características de los grupos sulfonamídicos, analizando el espectro correspondiente al complejo vemos que esta señal desaparece, indicando que el metal se coordinó con las sulfonamidas y no con los grupos amino, ya que las señales de los anillos condensados permanecen invariables.
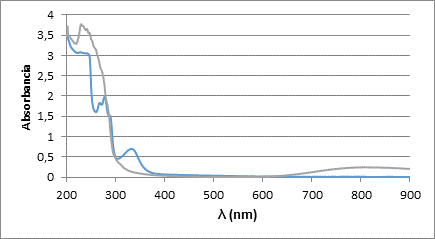
Fig. 8 Espectro UV-visible del ligando LA6 libre (azul) y en presencia de un equivalente de Cu (II) (verde), en NaCl 0.1 mol·dm-3 a 298 K.
Por lo general, los complejos de Cu2+ de cadena abierta, así como aminas macrocíclicas polidentadas son frecuentemente pentacoordinadas (Meyer, 2004), (Nunes, 2007), que adoptan estructuras descritas como pirámide de base cuadrada o bipirámide trigonal dependiendo principalmente de la naturaleza del ligando (Algarra, 2009).
Ensayos preliminares de reconocimiento de Cu(II).
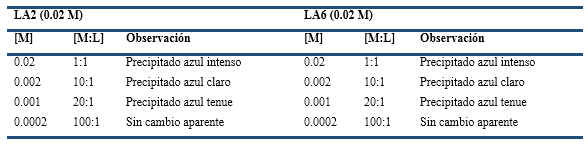
Para tener una idea aproximada de hasta qué concentración de Cu (II) puede ser detectada con estos compuestos se procedió a preparar disoluciones de CuCl2·2H2O y se hicieron interactuar con los ligandos LA2 y LA6, desde relación molar 1:1 hasta 100:1. Los resultados muestran que con disoluciones de los podandos de concentración 0.02M es posible detectar hasta concentraciones de Cu(II) hasta 0.001M, o sea, en el orden de 10-3M (Tabla 4).
Un aspecto realmente interesante lo constituye un cambio de coloración que ocurre durante la formación de complejos de Cu(II) con el ligando LA2, que pasa de azul intenso a verde olivo en 8 minutos aproximadamente (Esquema 4). Esto podría ser usado como corroboración de reconocimiento de cobre basado en la espera de 9 minutos y la observación de esta nueva coloración.
CONCLUSIONES
Se obtuvieron 3 podandos bipodales de naturaleza sulfonamídica, capaces de coordinar iones Cu(II). Se determinaron sus constantes de protonación en disolución acuosa, observándose protonaciones simultáneas como en otras sustancias de estructuras con simetría C2 semejantes a esta. Las constantes de formación de complejos avalan la disponibilidad de coordinar iones Cu(II), corroborándose por UV-Visible la aparición de bandas que indican la complejación. Tanto el podando LA2 como LA6 en disoluciones de 0.02 M, son capaces de detectar iones Cu(II) hasta 10-3 M. Por último, se sospecha de un proceso de reorganización molecular tipo pH-driven para complejos Cu-LA2, en un tiempo de 8 min, lo que podría utilizarse como comprobación del proceso de reconocimiento. Así, se sugiere el ligando LA2, como mejor sensor a Cu(II) en este estudio, pudiendo aplicarse como parte de un kit de reconocimiento instantáneo. Se sugiere en estudios posteriores perfeccionar la caracterización espectroscópica de los ligando obtenidos.