Introducción
El estrés oxidativo constituye una alteración producida por un desequilibrio entre la generación de radicales libres y la defensa antioxidante (superóxido dismutasa, catalasa, glutatión peroxidasa), basado en el daño a estructuras celulares como carbohidratos, ácidos nucleicos, lípidos y proteínas (Winterbourn et al, 2016). Este daño oxidativo puede atribuirse a una deficiencia de sustancias protectoras, asociado al estado nutricional, y se puede manifestar con la consiguiente presencia de enfermedades de la piel (Cao et al, 2020; Huerta et al, 2005). Diversos estudios han demostrado que la ingesta inadecuada de nutrientes deprime la acción de algunas enzimas antioxidantes, lo que favorece el estrés oxidativo (Sharifi et al, 2020; Colitti et al, 2019).
En este sentido el control de la alimentación balanceada en los perros desempeña una función importante en la calidad de vida de los animales, ya que las deficiencias de nutrientes en la dieta constituyen un factor predisponente para el desarrollo de trastornos dermatológicos que involucran un estrés oxidativo. Una alimentación adecuada debe estar compuesta por agua, proteínas, carbohidratos, grasa, vitaminas y minerales para cumplir con los requerimientos nutricionales de cada animal (Colitti et al, 2019).
La incorporación de las grasas en las dietas de los perros es una exigencia que favorece la absorción de las vitaminas liposolubles y garantiza una buena palatabilidad del alimento. Por otra parte, los caninos necesitan consumir ácidos grasos esenciales principalmente el ácido linoleico y el ácido araquidónico, ya que, de haber deficiencias de éstos, se presentan afectaciones en la salud de la piel y el pelo. La presencia de lesiones en la piel, así como la ausencia de brillo, la sequedad y la aspereza del pelo son manifestaciones clínicas que acompañan a las dermopatías (Osorio et al, 2010). En este sentido se destacan, la demodicosis (Romanucci et al 2011; Martínez et al, 2014) y la dermatitis atópica (Almela et al, 2018), ambas relacionadas con el estrés oxidativo.
Algunos autores han observado una reducción de los niveles de antioxidantes endógenos (glutatión peroxidasa, catalasa, cobre y zinc) en perros con demodicosis localizada y generalizada (Dimri et al, 2008).
El aceite de girasol ozonizado (AGO) es un producto registrado para uso humano con el nombre comercial (OLEOZON(), compuesto por una mezcla de principios activos (hidroperóxidos, peróxidos, aldehídos, ozónidos) obtenidos a partir de la ozonización parcial del aceite de girasol (Díaz et al, 2001; Díaz et al, 2005; Díaz et al, 2008; Ledea, 2004; Ledea et al, 2005). Dicho producto ha mostrado su acción germicida como efecto farmacológico principal en diversos estudios (Guerrer et al, 2012; Lezcano et al, 2000; Sechi et al, 2001) y como acciones pleiotrópicas presenta actividad antiinflamatoria (Zamora et al, 2006; Zamora et al, 2018). Específicamente, el AGO ha mostrado su acción coestimuladora del sistema antioxidante en diferentes modelos experimentales (Zamora et al 2007).
Estudios toxicológicos del AGO tópico en dosis repetida, evidencian la seguridad del producto (Díaz et al, 2006; Rodríguez et al, 1990). Teniendo en cuenta estos antecedentes, el presente trabajo tiene como objetivo evaluar la influencia de la administración tópica de diferentes dosis del aceite de girasol ozonizado en perros sobre el perfil lipídico, proteico e indicadores de estrés oxidativo durante 90 días.
Materiales y Métodos
Sustancias de estudio y/o referencia.
EL AGO procedente del Centro Nacional de Investigaciones Científicas (CNIC) con un índice de peróxido de 600-800 mmol-equiv/kg y como vehículo aceite de girasol refinado, fabricado en Borges-Ecasol, España, ambos almacenados a una temperatura de 2 a 8º C.
Animales
Se emplearon 30 perros hembras y machos sanos de la raza Cenp: BEAG, de 1 a 3 años de edad con un rango de peso corporal de 10 a 18 kg, perteneciente a la Colonia de Caninos de la Dirección de Animales Convencionales del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), La Habana. Los parámetros ambientales fueron monitoreados diariamente mediante un medidor de temperatura y humedad relativa RH 600. La temperatura de la sala fue de 22 ± 3 ºC, la humedad relativa de 50-80 % y el fotoperíodo de siete horas luz/17 oscuridad con libre acceso a agua y comida. El manejo de los animales se realizó de acuerdo a las normas establecidas en la “Guía Ética para el Manejo de Animales de Laboratorio” (La Habana, Cuba, 1992) y los principios éticos para el uso de animales de laboratorio recomendados en los lineamientos internacionales y en la República de Cuba, “Principios de las Buenas Prácticas de Laboratorio no Clínico de Seguridad Sanitaria y Medioambiental del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos 039/2004” (CECMED, 2004).
Grupos experimentales
Concluido el período de readaptación y realizado los exámenes complementarios, se seleccionaron los animales y se distribuyeron al azar en cinco grupos experimentales de seis animales (tres hembras y tres machos) en cada uno. El grupo 1 (Control): tratamiento con agua estéril, el grupo 2 (vehículo): Aceite de girasol sin ozonizar, el grupo 3 (Dosis Baja): AGO (4 mg/kg) el grupo 4 (Dosis Media): AGO (20 mg/kg) y el grupo 5 (Dosis Alta): AGO (100 mg/kg).
Se seleccionaron tres niveles de dosis, donde la dosis alta fue de 100 mg/kg, teniendo en cuenta los resultados previos derivados de estudios de dosis repetida en otras especies (Menéndez et al, 1999). La dosis baja fue de 4 mg/kg, la cual se halló ligeramente por encima de la dosis terapéutica recomendada. La dosis media, 20 mg/kg se determinó utilizando un factor 5 entre las 3 dosis.
Diseño experimental
Se realizó el rasurado del 10% de la superficie corporal de los animales en el área seleccionada (dorso-lateral derecha) como sitio de administración de los productos, con dimensiones de aproximadamente 22 x 22 cm para un perro de peso promedio de 10 kg. Posteriormente, cada producto fue administrado tópicamente utilizando jeringuillas de 5 y 10 ml. Una vez aplicado, éste se distribuyó uniformemente por toda la zona con la ayuda de una espátula plástica. Inmediatamente, se colocaron parches de gasa porosa y esparadrapo con el objetivo de evitar que el animal pudiera ingerirlo y asegurar el contacto del producto con la piel durante un período de seis horas.
Todos los productos se administraron una vez al día, en horas de la mañana (9:00 am y 11:00 am), durante cinco días semanales, hasta los 90 días. La duración del estudio se corresponde con una evaluación de toxicidad subcrónica dérmica de 90 días (OECD 1981). Los volúmenes administrados se ajustaron semanalmente en función del peso corporal. En los grupos Control y Vehículo, el volumen administrado se estableció a partir del esquema utilizado para calcular el volumen a administrar al grupo de dosis alta.
Obtención de las muestras
La sangre se obtuvo de las venas femorales de los animales utilizando jeringuillas de 5 o 10 ml y agujas 21 G x 1½ pulgadas. Los animales se sometieron a ayuno previo de aproximadamente 12 horas. Para la evaluación de indicadores de estrés oxidativo se tomaron dos muestras de sangre para la obtención de plasma, uno con ácido etilendiaminotetraacético (EDTA) (determinación de malondialdehído (MDA) (Ohkawa, 1979), proteínas totales (Marxwell, 1987) y grupos sulfhídricos (SH) (Miao-Lin, 1994) y el otro con heparina (determinación de catalasa) (Aebi, 1974). Para la evaluación de bioquímica sanguínea se tomaron alícuotas en viales de 2 y 1.5 ml respectivamente donde se dejó coagular y posteriormente se centrifugó a 12 000 r.p.m. en una centrífuga Eppendorf durante 10 minutos.
Variables analizadas
Se realizaron exámenes de bioquímica sanguínea y estrés oxidativo a todos los animales antes de efectuar la primera aplicación y al finalizar el período de administración.
Determinación bioquímica sanguínea
Se determinaron, la albúmina (Alb) el colesterol (Col) y los triglicéridos (TG), mediante el juego de kits (HELFA ( Diagnósticos (E.P.B. “Carlos J. Finlay”) en un Analizador Automático Cobas Integra 400 PLUS (Roche Diagnostic Systems).
Determinación de proteínas totales
Se determinaron las concentraciones de proteínas totales en el plasma, según el método de Lowry modificado (Marxwell et al, 1987).
Determinación de Sustancias Reactivas al Ácido Tiobarbitúrico (SRATB) en plasma
La determinación de las SRATB en el plasma, se realizó según la técnica de Ohkawa et al, 1979. Se añadió a la mezcla de reacción (500µL de plasma) 0,2 mL de SDS (Analar, Inglaterra) al 8,1%, 1,5 ml de ácido acético al 20 % ajustada a pH 3,5 y 1,5 mL de una disolución acuosa de ácido tiobarbitúrico al 0,8%. Se extrajo la capa superior orgánica y se realizó la lectura de la absorbancia a 534 nm en un espectrofotómetro UV-vis (GENESYS, China). Los niveles de SRATB se calcularon según las concentraciones de MDA, para lo que se construyó una curva patrón con malondialdehído bis (dimetil acetal, MERCK, EUA). Los valores de MDA se reportaron como mmol de MDA/mg de proteína.
Determinación de la actividad de la catalasa (CAT) en plasma.
La actividad de la CAT se determinó por el método modificado de Aebi, 1974, en el que se monitoreó la desaparición del H2O2 a 240 nm durante 5 min en espectrofotómetro. A 10 (L de muestra se añadió 2,89 mL de buffer fosfato de potasio 50 mmol/L (pH 7,4). El tiempo de descomposición del H2O2 fue determinado espectrofotométricamente por el cambio de absorbancia a 240 nm. La actividad de la enzima se calculó por el coeficiente de extinción molar (43,6 x 10-3) y se expresó en UI/min mg de proteínas x 10-1.
Determinación de las concentraciones de grupos sulfihídrilos en plasma.
La determinación de grupos sulfhídrilo (SH) se realizó mediante la técnica descrita por Miao-Lin Hu, 1994, para ello se tomó una alícuota de 200µL de la muestra de plasma, se le añadió 600µL de buffer TRIS-EDTA 20 mmol/L, pH 8,2; 40 µL de 5,5´- dithiobis-(2-nitrobenzoic acid) (DTNB) 10 mmol/L y 3,16 mL de etanol absoluto. La lectura se realizó a 412 nm en un espectrofotómetro. El total de grupos SH se calculó usando una absortividad de 13,600 cm-1M-1 y se expresó en mmol/L.
Resultados
En la tabla 1 se describe el comportamiento de los indicadores de estrés oxidativo (MDA, grupos SH y actividad de la CAT) en el plasma de los perros sin tratamiento y tratados con las sustancias vehículo (AG) y de ensayo (AGO). Los grupos de animales tratados tópicamente con el vehículo (AG), dosis baja y media de AGO, no mostraron diferencias significativas (p<0,05) en cuanto a los niveles de MDA antes y después de aplicado los productos durante 90 días. A diferencia de ello, el grupo tratado con dosis alta redujo significativamente los niveles de MDA (2,65 mmol/mg prot) en plasma al final del tratamiento durante 90 días, con respecto al tiempo de inicio del tratamiento (6,21 mmol/mg prot). En cuanto al análisis del comportamiento de los grupos SH en las muestras de plasma, no existieron diferencias significativas (p<0,05) entre los grupos estudiados. Con respecto a la actividad de la CAT, se evidenció que no mostró diferencias significativas (p<0,05), al inicio y al final del estudio, en ninguno de los grupos controles. Sin embargo, los grupos de animales tratados con dosis baja, media y alta de AGO, experimentaron un incremento significativo de la actividad de la CAT (0,57; 0,78; 0,84 UI/min/mg prot, respectivamente) después de 90 días de tratamiento, con respecto al inicio de este (0,20; 0,18; 0,23 UI/min/mg prot respectivamente).
Tabla 1 Comportamiento de indicadores de estrés oxidativo (malondialdehído, grupos sulfhídrilo y catalasa) en perros.

X±EEM: media ± error estándar de la media *p<0,05 **p<0,01 Prueba no paramétrica Tukey´s.
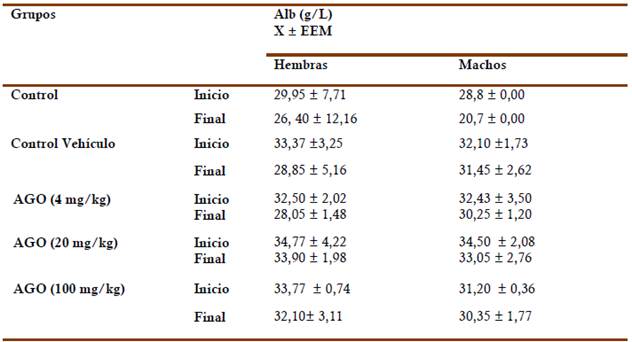
Las Tablas 2 y 3 muestran el comportamiento de los parámetros bioquímicos asociados al metabolismo proteico (albúmina) y lipídico (colesterol y triglicéridos) en los perros sin tratamiento y tratados con las sustancias vehículo (AG) y de ensayo (diferentes dosis de AGO). Los niveles de albúmina no mostraron diferencias significativas (p<0,05) en ninguno de los grupos experimentales por sexo, al inicio con respecto al finalizar el estudio. En cuanto al comportamiento del perfil lipídico (colesterol y triglicéridos), no se evidenciaron cambios significativos (p<0,05) para ninguna de las sustancias aplicadas tópicamente durante 90 días en las hembras y los machos.
Tabla 2 Comportamiento del parámetro de perfil proteico (albúmina) en perros hembras y machos.
X±EEM: media ± error estándar de la media. Prueba no paramétrica Tukey´s.
Discusión
La administración tópica de las diferentes dosis de AGO mostró su influencia sobre los indicadores de estrés oxidativo (niveles de MDA y actividad de la CAT) en el plasma de perros tratados durante 90 días.
En estudios anteriores, se ha evidenciado que la aplicación de sustancias ozonizadas como tratamiento de lesiones dérmicas inducidas experimentalmente por luz ultravioleta (UV) en ratas, incrementan la actividad de enzimas antioxidantes en la piel, revirtiendo el daño oxidativo inducido por las radiaciones (Sánchez et al, 2011). Por otra parte, la acción cito-protectora gástrica del AGO fue demostrada mediante el incremento de la actividad de antioxidantes enzimáticos en el tejido gástrico de ratas (Zamora et al, 2008; Zamora et al, 2007). Es importante destacar, que en este estudio se demuestra la influencia sistémica de las aplicaciones de las diferentes dosis de AGO aplicado tópicamente, sobre la liberación de la enzima antioxidante CAT en plasma, resultado que de forma indirecta sugiere la absorción de los principios activos (especies peroxídicas, aldehídos, ácidos, ozónidos, peróxido de hidrógeno e hidroxihidroperóxidos) del AGO a través de la piel. Este resultado sugiere la realización de estudios posteriores que demuestren dicha absorción e influencia sistémicas.
Teniendo en cuenta que el estrés oxidativo constituye un mecanismo de respuesta involucrado en los procesos fisiopatológicos de las enfermedades dermatológicas en caninos (Marlin et al, 2002), el uso del AGO constituye un potencial terapéutico para el tratamiento de las dermatopatías caninas, no solo por su actividad estimuladora local de los sistemas antioxidante sino también sistémica, tal como se demuestra en este estudio. En este sentido, vale resaltar que el incremento de la actividad de la CAT, logrado por la dosis de AGO (100 mg/kg), estuvo acompañado del decremento significativo de la peroxidación lipídica (MDA) en los animales tratados durante 90 días. Este resultado muestra que las aplicaciones tópicas de AGO estimula la actividad del sistema antioxidante endógeno para lograr la homeostasis celular y el equilibrio de sustancias necesarias en la piel de los animales. Con este resultado se demostró por primera vez que el AGO a diferentes dosis (4, 20 y 100 mg/kg) aplicado tópicamente durante 90 días en perros, incrementó de forma significativa, la actividad de la CAT en el plasma, mientras que a la dosis de 100 mg/kg redujo de forma significativa la peroxidación lipídica determinada mediante los niveles de MDA.
Tanto la acción antiinflamatoria (Barroetabeña et al, 2002) como cicatrizante (Pai et al, 2014) de aceites ozonizados (AOs), ha sido sustentada mediante el incremento de la actividad de enzimas antioxidantes, específicamente de la superóxido dismutasa (SOD).
Un indicador importante en el estudio, considerando que el AGO posee una base lipídica, fue la evaluación de los indicadores lipídicos como los niveles de colesterol y los triglicéridos, los cuales se encontraron entre los valores normales para la especie en estudio. De esta manera se demuestra que las aplicaciones tópicas con diferentes dosis de AGO durante 90 días, no modificaron los parámetros del perfil lipídico evaluados (colesterol y triglicéridos), los cuales se encontraron entre los valores normales, reportados para la especie, según: TG: hembras (0,39- 1,35 mmol/L) y machos (0,39- 1,26 mmol/L) y Col: (Hembras (2,17- 8,27 mmol/L) y machos (2,77- 8,27 mmol/L) (Camps). Sin embargo, no se descarta la posibilidad de ampliar el estudio y profundizar en el comportamiento de otros lípidos plasmáticos como son: lipoproteínas de baja densidad y alta densidad.
Por otro lado, la albúmina constituye una proteína plasmática esencial con diferentes funciones como: mantener el 80 % de la presión oncótica, como principal responsable de los movimientos acuosos intravasculares hacia el intersticio. Además, garantiza el transporte de diferentes sustancias como la bilirrubina, ácidos grasos, medicamentos y hormonas, incluyendo al calcio, por lo que una hipoalbuminemia, se acompaña de una hipocalcemia (Escalante, 2006). En este estudio los niveles de albúmina sérica, entre en los niveles normales reportados para la especie según la edad y sexo (hembras (26-36 g/L), machos (26- 39 g/L) (Camps). Teniendo en cuenta las funciones de dicha proteína, y que los niveles de ésta no fueron alterados por las aplicaciones de las sustancias evaluadas, se considera pertinente, observar el comportamiento de esta proteína y otras, en estudios posteriores. Ambos resultados, en cuanto el comportamiento de indicadores proteicos y lipídicos, avalan en parte, la seguridad de las aplicaciones tópicas de AGO a las dosis estudiadas en perros Beagles durante 90 días.
En sentido general, los resultados de este estudio, evidencian que las aplicaciones tópicas del AGO, sugieren una determinada absorción del compuesto a través de la piel, alcanzando compartimientos sistémicos que conllevan al incremento de la actividad de la CAT como enzima antioxidante. Sin embargo, se debe considerar que se trata de un compuesto oleoso que contiene ácidos grasos, además de los principios activos (peróxidos, hidroperóxidos y aldehídos entre otros) y que no se evidenció su influencia sobre el metabolismo de los lípidos (colesterol y triglicéridos) y proteínas (albúmina).















