INTRODUCTION
El propóleos, producto natural producido por las abejas a partir de fuentes vegetales resinosas, es una sustancia de composición química compleja. Se han identificado más de 300 compuestos químicos diferentes en muestras de propóleos recolectadas de diversas regiones geográficas en la última década solamente (Šturm y Ulrih, 2019). Entre todos los grupos de compuestos químicos, los fenoles (flavonoides, ácidos fenólicos y sus ésteres) se consideran los principales componentes de este material (Anjum et al., 2019). Son a estos a los que se les atribuye la mayoría de las actividades biológicas aprovechadas en la medicina y los responsables de conferirle las propiedades antibacterianas, antioxidantes, antifúngicas, antivirales, antiinflamatorias y antitumorales (Sforcin, 2016; Oryan et al., 2018).
La técnica más popular para la producción de extractos de propóleos es la extracción con etanol al 70 %. Este método resulta adecuado pues se obtienen extractos de propóleos bajos en cera y ricos en compuestos biológicamente activos que son fácilmente solubles en etanol (Pietta et al., 2002).
A pesar que la extracción con etanol resulta en un método simple y efectivo, presenta algunas desventajas. El extracto etanólico de propóleos ostenta un fuerte sabor residual y manifiesta algunas limitaciones en su aplicación en la industria farmacéutica y la medicina. De esta última se puede decir que los extractos de etanol no son adecuados para el tratamiento en especialidades médicas como la oftalmología, la otorrinolaringología y pediatría. Además, restringe su empleo en los casos de intolerancia al alcohol (Kubiliene et al., 2015).
Existen varios estudios sobre la producción de extractos acuosos de propóleos, así como también resultados disímiles respecto a la actividad biológica de los mismos (Orsolic y Basic, 2005; Saleh, 2012; Kubiliene et al., 2015; Bucio-Villalobos y Martínez-Jaime, 2017). Se ha planteado que solo una pequeña parte de las sustancias del propóleos es extraída en el agua, entre el 2-4 % y a largo plazo de extracción hasta el 11 % (Vakhonina et al., 2021).
Existen trabajos donde se analizan diferentes métodos para la obtención de extractos acuosos de propóleos con un alto contenido de sustancias biológicamente activas. Desde los naturales (Cunha et al., 2004; Vakhonina et al., 2021), hasta los que emplean otras sustancias químicas que faciliten la solubilidad de estos compuestos en agua (Kubiliene et al., 2015; Kubiliene et al., 2018; Funari et al., 2019). Según los resultados expresados por todos ellos, los extractos de propóleos no etanólicos poseen actividades biológicas tan altas como los extractos etanólicos. Por ello, resulta importante investigar la composición química y actividad biológica de extractos de propóleos acuosos.
En este sentido, y con vistas a obtener extractos de propóleos no etanólicos que mantenga sus propiedades biológicas, se compararon los extractos de propóleos acuosos obtenidos a partir de diferentes procedimientos de extracción, evaluando en los mismos, los contenidos de materia seca, fenoles totales, flavonoides totales, actividad antioxidante y antimicrobiana.
METODOLOGÍA
Origen del propóleos
El propóleos crudo se obtuvo del apiario La Cueva, ubicado en el municipio de Quivicán en la provincia de Mayabeque, Cuba, empleando el método de recolección por mallas. La formación vegetal presente en la zona es de Bosque semideciduo mesófilo, donde predominan el algarrobo, el almácigo, la baría y el cuyá como especies vegetales resiníferas que pueden contribuir a su composición química.
El propóleos extraído se conservó en nylon, limpios y bien cerrados. Después de mantenerse un mínimo de 24 horas en refrigeración, fue molido en partículas lo más finas posibles que facilitaron su posterior procesamiento y almacenado a temperatura de refrigeración de -18°C hasta su utilización.
Preparación de los extractos de propóleos
Los extractos de propóleos fueron realizados de la siguiente forma:
Método 1. Propóleos extraído con agua destilada, la proporción de propóleos y agua fue de 1:10 (p/v), en maceración con agitación magnética a 40 °C por tres días. Posteriormente se filtró y se conservó el filtrado (EA1).
Método 2. Propóleos extraído con mezcla de alcohol reactivo al 99.9% y agua destilada (30:70, v/v), la proporción de propóleos y la mezcla fue de 1:10 (p/v), en maceración con agitación magnética a 40 °C por tres días. Posteriormente se filtró y se conservó el filtrado (EA2).
Método 3. Propóleos extraído con agua destilada, la proporción de propóleos y agua fue de 1:10 (p/v), en ultrasonido, 40 kHz por 30 min a 40 °C. Posteriormente se filtró y se conservó el filtrado (EA3).
Método 4. Propóleos extraído con mezcla de alcohol reactivo a 99.9 % y agua destilada (70:30, v/v), la proporción de propóleos y la mezcla fue de 1:10 (p/v), en maceración con agitación magnética a 40 °C por tres días. Posteriormente se filtró y se realizó evaporación al vacío y presión reducida para eliminar el etanol con una rotación de 20 rpm y temperatura de 45 °C. Posteriormente se resuspendió en agua destilada a 40 °C y se filtró. Se conservó el filtrado (EA4).
Método 5. Propóleos extraído con agua destilada, la proporción de propóleos y agua fue de 1:10 (p/v), se extrajo en un extractor Soxhlet durante seis horas a una temperatura máxima de 100 ° C. El extracto resultante se conservó (EA5).
Método 6. Propóleos extraído con etanol a 70 grados, la proporción de propóleos y etanol fue de 1:10 (p/v), en maceración con agitación magnética a 40 °C por tres días. Posteriormente se filtró y se conservó el filtrado (EE1).
Método 7. Propóleos extraído con etanol a 90 grados, la proporción de propóleos y etanol fue de 1:10 (p/v), en maceración con agitación magnética a 40 °C por tres días. Posteriormente se filtró y se conservó el filtrado (EE2).
Los extractos se mantuvieron en refrigeración hasta el momento del filtrado para eliminar las ceras.
Determinación de materia seca
Se pesó una cantidad de cada extracto de propóleos en una placa previamente tarada y se llevó a estufa a 100 °C para eliminar completamente el solvente. Luego se pusieron en un desecador hasta que alcanzaron la temperatura ambiente y se pesaron. El proceso se repitió hasta que dos pesadas sucesivas no difirieron entre sí en más de 5 mg. El resultado se expresó como porciento de extracto seco.
Determinación del contenido de fenoles totales
Los análisis se realizaron basados en el método de Folin-Ciocalteu. Se tomaron muestras de los extractos obtenidos a los cuales se añadió el reactivo de Folin-Ciocalteu y posteriormente el carbonato de sodio. Se dejó reposando por dos horas hasta que finalmente se leyó la absorbancia a 750 nm. El ácido gálico se empleó como patrón en la curva de calibración. Los resultados se expresaron como miligramos equivalentes de ácido gálico por mililitro de extracto (mg AG/ml extracto).
Determinación de flavonoides totales
Para el análisis se tomaron muestras de los extractos obtenidos a los cuales se añadió cloruro de aluminio III. Se dejaron 30 minutos en la oscuridad y posteriormente se leyó la absorbancia a 424 nm. La quercetina se empleó como patrón en la curva de calibración. Los resultados se expresaron como miligramos equivalentes de quercetina por mililitro de extracto (mg Q/ml extracto).
Determinación del índice de oxidación
Se realizó adicionando una muestra de cada extracto de propóleos lentamente sobre agua con agitación. La mezcla se filtró a través de un papel de filtro y se recogió el filtrado. A este filtrado se le añadió solución de ácido sulfúrico y se agitó durante un minuto. Finalmente se agregó una gota de permanganato de potasio 0,1 N y se registró el tiempo, en segundos, que la solución tardó en decolorarse.
Determinación del Halo de inhibición
Se realizó mediante el método de difusión en doble capa de medio agarizado con cortes cilíndricos (Grove y Randall, 1955). Cepas de la bacteria Staphylococcus aureus (ATCC 29737) fueron incubadas durante 24 horas en medio agarizado y posteriormente sobre placas Petri con una capa base. Después de solidificado se abrieron los pozos sobre la superficie de los agares con ayuda de un sacabocados estéril y en cada uno de ellos se vertieron los extractos. Se incubaron y se midieron los halos de inhibición en milímetros.
Análisis por cromatográfía en capa delgada (CCD)
Las muestras para la CCD se adquirieron a partir de las obtenidas de la determinación de la materia seca diluida en etanol.
Se trabajó con una cámara de cromatografía de cristal a temperatura ambiente (25-29 °C). Se emplearon placas de sílica gel G 60 F254 para el análisis cualitativo y la aplicación se realizó mediante el uso de capilares con secado espontáneo de la muestra aplicada. El desarrollo de la cromatografía se realizó empleando como fase móvil un sistema de solventes consistente en tolueno: acetato de etilo: ácido fórmico (5:4:0,2).
Los resultados de la cromatografía fueron visualizados mediante el empleo de lámpara UV a 254 y 366nm.
Análisis estadístico
Los resultados fueron expresados como la media y su desviación estándar. El análisis estadístico para determinar las diferencias entre los valores medios de cada muestra fue llevado a cabo empleando el ANOVA simple. Se realizó el test de Bonferroni como herramienta post-hoc entre las muestras de extractos acuosos y el test de Dunnett para la comparación tomando como control el EE1.
Para el análisis de correlación entre los indicadores se empleó el coeficiente de Pearson mientras se utilizó una Regresión linear para la relación entre el contenido de fenoles y flavonoides con el índice de oxidación y el halo de inhibición.
Los análisis se llevaron a cabo para una p < 0.05 empleando el paquete estadístico STATISTICA 6.
RESULTADOS
Los extractos acuosos mostraron diferencias con el control EE1 en cuanto a materia seca, contenido de fenoles y flavonoides totales. El extracto EE2 no tuvo diferencias con EE1 en el contenido fenólico (tabla 1).
La muestra con mayor contenido de materia seca, fenoles y flavonoides totales corresponde con los extractos etanólicos de propóleos. En tanto, referente a las muestras de extractos acuosos las de mayor contenido de materia seca, fenoles y flavonoides totales corresponden con EA2, seguida de la EA4.
La actividad antioxidante, medidas por el índice de oxidación, no mostró diferencias entre los extractos analizados. En cuanto a la actividad antibacteriana, medida mediante el halo de inhibición, solo mostraron actividad los extractos acuosos EA2 y EA4 y ambos extractos etanólicos. Sin embargo, no hubo diferencias significativas entre los extractos acuosos con actividad y EE1.
Tabla 1 Indicadores analizados en los extractos obtenidos por varios métodos de extracción.
| Extracto |
|
|
|
|
|
| EA1 | 0.20 ± 0.00a*** | 0.63 ± 0.02a*** | 0.01 ± 0.00a*** | 2.09 ± 0.28NS | 0 ± 0.0a*** |
| EA2 | 1.12 ± 0.03b*** | 2.68 ± 0.11a*** | 0.23 ± 0.01b*** | 1.77 ± 0.63NS | 13 ± 1.4bNS |
| EA3 | 0.04 ± 0.03c*** | 0.17 ± 0.01a*** | 0.02 ± 0.00ac*** | 1.74 ± 0.5NS | 0 ± 0.0a*** |
| EA4 | 0.52 ± 0.01d*** | 1.44 ± 0.01a*** | 0.04 ± 0.01cd*** | 2.22 ± 0.97NS | 15 ± 0.0bNS |
| EA5 | 0.26 ± 0.00e*** | 0.78 ± 0.01a*** | 0.05 ± 0.00d*** | 2.60 ± 0.45NS | 0 ± 0.0a*** |
| EE1 | 7.81 ± 0.02 | 23.21 ± 1.92 | 1.91 ± 0.01 | 2.21 ± 0.17 | 15 ± 1.4 |
| EE2 | 8.46 ± 0.03*** | 24.90 ± 2.99NS | 2.61 ± 0.01*** | 1.77 ± 0.34NS | 18.5 ± 0.7* |
*: Test de Dunnett. P < 0.05 vs EE1 NS: no existen diferencias significativas a, b, c, d: Test de Bonferroni. P <0.05
El estudio de correlación mostró una correlación positiva entre los indicadores materia seca y contenido de flavonoides (r=0.990, P<0.005), materia seca y contenido de fenoles (r=1.000, P<0.005) y contenido de fenoles y flavonoides (r=0.989, P<0.005).
Las regresiones analizadas no resultaron significativas (figura 2) no permitiendo predecir la dependencia del índice de oxidación y el halo de inhibición con el contenido de fenoles y flavonoides.
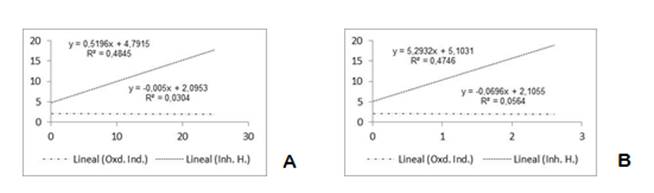
Fig. 1 Regresión lineal entre el contenido de flavonoides y fenoles totales con el índice de oxidación (Oxd. Ind.) y el halo de inhibición (Inh. H.). A) variable independiente contenido de fenoles. B) variable independiente contenido de flavonoides.
La CCD mostró la composición de los extractos analizados (figura 1). Los resultados indicaron un gran número de bandas correspondientes a los compuestos obtenidos de las diferentes extracciones. La ausencia de la banda correspondiente a la nemorosona y la presencia del patrón de las cuatro bandas con Rf entre 0.2 y 0.8 en todas las muestras, indican un propóleos Tipo II en la clasificación del propóleos cubano según su composición de compuestos mayoritarios. El patrón de bandas para cada uno de los extractos es el mismo. Aunque los extractos acuosos extraídos con etanol y los extractos etanólicos presentaron bandas muy intensas características de las altas concentraciones presentes de sus compuestos.
DISCUSION
En la última década los estudios sobre los extractos acuosos de propóleos han ido incrementándose.
La principal ventaja que presenta el propóleos acuoso, es la ausencia de los efectos no deseados del etanol sobre las células como las de mucosa y tejido epitelial. La naturaleza anfifílica del etanol lo hace un compuesto que difunde fácilmente por las membranas y mucosas biológicas. Además, sus interacciones se traducen como un aumento en la fluidez de las mismas de manera que podría alterar las interacciones normales entre lípidos y proteínas afectando así las funciones de estas últimas (Elvir, 2003).
Varios estudios han probado el agua como disolvente, dando como resultado soluciones que contenían menos compuestos extraídos (Park et al., 1998). Sin embargo, el empleo de uno u otro método también puede relacionarse con la aplicación posterior a la que será sometido el producto.
Hay pocas sustancias del propóleos que se pueden extraer con agua. Sin embargo, se plantea que el contenido de componentes acídicos del propóleos, son más altos en los extractos acuosos que en los etanólicos (Vakhonina, 1995). La fracción soluble del propóleos acuoso contiene ácidos fenólicos y carboxílicos, aminoácidos, vitaminas, compuestos órganominerales y algunos flavonoides (Kaygorodov, 2013).
Tomando en cuenta que se buscaba un extracto natural, sin la adición de otros compuestos sintéticos, se emplearon diferentes alternativas de extracción para aumentar la solubilidad de esos compuestos poco solubles.
El EA1 es un método sencillo que sigue las pautas de la metodología más empleada para la preparación de extractos etanólicos; consiste en la maceración del producto en el solvente con una posterior decantación o filtración del mismo para la extracción de la fracción útil (Yong y Liu, 2021). En este caso el solvente empleado fue el agua. A pesar de utilizar el mismo método, EA1 mostró diferencias con EE1 con bajos porcientos de materia seca y contenido de fenoles y flavonoides.
Buscando un método de extracción con otras ventajas, como un menor tiempo de extracción y menor degradación térmica, se empleó la extracción asistida por ultrasonido. La literatura reporta las ventajas de este método en la obtención de extractos ricos en fenoles a partir de fuentes vegetales (Marcelo-Díaz et al., 2017). No obstante, bajo las condiciones empleadas, el EA3 fue el extracto con los valores más bajos en todos los indicadores analizados.
Por otra parte, el punto de ebullición de los compuestos fenólicos generalmente se encuentra por encima de los 180 °C. El propóleos puede contener otros compuestos sensibles a las altas temperaturas. Teniendo en cuenta esto, se realizó una extracción por soxhlet empleando el agua como solvente. El EA5 también obtuvo diferencias con respecto al EE1 para los indicadores analizados.
Para la preparación de EA2 y EA4 se tuvo en cuenta que los fenoles se encuentran presentes en las plantas en forma de heterósidos, compuesto formado por una glicona o carbohidrato y la aglicona o genina formada por el fenol. Estos últimos por sí solos son insolubles en agua, mientras los heterósidos son solubles en ellas (Cartaya y Reynaldo, 2001). Las abejas, cuando recolectan las resinas, son capaces de modificar estos heterósidos. Durante la recolección y procesamiento del propóleos, la enzima β-glicosidasa, escinde el enlace liberando la glicona de la genina (Zhang et al., 2012). Esto hace que, en el propóleos, como producto final, se encuentre la presencia de las tres sustancias: geninas, gliconas y heterósidos (Zhang et al., 2012).
La actividad anfifílica del etanol permite la extracción de una gran variedad de sustancias. En este solvente las sustancias mencionadas son fácilmente extraíbles. Así pues, para garantizar la mayor extracción de flavonoides y fenoles en general, con la mínima presencia del etanol, se realizó la extracción empleando la mezcla etanol-agua (30:70) (EA2) y una extracción con la mezcla etanol-agua (70:30) con la posterior evaporación del etanol y solubilización en agua (EA4). Estos extractos fueron, entre los extractos acuosos, los que presentaron el mayor contenido de materia seca, contenido de flavonoides y fenoles.
El índice de oxidación se evaluó como la capacidad antioxidante de los extractos. Indica la presencia de compuestos de naturaleza fenólica o con grupos funcionales oxidables, con buena capacidad oxidante donde a mayor concentración de compuestos oxidables menor tiempo de decoloración. A pesar de la diferencia en el contenido fenólico de los diferentes extractos, la actividad antioxidante resultó muy similar en todos los extractos etanólicos y acuosos y sin diferencias significativas. Esto sugiere que a pesar de un contenido fenólico más bajo que los etanólicos, los procedimientos empleados para la extracción en medio acuoso no solo son capaces de extraer suficientes compuestos fenólicos, sino otros grupos o compuestos reactivos suficientemente fuertes para generar igual respuesta que los extraídos con etanol.
La actividad antimicrobiana medida a través de los halos de inhibición producidos por los extractos EA2 y EA4 resultó similar a EE1, e incluso, el empleo de concentraciones más altas de etanol provocó un aumento de la actividad en EE2. Sin embargo, para el resto de los extractos resultó nula. Dado que la actividad antimicrobiana depende de las características específicas de los principios activos presentes en los extractos y de su solubilidad en los solventes empleados para la extracción, esto llevó a pensar en la necesidad de la presencia del etanol en los procesos para la extracción de los compuestos responsables de la actividad antimicrobiana.
La correlación positiva entre el contenido de materia seca, flavonoides y fenoles, refleja la dependencia positiva de estos indicadores entre ellos. Existe una relación entre la cantidad de compuestos extraídos y el contenido de flavonoides y fenoles según cada método de extracción. El incremento de uno de estos indicadores puede asociarse a un aumento del otro.
El índice de oxidación podría estar solamente relacionado con el poder oxidante de los fenoles y otros compuestos solubles en agua extraídos por los diferentes métodos. No obstante, se pudo observar que aun con las diferencias en los contenidos de materia seca, flavonoides y fenoles en general, los extractos acuosos analizados mostraron similares resultados de este indicador.
La actividad antibacteriana por su parte, presentó un comportamiento similar al contenido de fenoles totales. De los propóleos acuosos destacan EA2 y EA4. Esto lleva a pensar que los compuestos responsables de la actividad antioxidante no tienen que coincidir con los implicados en la actividad antibacteriana.
La regresión lineal permitió predecir cuánto estas actividades dependen de los indicadores contenido de flavonoides y fenoles. Este caso, mostró un coeficiente de determinación (r2) muy bajo entre el índice de oxidación y el contenido de flavonoides (r2=0.0564) y fenoles (r2=0.0304) (figura 1). Esto sugiere que existe una relación muy baja entre la actividad antioxidante de los extractos analizados con el contenido de estas sustancias. El modelo lineal resultó muy pobre, con probabilidades por encima de 0.05, describiendo menos del cinco por ciento el pronóstico de la acción antioxidante si conocemos el contenido de flavonoides y fenoles.
Para el halo de inhibición, este mostró un coeficiente de determinación con el contenido de flavonoides de r2=0.4746 y fenoles de r2=0.4845. La relación en este caso es un poco más fuerte. El modelo describe casi un 50% el pronóstico de la acción antibacteriana sobre el S. aureus conociendo el contenido de flavonoides y fenoles.
La clasificación del propóleos cubanos según su composición de compuestos mayoritarios está dividida en tres grupos: tipo I, Tipo II y Tipo III (Cuesta-Rubio et al., 2007). El propóleos Tipo II se caracteriza por ser muy rico en isoflavonoides (Cuesta-Rubio et al., 2007; Piccinelli et al., 2011) y sus extractos etanólicos han tenido diferentes aplicaciones (Ledón et al., 1996; Fernandez et al., 2014;).
Varios autores han mostrado que según el solvente a emplear en la extracción, se pueden extraer unas u otras sustancias (Funari et al., 2019; Kubiliene et al., 2015; Kubiliene et al., 2018). El agua y el etanol presentan diferentes polaridades, así que cabe esperar que algunas sustancias, entre ellas algunos fenoles, sean capaces de ser extraídos en uno u otro de estos solventes. No obstante, en el estudio, la CCD revelada a 254 nm de los extractos acuosos y etanólicos (figura 2A), mostró las mismas bandas para ambos solventes con diferencias en la intensidad, y por tanto, concentración, de los compuestos revelados.
Con los diferentes métodos de extracción empleando el mismo solvente, se esperaba que algunos compuestos fuesen capaces de mantenerse en la matriz de estudio y ser muy poco extraídos, impidiendo su revelado en la cromatografía. A pesar de ello, los extractos preparados por diferentes métodos, mostraron mucha similaridad en el revelado de las bandas, aunque con intensidades diferentes sugiriendo la variación en la cantidad presente en el extracto de dichos compuestos.
Esto no exime la existencia de otros compuestos, entre ellos algunos con origen fenólico, que no fueran capaces de ser revelados en la CCD y que podrían ratificar la diferencia entre los solventes y métodos de extracción empleados en cuanto a la composición. Esto se pudo observar en la CCD revelada a 366 nm (figura 2B) donde bandas como la del Rf=0,25 no son visibles en los extractos etanólicos EE1 y EE2 y si lo son para el resto de los extractos acuosos, incluidos EA2 y EA4 donde se empleó el etanol como parte del solvente.
CONCLUSIONES
Los extractos de propóleos acuosos obtenidos a partir de la misma muestran y extraídos por diferentes métodos, presentan diferencias en las concentraciones de sus compuestos. De estos, los extraídos con mezclas hidroalcohólicas y disueltas en agua, presentaron los mayores valores en el contenido de materia seca, flavonoides, fenoles y actividad antibacteriana.
Las propiedades antioxidantes de los extractos, expresados por la determinación del índice de oxidación, depende en gran medida de la presencia de grupos fuertemente oxidables y no del contenido de flavonoides y fenoles. Mientras, la actividad antibacteriana, ensayada en S. aureous, depende, al menos en un 50%, del contenido de flavonoides y fenoles.
















