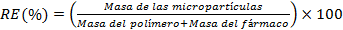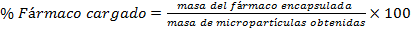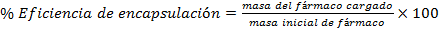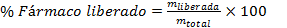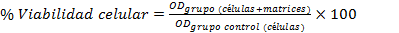INTRODUCCIÓN
La osteoartritis, es una afección articular que se observa con mucha frecuencia en la población adulta de cualquier región del mundo (Solis, Hernández, Prada, de Armas, Ulloa, 2013); (Iolascon et al, 2017) y que se caracteriza por: la pérdida del cartílago articular, la formación de osteofitos, dolor articular y reducción de la viscosidad del líquido sinovial afectando la lubricación articular (Arunkumar, Indulekha, Vijayalakshmi, Srivastava, 2016). Estas características conducen progresivamente a una pérdida o disminución de la función articular y a la atrofia muscular, produciendo afectación de la vida laboral y en muchos casos la incapacidad laboral permanente, aspectos que se asocian a un deterioro importante de la salud, influyendo en la calidad de vida de la persona (Solis, Hernández, Prada, de Armas, Ulloa, 2013).
En Cuba debido a la alta expectativa de vida al nacer, el 16,6 % de la población está por encima de los 60 años, cifra que aumentará a un 21 % para el 2025, por lo que las afectaciones del sistema osteoarticular constituyen un importante problema de salud. Generalmente durante el tratamiento farmacológico de la enfermedad se utiliza una combinación de analgésicos simples, antiinflamatorios no esteroideos (AINEs) y/o glucocorticoides tanto por vía oral como tópica.
Los pacientes con inflamación local y derrame articular requieren de inyecciones intraarticulares de glucocorticoides. Existe una amplia gama de formulaciones de glucocorticoides disponibles para la inyección intraarticular, en solución o suspensión, con un volumen de inyección típico de 1 o 2 mL. Para mejorar la seguridad de la aplicación, especialmente con respecto al manejo aséptico, varias de estas formulaciones están disponibles en jeringas pre-llenadas, listas para el uso (Gerwin, Hops, Lucke, 2006). Las formulaciones existentes en el mercado para la terapia localizada ofrecen a los pacientes un alivio rápido del dolor, pero presentan tiempos de residencia cortos con una vida media menor a las 12 horas dentro del espacio de la articulación, lo que conlleva a inyecciones frecuentes para lograr el intervalo de concentraciones terapéuticas adecuado (Arunkumar, Indulekha, Vijayalakshmi, Srivastava, 2016); (Heard et al, 2015); (Zhang et al, 2016).
Una de las limitaciones de la administración de medicamentos en las cavidades articulares es el flujo de salida de los fármacos del lugar de inyección después de la aplicación. En la literatura se reportan diferentes formulaciones basadas en hidrogeles termosensibles que se forman in situ en la zona de aplicación, sin embargo, en el caso específico de fármacos de bajo peso molecular la liberación ocurre rápidamente en las primeras horas, lo que se atribuye a no existencia de una distribución homogénea del fármaco en el hidrogel que se forma y a la naturaleza heterogénea de la matriz polimérica. Con el fin de obtener una liberación sostenida se investiga en diferentes enfoques en los que se incluye la incorporación al hidrogel termosensible de microesferas cargadas con fármacos (Ho, Kim, Choi, Kang, 2019)
Estos sistemas de micropartículas/ hidrogel integran dos materiales distintos en una misma formulación con propiedades fisicoquímicas que no pueden ser alcanzadas por ninguno de los dos componentes de manera independiente.
La policaprolactona es un poliéster semicristalino con una temperatura de transición vítrea muy baja (-60 ºC) y una temperatura de fusión de unos 62 ºC. Se sintetiza por polimerización aniónica, catiónica o de coordinación de la ε-caprolactona. Tiene carácter hidrófobo, buena estabilidad in vitro y es biocompatible. Su buena permeabilidad a moléculas pequeñas de fármacos y su ausencia de toxicidad hacen que este polímero tenga una gran utilidad en aplicaciones médicas (Mondal, Griffith, Venkatraman, 2016); (Gurler et al, 2019).
La quitosana [(1→4)-2-amino-2-desoxi-β-D-glucano] es un polímero lineal, semicristalino que se obtiene por desacetilación parcial de la quitina, [(1→4)-2- acetamido-2-desoxi-β-D-glucano], segundo polisacárido en abundancia en la naturaleza después de la celulosa. Es insoluble a pH neutro y básico, pero en presencia de ácidos como el glutámico, acético, láctico y clorhídrico, los grupos aminos libres de la glucosamina se protonan lo que posibilita la solubilidad de la molécula (Ahsan et al, 2018); (Ali & Ahmed, 2018). Este polímero presenta excelentes propiedades que permiten utilizarlo como biomaterial en aplicaciones biomédicas y en la industria farmacéutica como matriz para la liberación de fármacos. Es biocompatible, biodegradable, mucoadhesivo, bactericida y no tóxico, adopta diferentes estructuras físicas, favorece el crecimiento celular y su bioestimulación facilita la reconstrucción y la vascularización del tejido dañado (Qi et al, 2016); (Gegel et al, 2022).
Otro de los polímeros sintéticos ampliamente utilizados son los Pluronic® o poloxámeros, copolímeros tribloque que tienen un comportamiento termorreversible en soluciones acuosas. Su estructura consiste en bloques de óxido de polietileno y bloques de óxido de polipropileno (Fattahpour et al, 2020).
El poloxámero 407 (Pluronic® F127) tiene la capacidad de formar un gel transparente a temperatura corporal (37 °C), al 20 % p/v, que es un valor menor que las concentraciones referidas en la bibliografía para otros miembros de la serie de los poloxámeros. Se reporta en la literatura que las formulaciones a base de estos compuestos aumentan el tiempo de residencia de los fármacos en los lugares de aplicación, lo que resulta en una mejora de la biodisponibilidad y la eficacia; por lo que son ampliamente utilizados en investigaciones farmacéuticas, ya que la naturaleza termorreversible de los hidrogeles permite que el medicamento se administre por vía subcutánea o intraarticular como una solución micelar fluida, que se solidifica in situ para formar un depósito de medicamentos estable y de larga duración (Bodratti & Alexandridis,2018)
El objetivo principal de este trabajo consistió en obtener un sistema de inyección intraarticular, a base de micropartículas de policaprolactona e hidrogel de quitosana/Pluronic como matriz para la liberación controlada de dexametasona en el tratamiento de la osteoartritis.
MATERIALES Y MÉTODOS
Preparación de las micropartículas de policaprolactona
Las micropartículas se prepararon utilizando la técnica de doble emulsión y evaporación del disolvente. Para ello se prepararon disoluciones de policaprolactona (PCL) en diclorometano con diferentes concentraciones a las que se le incorporó agua para formar una emulsión estable con ayuda de un ultra-turrax a una velocidad de 20 000 rpm por 3 minutos. La emulsión resultante se añadió lentamente sobre una disolución de alcohol polivinílico (PVA) al 2 % para formar la segunda emulsión con ayuda de un agitador magnético. La evaporación del disolvente se realizó a temperatura ambiente durante 2 horas. Posteriormente se centrifugó y se realizaron los procesos de lavados con agua destilada, para eliminar el PVA. Las micropartículas fueron secadas mediante un proceso de liofilización y pesadas a continuación para conocer el rendimiento del proceso. Se realizaron varias formulaciones variando la concentración de la disolución de policaprolactona de partida y la velocidad de agitación durante la formación de la segunda emulsión (Tabla 1).
Morfológica y tamaño de las partículas obtenidas
La morfología de las micropartículas obtenidas se analizó mediante Microscopía Electrónica de Barrido (MEB) utilizando un microscopio (S-800, HITACHI, Tokio, Japón) y se utilizó un sistema de análisis de imágenes (Escan 4000, Bum-Mi Universe Co., Ltd., Ansan, Corea). Las muestras se colocaron en el porta muestras utilizando una cinta conductora doble adhesiva y se recubrieron con una capa ultrafina de Pd/Pt antes de su visualización utilizando un dispositivo de recubrimiento por bombardeo iónico (E1010, HITACHI, Tokio, Japón).
Se determinó el tamaño de las micropartículas procesando las micrografías obtenidas, mediante medición directa de 50 micropartículas seleccionadas aleatoriamente, utilizando el software de análisis de imágenes Image J 1.51j8, mediciones que fueron procesadas estadísticamente para normalizar su distribución.
Incorporación de la dexametasona a las micropartículas de policaprolactona. Morfología y tamaño
Se empleó el mismo procedimiento para obtener las micropartículas cargadas con dexametasona, en este caso para formar la primera emulsión se adicionan 100 mg de dexametasona disueltos en 1,25 mL de agua a la disolución de PCL en diclorometano.
En este caso también se analizó la morfología mediante MEB y se determinó el tamaño de las partículas procesando las micrografías utilizando el software de análisis de imágenes Image J 1.51j8.
Determinación del rendimiento y de la eficiencia de encapsulación
Para determinar el rendimiento del proceso se pesó la masa de micropartículas obtenidas y se aplicó la siguiente ecuación.
Para determinar la eficiencia de encapsulación primeramente se determinó el contenido de fármaco cargado, para ello se disolvieron 50 mg de micropartículas cargadas en 5 mL diclorometano, el fármaco se extrajo 3 veces con disolución tampón fosfato salino (PBS). Los extractos acuosos fueron recopilados para posteriormente ser analizados mediante espectrofotómetro UV- Visible a una longitud de onda de 242 nm y así determinar el contenido de fármaco encapsulado. El % de fármaco cargado y el % de eficiencia de encapsulación se calculó utilizando las ecuaciones.
Obtención del hidrogel y determinación del tiempo de gelificación
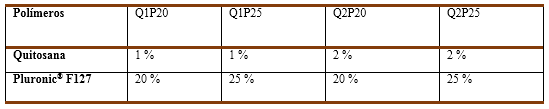
El hidrogel termosensible se preparó a partir de la mezcla física de los polímeros que lo componen. A una disolución de quitosana se le añadió el Pluronic® F127 manteniendo la agitación hasta total disolución y controlando que la temperatura no exceda los 4 °C. Las muestras fueron colocadas en una incubadora a 37 °C para la formación del hidrogel. Se variaron las proporciones de los polímeros en la mezcla resultante según se muestra en la Tabla 2.
El tiempo de gelificación del hidrogel obtenido se determinó de forma aproximada mediante la técnica del vial invertido. Para ello se añade 1 mL de la mezcla líquida en un tubo de ensayo de 10 mL y se coloca en un baño termostatado a 37 ºC, cada 1 minuto se retira y se invierte para observar la fluidez. El momento en que la disolución deja de fluir se considera como el tiempo de gelificación.
Caracterización por FTIR del hidrogel
Se obtuvieron los espectros FTIR de la mezcla polimérica en forma de hidrogel y de sus componentes por separado en un espectrofotómetro FTIR IRSpirit-T, en el intervalo de 4000 a 400 cm-1, a 4 cm-1 de resolución y 32 escaneos para cada muestra, acoplado con software LabSolutions IR.
Obtención del sistema micropartículas/hidrogel y determinación del tiempo de gelificación
Las micropartículas cargadas con dexametasona (50 mg) se incorporaron a 2 mL del hidrogel de quitosana/Pluronic® F127 y posteriormente se colocan en una incubadora a 37 °C para su gelificación.
Para determinar el tiempo de gelificación del sistema hibrido se procedió de igual manera que en el caso del hidrogel de quitosana/Pluronic® F127, utilizando el método del vial invertido.
Estudio de liberación in vitro de dexametasona desde las micropartículas, el hidrogel y el sistema
Para el estudio de liberación de las micropartículas, se colocaron 50 mg de estas en una membrana de diálisis para evitar su pérdida durante el proceso de extracción de las alícuotas. Posteriormente la membrana se introduce en un recipiente que contiene 100 mL de PBS a 37 °C. A intervalos de tiempos previamente fijados se extrajo una alícuota de 5 mL del medio de liberación para realizar las mediciones y el volumen extraído fue remplazado por disolución de PBS fresca para mantener el volumen constante.
En el caso del estudio de liberación de dexametasona desde el hidrogel y el sistema inyectable se introduce la disolución de quitosana/Pluronic® F127 con y sin las micropartículas cargadas de dexametasona en la membrana de diálisis y se colocan en el recipiente con PBS a 37 °C, se observa la formación del gel en los primeros 5 minutos y se procede de igual forma que en el caso de las micropartículas.
Todos los estudios se realizaron por triplicado y con una agitación mecánica continua. La cantidad de dexametasona liberada se siguió por espectrofotometría UV-Visible a una longitud de onda de 242 nm.
Para realizar el cálculo del porciento de fármaco liberado en el tiempo se empleó la siguiente ecuación
Estudio de citotoxicidad de las micropartículas, el hidrogel y el sistema
Para evaluar la citotoxicidad de las matrices obtenidas de acuerdo con la Norma ISO 10993-5() se empleó el ensayo MTS. Este ensayo se basa en la reducción metabólica de la sal de tetrazolio (3-(4,5-dimetiltiazol-2-il)-5-(3-carboximetoxifenil)-2-(4 sulfofenil)-2H tetrazolio) (MTS) a cristales de formazán por el sistema succinato-tetrazolio reductasa, que se encuentra activo solamente en células viables. Las células empleadas para el estudio (C-28 de condrocitos humanos) se incubaron a 37 ºC, en atmosfera de CO2 (5 %) de conjunto con matrices preparadas en placas de 96 pocillos en condiciones de cultivo estándar a una densidad de 1(104 células / pocillo. Después de 24 h, 48 h y 72 h de incubación se adicionaron 20 µL del reactivo de MTS (CellTiter 96®, Promega) y las células se incubaron por otras 3 h protegiendo las placas de la luz. Finalmente se midió la densidad óptica (OD, en inglés) a 490 nm utilizando un lector de placas (FLUOstar OPTIMA, BMG Lab technologies, Alemania) (Programa Softmax Pro). El ensayo se realizó por triplicado para el caso de las micropartículas, el hidrogel y el sistema inyectable, utilizando como control positivo dimetilsulfóxido y como control negativo solo células.
El porciento de viabilidad celular se determinó mediante la relación de la densidad óptica de la muestra y el control negativo según la ecuación siguiente:
RESULTADOS Y DISCUSIÓN
Preparación de las micropartículas de policaprolactona
Se obtuvieron micropartículas de PCL con diferente composición como se muestra en la Tabla 1 del capítulo de Materiales y Métodos. Los rendimientos obtenidos para las diferentes composiciones se encuentran en un rango de (84 ± 2) %.
Una vez obtenidas las micropartículas, el trabajo se centró en su caracterización morfológica, así como la determinación de su tamaño para posteriormente incluirlas en el hidrogel.
La concentración de PCL y la velocidad de agitación en la segunda emulsión empleadas en la obtención de las micropartículas son factores que influyen en características como el tamaño, la distribución de tamaños y la morfología de las mismas, lo que se analizará más adelante.
Morfológica y tamaño de las partículas obtenidas
Las Figuras 1 y 2 muestran las micrografías correspondientes a las micropartículas obtenidas con 500 y 1000 rpm respectivamente, como velocidad de agitación en la segunda emulsión del proceso.

Fig. 1 Micrografías de las partículas obtenidas a una velocidad de 500 rpm en la segunda emulsión, magnificación de 1000 x.
El análisis morfológico en ambos casos reveló que las micropartículas presentan forma esférica y se observa una gran aglomeración de las mismas y una elevada polidispersión.
Para las dos velocidades de agitación se observa una dependencia directa entre el tamaño de las micropartículas y la concentración del polímero. Esta tendencia se ve más acentuada en las micropartículas obtenidas utilizando 500 rpm como velocidad de agitación de la segunda emulsión.
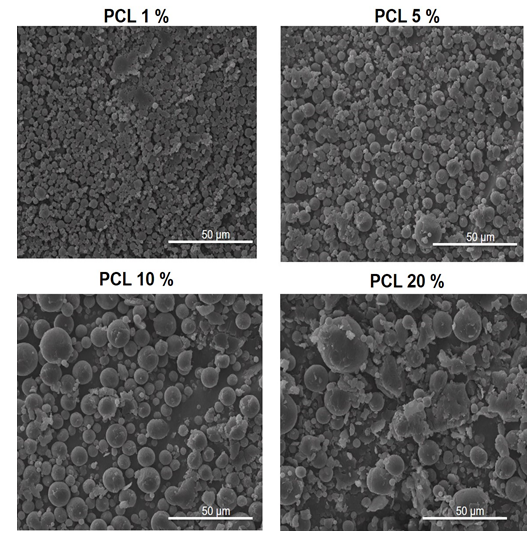
Fig. 2 Micrografías de las partículas obtenidas a una velocidad de 1000 rpm durante la segunda emulsión, magnificación de 1000 x
Las micropartículas obtenidas a partir de la disolución de PCL al 20 % y a las dos velocidades de trabajo no mostraron una forma bien definida lo que pudiera deberse a la alta concentración de polímero, que aumenta la viscosidad de la disolución al preparar la primera emulsión.
Esta conclusión se corresponde con lo observado por Iqbal y colaboradores, al obtener micropartículas de PCL mediante doble emulsión evaporación del disolvente usando la técnica de ultrasonido (Iqbal, Valour, Fessi, Elaissari, 2015).
El tamaño de las micropartículas es una de las características más importantes a evaluar en este tipo de sistema para su aplicación como sistema de liberación de fármacos, debido a que la misma influye en la ruta de administración del principio activo.
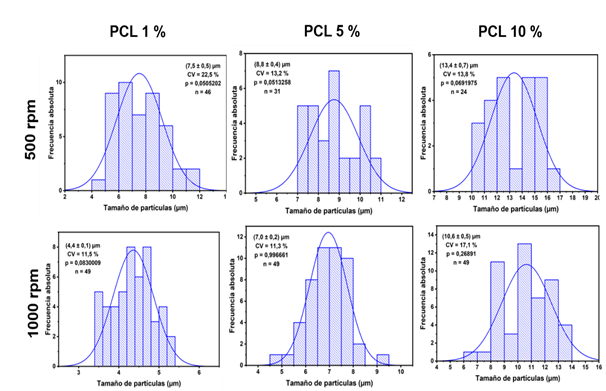
Las micropartículas obtenidas presentan tamaños entre 4-14 µm (Figura 3). Se analizó la influencia de factores como el contenido de PCL empleado y la velocidad de agitación de la segunda emulsión en el tamaño y su distribución en las micropartículas obtenidas.
Los resultados corroboran lo observado en las micrografías, a medida que aumenta el contenido de polímero en la formulación aumenta notablemente el tamaño de partícula, esto se corresponde con lo observado por Iqbal y colaboradores y se debe fundamentalmente al aumento de la viscosidad de la primera emulsión que disminuye la eficiencia del segundo paso de reducir el tamaño de partículas (Iqbal, Valour, Fessi, Elaissari, 2015).
Por otra parte, al aumentar la velocidad de agitación durante la formación de la segunda emulsión el tamaño de micropartículas disminuye ya que hay una mayor probabilidad de que las gotas grandes se rompan y formen partículas de menor tamaño.
Micropartículas cargadas con dexametasona. Morfología y tamaño
Debido a que las micropartículas de menor tamaño se obtienen con la disolución de PCL al 1 % y a una velocidad de agitación de 1000 rpm durante la formación de la segunda emulsión, estas fueron las condiciones escogidas para preparar las micropartículas cargadas con dexametasona.

Fig. 4 Micrografías de las micropartículas de PCL 1 % sin cargar y cargadas con dexametasona (PCL 1%-DMT) a diferentes magnificaciones (A y B:1000 x y C:5000 x)
En las micrografías de las micropartículas cargadas con dexametasona (Figura 4) también se observa una gran aglomeración. Las micropartículas muestran forma esférica y no se aprecian cristales de fármacos o restos de polímeros en la superficie.
Las micropartículas de PCL 1 % cargadas con dexametasona presentan un menor tamaño en comparación con las micropartículas sin cargar a esa misma concentración (Figura 5), lo que evidencia que la presencia del fármaco en el proceso de obtención de las micropartículas tiene un efecto sobre el tamaño de las mismas.
Este efecto puede estar asociado a que la presencia de la dexametasona en forma de sal fosfato sódica influya en la repulsión electrostática entre las gotas, disminuyendo la posibilidad de agregación entre ellas, en la estabilidad y tamaño de las microgotas formadas durante la primera emulsión y por ende favorezca la formación de micropartículas de menor diámetro.
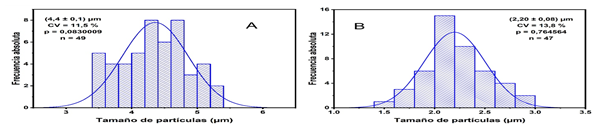
Fig. 5 Curvas de distribución de las micropartículas PCL 1% sin cargar (A) y cargadas con dexametasona (B).
El tamaño obtenido para las micropartículas cargadas con dexametasona (2,20 ± 0,08 µm) en nuestra investigación se corresponde con el reportado por Chen y colaboradores para el sistema de administración intraarticular a base de microesferas e hidrogel de quitosana para la liberación de brucina.
Determinación del rendimiento y de la eficiencia de encapsulación
En la Tabla 3 se muestran los resultados obtenidos en porciento para el fármaco cargado, el rendimiento y la eficiencia de encapsulación, según las ecuaciones I, II y III, expuestas anteriormente
El contenido de fármaco cargado es bajo, lo que puede estar condicionado por la alta tendencia a migrar de los fármacos hidrofílicos, como la dexametasona, al medio externo acuoso desde las microgotas formadas en la primera emulsión. La eficiencia de encapsulación, que está asociada a la cantidad de fármaco total que logra ser encapsulado en la masa de micropartículas obtenidas, depende proporcionalmente de la carga, por ello en este caso, aunque la masa de micropartículas obtenidas en el proceso fue alta la eficiencia no lo fue.
Obtención del hidrogel y determinación del tiempo de gelificación
Se prepararon cuatro formulaciones de hidrogeles con diferentes composiciones de quitosana y Pluronic® F127 como se muestra en la tabla 2, pero sólo las formulaciones Q1P20 y Q1P25 gelificaron después de ser incubadas a 37°C, manteniendo su aspecto transparente. En la formulación Q2P25 no se logra la total disolución del Pluronic® F127 en la disolución de quitosana al 2 %, lo que se debe fundamentalmente a la alta viscosidad del medio. En el caso de la formulación Q2P20, luego de su exposición a 37 °C, no se logró la formación del hidrogel. Aunque en la literatura está reportada la gelificación de disoluciones de Pluronic® F127 en un intervalo de concentraciones entre 20 -30 %, y se define el proceso de formación de micelas como el principal en su gelificación al aumentar la temperatura, consideramos que la concentración de quitosana en el medio influyó en los cambios estructurales necesarios para la formación del hidrogel, al complejizar aún más un mecanismo que genera discusión (Hashemnejad, Badruddoza, Zarket, Castaneda, Doyle, 2019); (García, et al, 2022).
Se emplearon las formulaciones Q1P20 y Q1P25 para determinar el tiempo de gelificación del hidrogel para lo cual se utilizó la técnica del vial invertido. Después de ser expuestas las muestras a la temperatura de 37 °C se observa que la formulación Q1P25 gelifica en un tiempo alrededor de los 5 minutos mientras que la formulación Q1P20 lo logra alrededor de los 7 minutos.
Se seleccionó la formulación Q1P25, que presenta 1 % de quitosana y 25 % de Pluronic® F127, ya que mostró mejor consistencia y un menor tiempo de gelificación, lo que reduce la posible migración de las micropartículas fuera del sitio de inyección.
Caracterización por FTIR del hidrogel
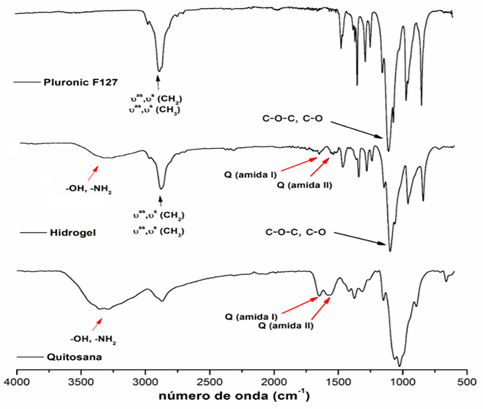
Se realizó la caracterización mediante FTIR con el objetivo de verificar si ocurrió alguna interacción química entre los polímeros que conforman el hidrogel. Los espectros resultantes se muestran en la Figura 6.
El espectro de absorción correspondiente al Pluronic® F127 muestra las bandas características de este polímero. Una banda alrededor de los 2990 cm-1 correspondiente a las vibraciones de valencia (C-H) de los grupos CH3 y CH2. Otras bandas características de este polímero son las correspondientes a las vibraciones de valencia de los enlaces -C-O-C y -C-O, que aparecen alrededor de los 1000 cm-1.
En el espectro infrarrojo de la quitosana se observan las bandas de absorción 3400 cm-1 solapadas por las vibraciones de valencia de los grupos OH- y NH2 y las bandas alrededor de 1600 cm-1 y 1500 cm-1 se corresponde con el enlace C=O propio de los grupos amida (Martínez, 2010)
En el espectro del hidrogel de quitosana/Pluronic® F127 se observan las bandas características de ambos polímeros indicando que no existen interacciones químicas entre los polímeros que conforman el hidrogel, demostrando que solo se obtiene una mezcla física entre ambos. Esta condición posibilita que cada uno de los polímeros brinde sus ventajas al material final.
Obtención del sistema micropartículas/hidrogel y determinación del tiempo de gelificación
El sistema se obtuvo incorporando las micropartículas de PCL al hidrogel Q1P25 como se describió anteriormente. Al sistema también se le determinó el tiempo de gelificación mediante el método del vial invertido. La inclusión de las micropartículas en el hidrogel no varió su tiempo de gelificación ya que fue de 5 minutos aproximadamente.
Estudio de liberación in vitro de dexametasona desde las micropartículas, el hidrogel y el sistema
Los estudios de liberación se realizaron en PBS, (pH= 7,4) para comparar el comportamiento de la liberación de dexametasona a partir de las micropartículas, el hidrogel y el sistema.
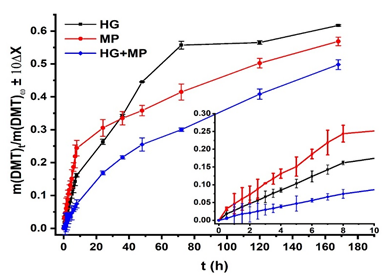
Fig. 7 Liberación in vitro de la dexametasona desde las micropartículas, el hidrogel y el sistema micropartículas/hidrogel, se amplía la liberación en las primeras 8 horas.
Los resultados obtenidos (Figura 7) evidencian que hasta los 7 días que se realizó el estudio, se liberó cerca de un 60 % de dexametasona desde el hidrogel y las micropartículas, mientras que desde el sistema micropartículas/ hidrogel se libera alrededor de un 50 %, lo que demuestra un mayor control en el proceso de cesión del fármaco al medio.
Al ampliar las primeras 8 horas de la liberación se observa una continua liberación de dexametasona desde cada uno de las matrices utilizadas.
El sistema inyectable micropartículas / hidrogel mostró un mayor control de la liberación, fundamentalmente durante las primeras horas. Este comportamiento es el esperado y se debe fundamentalmente a la doble barrera que el fármaco debe traspasar para ser liberado (Chen et al, 2012)
Estudio de citotoxicidad de las micropartículas, el hidrogel y el sistema
La citotoxicidad celular se define como una alteración de las funciones celulares básicas que conlleva a un daño que puede ser detectado. Como las matrices empleadas en este trabajo presentan una aplicación potencial como sistemas de liberación de fármacos en un sitio de implante es imprescindible evaluar esta propiedad.
Con el propósito de evaluar la viabilidad celular en presencia de los materiales obtenidos se realizó el ensayo MTS descrito anteriormente.
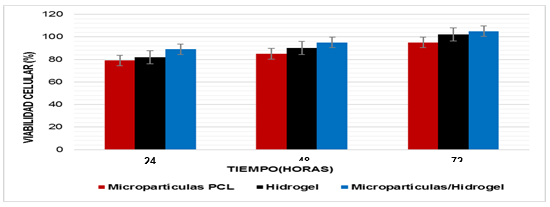
Fig. 8 Viabilidad celular de las micropartículas de PCL, el hidrogel y el sistema micropartículas/hidrogel.
La viabilidad celular de los condrocitos humanos determinada a partir del ensayo de MTS realizado para los tres sistemas evaluados fue superior al 70 % en los tiempos estudiados (24, 48 y 72 horas) (Figura 8). Teniendo en cuenta lo establecido por la norma ISO 10993-5 y de acuerdo a estos resultados podemos decir que los materiales no presentan efecto citotóxico sobre esta línea celular. Además, los resultados muestran un incremento en el porciento de células viables en el transcurso de los días lo cual sugiere que los materiales presentan propiedades favorables para la proliferación celular.
CONCLUSIONES
El sistema inyectable se obtuvo a partir de las micropartículas preparadas con menor concentración de PCL y mayor velocidad de agitación junto con el hidrogel preparado con las disoluciones de quitosana al 1 % y Pluronic® al 25 %. El sistema inyectable demostró un mayor control sobre la liberación de la dexametasona en el estudio preliminar in vitro de liberación y demostró no ser citotóxico con la línea celular C-28. El sistema inyectable obtenido evidencia ser una opción prometedora para el desarrollo de sistemas de administración intraarticular en el tratamiento farmacológico de la osteoartritis.