INTRODUCCIÓN
El síndrome respiratorio agudo grave (SARS por sus siglas en inglés) es el estadio grave de la enfermedad COVID-19 producido por un daño masivo alveolar y una falla respiratoria progresiva, ocasionado por el coronavirus tipo-2 del SARS (SARS-CoV-2) (Xu Z, et al. 2020). El espectro de las manifestaciones clínicas de la enfermedad es amplio e incluye desde un curso asintomático y autolimitado hasta neumonía atípica severa y progresiva, falla multiorgánica y muerte (Tian, S., 2020, Rodríguez-Morales AJ, et. al., 2020).
Se ha demostrado que el SARS-CoV-2 utiliza la enzima convertidora de la angiotensina-2 (ACE2) como el receptor diana para el ingreso en una célula hospedera. La expresión de ACE2 en células de tejidos humanos podría indicar un potencial riesgo de reconocimiento por parte del virus y, por ende, ser susceptibles a la infección. (Saez-Valero, J. 2021)
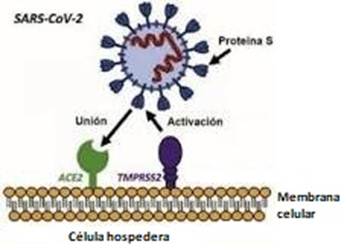
Fig. 1 Reconocimiento de ACE2 y mecanismo de entrada del SARS-CoV-2. La proteína S reconoce y se une al factor de unión celular (ACE2) por medio del dominio RBD. Posteriormente, la proteína de unión S es procesada proteolíticamente por TMPRSS2 (proteasa celular) produciéndose la separación del dominio RBD, la activación de la proteína de unión S y la posterior fusión de ambas membranas (Adaptado de Mousavizadeh & Ghasemi, 2020)
Se trata de una glicoproteína que se encuentra distribuida de manera abundante en las membranas celulares de nuestro organismo. Particularmente, en la mucosa oral, nasal y en el epitelio del pulmón, lo que proporciona posibles vías de entrada para el coronavirus. El tracto gastrointestinal, los riñones, el corazón, las glándulas suprarrenales, el cerebro y los testículos son ejemplos de tejidos extrapulmonares con expresión de ACE2 confirmada e invasión por SARS-CoV-2. Esta proteína se dispone atravesando la membrana. De esta forma, la mayor parte de su estructura queda expuesta hacia fuera de la célula. Esto hace que pueda funcionar como receptora e interaccionar con otras proteínas o ligandos. (figura 1) (Saez-Valero, J. 2021; Sáez-Valero J., et al. 2021)
La respuesta humoral a la proteína-S del SARS-CoV-2 determina el desarrollo de inmunidad protectora frente a esta infección. El método estándar de detección de anticuerpos neutralizantes es una prueba de neutralización de virus vivo. Se puede reemplazar con la prueba sustituta de neutralización de virus (sVNT, en inglés) basada en un ELISA, que mide la capacidad de los anticuerpos séricos para inhibir la formación de complejos entre el dominio de unión al receptor (RBD) de la proteína S y el receptor celular ACE2. (Kolesov, D., et al. 2022)
En la actualidad, se han propuesto diversas alternativas terapéuticas, aunque los resultados de estudios en la población no son concluyentes y no se dispone de ninguna intervención terapéutica aprobada frente a COVID-19, por lo que existe un gran número de trabajos abogando por el uso de estrategias de inmunización pasiva entre ellas las inmunoglobulinas intravenosas (IGIV) que se han utilizado de forma segura durante décadas para tratar enfermedades autoinmunes, inmunodeficiencias, y ciertas infecciones bacterianas y virales (Prete M., et. al, 2020; Scoppetta C., et. al. 2020; Saghazadeh A., Rezaei N., 2020; Nguyen AA., et. al. 2020). Los mecanismos moduladores de la inflamación inducidos por las IGIV y el incremento consistente observado del nivel de inmunoglobulina conforme avanzan el curso de la enfermedad (Requena I., Nuñez C. 2020), sustenta la posibilidad de que la terapia con IGIV hiperinmune anti SARS-CoV-2 pueda mejorar el pronóstico clínico y ayudar a acelerar la recuperación de pacientes con COVID-19 (De Alwis R., Chen S., Gan ES., Ooi EE. 2020).
El plasma de convalecientes (PC) utilizado en los últimos meses (Tanne JH., 2020) en los primeros estadios de la enfermedad, ha dejado muchas cuestiones pendientes en la demostración de su eficacia debido al limitado tamaño de las muestras, el diseño de los estudios, la terminación anticipada de los ensayos y el no completamiento de los resultados (Shen C, Wang Z, Zhao F et. al., 2020; Chai KL, Valk SJ, Piechotta V., et. al. 2020).
Algunos países obtuvieron donaciones de PC para utilizarlo en la obtención de una formulación de inmunoglobulina enriquecida en anticuerpos anti-SARS-CoV-2 (Vandeberg, P.; Cruz, M.; Diez, J.M.; et al. 2020; Shaukat A., Syed M., Ayesha A., et. al. 2021; Díez, J.M.; Romero, C.; Cruz, M.; Vandeberg, P.; et. al. 2021) la cual pudiera ser administrada por vía intravenosa, intramuscular o subcutánea.
En este trabajo vamos a describir los resultados del desarrollo de una inmunoglobulina intravenosa, obtenida a partir del plasma de pacientes convalecientes de la Covid-19, el cual fue analizado usando técnicas de biología molecular y procesado en la Planta de Hemoderivados perteneciente a los Laboratorios AICA de la República de Cuba.
MATERIALES Y MÉTODOS
Reactivos
Se empleó un kit de ácidos nucleicos (NAT) para el diagnóstico de los virus de Hepatitis B, Hepatitis C, y los serotipos 0, 1 y 2 del VIH de Roche Diagnostic (Suiza). Se empleó una variante del método ELISA (método UMELISA SARS-CoV-2 IgG) para determinar el título de anticuerpo (Centro de Inmunoensayos (CIE), Cuba).
El reactivo PerciNorm-U fue obtenido de Roche, (Suiza). Se usó un Kit cinético cromogénico PyroChrome para determinación de endotoxinas (LAL) de Cape Cod Inc., (USA).
El sodio di-hidrógeno fosfato dihidratado, el di-sodio hidrógeno fosfato anhidro, el sodio cloruro, el sodio hidróxido, el ácido acético, la solución buffer de suero de carnero y la fosfatasa alcalina fueron obtenidos de Merck-Millipore, (Alemania) y el 4-metil-umbriferyl fosfato de Koch Light, del Reino Unido.Todos los productos químicos usados fueron de grado reactivo y se usaron tal como se recibieron.
MÉTODOS
Selección de los donantes y colección de plasma
Fueron seleccionados pacientes convalecientes del SARS-CoV-2 entre 18 y 60 años de edad, que resultaron negativos al test por RT-PCR y con presencia de anticuerpos anti-SARS-CoV-2, a las 4 semanas posteriores al diagnóstico de la infección y sin otro criterio de exclusión como donante de acuerdo a las regulaciones de los procedimientos de Cuba para los Bancos de Sangre y Servicios de transfusión y específicamente el protocolo de actuación nacional para la Covid-19. (Ministerio de Salud Pública, 2020). Las donaciones se obtuvieron mediante estricta voluntariedad de los donantes manteniendo el consentimiento informado. Las bolsas de plasma fueron almacenadas inmediatamente en condiciones de congelación a -20°C. El plasma fue procesado usando un sistema Cobas-201 de Roche Diagnostic (Suiza) que permite mediante técnica de ácidos nucleicos (NAT) el diagnostico de los virus de Hepatitis-B, Hepatitis-C, y los serotipos 0, 1 y 2 del VIH para los cuales tienen que resultar negativo.
UMELISA SARS-CoV-2 IgG
Las placas de Ultramicroelisa fueron incubadas cuatro horas a 45°C con péptidos sintéticos de la región inmunodominante de la proteína RBD del virus (15 μL por pocillo). Las muestras del plasma fueron diluidas del 1 al 20 en doble diluciones de la concentración inicial con solución buffer de suero de carnero (en otra placa). Fueron añadidos 10 μL de plasma diluido a los pocillos e incubados a 37°C por 30 minutos. Después de 4 lavados con la solución buffer, se añade 10 μL de anticuerpos anti-IgG humana conjugada con fosfatasa alcalina (para la titulación de los anticuerpos IgG) en cada placa y se incubó a 37°C por 30 minutos. Posterior a 4 lavados, se añadió 10 μL de 4-metil-umbriferyl fosfato y se incubó a 20-25°C por 30 minutos en la oscuridad y el sustrato se hidroliza. La intensidad de fluorescencia es proporcional a la presencia de anticuerpos. Todas las muestras se analizaron por duplicado. El título de anticuerpos se determinó por dilución final.
Determinación de endotoxinas
Las mediciones se realizaron utilizando un lector de microplacas de incubación modelo ELx808 IU (BioTek® Instruments, USA) para la determinación de endotoxinas por el método in-vitro del lisado de amebocitos del Limulus (LAL en inglés) Se tomaron muestras antes de inyectar en la cápsula cromatográfica Sartobind-Q, así como a la salida.
Medición de la absorbancia
Las mediciones de absorbancia se realizaron a temperatura ambiente utilizando un espectrofotómetro UV-Vis modelo V-630 (Jasco international Co., Ltd., Tokio, Japón) y una celda de cuarzo de 10 mm de paso óptico. El tamaño de la muestra es de 10 µL usando el coeficiente para 1 mg/mL. Se tomó una muestra de la solución de inmunoglobulina antes de inyectar/salida a la columna/cápsula cromatográfica.
Los valores de absorbancia obtenidos permiten calcular usando el método de Biuret:
Proteínas totales de la muestra inicial y final de cada etapa.
Recobrado, que se obtiene de dividiendo el valor de las proteínas al finalizar una etapa entre las proteínas de la muestra inicial.
Perfil de pureza
El perfil de pureza del producto en cada etapa fue determinado mediante electroforesis en gel de poliacrilamida de sodio dodecil sulfato (SDS-PAGE)
Determinación de IgA e IgM
La concentración de IgM e IgA fueron determinadas en el Instituto de Hematología e Inmunología mediante un analizador automático (química clínica) Inlab-240 (CPM Scientifica Tecnologie Biomediche, Roma, Italia) por método turbidimètrico utilizando multicalibradores de proteínas específicas.
Titulación del preparado
Fue determinado el título de inmunoglobulina anti-SARS-CoV-2 mediante un kit ELISA del tipo Elecsys® Anti-SARS-CoV-2 S de Roche, Suiza, que se comparó con un kit nacional del tipo UMELISA SARS-CoV-2 anti-RBD, desarrollado por el Centro de Inmunoensayos (CIE) de Cuba.
Esterilidad y pirógenos
El producto terminado fue analizado para cualquier tipo de contaminación potencial. La esterilidad y la presencia de pirógenos fueron determinadas de acuerdo a la Farmacopea Europea edición 10.0, 2019.
Respuesta inmune humoral
La respuesta inmune humoral de la inmunoglobulina-anti-SARS-CoV-2 y del panel de suero de control negativos y positivos fue determinada mediante:
Descripción del Ensayo de neutralización molecular del virus (mVNT): Se basa en el bloqueo de la interacción RBD:hACE2, mediado por anticuerpos. Este ensayo es un sustituto (sVNT) del ensayo convencional de neutralización del virus SARS-CoV-2 activo (cVNT). El mVNT emplea la proteína recombinante RBD-Fcm (RBD de SARS-CoV-2 fusionada a Fc de una IgG de ratón) y usa como molécula de recubrimiento, la proteína recombinante ACE2-Fch (Dominio extracelular del receptor ACE2 humano fusionado a región Fc de IgG humana). El RBD-Fcm se preincubó con la inmunoglobulina (o IgG) humana purificada, a diferentes diluciones (1:25 hasta 1:102400), antes de añadirse a las placas recubiertas. El RBD-Fcm que no fue inhibido se puede unir al ACE2-Fch inmovilizado en la placa, y es detectado mediante la adición de un Ac anti-IgG de ratón conjugado a fosfatasa alcalina. La inhibición se expresó como porcentaje y se calculó según la siguiente fórmula: Inhibición (%) = [1-(DO405nm muestra/ DO405nm reconocimiento máximo)] × 100. El reconocimiento máximo corresponde a pozos incubados solo con RBD-Fcm. Para la determinación de la ID50 o título de neutralización molecular (dilución de suero a la cual se obtiene el 50% de inhibición máxima) las diluciones de IgG humana purificada se transformaron logarítmicamente y los datos se ajustaron a log(inhibidor) vs una respuesta normalizada con regresión no lineal de pendiente variable, a través del programa GraphPadPrism (versión 7 para Windows, California, USA).
Ensayo de reconocimiento de la RBD por la IgG-anti-SARS-CoV-2 cubana. consistió en un ELISA in-house anti-RBD que emplea la RBD dimérica, purificada (dRBD) por el Centro de Inmunología molecular (CIM) de Cuba, como antígeno de recubrimiento y un conjugado anti-human-γ:peroxidasa.
La capacidad de reconocimiento de RBD por la IgG-anti-SARS-CoV-2 cubana se realizó mediante ELISA, utilizando diferentes diluciones de la muestra, y los correspondientes controles positivo (suero de convaleciente COVID19) y control negativo (suero de donante sano). La curva estándar fue construida realizando ocho diluciones seriadas dobles: desde 1:100 hasta 1:12800.
Proceso tecnológico
Pool de bolsas de plasma hiperinmune anti-SARS-CoV-2
Las bolsas de plasma se descongelaron durante la noche desde -20°C hasta +2°C preparándose un primer lote de 43 L en reactores de acero inoxidable AISI 316L. La apertura de las bolsas de plasma se realizó bajo flujo laminar de techo. Se tomó una muestra inicial de la mezcla (pool en inglés) de todas las bolsas de plasma para determinar la concentración de proteínas, el título de anticuerpos específicos anti-SARS-CoV-2 y endotoxinas bacterianas.
Fraccionamiento alcohólico del plasma
Para la obtención de una inmunoglobulina anti-SARS-CoV-2 se emplea el método de fraccionamiento alcohólico a bajas temperaturas de Cohn (Cohn E., Strong L., Hughes W., et al. 1946) en la variante modificada que forma parte de la plataforma del INTACGLOBIN®, IGIV producida en Cuba (Cádiz A. et al. 2004), que es un producto líquido, estabilizado a pH ácido y de molécula intacta con amplio uso clínico desde 1988. (Cádiz A. et al. 1984),
Procedimiento cromatográfico de remoción de contaminantes
En esta nueva formulación se optimizó el paso cromatográfico usando cápsulas con membrana (microporos > 3µm) de intercambio aniónico del tipo Sartobind-Q de 200mL, que emplea el concepto de cromatografía negativa para acoplar los contaminantes, el cual tiene la ventaja adicional de resistir hasta 20 % de etanol durante el almacenamiento. Toda la operación se ejecutó mediante el software del sistema Bioprocess de GE (USA), que permite el control y trazabilidad del proceso. El producto en forma de pasta-II es disuelto en un buffer fosfato y luego fue filtrado antes de hacerlo pasar mediante la bomba de trasiego a través de las cápsulas Sartobind-Q las cuales acoplan los contaminantes dejando pasar el producto libremente que fue colectado en un recipiente estéril y apirogénico, del que se tomaron muestras para determinar el nivel de endotoxinas y la concentración de proteínas.
Remoción del etanol residual
Para ejecutar la remoción del etanol residual y alcanzar la concentración de proteínas final deseada se empleó un proceso de ultradiafiltración de escala piloto usando casetes de ultrafiltración con un área de 0,1 m² con material de polietersulfona (PESU-50k) o Hydrosart-30k de Sartorius (Alemania). El proceso tecnológico transcurrió en un área clasificada bajo flujo laminar de techo. La secuencia de proceso comprende un paso de concentración inicial del producto para alcanzar una concentración de proteínas entre 40-50g/L. Sin detener el proceso se ejecutó el paso de diafiltración para la remoción del etanol residual que consiste en un intercambio a volumen constante de 5-7 volúmenes de diafiltración (VD), lo cual garantiza la eliminación entre el 98-99% del solvente a eliminar y que, en nuestro caso, permite alcanzar una concentración de etanol residual inferior a 5 mg/g proteína. Seguidamente se ejecutó el paso de concentración final hasta alcanzar el valor de la concentración de proteínas en el rango establecido, resultando la eficiencia total del proceso en un recobrado de proteínas superior al 98%. Al producto final ultrafiltrado se le tomaron muestras para determinar, por triplicado, los parámetros de proceso (concentración de proteínas, nivel de endotoxinas, concentración de etanol residual) acorde con lo establecido en los procedimientos de control de procesos de la Planta de Hemoderivados de Cuba, así como el título de anticuerpos específicos anti-SARS-CoV-2 según la tecnología que fue desarrollada por el CIE.
RESULTADOS
En la figura 2 se presenta un esquema simplificado del proceso de fraccionamiento alcohólico del plasma para obtener la pasta-II (IgG) que contiene las inmunoglobulinas humanas. En el mismo se recoge el comportamiento de las variables criticas durante este proceso como el pH, la temperatura y concentración de etanol y proteínas en cada fracción. El lote DTC-00-PT analizado se fraccionó a partir de 43 L de plasma de convalecientes de la enfermedad (figura 2), teniendo un título de 86,24 U/mL (UMELISA SARS-CoV-2 IgG). la muestra (inicial) tomada del pool plasma. En el producto purificado, la IgG obtenida alcanzó un título de 458,03 U/mL, mostrando un factor de concentración de la actividad 5,3 veces superior en relación con el plasma de origen.
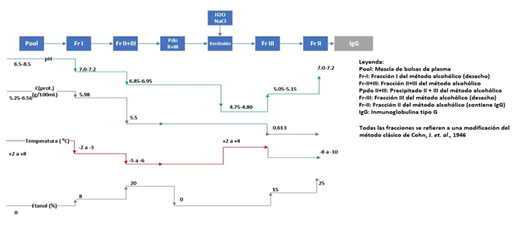
Fig. 2 Diagrama de flujo fraccionamiento alcohólico del plasma. fuente: Cádiz A., et. al. Inmunoglobulinas de uso intravenoso. Características y usos clínicos. 2004. Medellín, Colombia.
En la figura 3 en el gráfico A se expresó la capacidad de inhibición de la RBD de la proteína S del SARS-CoV-2 al receptor rACE2, medido por ELISA. En la tabla B se recogieron los valores de la capacidad de inhibición expresados en porciento con valores cercanos al 95% para diluciones entre 1:25 y 1:400, manteniéndose cercana al 60% para una dilución de 1:1600, que son valores aceptables. El porciento de inhibición para una dilución 1/100 de la preparación de IgG purificada fue de 95.7, mientras el título de neutralización (ID50) fue de 2559.
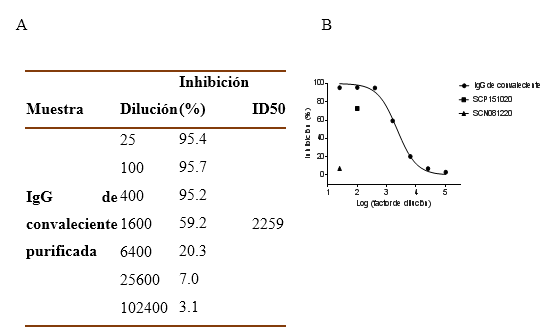
Fig. 3 Inhibición molecular (mVNT) de la unión de RBD-Fcm a ACE2 Fch (A 740H) mediada por la IgG de plasma de convalecientes, comparado con suero control positivo (SCP151020) y suero control negativo (SCN081220). fuente: Laboratorio de virología del CIM, Cuba.
En la figura 4 se representó en el gráfico A una curva con los valores promedios de la densidad óptica observándose que a medida que aumentó la dilución fue disminuyendo progresivamente la D.O. de la muestra de inmunoglobulina-anti-SARS-CoV-2.
Por otra parte, en la tabla B2 se recogieron los valores individuales de cada muestra de IgG-anti-SARS-CoV-2 ensayada por triplicado la cual tuvo el comportamiento esperado al disminuir a medida que se incrementó el factor de dilución. Para la muestra de suero control negativo el valor promedio de la D.O para la dilución 1:200 fue 4,38 veces inferior a valor promedio de la IgG ensayada indicando una alta capacidad de reconocimiento de la RBD para esa condición.
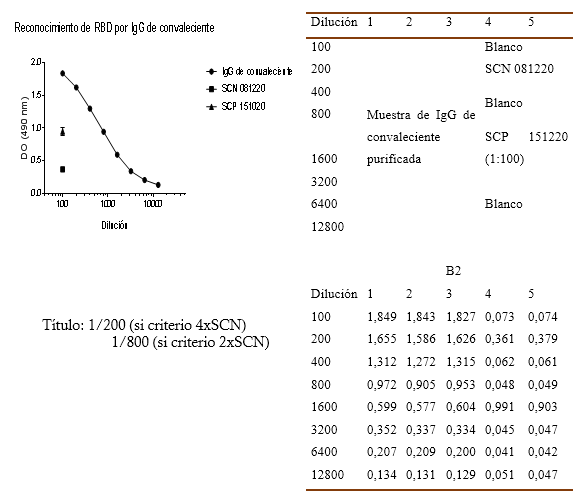
Fig. 4 Ensayo in-house anti-RBD ELISA, comparado con suero control positivo (SCP151020) y suero control negativo (SCN081220). A. Gráfico de Densidad Óptica (D.O) Vs. Dilución de muestras. B. Esquema (Tabla B1) y lectura de D.O (tabla B2) de cada pocillo del ensayo ELISA donde del 1 al 3 corresponde a la muestra de IgG para cada dilución, los blancos fueron ubicados en la posición 4 y 5, así como la muestra del suero control negativo y del suero control positivo. fuente: Laboratorio de virología del CIM, Cuba.
Además, se observó que la preparación de IgG purificada tenía un título de 1/200 si se asumía el criterio de seroconversión que la D.O de la IgG purificada fuese 4 veces la DO del suero control negativo. O sea, 1/200 es la mayor dilución que satisface esa condición. Si el criterio de seroconversión es valores de D.O dos veces superiores al del suero control negativo, el título de la preparación de IgG purificada es 1/800.
En el caso de los blancos los valores promedios de las lecturas de la D.O estuvieron entre 25 - 2.7 veces inferiores a los de la inmunoglobulina analizada a medida que aumenta el factor de dilución lo cual estuvo acorde a lo esperado.
La figura 5 presenta una electroforesis en gel de poliacrilamida (SDS-PAGE) donde se observan las bandas de proteínas (1-6) presentes en las principales etapas del proceso de fraccionamiento alcohólico en frío realizado, comparado con un patrón de albúmina (7) y otro de INTACGLOBIN® .

Fig. 5 Electroforesis en gel de poliacrilamida (SDS-PAGE) del fraccionamiento alcohólico del plasma anti-SARS CoV-2, basado en el método de Cohn, J. et. al. Modificado por Cádiz A. et. al. fuente: resultados del Laboratorio de Control de Calidad de los productos hemoderivados.
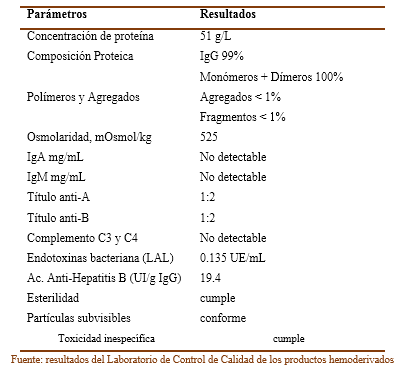
Finalmente, en la tabla 1 se puede constatar el perfil molecular y la pureza del producto donde podemos destacar que los niveles de agregados y fragmentos en la preparación son inferiores al 1% lo que indica un alto nivel de calidad, una composición proteica del 99% de IgG lo que indica una alta pureza, así como un bajo nivel de isoaglutininas anti-A y anti-B, así como de las proteínas C3 y C4 involucradas en la actividad anticomplementaria que representa una muy baja posibilidad de reacciones adversas.
DISCUSIÓN
De acuerdo con la experiencia alcanzada a partir del tratamiento de pacientes infectados con otros virus respiratorios humanos, se conoce que existen varias opciones de inmunoterapia pasiva con anticuerpos para tratar esas infecciones. Estas son: el uso de plasma de pacientes convalecientes o de anticuerpos purificados de ese plasma y el uso de anticuerpos monoclonales contra las proteínas del virus. (Casadevall A., Pirofski L.A, Joyner M.J., 2021)
Las diferencias entre estas opciones terapéuticas potenciales podrían estar basadas en la relación eficacia/seguridad, principalmente debido al riesgo potencial de desarrollar reacciones adversas. Las preparaciones de inmunoglobulinas purificadas son una opción más segura y con mayor actividad que el plasma convaleciente, y al ser producidas por una combinación del plasma de múltiples pacientes puede aumentar la polivalencia de los anticuerpos contra el virus y podría resultar en un mejor tratamiento para los pacientes en estado avanzado de la infección y con un cuadro clínico más severo.
En términos de la eficacia, el plasma convaleciente ya ha sido previamente aplicado para infecciones con otros coronavirus como SARS-CoV y el MERS-CoV y, aunque no se encuentran disponibles ensayos clínicos controlados, los meta-análisis sustentan su uso, comparado con la ausencia de terapia específica para mejorar la tasa de supervivencia de los pacientes. (Cheraghali, A.M., et.al. 2020)
En los años 80 del siglo XX se desarrolló la tecnología para la producción de inmunoglobulina de uso intravenoso que se ha empleado en pacientes graves o críticos para la terapia en pacientes con enfermedades virales como la Hepatitis-B, la rabia, el Citomegalovirus y más recientemente durante la epidemia de Ébola la multinacional de hemoderivados Grifols desarrolló una inmunoglobulina específica a partir de la colecta de plasma anti-Ébola en Liberia de pacientes convalecientes. Lo anterior provee una expectativa razonable para la eficacia y seguridad de este nuevo producto.
El desarrollo del proceso productivo de una inmunoglobulina anti-SARS-CoV-2 usando la plataforma del INTACGLOBIN®, IGIV producida en Cuba (Cádiz A., et al., 2004) con un extenso uso clínico desde 1988 que es un producto líquido, estabilizado a pH ácido y de molécula intacta nos ha permitido obtener un preparado de alta pureza que cumple con los requisitos regulatorios (concentración de proteínas, pureza, nivel de agregación, esterilidad, endotoxinas, etc.) de la Farmacopea Europea 10ma edición. En esta nueva formulación se optimizó el paso cromatográfico de intercambio iónico usando membranas (cápsulas) del tipo Sartobind-Q y combinado con una etapa de ultra-diafiltración complementado. En este lote la proteína de IgG está presente en su forma monomérica, así como una pequeña fracción de dímeros no detectables al igual que los agregados y fragmentos. Los títulos de isoaglutininas anti-A y anti-B se encuentran en concentraciones muy bajas en el producto terminado, lo cual está acorde a lo obtenido por la multinacional de los hemoderivados Grifols (Vandeberg, P., et al. 2021).
Existen evidencias científicas y amplia experiencia en el uso de las inmunoglobulinas contra otros agentes infecciosos. (Hemming, V. G. 2001). Las inmunoglobulinas son los anticuerpos que actúan como defensas del organismo que se unen al patógeno (virus) y lo neutralizan para que no pueda penetrar en la célula e iniciar el proceso infeccioso. Además, es un tratamiento seguro y de bajo riesgo, pues este plasma sanguíneo se obtiene de personas que han superado la infección; es decir, de personas cuyo organismo ha creado una respuesta inmunológica para bloquear el proceso infeccioso. La novedad de esta aproximación radicaría en la administración únicamente de los anticuerpos anti-SARS-CoV-2 existentes en el plasma y no todo el plasma sanguíneo o suero inmunológico, a fin de incrementar la concentración.
El factor de concentración de la actividad alcanzado es 5,3 veces superior al plasma de origen, lo que nos indica que los pacientes tratados con el preparado cubano de inmunoglobulina intravenosa anti-SARS-CoV-2 recibieron una actividad de anticuerpos neutralizantes superior a aquella del plasma de convalecientes equivalente, lo que hace pensar en una reducción de volumen de aplicación de esta inmunoglobulina, lo cual es beneficioso. Por otro lado, la remoción de la IgA permite disminuir potenciales eventos adversos en pacientes deficientes de IgA (Cádiz A., et al. 2004), además la remoción de la IgM disminuye la actividad anticomplementaria, así como la presencia de isoaglutininas anti-A y anti-B en cantidades superiores. Se obtuvo un autorizo del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) para un ejecutar ensayo clínico fase-1.
La limitación de este trabajo estaría asociada a la disminución de la disponibilidad de plasma específico anti-SARS-CoV-2 de donantes convalecientes, asociados a la vacunación contra el SARS-CoV-2, pues entonces la cifra de enfermos irá disminuyendo. No obstante, hemos pensado en emplear la alternativa de colectar plasma de donantes que haya inmunizados con las vacunas cubanas y resulten con un alto título de anticuerpos específicos.