Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Centro Azúcar
versión impresa ISSN 0253-5777versión On-line ISSN 2223-4861
cen. az. vol.43 no.3 Santa Clara jul.-set. 2016
ARTICULO
Aislamiento de materia insaponificable a partir de cachaza utilizando etanol como solvente
Unsaponifiable matter from sugar cane filter cake using ethanol as solvent
Inés María San Anastacio Rebollar 1*, José Gerardo Baltá García2 y Gretel Villanueva Ramos3
1 Departamento de Química. Facultad de Ciencias Aplicadas a la Industria. Universidad de Camagüey Ignacio Agramonte Loynaz. Carretera Circunvalación Norte km 5 ½, Camagüey, Cuba.
2 Departamento de Ingeniería Química. Facultad de Ciencias Aplicadas a la Industria. Universidad de Camagüey Ignacio Agramonte Loynaz. Carretera Circunvalación Norte km 5 ½, Camagüey, Cuba.
3 Departamento de Ingeniería Química. Facultad de Química y Farmacia. Universidad Central "Marta Abreu" de las Villas. Carretera a Camajuaní km 5 ½, Santa Clara, Villa Clara, Cuba.
*Autor para la correspondencia: Inés M. San Anastacio, Email: ines.sananastacio@reduc.edu.cu
RESUMEN
En este artículo se propone una metodología para la obtención de materia insaponificable a partir de la cachaza de caña de azúcar, en la que solamente se emplea etanol 96 °GL como solvente. La cera se extrae de la cachaza con etanol (con una pureza de 96 ºGL) mediante un proceso de lixiviación empleando una relación cachaza/etanol de 0,05 kg/L a 70 ºC, presión atmosférica, velocidad de agitación de 700 rpm y tiempo de extracción de 2,5 horas. Bajo estas condiciones se obtiene 86,21% de extracción. Luego el extracto obtenido se hace reaccionar con NaOH alcohólico a 70 ºC durante 75 minutos a presión atmosférica y agitando a 200 rpm. El empleo de la metodología propuesta permite obtener 1,942 g de materia insaponificable impura a partir del procesamiento de 50 g de cachaza y 1,05 L de etanol 96 °GL.
Palabras clave: cachaza, etanol, cera, saponificación, materia insaponificable
ABSTRACT
In this paper, we propose a methodology for the obtaining of unsaponificable matter starting from the sugar cane filter cake, in the one that only ethanol 96 °GL is used as solvent. The wax is extracted of the mud with ethanol (with a purity of 96 ºGL) by means of a leaching out process using a mud/ethanol ratio of 0.05 kg/L to 70 ºC, atmospheric pressure, agitation speed of 700 rpm and extraction time of 2,5 hours. Under these conditions 86.21 % of extraction is obtained. Then, the obtained extract reacts with alcoholic NaOH to 70 ºC during 75 minutes to atmospheric pressure and shaking to 200 rpm. The employment of the proposed methodology allows to obtain 1.942 g of impure unsaponifiable matter starting from 50 g of mud and 1.05 L of ethanol 96 °GL.
Key words: mud, ethanol, wax, saponification, unsaponificable matter.
INTRODUCCIÓN
La cachaza, residuo en la fabricación de azúcar, está compuesta aproximadamente por 10-14 % de cera y tiene un alto contenido de agua, estimado en el rango de 75-77 %, representando el material seco del 23 al 25 % (Kumar et al., 2010) (Santiago et al., 2010). De ella, por extracción con solvente, se obtiene como producto principal la cera cruda. Los disolventes más utilizados en este proceso son hexano, heptano y nafta aunque también se ha empleado benceno y tolueno (Bhosale et al., 2012). Estos solventes causan graves daños a la salud humana y el medio ambiente (Hegel et al., 2013). García (García, 2011), en un proceso para obtener biodiesel, propone la extracción de cera por lixiviación de la cachaza con etanol 96 °GL durante cuatro horas, reportando 94,92 % de extracción, determinado por diferencia de peso. El tiempo de extracción representa el principal inconveniente de esta propuesta.
De acuerdo a Suarez (Suarez y Morín, 2014), de la extracción se separan tres fracciones: cera (55–62 %), aceite (25–31 %) y resina (10–13 %), volátiles (0,8–2 %) e insolubles (0,7-0,8 %). Según Orthoefer (Orthoefer, 2005) y Liu (Liu y Yu, 2008),todas las ceras están constituidas por ésteres de alto peso molecular de alcoholes grasos de C24 a C40 y ácidos grasos de C16 a C24. Como plantean varios autores, entre ellos Taylor (Taylor et al, 2000) y George (George et al., 2010), la cera es un producto de amplio uso, ya que puede emplearse en la fabricación de cosméticos, en las industrias textil y farmacéutica, entre otras. A pesar de esto, para Orthoefer (Orthoefer, 2005),esta resulta más atractiva por su composición química: 64,5 % de alcoholes grasos y 33,5 % de ácidos grasos, con solamente 2 % de hidrocarburos. Su saponificación, proceso de hidrólisis con aplicación de calor, que usualmente se realiza con potasa u otro álcali en medio alcohólico, conlleva a la formación de sales de ácidos grasos y una fracción insaponificable, término empleado por Afinisha (Afinisha y Arumughan, 2012) para referirse a la mezcla de sustancias que no forman jabones, fundamentalmente alcoholes grasos. Warth (Warth, 1956) es el primero en describir un proceso de saponificación. Luego Schubert (Schubert, 1967) propone un método que al no utilizar solvente, es poco eficiente, además, la filtración debe realizarse en caliente, pues de lo contrario aparecen cristales, que dificultan tecnológicamente el proceso. Más tarde Verdecia (Verdecia, 1986), describe una variante en la que se requieren tres extracciones sucesivas, lo que implica gasto de gran cantidad de solvente. Posteriormente, en la propuesta realizada por Neuma de Castro (Neuma de Castro, 1995), la mezcla reaccionante se somete a 24 horas de reflujo, lo que alarga mucho la duración del proceso. En el 2000, Vera (Vera, 2000) resuelve el problema de la separación de la materia insaponificable, disminuye la cantidad de solvente utilizado y el tiempo de reacción, aunque no logra la reacción de toda la cera y se dificulta la etapa de lavado de la materia insaponificable debido a la presencia de nafta.
Los alcoholes grasos, componente mayoritario de la materia insaponificable, tienen una amplia aplicación en el tratamiento de enfermedades cardiovasculares como la deficiencia arterial y la hipercolerestolemia (Marinangeli et al., 2010) y disminuyen los niveles de colesterol (Varady et al., 2003). Además, se aplican en la industria de los cosméticos en la formulación de cremas anti-acné, como fertilizantes en la agricultura (Izzat et al., 2013), entre otros usos. Por todo ello, el objetivo del presente trabajo es obtener la materia insaponificable a partir de cachaza empleando solamente el etanol como solvente.
MATERIALES Y MÉTODOS
2.1Características de la cachaza y extracción con etanol 96 °GL
Se determina la humedad en la cachaza a través de un analizador de humedad Scaltel modelo SMO 01, mientras que para establecer el contenido de extractables se usa el método Soxhlet, utilizando etanol 96 °GL como solvente. La cuantificación del contenido de extractables se realiza mediante espectrofotometría Ultravioleta; para ello se confecciona la curva de calibración utilizando como patrón cera cruda producida en la UEB Antonio Guiteras de la provincia Las Tunas, Cuba, preparando una solución etanólica de la misma de 8,75.10-2 g/mL. A partir de esta, se preparan soluciones de concentración 1,25.10-3, 2,5.10-3, 3,75.10-3, 5.10-3, 6,25.10-3 y 7,5.10-3 g/mL y se leen a 205 nm en un espectrofotómetro UV-VIS Rayleigh modelo 1601.
La extracción se realiza en un recipiente cilíndrico de dos litros, con un condensador de reflujo acoplado, mezclando 50 g de cachaza y 1,05 L de etanol 96 ºGL a 70 ºC y presión atmosférica agitando a 700 rpm durante 2,5 h. Al concluir la extracción se separa la cachaza agotada por filtración a través de una malla de orificios de 75 μm de diámetro. Los resultados se procesan mediante el programa Statgraphics Centurión XVI y el rendimiento se calcula según la ecuación:
2.2 Determinación del índice de saponificación y preparación de la solución de sosa alcohólica
El índice de saponificación se determina mediante el procedimiento descrito en las normas de A.S.T.M. reportadas por Ross y col. (Ross y col., 1987), pero empleando una solución de NaOH 0,5 mol/L en lugar de KOH 0,5 mol/L.
Una vez determinada la cantidad de NaOH a añadir para la saponificación se prepara la solución de sosa alcohólica mezclando la sosa en piedra con 10 mL de etanol 96 ºGL a 70 ºC, agitando a 100 rpm durante 5 minutos.
2.3Determinación del tiempo de saponificación
Se determina el tiempo de reacción para lo cual se mide la conductividad del extracto etanólico y la inicial (conductividad al añadir al extracto etanólico la solución de sosa alcohólica) en un conductímetro modelo DDSJ- 308A. Luego se deja reaccionar en un recipiente cilíndrico de dos litros con un condensador de reflujo acoplado, a 70 ºC y presión atmosférica agitando a 200 rpm, midiendo la conductividad cada 15 minutos. En el procesamiento de los datos obtenidos se utiliza el programa Statgraphics Centurión XVI.
2.4Obtención de la materia insaponificable
En un recipiente cilíndrico de dos litros, con un condensador de reflujo acoplado, se mezclan 50 g de cachaza y 1,05 L de etanol 96 ºGL agitando a 700 rpm a 70 ºC y presión atmosférica durante 2,5 h. Luego se separa la cachaza agotada filtrando a través de una malla de orificios de 75 μm de diámetro. Al extracto etanólico obtenido se le añade la solución de sosa alcohólica y se dejan reaccionar, en un recipiente de dos litros con condensador de reflujo acoplado, a 70 ºC y presión atmosférica agitando a 200 rpm durante el tiempo determinado. Posteriormente se enfría a 15 ºC durante 10 min y después se filtra a través de una malla de 75 µm de diámetro. Se calcula el rendimiento en cada caso según:
Donde:
mp: masa insaponificable precipitada en gramo
me: masa extractables inicial en gramo
y los datos obtenidos se procesan mediante el programa Statgraphics Centurión XVI.
RESULTADOS Y DISCUSIÓN
3.1. Características de la cachaza y extracción con etanol 96 °GL
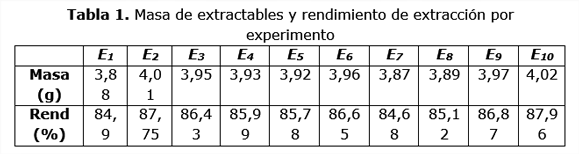
El contenido de humedad de la cachaza y de extractables en etanol 96 °GL (cuyo componente principal es cera) es de 7,82 % y 9,92 % b.s. respectivamente. La tabla 1 que aparece a continuación refleja los resultados alcanzados en el proceso extractivo llevado a cabo:
El procesamiento de estos datos muestra que los mismos siguen una distribución normal, ya que los valores de los estadígrafos de asimetría y de kurtosis estandarizados se encuentran dentro del rango de ± 2, además, no existen diferencias estadísticamente significativas entre ellos para un 99% de confianza. Esto permite establecer que, del procesamiento en una etapa de 50 g de cachaza y 1,05 L de etanol 96 °GL, se extraen 3,94 g de extractables, lo que representa 86,21 % de extracción.
3.2. Determinación del índice de saponificación y preparación de la solución de sosa alcohólica
La determinación del índice de saponificación se realiza con NaOH, ya que esta es la base que se utiliza para la saponificación de los extractables. Debido a que el contenido de extractables en los extractos es similar, el índice de saponificación también resulta serlo, siendo su valor promedio de 1 mg/g de extracto. Este valor determina la cantidad de NaOH a añadir para la saponificación, de forma tal que la reacción ocurra completamente pero que no quede NaOH en exceso.
3.3. Determinación del tiempo de saponificación
La conductividad del extracto etanólico es de 44,7 µs/cm, sin embargo, al adicionar la solución de sosa alcohólica la misma aumenta hasta 459,82 µs/cm. El NaOH es un electrólito mucho más fuerte que las sales de los ácidos grasos que se forman en la reacción, siendo por tanto mayor su conductividad. Esto ocasiona que, a medida que transcurre la reacción, se produce una disminución de la conductividad, lo que permite emplear este parámetro para determinar el tiempo de la reacción.
Como refleja la gráfica que aparece en la figura 1, durante los primeros 75 minutos de reacción la conductividad disminuye 3,36 veces, es decir, de un valor inicial de 459,82 µs/cm hasta 136,65 µs/cm, valor a partir del cual permanece prácticamente constante.
El procesamiento de los resultados obtenidos prueba que no existen estadísticamente diferencias significativas entre los experimentos realizados y que los mismos siguen una distribución normal, ya que los valores de los estadígrafos kurtosis y skewness (de asimetría) se encuentran en el rango de ± 2. Por su parte, una prueba de múltiples rangos mediante el método Student- Newman- Keuls con un 99 % de confianza, muestra que a partir de los 75 min de reacción, los valores de conductividad no presentan estadísticamente diferencias significativas. Esto permite establecer 75 min como tiempo de reacción.
3.4. Obtención de la materia insaponificable
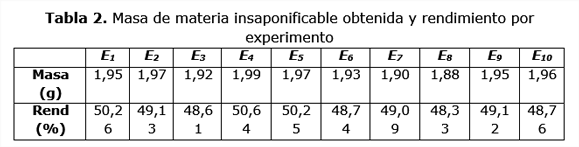
En la tabla 2 aparece la cantidad de materia insaponificable obtenida a partir del procesamiento de 50 g de cachaza en las diez corridas experimentales realizadas. Estos datos siguen una distribución normal y no presentan diferencias estadísticamente significativas al ser la probabilidad menor que 0,05 con un 99 % de confianza. El valor promedio del rendimiento de materia insaponificable obtenida es de 49,29 %, es decir, alrededor del 50 %, valor esperado si se tiene en cuenta que por cada mol de cera, fracción saponificable principal en los extractables, se forma un mol de sal de ácido graso y uno de alcoholes grasos, que constituyen los componentes mayoritarios de la materia insaponificable. De esta forma puede plantearse que a partir de 50 g de cachaza, mediante el procedimiento descrito, en el que se emplea como solvente solamente etanol 96 °GL, se obtienen 1,942 g de materia insaponificable impura. Estos resultados son similares a los obtenidos por Vera (Vera, 2000) quien reporta una conversión del 50 %
3.5. Metodología para la obtención de materia insaponificable a partir de cachaza y etanol
El trabajo de laboratorio realizado permite establecer, para la obtención de materia insaponificable a partir de cachaza, empleando etanol 96 °GL como solvente, la metodología siguiente:
a) Extracción: se mezclan 47,6 g de cachaza/ L de etanol 96 ºGL a 70 ºC y presión atmosférica agitando a 700 rpm durante 2,5 horas, luego se separa la cachaza agotada por filtración.
b) Preparación de sosa alcohólica: se disuelve la cantidad de NaOH (a razón de 1 mg/g de extracto) en 10 mL de etanol 96 ºGL a 70 ºC, agitando a 100 rpm durante 5 minutos.
c) Saponificación: se hacen reaccionar el extracto etanólico y la solución de NaOH alcohólico a 70 ºC y presión atmosférica agitando a 200 rpm durante 75 minutos. Posteriormente se enfría a 15 ºC durante 10 min y luego se filtra a través de una malla de 75 µm de diámetro.
CONCLUSIONES
- Se establece una metodología para la obtención de materia insaponificable a partir de cachaza, empleando como solvente solamente etanol; la misma consta de tres pasos: extracción, preparación de sosa alcohólica y saponificación.
- La metodología propuesta permite obtener 1,942 g de materia insaponificable impura a partir del procesamiento de 50 g de cachaza y 1,05 L de etanol 96 °GL.
REFERENCIAS
Afinisha, L. S. y Arumughan, D., Effect of saponification on composition of unsaponifiable matter in rice brain oil., Journal of Oleo Science, Vol. 61, No. 5, 2012, pp. 241-247.
Bhosale, P. R., Chonde, G. y Raut, P. D., Studies on extraction of sugarcane wax from press mud of sugar factories from Kolhapurdistrict, Maharashtra., Journal of Environmental Research and Development, Vol. 6, No. 3A, 2012, pp. 715-720.
García, R., Utilización de la cera de caña de azúcar en la obtención de biocombustibles en Guatemala., Tesis presentada en opción al Grado Científico de Doctor en Ciencias Técnicas, Especialidad Ingeniería Química en la Universidad Central Marta Abreu de Las Villas, Cuba, 2011.
George, P., Eras, J.C., Gutierrez, A. S., Hens, L. y Vandecasteele, C., Residue from sugarcane juice filtration (filter cake): energy use at the sugar factory., Waste and Biomass Valorization, Vol. 1, No. 4, 2010, pp. 407–413.
Hegel, P., Mabe, G., Brignole, E. A. y Pereda, S., Phase equilibrium engineering of jojoba oil extraction with mixed-CO2+propane solvent., The Journal of Supercritical Fluids, No. 79, 2013, pp. 114-122.
Izzat, M., Nasrulhaq, A., Moneruzzaman, M., Saadb, J., Aziz, T. A., Shakirin, M. y Bakara, B., Pilot Studies on Rice Yield Enhancement with Foliar Application of SBAJA in Sungai Besar, Selangor, Malaysia., Life Science Journal, Vol. 10, No. 1, 2013, pp. 329-335.
Kumar, R., Verma, D., Singh, B. L. y Kumar, U., Composting of sugar-cane waste by-products through treatment with microorganisms and subsequent vermicomposting., Bioresource Technology, Vol. 101, No. 17, 2010, pp. 6707–6711.
Liu, Y. y Yu, J., Extraction of policosanols from hydrolysed rice bran wax by high-intensity ultrasound., International Journal of Food Science & Technology, Vol. 43, No. 5, 2008, pp. 763-769.
Marinangeli, C.P.F., Jones, P.J.H., Kassis, A.N. y Eskin, M.N.A., Policosanols asnutraceuticals: fact or fiction., Rev. Food Sci. Nutr, No. 50, 2010, pp. 259–267.
Neuma de Castro, T., Alternativas Tecnológicas para cera de carnaúba., Natal, Vol. 43, No. 1, 1993, pp. 20-30.
Orthoefer, F. T., Rice Bran Oil., Bailey's Industrial Oil and Fat Products, John Wiley & Sons, Inc, 2005.
Ross, F.B., Ross Waxes., 10 th Edition, Jersey City, NJ 07304, 1987.
Santiago, A. D., Rossetto, R., De Mello, W. y Urquiaga, S., Sugarcane., Environmental Science and Technology, 2010, pp. 77–103.
Schubert, A., Pharmazile., No. 2, New York; DC: Oficina de Patentes y Marcas de EE.UU, 1967.
Suarez, R. y Morín, R., Caña de azúcar y sostenibilidad: enfoques y experiencias cubanas.,http://www.uv.mx/personal/tangarcia/files/2014/02/A6 Caña en CUBA.pdf, 2014.
Taylor, A. K., From raw sugar to raw materials., Chemical Innovation, Vol. 30, No. 11, 2000, pp. 45–48.
Varady, K. A., Wang, Y. y Jones, P. J., Role of policosanols in the prevention and treatment of cardiovascular disease., Nutrition Reviews, Vol. 61, No. 11, 2003, pp. 376–383.
Vera, L. M., Extracción de alcoholes de alto peso molecular a partir de la cachaza y sus derivados, Tesis presentada en opción al Grado Científico de Doctor en Ciencias Técnicas, Especialidad Ingeniería Química en la Universidad Central Marta Abreu de Las Villas, Cuba, 2000.
Verdecia, F., Procedimiento industrial para el aislamiento de la mezcla de fitoesteroles de la fracción de aceite de la cera de la caña de azúcar., Revista Cubana de Farmacia, Vol. 1, No. 2, 1989, pp. 24-28.
Warth, H.A., The Chemistry and technology of waxes., 2nd. Ed., New York, Reinhold Publishing Corporation, 1956, pp. 88, 76-121, 154.
Recibido: Mayo 2, 2016;
Revisado: Mayo 26, 2016;
Aceptado: Junio 3, 2016;