My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Centro Azúcar
Print version ISSN 0253-5777On-line version ISSN 2223-4861
cen. az. vol.44 no.1 Santa Clara Jan.-Mar. 2017
ARTICULO
Análisis Elemental Prospectivo de la Biomasa algal acumulada en las costas de la República Dominicana durante 2015
Prospective elemental analysis of algal biomass acumulated at the dominican republic Shores during 2015
Fernando Fernández1, Carlos José Boluda1, Jesús Olivera1,Luis Alberto Guillermo1 Bolivar Gómez1, Enmanuel Echavarría1 y Aris Mendis Gómez1*
1 Laboratorio de la Dirección General de Aduanas de República Dominicana Calle Carlos Sánchez, esquina Lope de Vega, Ensanche Naco, Santo Domingo, República Dominicana.
*Autor para la correspondencia: Aris M. Gómez, Email: ar.gomez@dga.gov.do
RESUMEN
La acumulación y descomposición de cantidades masivas de las algas pardas Sargassum natans y Sargassum fluitans en las costas antillanas se ha convertido en un problema importante de Centroamérica y el Caribe, afectando gravemente al turismo. No obstante el valor de la biomasa algal no debe ser subestimado, dado que contienen compuestos orgánicos bioactivos con aplicación industrial, o en un uso más tradicional como fertilizante. Por otra parte, las algas tienen capacidad para bioacumular metales tóxicos como Hg, Pb, Cd, Ni y Cr entre otros. Con el objeto de asegurar la inocuidad de este material biológico en sus posibles aplicaciones, se ha llevado a cabo un estudio prospectivo sobre su contenido en distintos metales de transición y tierras raras. Se detectaron niveles ligeramente elevados de Hg, lo que podría limitar la utilización de la biomasa. También se determinó el contenido en Sc (escandio), Y (itrio) y de 14 Lantánidos (La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb y Lu) que en conjunto se conocen como tierras raras, encontrándose niveles más elevados que en el océano. Este hecho es consistente con la hipótesis que sitúa el origen de estas algas a latitudes más australes, dónde proliferan al abrigo de la desembocadura de grandes ríos.
Palabras clave: algas, metales tóxicos, tierras raras, Sargassum, feofíceas.
ABSTRACT
The massive accumulation and decomposition of the Sargassum natans and Sargassum fluitans brown seaweeds on the Antillean shores has become a major problem in Central America and the Caribbean, seriously affecting tourism. However, the value of the algal biomass should not be underestimated, since it contains bioactive compounds with industrial application or in a more traditional use as fertilizers. On the other hand, seaweeds have the ability to bioaccumulate toxic metals such as Hg, Pb, Cd, Ni and Cr, among others. In order to ensure the safety of this biological material in its possible applications, it has been carried out a prospective study of the content in different transition metals and rare earths. Slightly elevated mercury levels were detected, which could limit the use of biomass. The content in Sc (scandium), Y (yttrium) and 14 lanthanides (La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb and Lu), collectively known as rare earths, was also determined, being higher than in the ocean levels. This is consistent with the hypothesis that places the origin of these algae to more southern latitudes, where they proliferate in the shelter of the mouth of large rivers.
Key words: seaweeds, toxic metals, rare earth elements, Sargassum, brown algae.
INTRODUCCIÓN
Las algas pardas o feofíceas incluyen a unas 1500-2000 especies (Sitte et al., 2004) y presentan un desarrollo notable en las regiones frías y templadas del océano. Estas algas figuran entre las plantas marinas de desarrollo más elevado y muestran, en sus grupos más evolucionados, órganos denominados filoides, cauloides y rizoides que recuerdan a las hojas, tallos y raíces de las plantas superiores (Sitte et al., 2004).
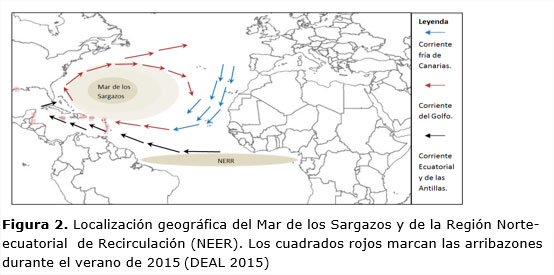
Sargassum fluitans (Børgesen) Børgesen 1914 y Saragassum natans (Linnaeus) Gaillon 1928 son dos algas pardas de vida libre (Davis et al., 2003) que flotan libremente por medio de vesículas denominadas aerocistos y se reproducen por fragmentación del talo (Sitte et al., 2004, Muñoz, 2013 y Széchy et al., 2012). Habitualmente se asocian a una región de aguas oligotróficas (Gower et al., 2013) de contorno elíptico (Muñoz, 2013) que está localizada en el Atlántico noroccidental conocida como Mar de los Sargazos.
Ambas especies de algas pueden alcanzar las costas, acumulándose en cantidades importantes en todo el arco del caribe, desde las Antillas Menores, hasta Cuba (Moreira et al., 2013). Estas llegadas masivas de Sargassum también han afectado recientemente a Belize, Caribe Mexicano e incluso, la costa de Texas (Galvestone) en Estados Unidos, pasando por Puerto Rico, República Dominicana y Jamaica (DEAL, 2015).
Las acumulaciones masivas de estas feofíceas pueden ejercer un impacto negativo sobre la actividad pesquera, tal como ocurrió en 2011 en las Antillas Menores (Gower et al., 2013), en 2012 en Nigeria (Oyesiku y Egunyomi, 2014), afectando también al turismo, tal como sucedió en 2015 en República Dominicana.
El origen de estas algas, que han alcanzado las costas dominicanas masivamente durante el verano de 2015, es controvertido y la cuestión sigue sin respuesta definitiva hasta la fecha. Según (Oyesiku y Egunyomi, 2014), el hecho de que ambas especies aparezcan mezcladas en la línea de costa, tal como sucedió en Nigeria en julio de 2012, sugiere que la fuente de la invasión podría localizarse en el Mar de los Sargazos, dónde ambas algas coexisten. En efecto, la arribazón acontecida en las costas dominicanas en 2015 ha sido atribuida a ambas especies, si bien en el muestreo realizado en las playas de Boca Chica, Guayacanes y Barahona se ha observado un claro predominio de Sargassum fluitans, en coherencia con la arribazón en la Bahía de Cienfuegos (Cuba) de 2012, que fue catalogada como monoespecífica (Moreira et al., 2013). Por otra parte, teniendo en cuenta los antecedentes de 2011, podría ser que la fuente de la biomasa no esté localizada en esta región del Atlántico Norte sino mucho más al sur. Así pues, se ha sugerido que la invasión de Sargazo que tuvo lugar en el verano de 2011 (Gower et al., y Johnson et al., 2013), puede haber tenido su origen en alguna zona de la denominada Región Norte-Ecuatorial de Recirculación (NERR), teniendo especial importancia la desembocadura del río Amazonas, en la costa atlántica de Suramérica. Esta idea está apoyada por el hecho conocido de que, aunque el crecimiento de Sargassum natans está limitado en aguas oceánicas, éste sufre un notable incremento en aguas costeras por el aporte de aguas ricas en nutrientes desde las zonas continentales (Lapointe et al., 1995). Este puede ser el factor de mayor relevancia en la proliferación de estas especies de Saragassum, en el que los aportes de nutrientes de origen fluvial por parte de los ríos como el Amazonas en Sudamérica o el Misisipi en el Golfo de México, tienen un papel determinante.
Con independencia de su origen, una vez alcanza la costa y bajo condiciones de elevada humedad, la biomasa algal se descompone rápidamente emitiendo sustancias que poseen olores desagradables pudiendo ser incluso tóxicas. Ante los efectos perjudiciales que para la economía tiene la acumulación masiva de estas especies en la línea de costa, se ha sugerido que podría obtenerse beneficios de tales eventos (Oyesiku y Egunyomi 2014). Así por ejemplo, las algas pardas se han utilizado tradicionalmente como fertilizantes agrícolas (López-Mosquera et al., 2011) y en alimentación animal, habiéndose sugerido tal uso para la biomasa que se acumula en la costa (Moreira et al., 2012). No obstante, las posibles aplicaciones de estas algas deben ser analizadas con cautela, debido a la capacidad que tienen de acumular metales tóxicos. El término biosorción se utiliza para describir la capacidad que tiene cierto material inerte de origen biológico, para unirse de manera pasiva por absorción y/o adsorción a metales tóxicos (Davis et al., 2003). La elevada capacidad biosortiva de las algas pardas (Phaeophyceae) para los metales como Pb, Cu, Cd, Ni, Mn, Co, Cr y Zn es bien conocida (Agusto et al., 2001, Davis et al., 2000, Davis et al., 2003, Volesky et al., 1995, Diniz y Volesky, 2005). Así por ejemplo, la biomasa seca de especies de los géneros Ascophyllum y Sargassum puede concentrar plomo y cadmio de disoluciones muy diluidas, pudiendo acumular más del 30% de su peso seco en metales (Volesky et al., 1995). Dentro de las algas pardas, los órdenes Laminariales y Fucales, dónde se incluye el género Sargassum, son los más importantes en lo que a procesos de biosorción se refiere y ello se debe a la abundancia de polisacáridos que integran la matriz de la pared celular y que, en las feofíceas, están formados predominantemente por alginatos y fucoidanos. Esta capacidad de la biomasa no debe ser confundida con otra propiedad conocida como bioacumulación que, por el contrario, hace referencia a la retención de determinados elementos mediante un mecanismo activo, controlado por el metabolismo celular (Davis et al., 2003). En este sentido se sabe que las algas, y en especial las algas pardas, poseen la capacidad de bioacumular metales tóxicos y por ello son utilizadas como bioindicadores para la contaminación por estos metales. Para garantizar que la biomasa algal no contenga elementos tóxicos que puedan introducirse en la cadena alimentaria o contaminar el medio ambiente, desde el Laboratorio de la Dirección General de Aduanas de República Dominicana se llevó a cabo un análisis prospectivo de metales de transición del material biológico acumulado en las playas de Boca Chica (Santo Domingo), Guayacanes (San Pedro de Macorís) y Ojeda (Barahona) durante el año 2015. Se analizaron también los elementos conocidos como tierras raras, en dónde se incluyen los Lantánidos, el escandio e itrio.
MATERIALES Y MÉTODOS
Un mínimo de 4 muestras fueron recolectadas en el mes de octubre (2015) en cada uno de los lugares de muestreo: playa de Ojeda (provincia de Barahona), playas de Boca Chica (provincia de Santo Domingo) y Guayacanes (provincia de San Pedro de Macorís). Las muestras fueron introducidas en contenedores plásticos con agua de mar y transportadas hasta el Laboratorio de la Dirección General de Aduanas dónde se llevó a cabo su clasificación atendiendo a los caracteres morfológicos diferenciales que muestran ambas especies y que están recogidos en la literatura (Széchy et al., 2012, Moreira et al., 2013, Oyesiku y Egunyomi, 2014). Se confirmó la presencia de ambas especies, tanto de Sargassun fluitans como de Sargassum natans, pero con un claro predominio de la primera.
Ambas especies fueron identificadas atendiendo a diferencias morfológicas a nivel de los filoides (Moreira et al., 2013), que son lanceolados y puntiagudos en S. fluitans y más estrechos en S. natans (Széchy et al., 2012), y también a partir de diferencias en los aerocistos, que están provistos de espinas en S. natans pero no en S. fluitans, tal como se aprecia en la Figura 1 (Széchy et al., 2012, Morerira et al. 2013, Oyesiku et al., 2014). Por otra parte, los aerocistos de S. fluitans poseen un pedúnculo más corto que los de S. natans y están provistos de un ala de tejido alrededor (Oyesiku y Egunyomi 2014).
El procesamiento de las muestras incluyó un lavado inicial con agua, seguido de un lavado con agua desionizada y secado utilizando una cámara de secado por convención natural marca Binder modelo ED115 E2, durante 24 horas a 110 °C. Posteriormente las muestras fueron homogeneizadas mediante pulverización y tamización. La digestión del material se llevó a cabo preparando por duplicado 500 mg de cada muestra, que fueron vertidos en un vial de teflón de 75 mL, a los que se agregaron 7,0 mL de HNO3 al 69 %, 1,5 mL de H2O2, 0,5 mL de HF (40-45 %) y 2,0 mL de agua desionizada. Para la digestión se empleó un digestor PerkinElmer modelo Titan MPS. El HF residual fue tratado con H3BO3 y se procedió a colocar nuevamente los viales en el sistema de preparación de muestras.
Tras filtrar y el contenido de las muestras fue vertido en matraces aforados de 250 mL, completando con agua desionizada hasta la línea de aforo. Posteriormente se tomó un (1) mL de las mismas, se diluyeron en un matraz y se aforaron en 100mL con una disolución al 2 % w/v de ácido nítrico (TraceMetal Grade de Scharlau, Cat#AC16171000) preparada con agua desionizada con una resistividad de 18,2 MΩ. Para la cuantificación de los elementos presentes en las muestras estudiadas se empleó un espectrómetro de masa con plasma acoplado inductivamente (ICP-MS) marca PerkinElemer, modelo NexION 300X. Para cada uno de los analitos se estableció una curva de calibración, llevándose a cabo los análisis por triplicado.
RESULTADOS Y DISCUSIÓN
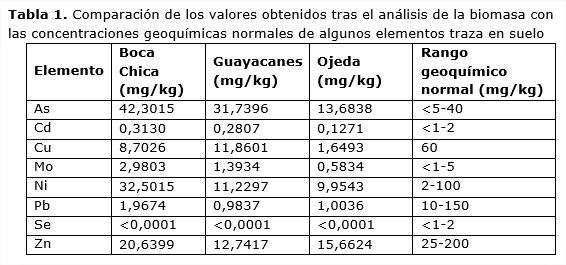
En comparación con las concentraciones geoquímicas consideradas normales por Bowie y Thornton (Galán y Romero, 2008), no se detectaron niveles elevados de As, Cd, Cu, Mo, Ni, Pb, Se y Zn (Tabla 1).
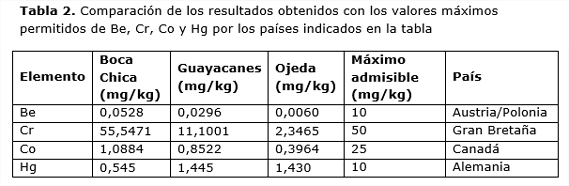
Los valores de Be, Cr y Co no excedieron de forma significativa los niveles máximos permitidos por los países más restrictivos (Galán y Romero 2008, Belmonte et al., 2010), tal como se muestra en la Tabla 2.
La concentración de talio (Tl), elemento que posee una elevada toxicidad (Tabla 5), resultó ser un orden de magnitud menor respecto a los valores naturales del suelo (0,3-0,7 ppm) (HHS 1992).
No obstante, en dos de las tres localidades en las que se llevó a cabo el muestreo, se detectaron concentraciones ligeramente elevadas de mercurio (Tabla 2) si bien estos valores no son tan altos como otros citados en la literatura, en el que se observa una elevada contaminación de las feofíceas con valores que oscilan desde 4,65 ppm (Turbinaria triquetra) hasta los 7,61 ppm (Padina boryana) (El-Naggar y Al-Amoudi, 1989). Debe tenerse en cuenta que la utilización de la biomasa algal como fertilizante podría elevar de forma innecesaria los niveles de mercurio en los suelos dominicanos.
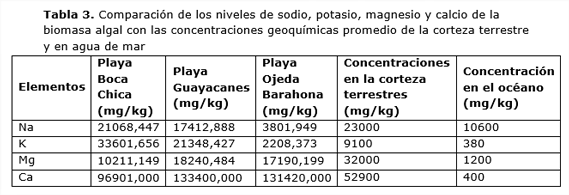
Un inconveniente adicional para la utilización de estas algas como fertilizantes podría ser los altos niveles de sodio, calcio y magnesio presentes y que podrían provocar la salinización de los suelos de cultivo (Tabla 3). En este sentido, destacan los elevados valores de calcio encontrados, mayores incluso que los valores geoquímicos promedio de la corteza terrestre. Tal como se recoge en la Tabla 5, los niveles algales de estos cuatro metales alcalinos y alcalinotérreos son muy superiores en comparación con la del agua de mar.
Estos estudios prospectivos deberán ampliarse, incluyendo un muestreo más amplio y deberán preceder a cualquier utilización que se pretenda dar a la biomasa, fruto de futuras arribazones de estas algas a las costas dominicanas. Ello evitaría posibles problemas de salud pública y contaminación medioambiental.
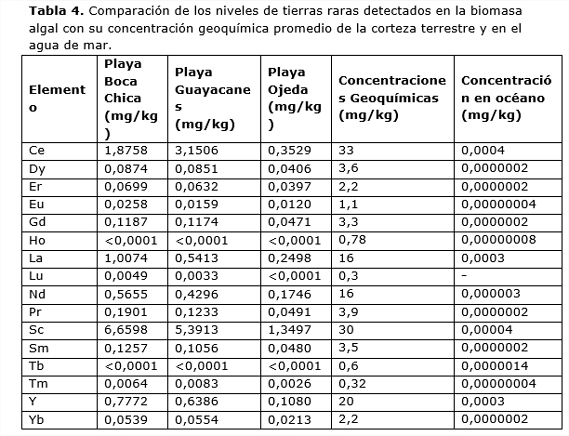
En relación a los metales conocidos como tierras raras se observa que estas algas poseen una concentración menor que la corteza terrestre (Tabla 4), pero niveles mucho mayores respecto al agua de mar, en la que las concentraciones son del orden de partes por trillón (ppt = ng/kg) en lugar de partes por millón (ppm = mg/kg) (Generalic, 2015).
Este hecho sugiere que estas algas pelágicas son capaces de concentrar estos metales hasta en seis órdenes de magnitud, respecto a su concentración en el agua de mar, como ocurre en el caso del Praseodimio (Pr). Una explicación alternativa sería asumir que estas algas, han proliferado en agua más ricas en estos metales (Figura 2), al abrigo de la desembocadura de grandes ríos como el Amazonas que aportarían importantes cantidades de sedimentos provenientes de la meteorización de suelos y rocas.
Los valores obtenidos para la totalidad de los elementos analizados se muestran en la Tabla 5. Entre los elementos estudiados se muestras 16 de los 17 elementos conocidos como Tierras Raras.
CONCLUSIONES
1.En el presente estudio no se han detectado niveles preocupantes de ninguno de los elementos estudiados en la biomasa algal, no obstante su posible uso como fertilizante agrícola o en alimentación animal, podría incrementar las concentraciones de metales tóxicos y sales en los suelos y/o de incorporarlos a la cadena alimentaria.
2.La comparación entre las concentraciones de tierras raras del agua de mar y los detectados en la biomasa algal revela importantes anomalías de varios órdenes de magnitud, lo que podría indicar que estas algas son capaces de bioacumular estos metales. Otra posible explicación a estos resultados parece apoyar la hipótesis que sitúa el origen de la biomasa en la Región Norte-Ecuatorial de Recirculación (NERR) (Figura 2), en la que los aportes fluviales de ríos como el Amazonas producirían una mayor exposición a estos metales
REFERENCIAS
Agusto, A.C., Mora, A.P., Pessôa, F., The release of light metals from a brown seaweed (Sargassum sp.) during zinc biosorption in a continuous system., [versión electrónica], Electronic Journal of Bioctechnology, Vol. 4, No. 3, 2001.
Belmonte, F., Romero, A., Alonso, F., Moreno, J., Rojo, S., Afección de suelos agrícolas por metales pesados en áreas limítrofes a explotaciones mineras del sureste de España., Papeles de Geografía, No. 51-52, 2010, pp. 45-54.
Davis, T.A., Volesky, B., Vieira, R.H.S.F. , Sargassum seaweed as biosorbent for heavy metals., Water Res., Vol. 34, 2000, pp. 4270-4278.
Davis, T.A., Volesky, B., Mucci, A. A review of the biochemistry of heavy metal biosorption by brown algae., Water Research, Vol. 37, 2003, pp. 4311-4330.
DEAL, Direction de l’Environnement, de l’ Aménagement et du Logement. Republique Française) L’ invasión des sargasses.. Revue de presse <<Caraïbes>>, 2015.
Diniz, V., Volesky, B., Biosorption of La, Eu and Yb using Sargassum biomass., Water Res., Vol. 39, 2005, pp. 239-247.
El-Naggar, M.E.E., Al-Amoudi, O.A., Heavy Metal Levels in Several Species of Marine Algae from Red Sea of Saudi Arabia. J.K.A.U. Sci, Vol. 1, (1409 A.H./1989 A.D.) 1989, pp. 5-13.
Galán, E., Romero, A., Contaminación de suelos por Metales Pesados. Revista de la Sociedad Española de Mineralogía Macla, Vol. 10, 2008, pp. 48-60.
Generalic, Eni. "Bibliografía." EniG. Tabla periódica de los elementos. KTF- Split, 23 Aug. 2015, Web. 29 Dec. 2015. http://www.periodni.com/es/bibliography.html
Gower, J., Young, E., King, S., Satellite images suggest a new Sargassum source region in 2011., Remoting Sensing Letters, Vol. 4, No, 8, 2013, pp. 764-773.
Johnson, D.R., Ko, D.S., Franks, J.S., Moreno, P., Sánchez-Rubio, G., The Sargassum Invasion of the Eastern Caribbean and Dynamics of the Equatorial North Atlantic., Proc. of the 65th Gulf and Caribbean Fisheries Institute, Santa Marta, Colombia, 2013, pp. 102-103.
Lapointe, B.E., A comparison of nutrient-limited productivity in Sargassum natans from neritic vs. oceanic waters of the western North Atlantic Ocean., Limnology and Oceanography, Vol. 40, 1995, pp. 625-633.
López-Mosquera, M.E., Fernández-Lema, E., Villares, R., Corral, R., Alonso, B., Blanco, C., Composting fish waste and seaweed to produce a fertilizer for use in organic agricultura., Procedia Enviromental Sciences, Vol. 9, 2011, pp. 113-117.
Moreira, A., Alfonso, G., Inusual arribazón de Sargassum fluitans (Børgesen) Børgesen en la costa centro-sur de Cuba., Rev. Invest. Mar., Vol. 33, No. 2, 2013, pp. 17-20.
Muñoz Bautista, A.N., Composición Taxonómica y abundancia de la macrofauna asociada A Sargassum (Phaephyceae: Fucales) Flotante en el Sistema Arrecifal Veracruzano, Suroeste del Golfo de México., Tesis presentada en opción al grado científico de Maestra en Ecología y Pesquerías, Universidad Veracruzana, Instituto de Ciencias Marinas y Pesquerías, 2013.
Oyesiku, O.O., Egunyomi, A., Identification and chemical studies of pelagic masses or Sargassum natans (Linnaeus) Gailon and S. fluitans (Borgensen) Borgensen (brown algae), found offshore in Ondo State, Nigeria., African Journal of Biotechnology, Vol. 13, No.10, 2014, p.1189-1193.
Sitte, P., Weiler, E.W., Kadereit, J.W., Bresinsky, A., Körner, C. Strasburguer Tratado de Botánica. 35.a edición. Edit Omega, Barcelona, 2004, pp. 668-669.
Széchy, M.T., Guedes, P.M., Baeta-Neves, M.J., Oliveira, E.N., Verification of Sargassum (Linnaeus) Gaillon (Heterokontophyta: Phaeophyceae) from Sargasso Sea off the coast of Brazil., western Atlantic Ocean, Check List Vol. No. 4, 2012, pp. 638-641.
Volesky, B., Holan Z.R., Biosorption of heavy metals., Biotechnol. Prog, Vol. 11, 1995, pp.235-250.
Recibido: Julio 7, 2016
Revisado: Julio 26, 2016
Aceptado: Septiembre 8, 2016