Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Centro Azúcar
versión impresa ISSN 0253-5777versión On-line ISSN 2223-4861
cen. az. vol.45 no.1 Santa Clara ene.-mar. 2018
ARTICULO
Crecimiento microbiano en pilas de compostaje de residuos orgánicos y biosólidos después de la aireación
Microbial growth in compost piles of organic waste and biosolids after the aeration process
Marisol Ballesteros Trujillo1, María del Consuelo Hernández Berriel 1*, Isaías de la Rosa Gómez1, María del Consuelo Mañón Salas1y María del Carmen Carreño de León1
1 División de Estudios de Posgrado e Investigación, Instituto Tecnológico de Toluca; Av. Tecnológico S/N, Col. Agrícola Bellavista, C.P. 52149, Metepec, Estado de México.
*Autor para la correspondencia: María del C. Hernández, Email: mhernandezb@toluca.tecnm.mx
RESUMEN
En la actualidad, la fracción orgánica contenida en los residuos sólidos urbanos (FORSU) y la generación de biosólidos de plantas de tratamiento de aguas residuales (PTAR) requiere alternativas de solución. El compostaje es un método que puede transformar estos residuos para su aprovechamiento. La duración del proceso depende tanto de los sustratos iniciales, tamaño de partícula, disposición de la pila, aireación, humedad y población biológica activa.El objetivo de este estudio es determinar el efecto de la aireación sobre el crecimiento de bacterias y actinomicetos en pilas de compostaje de 250 kg. La pila denominada P1 está elaborada con arcilla (30%), lama (5%), biosólido (32,5%) de PTAR y (32,5%) FORSU y, la P2 está preparadacon arcilla (30%), lama (5%) y biosólido (65%). Durante el proceso se monitorea humedad, temperatura, pH y crecimiento de bacterias y actinomicetos, antes y después de realizar la aireación en ambas pilas. En la fase termófila la P1 alcanzó temperaturas de 49,0-51,5°C por cinco días consecutivos, mientras que P2 llegó a 45,2-48,4°C por tres días. En ambas pilas el rango de pH fue de 6,8-8,8. Para P1 la humedad base húmeda fue 35-42 % (%Hbh) y para P2 fue 32-35 %Hbh, obteniéndose composta en 28 días. La aireación tuvo un efecto significativo en el crecimiento microbiano en la fase termófila, debido a que alteró las condiciones de los microsistemas, siendo menor para los actinomicetos que para las bacterias.
Palabras clave: composta; biosólidos; residuos orgánicos; crecimiento microbiano; aireación.
ABSTRACT
Nowadays, the problem of dealing with the organic fraction contained in urban solid waste (OFUSW) and the biosolids generated from wastewater treatment plants (WWTP) requiresalternative solutions. Composting is a method that can transform these wastes for their use. The length of the process depends on initial substrates, particle size, arrangement of the pile, moisture, aeration, and active biological population. The objective of this study is to determine the effect of aeration on the growth of bacteria and actinomycetes in composting piles of 250 kg. The pile identified as P1 is made with clay (30%), lama (5%), biosolids of WWTP (32.5%) and OFUSW (32.5%); and the one identified as P2 is prepared with clay (30%), lama (5%) and biosolids (65%). During the process, moisture content in wet basis (Hbh), temperature, pH, and growth of bacteria and actinomycetes are monitored in both piles, before and after performing aeration. In the thermophilic phase, P1 reached 49.0 – 51.5 °C for five consecutive days, while P2 reached 45.2 – 48.4 °C for three days. In both piles, pH ranged from 6.78 to 8.75 and compost was obtained in 28 days. The moisture for P1 was 35-42%Hbh, and for P2 it was 32-35%Hbh. Aeration had a significant effect on microbial growth in the thermophilic phase because it altered the conditions of the microsystems, being lower in the case of actinomycetes than in the case of bacteria.
Key words: composting; biosolids; organic wastes; microbial growth; aeration.
INTRODUCCIÓN
Más del 50 % de los residuos sólidos urbanos (RSU) generados en países de América Latina son orgánicos y la mayoría de los municipios no cuentan con planes de manejo que permitan minimizar y valorizar los RSU, por lo que son confinados de manera inadecuada en tiraderos a cielo abierto (GEM, 2017; OPS-AIDIIS, 2010).
En México es incipiente el aprovechamiento de los RSU, especialmente de su fracción orgánica (FORSU), la cual representa sobre el 50% del total de los mismos. La FORSU dispuesta en rellenos sanitarios o tiraderos a cielo abierto se biodegrada y genera principalmente metano (CH4) y dióxido de carbono (CO2), ambos gases de efecto invernadero (SEMARNAT, 2014, Ramos, 2011). Aunado a lo anterior se tiene la formación de lixiviados, que son potencialmente contaminantes por sus altas cargas orgánicas y contenido de metales pesados (Novelo et al., 2009).
Otro problema no menos importante es el agua residual doméstica, la cual al ser tratada tiene como subproducto lodos o biosólidos; se estima que una población de 100,000 habitantes produce 5520 kg/d de biosólidos. De acuerdo con datos reportados en la Comisión Nacional del Agua (CONAGUA), en México en el 2011 solo se trató el 46,5% de las aguas residuales nacionales, depositándose la mayor parte de los biosólidos en rellenos sanitarios. La principal problemática del manejo de biosólidos en México y el mundo consiste en la acumulación excesiva, la atracción de vectores, el aprovechamiento inadecuado, el riesgo de salud pública, malos olores y el rechazo de la comunidad (CONAGUA, 2013).
Entre las alternativas de tratamiento para la FORSU y los biosólidos destaca el composteo, la cual es una opción que puede reducir al 25% su peso original. El aprovechamiento de la FORSU y de los lodos permite la prolongación de la vida útil de los rellenos sanitarios y representa un beneficio económico y ambiental, ya que la composta resultante puede ser utilizada como mejorador de suelos, donde al integrarse a los ciclos biogeoquímicos, ayuda a conservar la fertilidad del mismo de forma amigable con el ambiente (Gordillo et al., 2011; GODF, 2012).
Durante el proceso de compostaje se lleva a cabo una compleja sucesión de poblaciones de microorganismos, que están en función de la evolución de la temperatura, disponibilidad de nutrientes, concentración de oxígeno, contenido de agua, pH y acumulación de compuestos antibióticos (Laich, 2011; Morales y Peláez, 2010). De estas las poblaciones las más importantes son: bacterias, actinomicetos y hongos filamentosos (Cariello et al., 2007).
La temperatura es un indicador de la actividad microbiana, a medida que se eleva la temperatura, las poblaciones microbianas son reemplazadas por otras mejor adaptadas. Entre las etapas, la termófila es la más importante, ya que en ésta se incrementa la temperatura, provocando la proliferación de bacterias y hongos presentes en los residuos en estado latente, que viven en temperaturas de 45°C a 75°C. Es necesario mantener una adecuada aireación para que el proceso se produzca en condiciones aerobias, así como una humedad cercana a 50% base húmeda (%Hbh) que permita la presencia de los microorganismos descomponedores (Escobar et al., 2012; Laich, 2011).
En cuanto al crecimiento microbiano se conocen cuatro fases: latencia, de crecimiento o exponencial, estacionaria y de muerte (FAO, 2006); sin embargo, se carece de información sobre las poblaciones durante el composteo de FORSU y biosólidos; por lo que el objetivo de este estudio es determinar el efecto de la aireación sobre el crecimiento de bacterias y actinomicetos en pilas de compostaje de 250 kg, empleando estos dos sustratos.
MATERIALES Y MÉTODOS
2.1 Preparación de sustratos
A cada uno de los materiales a utilizar para el montado de las pilas seles debe preparar como se describe a continuación.
La FORSU se obtuvo de la Central de Abastos de Toluca, Estado de México. Estos residuos se fraccionaron en un molino de cuchillas marca Bear Cat modelo SC3305E, obteniendo un tamaño de partícula aproximadamente de 2,0 cm. Estos se deshidrataron mediante radiación solar (24 horas) y aireación manual cada tres horas, hasta obtener una humedad aproximada de 50 + 5 % base húmeda (%Hbh).
Los biosólidos se colectaron de la planta tratadora de aguas residuales operada por la empresa ECOSYS S.A de C.V. y posteriormente se secaron por medio de radiación solar hasta una humedad de 35-40%Hbh; finalmente se trituraron con un molino de martillos marca INGAR modelo PPG-00124, rompiendo los aglomerados hasta un tamaño de 2-5 mm de diámetro.
La arcilla se obtuvo de las minas del municipio de Calimaya, Estado de México. A ésta se le realiza una inspección visual con el propósito de retirar materia extraña, después se hace pasar a través de una criba malla 2,0 para obtener un tamaño de partícula uniforme.
La lama se colecta de caballerizas ubicadas en la zona noroeste del Valle de Toluca y se le inspecciona de manera visual para retirar todo material extraño.
2.2 Montado de las pilas y seguimiento
Se montaron dos pilas estáticas de 250 kg cada una. De cada sustrato se pesa la cantidad correspondiente al porcentaje que se muestran en la Tabla 1. Una vez colocadas las cantidades en el suelo, se mezclaron perfectamente y se humectaron con agua hasta un 35-50 % Hbh. Las pilas se acomodaron en forma trapezoidal, con dimensiones de 0,60 x 1,20 x 1,50 m (alto, ancho de la base y largo).
Se dio seguimiento al proceso de compostaje mediante las variables de temperatura y humedad. La temperatura se midió diariamente con un termómetro bimetálico en 9 puntos equidistantes de cada pila a una profundidad de aproximadamente 20 cm y, la humedad se determinó con una termobalanza marca Sartorius MA-150®. De acuerdo al contenido de humedad determinado, se humedecieron las pilas con agua potable.
También se realizó aireación mediante paleo manual cada 48 horas, con la finalidad de mantener el proceso en condiciones aerobias. Esta actividad consistió en trasladar los materiales de la pila hacia el frente y regresarla en dos partes.
2.3 Análisis Microbiológico
Para determinar el crecimiento microbiano se tomaron muestras compuestas de cada pila antes y después de airearlas. De la muestra compuesta se tomó 1,0g para diluirse en 50ml de solución Buffer pH 7 y de ésta se preparó la primera dilución, se agito en vórtex por 1 min para lograr la homogeneidad y se realizaron siete diluciones seriadas.
Se tomó 1mL de las diluciones cinco, seis y siete, sembrándose en agar nutritivo TSA tripticaseína de soya (marca Bioxon) para bacterias termófilas y mesófilas y en agar Actinomicete (marca Difco) para actinomicetos conforme a la Norma Oficial Mexicana NOM-092-SSA1-1994 (Camacho et al., 2009). Las cajas sembradas por triplicado se incubaron por 48 horas a 35-37 °C y se cuantificaron las unidades formadoras de colonias por gramo de peso seco (UFC/g). A los resultados se les realizó un análisis estadístico aplicando la t de student para datos dependientes.
2.4 Caracterización fisicoquímica
Tanto a los sustratos como a la composta obtenida se les determina humedad y pH, conforme a las normas Mexicanas NMX-AA-016-1984 y NMX-AA-025-SCFI-1984 respectivamente (SEMARNAT, 2014); así como Sólidos Volátiles Totales (SVT) mediante el método 2540G (APHA, 2005).
RESULTADOS Y DISCUSIÓN
3.1. Dinámicas de temperatura
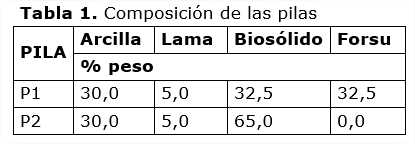
En la Figura 1 se presentan las dinámicas de temperatura. Las fases termófilas comprendieron los días 2-7 (49,0-51,5°C) y 2-5 (45,2-48,4°C) para P1 y P2 respectivamente. La temperatura alcanzada en la P1 puede atribuirse la FORSU, donde los residuos fácilmente degradables favorecieron la actividad de la población de microorganismos. Las temperaturas ambientales registradas oscilaron entre 10 y 20°C, debido a que el montado de las pilas fue a finales del otoño y el periodo de compostaje trascurrió durante parte del invierno, época que es la más fría en el Valle de Toluca. Se dio por terminado el proceso de compostaje a los 28 días, cuando la temperatura de ambas pilas fue menor a 20°C.
3.2. Análisis Microbiológico
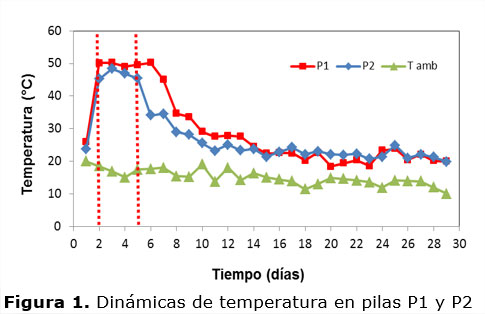
En la Figura 2 se presentan las dinámicas de las bacterias en la P1, donde puede observarse un mayor crecimiento antes de la aireación, sobre todo durante la fase termófila. La densidad bacteriana fue mayor antes de la aireación, considerando el proceso completo 6,7% en promedio y en la fase termófila 22,2%.
En la Figura 3 se presentan las dinámicas de las bacterias en la P2, donde puede observarse un mayor crecimiento antes de la aireación durante la fase termófila. La densidad bacteriana fue mayor antes de la aireación, considerando el proceso completo 5,9% en promedio y en la fase termófila 13,6%.
Para el proceso completo no de encontró diferencia significativa entre el crecimiento bacteriano antes y después de airear ambas pilas, sin embargo, durante la fase termófila sí mostraron diferencia significativa, lo cual puede atribuirse a la alteración de los microsistemas. Durante la fase mesófila de estabilización, las densidades bacterianas son similares antes y después de airear, debido a que las bacterias que sobresalen en número son de este tipo (Haug, 1993; Ramos, 2011). Las densidades bacterianas son en general mayores en la P1 que en la P2, lo cual está directamente relacionado con los sustratos utilizados. En ambas pilas al final de proceso de composteo decrecen las poblaciones, debido a que los nutrientes fácilmente disponibles también disminuye (Gordillo et al., 2011).
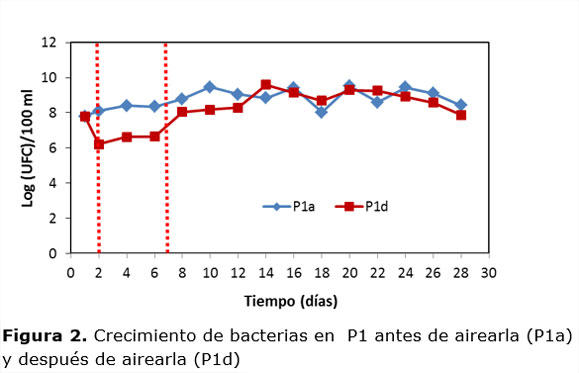
Las dinámicas de crecimiento de los actinomicetos en la P1 (Figura 4), muestran una mayor población antes de la aireación durante la fase termófila. En el proceso completo la densidad microbiana fue mayor antes de la aireación solo 1,8%, mientras que en la fase termófila fue 11,7%. Estos microorganismos se vieron favorecidos después de airear la pila en la fase mesófila, debido a que los actinomicetos son microorganismos que se incrementan al airear las pilas (Laich, 2011).
En cuanto a la P2, el crecimiento de los actinomicetos (Figura 5) se vio favorecido principalmente durante la fase termófila, lo que concuerda con lo reportado por Escobar et al., (2012) y Laich (2011). La densidad microbiana fue mayor antes de la aireación en un 4,9% tomando el proceso completo y en un 12,5 en la fase termófila.
En el proceso completo no de encontró diferencia significativa entre el crecimiento de los actinomicetos antes y después de airear ambas pilas, sin embargo, durante la fase termófila sí mostraron diferencia significativa. De manera similar que para las bacterias, las densidades de actinomicetos son mayores en la P1 que en la P2, lo cual puede atribuirse a la FORSU empleada en P1 (Cariello et al., 2007). En ambas pilas al final de proceso de composteo se incrementan las poblaciones a diferencia de lo reportado por Haug (1993).
3.3. Caracterización fisicoquímica
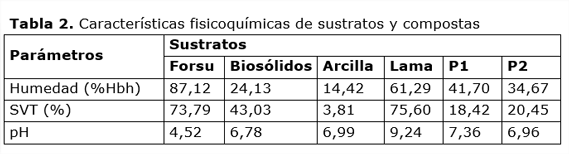
En la Tabla 2 se presenta la caracterización fisicoquímica realizada tanto a sustratos como a las compostas obtenidas en cada pila. La FORSU aportó 87,12%Hbh, mientras que la arcilla solo el 14,42%Hbh, de ahí la importancia de la humidificación inicial con agua, para que las condiciones sean las idóneas para la degradación microbiana (Escobar et al., 2012; Laich, 2011).
En cuanto a SVT, los sustratos que mayor cantidad de materia orgánica aportan son la FORSU y la lama. El pH la FORSU es la que tiene el valor de pH menor con respecto a los otros sustratos, de manera que cuando se conformó la P1 mezclando todos los sustratos, el pH de ésta se incrementó favorablemente (Gordillo et al., 2011).
Los valores de P1 mostraron una mayor variación de humedad durante el proceso de composteo (35-42 %Hbh) y fueron superiores a los de P2 (32-35 %Hbh) hasta finales de la fase termófila. Es posible que lo anterior haya afectado las temperaturas alcanzadas por P2, dado que durante esta fase es cuando se requiere un porcentaje mayor de humedad por la alta actividad microbiana, mientras que durante la fase de enfriamiento la población microbiana disminuye, debido a que la cantidad de materia orgánica disponible también es menor (Alzate-Gaviria et al., 2003; Juárez, 2014).
El contenido de SVT en P1 es indicio de una mayor degradación de materia orgánica que en P1. El pH tanto en la P1 como en la P2 se mantuvo en los rangos de 6,5 a 8,8; los cuales son apropiados para la sobrevivencia de los microorganismos durante el proceso de degradación; finalmente las compostas obtenidas en ambas pilas alcanzaron la neutralidad, aunque la humedad final de la P2 fue menor, lo que pudo afectar la degradación misma (Cariello et al., 2007; Castrillón et al., 2007).
CONCLUSIONES
1. Se caracterizaron microorganismos en las fases mesófila uno (de acondicionamiento), termófila y mesófila dos (de estabilización) de P1 y P2, encontrando en promedio mayores densidades de población de bacterias que de actinomicetos en ambas pilas.
2. La cantidad de microorganismos presentes en la P1 fue mayor a los de la P2, debido a la mayor aportación de éstos por la FORSU utilizada en la P1, así como de compuestos fácilmente biodegradables.
3. La aireación tuvo un efecto significativo en el crecimiento microbiano en la fase termófila, debido a que alteró las condiciones de los microsistemas, siendo menor el efecto para los actinomicetos que para las bacterias.
AGRADECIMIENTOS
· Los autores agradecen al CONACYT por la beca otorgada para la tesista y al Tecnológico Nacional de México por el apoyo para la realización de la parte experimental de esta investigación, mediante el proyecto 5443.1.14-P.
· Así mismo, agradecen al COMECYT por el apoyo otorgado para la asistencia y presentación de este trabajo en el IV Simposio Internacional de Seguridad Tecnológica y Ambiental, a realizarse en la Universidad Central de "Marta Abreu" de las Villas en Santa Clara, Cuba.
REFERENCIAS
Alzate-Gaviria, L.M., Pérez-Hernández, A., Nevárez-Morillón, V.G., Rinderknecht-Seijas, N., y Poggi-Varaldo, H.M., Comparación de dos sistemas anaerobios acoplados para la biometanización de la fracción orgánica de residuos sólidos urbanos., INTERCIENCIA, Vol. 28, No. 8,2003,pp. 436-442.
APHA., Standard Methods for Water and Wastewater Examination 21st ed., American Public Healt Association- American Water Works Association, Water Environment Federation Publication, Washington, DC, USA, 2005, pp. 2540E-2540G.
Camacho, A., Giles, M., Ortegón, A., Palao, M., Serrano, B., Velázquez, O., Técnicas para el Análisis Microbiológico de Alimentos. NOM-092-SSA1-1994, Bienes y Servicios, Método para la Cuenta de Bacterias Aerobias en Placa. 2ª ed. Facultad de Química, UNAM. México.DOF., 2009, pp. 1-10. (Consultado en Mayo del 2015). Disponible en: http://depa.fquim.unam.mx/amyd/archivero/TecnicBasicas-Cuenta-en-placa_6527.pdf
Cariello, M., Castañeda, L., Riobo, I., & González, J., Inoculante de microorganismos endógenos para acelerar el proceso compostaje de residuos sólidos urbanos., R.C. Suelo Nutr. Veg, Vol. 7, No. 3, 2007, pp. 26–37.
Castrillón, Q.O., Bedoya, O.M., Efecto del pH sobre el crecimiento de microorganismos durante la etapa de maduración en pilas estáticas de compost., Producción + Limpia, Vol. 1, No. 2, Universidad de Antioquia, 2006, pp. 87-89.
CONAGUA., Comisión Nacional del Agua. Inventario nacional de plantas municipales de potabilización y de tratamiento de aguas residuales en operación, 2014, pp. 1-302.
Escobar, N.E., Mora, J.D., Romero, N.J.J., Identificación de poblaciones microbianas en composta de residuos orgánicos de fincas cafeteras de Cundinamarca., Boletín científico centro de museos Museo de Historia Natural, Vol. 16, No. 1, 2012, pp. 75 – 88.
FAO, Food and Agriculture Organization., Conservación de los recursos naturales para una Agricultura sostenible, Integración cultivo-ganadería, 2006, pp. 1–28. (Consultado en Enero del 2016). Disponible en: http://www.fao.org/ag/ca/training_materials/cd27-spanish/li/livestock.pdf
GEM, Gobierno del Estado de México., Programa de protección civil para basureros, 2017, pp. 1-47. (Consultado en Octubre del 2017). Disponible en:http://cgproteccioncivil.domex.gob.mxsites/cgproteccioncivil.edomex.gob.mx/files/files/programas%20de%20Prevencion/programas%20nuevo%20directorio/PPC%20BASUREROS%202017.pdf
GODF, Gobierno del Distrito Federal. NADF-020-AMBT-2012, que establece los requerimientos mínimos para la producción de composta a partir de la fracción orgánica de los residuos sólidos urbanos, agrícolas, pecuarios y forestales, así como las especificaciones mínimas de calidad de la compost. Septiembre de 2012, pp. 69–83. (Consultado en Octubre del 2015). Disponible en: http://www.inecc.gob.mx/descargas/dgcenica/diagnostico_basico_extenso_2012.pdf,\nhttp://www.sma.df.gob.mx/sma/links/download/biblioteca/IRSDF2011_FINAL.pdf
Gordillo, F., Peralta, E., Chávez, E., Contreras, V., Campuzano, Ruiz, O., Producción y evaluación del proceso de compostaje a partir de desechos agroindustriales de Saccharum officinarum (caña de azúcar). RIA: Revista de Investigaciones Agropecuarias, Vol. 37, No. 2, 2011, pp. 140–149.
Haug, T.R., The Practical Handbook of Compost Engineering., Lewis Publishers, CRC Press LLC, Boca Ratón Florida, USA, 1993, pp. 1-752.
Juárez, R.B., Obtención de composta a partir de un biosólido y residuos sólidos orgánicos con una relación carbono nitrógeno entre 4 y 8, y en tiempo menor a 3 meses., Tesis presentada en opción al Grado Científico de Master en Ciencias en Ingeniería Ambiental, Instituto Tecnológico de Toluca, México, 2014.
Laich, F., El papel de los microorganismos en el proceso de compostaje., Jornada Técnica: Fertilidad y Calidad del Suelo. Experiencias de fertilización orgánica en platanera. Instituto Canario de Investigaciones Agrarias. ICIA. 21 de Octubre de 2011, Santa Cruz de Tenerife, España. pp. 1-7.
Morales G., y Peláez, C., Evaluación cinética de los Dípteros como indicadores de la evolución del proceso de compostaje., Revista Ingenierías Universidad de Medellín, Vol.9, No. 17, 2010, pp. 13-28.
Novelo, R.I.M., Borges, E.R.C., Riancho, M.R.S., Franco, C.A.Q., Vallejos, G.G., & Cisneros, B.J., Comparación de cuatro tratamientos fisicoquímicos de lixiviados. Revista Internacional de Contaminación Ambiental, Vol. 25, No. 3, 2009, pp. 133-145.
OPS-AIDIIS,. Informe de la evaluación regional del manejo de residuos sólidos urbanos en América Latina y el Caribe 2010.,Organización Panamericana de la Salud (OPS), el Banco Interamericano de Desarrollo (BID) y la Asociación Interamericana de Ingeniería Sanitaria y Ambiental (AIDIS),2010, pp. 1-158. (Consultado en Diciembre del 2015). Disponible en: https://publications.iadb.org/handle/11319/3286?locale-attribute=es&
Ramos, P.D., Análisis del composteo de residuos sólidos domiciliarios de Torreón, Coahuila., Tesis de Ingeniería en Agroecología, Universidad Autónoma Agraria Antonio Narro, Unida Laguna. Torreón, Coahuila, México, 2011. (Consultado en Octubre del 2015). Disponible en: http://repositorio.uaaan.mx:8080/xmlui/bitstream/handle/123456789/2435/DEYSI%20RAMOS%20PINTO.pdf?sequence
SEMARNAT., Secretaría del medio ambiente y Recursos Naturales. El Medio Ambiente en México 2013-2014., 2014, pp. 1-10. (Consultado en Septiembre del 2015). Disponible en: http://apps1.semarnat.gob.mx/dgeia/informe_ resumen14/07 _residuos/7_1_1.html
Recibido: Octubre 26, 2016
Revisado: Febrero 7, 2017
Aceptado: Agosto 2, 2017