Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Centro Azúcar
versión impresa ISSN 0253-5777versión On-line ISSN 2223-4861
cen. az. vol.45 no.2 Santa Clara abr.-jun. 2018
ARTICULO
Modelo cinático para la producción de celulasas por una cepa de aspergillus niger en fermentación sólida
Kinetic model for the production of cellulases by a strain of aspergillus niger in solid-state fermentation
Luis Beltrán Ramos-Sánchez1*, Gualberto Leon-Revelo1, Mario César Cujilema-Quitio1, Linnet Baryolo1, Ernesto Rosero Delgado2 y Jesús Córdova3
1 Departamento de Ingeniería Química, Universidad de Camagüey Ignacio Agramonte Loynaz, Circunvalación Norte km 5 ½, Camagüey, Cuba.
2 Universidad Técnica de Manabí. Av. Urbina y Che Guevara, Manabí, Ecuador.
3 Departamento de Química. Universidad de Guadalajara. Av. Juárez 976 y América,
Guadalajara, México.
*Autor para la correspondencia: Luis Beltrán, Email: luis.ramos@reduc.edu.cu
RESUMEN
En este trabajo se presenta una propuesta de modelo cinético para describir la producción de celulasas en un proceso de fermentación sólida de una cepa de Aspergillus niger. La validación del modelo fue realizada a cinco temperaturas: 20; 25; 30; 35 y 40°C. En la validación fueron identificados los parámetros característicos del modelo haciendo uso de datos dinámicos generados a temperatura constante. Dentro de las variables respuestas descritas por el modelo se encuentran: la concentración de biomasa del hongo expresada como proteína verdadera, las concentraciones de: azúcares reductores, fibra bruta, actividades de PFasa, CMCasa y proteasas en el medio. Para la identificación de los parámetros fue programado el modelo del proceso en MATLAB y el procedimiento de ajuste no lineal de sus parámetros. Los resultados indican que el modelo es perfectamente aplicable para describir la cinética de la producción de celulasas en estas condiciones. Las temperaturas donde se observó una mayor producción de celulasas fueron 30°C y 35°C. Los niveles experimentales de PFasa y CMCasa son significativos pues se alcanzan máximos de PFasa de 60 UI gMS-1 y de CMCasa de 50 UI gMS-1 en un tiempo que oscila entre 24 y 30 horas. Los parámetros identificados se ven fuertemente asociados a la temperatura.
Palabras clave: celulasas; modelación; cinética; Aspergillus niger; fermentación sólida.
ABSTRACT
In this work a kinetic model proposal is presented for describing cellulase production in a solid-state fermentation process of an Aspergillus niger strain. The validation of the model was carried out at five temperatures: 20, 25, 30, 35 and 40°C. In the validation the characteristic parameters of the model were identified using a dynamic data generated at constant temperature. The response variables described by the model are: concentration of biomass of fungus measured as true protein, total reducing sugars, crude fiber, FPase activity, CMCase activity and the activity of proteases in the medium. For parameters identification the process model was programmed in MATLAB. The results indicate that the model is perfectly capable describing the cellulase production kinetics under these conditions. The temperatures where cellulase production was higher were 30°C and 35°C. The experimental levels of FPase and CMCase are significant because maxim values of FPase of 60 UI gDW-1 and of CMCase of 50 UI gDW-1 are reached in a fermentation time ranging from 24 to 30 hours. The identified parameters are strongly associated to temperature.
Key words: Cellulases; Aspergillus niger; solid-state fermentation; kinetics; modeling.
INTRODUCCIÓN
Durante las últimas dos décadas, el uso de celulasas ha aumentado considerablemente por sus amplias aplicaciones en diferentes industrias (Oulad y col., 2009). La fermentación en estado sólido (FES) tiene el potencial para volverse un método económicamente competitivo en la producción de celulasas, por las ventajas que presenta (Flodman y Noureddini, 2013). La FES usa preferentemente hongos filamentosos como organismos productores, siendo el género Aspergillus ampliamente empleado (Ahamed y Vermette, 2008; Santos y col., 2011).
Los modelos cinéticos para la producción de celulasas son escasos en la amplia literatura consultada por los autores. En particular, se reporta un modelo propuesto para el cultivo sumergido de una cepa de Trichoderma viride (Velkovska y col., 1997). Resulta interesante en este modelo que el término de acumulación de enzima aparece no asociado al crecimiento y el término de desactivación enzimática se asocia con la concentración de la enzima. Shahriarinour y col. (2011) proponen el desarrollo de ecuaciones para explicar la síntesis de celulasas en cultivo sumergido, basadas en el modelo de Luedeking-Piret(Piret., 1959); pero, los autores no analizaron la síntesis y el consumo de azúcares, ni el crecimiento microbiano.Lo y col., (2010) proponen un modelo simplificado para la producción continua de celulasas en cultivo sumergido, usando polisacáridos inductores, pero no expusieron la parte del modelo dedicado a la síntesis de las enzimas. Por su parte, Hosseini y Shah (2011) estudiaron la hidrólisis enzimática, ofreciendo una profunda interpretación de la interacción de las enzimas con el sustrato lignocelulósico. Dimian y Bildea (2008) desarrollaron ecuaciones sobre la hidrólisis de la celulosa basadas en la inhibición competitiva de la glucosa, la celobiosa y la xilosa sobre las celulasas, así como la dependencia de los parámetros cinéticos con la temperatura. No se reportan trabajos que modelen la cinética de la producción de celulasas por fermentación sólida. No obstante, los trabajos antes referidos sirven de base para representar este proceso durante la fermentación sólida. La temperatura juega un papel muy importante en la producción de celulasas (Dubey y col., 2015). Se ha reportado que el óptimo de temperatura para la producción de celulasas se encuentra en un rango bastante amplio de: 20 a 50 ºC (Brijwani y Vadlani., 2011; Colina y col., 2009; Dubey y col., 2015; Falkoski y col., 2013; Gamarra y col., 2010). La búsqueda de un modelo cinético que sirva a los fines prácticos del diseño debe ser capaz de representar el comportamiento de la actividad microbiana en un intervalo amplio de temperaturas alrededor de los niveles más favorable para el proceso. Por lo cual, es de sumo interés el estudio de la temperatura en la validación de un candidato a modelo del proceso.
Esta investigación tiene por objetivo validar la propuesta de un nuevo modelo cinético para la producción de celulasas, a diferentes temperaturas, en el cultivo de una cepa del hongo Aspergillus niger en procesos de fermentación en estado sólido.
MATERIALES Y MÉTODOS
2.1. Procedimientos relacionados con la fermentación
2.1.1. Microorganismo y preparación de inóculo
Se utilizó la cepa UC33 de Aspergillus niger de la colección del grupo científico de Desarrollo de Bioprocesos de la Universidad de Camagüey. Las cepas se conservaron en un medio de cultivo papa-dextrosa-agar (PDA), a temperatura de 4±1°C.
La propagación del inóculo se realizó mediante el método propuesto por Mossawi y col. (2016). El microorganismo se cultivó en placas Petri con 10 mL de un medio con extracto de levadura (10 g/L), peptona (10 g/L), dextrosa (20 g/L), agar (15 g/L). Se inoculó siguiendo la técnica de estriado. Después de 72 horas de incubación a 30°C, se cosecharon los conidios, los que fueron arrastrados con agua destilada estéril. Esta suspensión de conidios se inoculó en una concentración de 1x107 conidios/mL en un medio líquido, extracto de levadura (10 g/L), peptona (10 g/L) y miel final de caña (43 g/L). La producción de micelio se realizó, incubando a 30°C y 150 rpm de agitación por 30 horas.
2.1.2. Material lignocelulósico inductor y su pretratamiento
Se utilizó un medio no reportado por la literatura rico en fuentes de carbono y nitrógeno. Este medio consta de, afrecho cervecero proporcionado por la cervecería Tínima y la cáscara de arroz procedente de una fábrica de pienso local, ambas localizadas en la provincia de Camagüey. Las materias primas fueron secadas a 70°C durante 24 h y se guardaron en bolsas plásticas hasta su posterior uso (León-Revelo., 2017).
A la cáscara de arroz se le realizó un pretratamiento con ácido sulfúrico al 1% durante 2h, a temperatura ambiente (Galbe y Zacchi., 2007). Al afrecho cervecero, sin embargo, se decidió no realizarle procedimiento alguno, ya que éste, al ser un residuo de la fabricación de cerveza, ha recibido pretratamientos térmicos y enzimáticos durante el proceso de maceración de la cebada haciendo factible para el ataque de las enzimas celulolíticas.
2.1.3. Fermentación en Estado Sólido (FES)
La fermentación se llevó a cabo por método establecido por León-Revelo (2017). Se fermentaron 5 g de medio húmedo en erlenmeyers de 250 mL, y se utilizó como material lignocelulósico la mezcla de cáscara de arroz y afrecho cervecero con una disolución de aditivos, cuya composición no será descrita por estar bajo solicitud de patente, impregnando con una relación sólido-líquido de 1:6. Se incubó a 30°C durante 30 horas en cultivo estático, la humedad de la masa total húmeda (MTH) fue de 57,67 %. El muestreo se realizó cada 6 horas en condiciones asépticas. El pH inicial del medio sólido fue de 4,5; selección basada en estudios previos realizados por los autores.
2.1.4. Extracción del crudo enzimático
Para extraer las celulasas fue necesario suspender el material fermentado en agua destilada en una relación de 1:9 y agitarlo a 200 rpm por 1h a temperatura ambiente. Seguidamente, el material suspendido y la biomasa fúngica fueron separados por centrifugación (10000 rpm durante 15 min). El sobrenadante filtrado fue usado como fuente para la determinación de las enzimas en estudio y los azúcares.
2.2. Técnicas analíticas
2.2.1. Concentración de la biomasa del hongo como proteína verdadera
La biomasa del hongo es muy difícil calcularla directamente pues penetra y se adhiere fuertemente en el sólido durante su crecimiento. Es por ello que se utiliza un método indirecto. Se determina el contenido de proteína verdadera, la que es proporcional a la biomasa del microorganismo (Farinas y col., 2011). La concentración de proteína verdadera fue determinada mediante el método Berstein (Winton y Winton., 1944) en el medio sólido fermentado. La muestra fue lavada previamente para retirar el nitrógeno soluble, proteico y así dejar en el sólido al residuo lignocelulósico y la biomasa fúngica que se encuentra fijada al material. El resultado contiene la proteína de la biomasa del hongo junto con la proteína insoluble presente en el afrecho cervecero. Las concentraciones de proteína se consideran constante por estar ligada a la estructura lignocelulósica de este material. En cambio, la proteína total del hongo crece con el tiempo al incorporar éste el nitrógeno proteico y no proteico suministrado con el medio de cultivo. En estas condiciones algunos parámetros del modelo asociados a la biomasa del hongo tendrán valores algo superiores respecto a si se midiera sólo la biomasa del hongo. De cualquier modo, los resultados servirán a los efectos del diseño del proceso para este medio.
2.2.2. Análisis de la actividad enzimática PFasa y CMCasa
La actividad celulasa fue analizada al medir la glucosa liberada de la hidrólisis enzimática de la celulosa, utilizando como sustratos papel filtro Whatman #1 al 1% para actividad PFasa y carboximetilcelulosa (CMC) al 1 % para actividad CMCasa, a un pH de 4,8 utilizando como solución tampón citrato de sodio 0,1 M a 50 oC y tiempo de hidrolisis de 60 minutos. La concentración de glucosa fue medida con el método del ácido dinitrosalicílico (DNS), método empleado por Chaplin (1986). La actividad enzimática celulasa se expresó en unidad internacional de enzima (UI). Una UI es la cantidad de enzima que libera 1 µmol de glucosa por minuto, bajo las condiciones de ensayo. Se expresa como UI gMS-1.
2.2.3. Análisis de la actividad proteasa
La actividad proteasa se determinó por el método descrito por Shang-Shyng y Jan-Yi (1999), que utiliza como sustrato a la caseína. Una unidad de actividad de proteasas se definió como la cantidad de enzima que produjo una absorbancia a 280 nm equivalente a un 1 µmol de péptidos obtenidos de la hidrólisis de la caseína (sustrato) en un minuto, bajo las condiciones del ensayo.
2.2.4. Análisis de los azúcares reductores totales (ART)
La concentración de ART fue medida con el método del DNS, según Chaplin (1986). La concentración fue expresada en (g ART/kg de masa sólida seca).
2.3. Diseño experimental
Se escogieron cuatro niveles de temperatura (20; 25; 30 y 35 ºC) de incubación y cinco niveles de tiempo (6; 12; 18; 24 y 30 horas) para medir la dinámica de las variables (León-Revelo., 2017). El experimento se replicó dos veces y las mediciones se realizaron por triplicado. Se midieron en cada caso las variables respuestas: humedad del sólido, el pH, los ART, la actividad papel filtro (PFasa), la actividad carboximetilcelulasa (CMCasa), la actividad proteasa, el contenido de fibra bruta y el contenido de proteína verdadera como medida del crecimiento celular.
2.4. Modelo matemático del proceso
2.4.1. Modelo cinético de la actividad del hongo en el medio celulósico
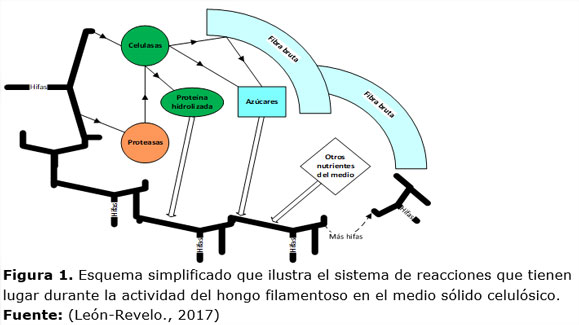
Se considera que las hifas tienen como actividad fundamental crecer, excretar enzimas, así como, adquirir por diferentes mecanismos de transporte molecular, aminoácidos, azúcares derivados de la actividad de las celulasas sobre la fibra lignocelulósica, así como otros nutrientes inicialmente presentes en el medio sólido (Figura 1). Las celulasas por su parte actúan en forma combinada como ya se ha explicado antes (Castro., 2010; Mathew y col., 2008) sobre las regiones cristalina y amorfa de la celulosa, produciendo azúcares más simples con la b-glucosidasa (Figura 1).
Las proteasas tienen una actividad de recuperación, para el consumo del hongo, de compuestos proteicos existentes inicialmente en el medio o, colocados allí por la actividad metabólica del hongo, como es el caso del complejo celulolítico. Esta actividad limita en cierta forma la actividad celulolítica global del proceso. El modelo matemático de la cinética se expone en la tabla 1. Las ecuaciones (1) y (2) describen la velocidad de crecimiento celular. Se consideró que la velocidad de muerte celular era despreciable en el corto intervalo de tiempo que duró el proceso. La velocidad específica de crecimiento fue descrita por el modelo Logístico, ecuación (1). El consumo de sustrato para la síntesis de biomasa fúngica, el mantenimiento celular y la síntesis de las enzimas: PFasa y proteasas se describen por las ecuaciones (3) y (5). En este término no se incluye la CMCasa, pues la PFasa contiene el efecto combinado de todas las celulasas.
La cinética de la producción de las enzimas está basado en el modelo propuesto por Piret (1959) y se encuentra representado en las ecuaciones (6) a la (8). La síntesis de estas enzimas está asociada al crecimiento celular (Bhat y Bhat, 1997; Mathew y col., 2008), por lo que la velocidad de síntesis es proporcional a la velocidad de producción de la biomasa fúngica. Adicionalmente, se postuló la existencia de un término negativo asociado a la concentración de biomasa, o sea, un término no asociado al crecimiento. En la fermentación sólida el área superficial, aunque grande, es limitada. Por observaciones previas, durante la optimización del medio de cultivo utilizado, se pudo constatar que el hongo crece muy intensamente en apenas 30 horas. Esto hizo suponer que la falta de espacio vital podría afectar la producción específica de las enzimas por unidad de biomasa (UI/gPV). Adicionalmente, este término negativo podría contener, al mismo tiempo, los efectos de la desnaturalización de la enzima debida a reacciones irreversibles en el medio (Ximenes y col., 2011). La presencia del término Xv (concentración de la biomasa del hongo) podría estar describiendo la asociación de este mecanismo con el tiempo, en el cual Xv crece. En la velocidad neta de síntesis de las enzimas celulolíticas (ecuaciones (6) a la (8)), se consideró la existencia de una reacción adversa al aumento de su concentración. Esta es la hidrólisis de estas enzimas, catalizada por las proteasas existentes en el medio y producidas por el propio hongo.
Como resultado de la actividad celulolítica se producen azúcares que son consumidos por el hongo en su crecimiento. Para este proceso, se propuso un modelo (ecuación (9)) que describe la síntesis de los azúcares proporcional a la velocidad de síntesis de la enzima PFasa y para el consumo de estos azúcares se consideró serían proporcionales a la velocidad de síntesis de la biomasa fúngica.
Donde: mS – Coeficiente de mantenimiento celular (gFBh-1 gPV-1); rART - Velocidad neta de síntesis de ART (gART h-1); rCMC - Velocidad de síntesis de la enzima CMCasa (UI h-1 kgMS-1); rpf - Velocidad de síntesis de la enzima PFasa (UI h-1 kgMS-1); rprot - Velocidad de síntesis de la enzima proteasa (UI h-1 kgMS-1); rSm - Velocidad de consumo de nutrientes para el mantenimiento celular (gFBh-1 kgMS-1); rSp - Velocidad de consumo de sustrato para la síntesis de enzimas (gFB h-1 g); rSx - Velocidad de consumo de fibra bruta para la síntesis de células (gFB h-1 kgMS-1); rXv - Velocidad de síntesis de biomasa
(gpv h-1 kgMS-1); Xv - Biomasa fúngica (gPV kgMS-1); Xvmax - Biomasa fúngica máxima (gPV kgMS-1); Yp - Rendimiento Proteasa/Fibra bruta (UI gFB-1); Ypf - Rendimiento PFasa/Fibra bruta (UI gFB-1); YXS - Rendimiento proteína verdadera/fibra bruta (Rendimiento proteína verdadera/fibra bruta); ECMC – Actividad CMCasa (UI gMS-1); EP - Actividad proteasa (UI gMS-1); EPF - Actividad PFasa (UI gMS-1); k1 - Velocidad específica de hidrólisis de PFasa por las proteasas (UIPF UIProt-1); k2 - Velocidad específica de hidrólisis de CMCasa por las proteasas (UICMC UIProt-1); SART - Concentración de azúcares reductores totales (ART); SFB - Concentración de Fibra bruta (g kgMS-1); t - Tiempo de fermentación (h); µ - Velocidad especifica de crecimiento (h-1); µmax - Velocidad máxima especifica de crecimiento (h-1); αpf - Coeficiente de formación de PFasa asociada al crecimiento (UI gPV-1); βpf - Coeficiente de formación de PFasa no asociada al crecimiento (UI h-1 gPV-1); αCMC - Coeficiente de formación de CMCasa asociada al crecimiento (UI gPV-1); βcmc - Coeficiente de desactivación de CMCasa no asociada al crecimiento (UI h-1 gPV-1); αp - Coeficiente de formación de proteasas asociada al crecimiento (UI gPV-1); βp - Coeficiente de desactivación de proteasas no asociada al crecimiento (UI h-1 gPV-1); αART - Coeficiente de formación de ART asociada al crecimiento (gART UI-1); βART - Coeficiente de degradación específica de ART asociada al crecimiento (gART gPV-1).
La identificación de las constantes cinéticas servirá como evidencia sobre lo adecuado del modelo para representar el comportamiento real del sistema.
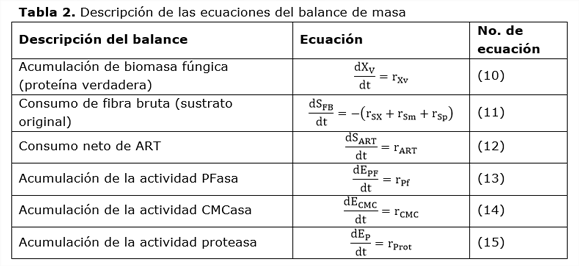
2.4.2. Balances de masa en la fase sólida
El balance de masa considera que el proceso de fermentación es discontinuo en la fase sólida (Tabla 2). En la fase sólida se tuvieron en cuenta la concentración de la biomasa fúngica, la concentración de la fibra bruta (como medida de la disponibilidad de fuente de carbono), las actividades: PFasa, CMCasa y proteasa, así como la concentración neta de azúcares reductores totales.
2.5. Identificación de los parámetros cinéticos a diferentes temperaturas
El modelo del proceso de fermentación sólida expuesto en la tabla 1 y en la tabla 2 fue programado usando la plataforma de cálculo MATLAB, versión: 8.1.0.604 (R2013a). Para la identificación de los parámetros cinéticos se hizo uso de una herramienta de ajuste no lineal multifactorial: lsqcurvefit. Esta función usa algoritmos para resolver el problema de optimización en el que se minimiza la suma de cuadrados dada por:
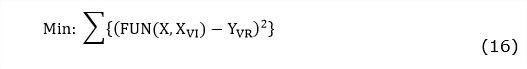
El ajuste de las dinámicas del proceso a diferentes temperaturas se hizo con las ecuaciones de la tabla 1 y tabla 2. La variable independiente es el tiempo y la temperatura un parámetro en cada dinámica. Las variables respuestas en el ajuste de las dinámicas vienen dadas por el vector de la concentración de biomasa, de fibra bruta, de ART y de las actividades enzimáticas: PFasa, CMCasa y de las proteasas, obtenidas a diferentes tiempos.
RESULTADOS Y DISCUSIÓN
3.1 Ajuste del crecimiento fúngico
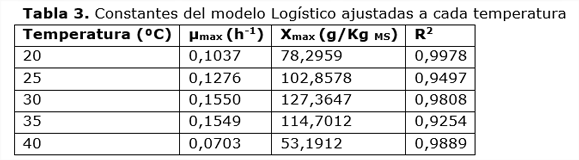
El modelo Logístico describe la cinética del crecimiento y se ajusta a los datos experimentales de producción de biomasa proteica. Esto coincide con lo reportado por Julián-Ricardo (2008). El modelo considera que el sustrato no es una limitante para el crecimiento, mientras que Xmax es la que describe el límite del crecimiento en el proceso. Según este modelo, la inhibición del crecimiento se produce por la reducción del espacio vital, al ocupar el micelio el espacio intrapartícula e inter-partícula del sólido. Los coeficientes de determinación calculados para el ajuste del modelo logístico en cada temperatura (tabla 3) muestran altos valores, lo que corroboran la correspondencia observada entre datos calculados y observados. Esta correlación se aprecia en la figura 2 para dos temperaturas, 30°C y 35°C.
Los valores calculados de velocidad específica de crecimiento máxima de la biomasa proteica son altos para el crecimiento en un proceso celulolítico, lo que demuestra la calidad del medio para promover el crecimiento fúngico. Los resultados indican que en el rango de temperatura de 30 a 35 ºC se maximizan µmax y Xmax. En este intervalo, µmax llega a alcanzar niveles superiores a 0,15 h-1; mientras que, Xmax alcanzó niveles por encima de los 110 gpv/kgMS. Estos resultados son superiores a los reportados por varios autores como: (Saithi y col., 2016; Shahriarinour y col., 2011; Velkovska y col., 1997). En el caso de Xmax debe recordarse que no todo su valor pertenece a la biomasa del hongo pues el propio medio tiene una pequeña cantidad inicial que no ha sido restada.
Por los altos niveles de proteína finalmente alcanzados en el sólido, reflejados en los valores de Xmax (tabla 3), el residuo de esta fermentación podría ser utilizado después de la extracción de las enzimas, como posible alimento para rumiantes, aprovechando el rico contenido proteico y su capacidad para estimular el crecimiento de la flora microbiana existente en el rumen de animales. De ser posible esta solución, aumentaría la factibilidad económica del proceso de la producción de celulasas.
3.2. Ajuste de la actividad enzimática
Se puede observar que el modelo propuesto predice el comportamiento de los datos experimentales desde el punto cualitativo y cuantitativo para las tres enzimas medidas: actividad PFasa, CMCasa, así como la actividad de las proteasas. Prueba de ello son los niveles del coeficiente de determinación del ajuste que, en la mayoría de, los casos es superior al 0,90 y oscila entre 0,88 y 0,98; en los datos mostrados en la figura 2. El buen ajuste del modelo se observa también para el resto de las variables respuestas analizadas: fibra bruta y ART.
Nótese en esta figura que los niveles de actividad PFasa alcanzados a 30°C oscilan entre 40 y 60 UI gMS-1 a las 24 horas, resultado éste importante para lograr un futuro proceso competitivo desde el punto de vista económico. La actividad CMCasa presenta un comportamiento semejante en ambas temperaturas y exhibe buenos niveles para esta enzima, los que oscilan entre 40-50 UI gMS-1. La actividad proteasa presentó comportamiento semejante a la CMCasa en las temperaturas mostradas pero, para todas las enzimas analizadas, temperaturas por debajo o por encima de estos dos valores afectan su actividad.
3.3. Ajuste de la dinámica de la fibra bruta y los ART
La dinámica de la fibra bruta en la figura 2 muestra que su conversión o degradación enzimática osciló entre 15-20% en las 30 horas de estudio, para las dos temperaturas mostradas, en la que se obtuvieron los mejores resultados de los cinco niveles analizados. Este resultado de conversión puede considerarse adecuado debido a los significativos resultados de actividad celulolítica alcanzados en ese tiempo.
3.4. Otros parámetros del modelo ajustado
En la tabla 4se muestra la interpretación de la dependencia de los parámetros cinéticos con la temperatura, que permitirá esclarecer aspectos importantes para el diseño del proceso de producción de celulasas en las condiciones indicadas. Por otra parte, la tabla 5 ofrecen todas las constantes cinéticas ajustadas a cada dinámica experimental obtenida para cada temperatura de cultivo. En estas dos tablas se observa que la temperatura ofrece una significativa influencia sobre los valores de estos parámetros. Dado que los parámetros cinéticos se modifican con la temperatura, sería conveniente para el diseño del proceso, identificar modelos matemáticos adicionales que sean capaces de predecir la dependencia de estos datos con la temperatura.
En la vasta literatura consultada se encontraron pocos trabajos sobre cinética de producción de celulasas con hongos filamentosos, por lo que se considera que el modelo propuesto en este trabajo es de interés para futuras investigaciones.
CONCLUSIONES
1. El modelo cinético propuesto consiguió representar adecuadamente los datos experimentales generados en cada cultivo de Aspergillus niger a las diferentes temperaturas.
2. Las dinámicas experimentales indican que las temperaturas más adecuadas para la producción de celulasas están en el rango de 30 a 35°C.
3. En las condiciones estudiadas se alcanzaron actividades PFasa de 60 UI gMS-1 y de CMCasa de 50 UI gMS-1, en un tiempo que va de 24 a 30 horas, resultados que se consideran muy productivos.
AGRADECIMIENTOS
La realización del trabajo de investigación que ha servido de base para esta publicación ha contado con el apoyo de la Secretaría Nacional de Educación Superior, Ciencia Tecnología del Ecuador (SENESCYT) y la Universidad de Camagüey Ignacio Agramonte Loynaz, Cuba.
REFERENCIAS
Ahamed, A., and Vermette, P., Enhanced enzyme production from mixed cultures of Trichoderma reesei RUT-C30 and Aspergillus niger LMA grown as fed batch in a stirred tank bioreactor., Biochemical Engineering Journal, Vol. 42, No. 32, 2008, pp. 41–46.
Bhat, M.K., and Bhat, S., Cellulose degrading enzymes and their potential industrial applications., Biotechnology Advances, Vol. 15, 1997, pp. 583-620.
Brijwani, K., and Vadlani, P.V., Cellulolytic Enzymes Production via Solid-State Fermentation: Effect of Pretreatment Methods on Physicochemical Characteristics of Substrate.,Enzyme Research, Vol. 2011, 2011, pp. 1-10.
Castro, A.M., Produção, Propriedades e Aplicação de Celulases na Hidrólise de Resíduos Agroindustriais.,Quim. Nova, Vol. 33, No. 1, 2010, pp. 181-188.
Colina, A., Ferrer, A., and Urribarrí, L., Cellulase production by Trichoderma reesei Rut C-30 from different cellulosic substrates., Revista Técnica de Ingeniería de la Universidad de Zulia, Vol. 32, No. 2, 2009, pp. 152-159.
Chaplin, M., Monosaccharides In Carbohydrate Analysis: A Practical Approach., Analitical Biochemistry, Vol. 167, 1986, pp. 423-424.
Dimian, A.C., and Bildea, C.S., Chemical Process Design- Computer-Aided Case Studies., African Journal of Biotechnology, Vol. 8, No.2, 2008, pp. 1- 529.
Dubey, A.K., Garg, N., and Gupta, P.K., Optimization of operatinal parameters for production of cellulase enzyme by shake flask fermentation from isolated fungus., Trends in carbohydrate research, Vol. 7, 2015, pp. 18-24.
Falkoski, D.L., Guimarães, V.M., Almeida, M.N., Alfenas, A.C., Colodette, J.L., and Rezende, S.T., Chrysoporthe cubensis: A new source of cellulases and hemicellulases to application in biomass saccharification processes., Bioresource Technology, Vol. 130, 2013, pp. 296-305.
Farinas, C. S., Vitcosque, G. L., Fonseca, R. F., Neto, V. B., and Couri, S., Modeling the effects of solid state fermentation operating conditions on endoglucanase production using an instrumented bioreactor., Industrial Crops and Products, Vol. 34, 2011, pp. 1186-1192.
Flodman, H. R., and Noureddini, H., Effects of Intermittent Mechanical Mixing on Solid-State Fermentation of Wet Corn Distillers Grain with Trichoderma reesei., Biochemical Engineering Journal, Vol. 81, 2013, pp. 24-28.
Galbe, M., and Zacchi, G., Pretreatment of Lignocellulosic Materials for Efficient Bioethanol Production., Biochem Engin/Biotechnol, Vol. 108, 2007, pp. 41-65.
Gamarra, N.N., Villena, G.K., and Gutiérrez-Correa, M., Cellulase production by Aspergillus niger in biofilm, solid-state, and submerged fermentations., Appl Microbiol Biotechnol, Vol. 87, 2010, pp. 545–551.
Hosseini, S.A., and Shah, N., Enzymatic hydrolysis of cellulose part II: Population balance modelling of hydrolysis by exoglucanase and universal kinetic model., Biomass and Bioenergy, Vol. 35, 2011, pp. 3830-3840.
Julián-Ricardo, M.C., Diseño tecnológico de una planta para el enriquecimiento proteico del bagazo de caña de azúcar. Tesis presentada en opción al Grado Científico de Doctor en Ciencias Técnicas, Especialidad Ingeniería Química, Universidad de Camagüey, Cuba, 2008.
León-Revelo, G.G., Diseño del proceso de fermentación sólida a escala piloto para la producción de celulasas con residuos agroindustriales. Tesis presentada en opción al Grado Científico de Doctor en Ciencia Técnicas, Especialidad Ingeniería Química, Universidad de Camagüey "Igancio Agramonte Loynaz", Cuba, 2017, pp. 173.
Lo, C.M., Zhang, Q., Callow, N.V., and Ju, L.K., Cellulase Production by Continuous Culture of Trichoderma reesei Rut C30 Using Acid Hydrolysate Prepared to Retain more Oligosaccharides for Induction., Bioresource Technology, Vol. 101, No. 7, 2010, pp. 717–723.
Mathew, G.M., Sukumaran, R.K., Singhania, R.R., and Pandey, A., Progress in research on fungal cellulases for lignocellulose degradation., Journal of Scientific and Industrial Research, Vol. 67, 2008, pp. 898-907.
Mossawi, L.H., Mahdi, N.Z., and Zwain, L.A., Higher production of lipase enzyme from different microorganisms grown in local natural culture media., International Journal of Advanced Research in Biological Sciences, Vol. 3, No. 5, 2016, pp. 232-239.
Oulad, F., Kaddour, S., and Sadoun, T., Adsorption of cellulase Aspergillus niger on a commercial activated carbon: Kinetics and equilibrium studies., Bioresource Technology, Vol. 75, 2009, pp. 93-99.
Piret, L.R., A Kinetic Study of the Lactic Acid Fermentation: Batch Process at Controlled pH., J. Biochem. Microbiol. Technol. Eng, Vol. 1, 1959, pp. 393-412.
Saithi, S., Borg, J., Nopharatana, M., and Tongta, A., Mathematical Modeling of Biomass and Enzyme Production Kinetics by Aspergillus niger in Solid-State Fermentation at Various Temperatures and Moisture Contents., Journal of Microbial & Biochemical Technology, Vol. 8, 2016, pp. 123-130.
Santos, T.C., Cavalcanti, I.S., Bonomo, R.C., Santana, N.B., and Franco, M., Optimization of productions of cellulolytic enzymes by Aspergillus niger using residue of mango a substrate., Ciência Rural, Vol. 41, 2011, pp. 2210-2216.
Shahriarinour, M., Wahad, M.N., Ariff, A.B., Mustafa, S., and Mohama, R., Kinetics of cellulase production by Aspergillus terreus at various levels of dissolved oxygen tension in a stirred tank bioreactor., BioResources, Vol. 6, No. 4, 2011, pp. 4909-4921.
Shang-Shyng, Y., and Jan-Yi, W., Protease and amylase production of Streptomyces rimosus in submerged and solid state cultivations., Botanical Bulletin of Academia Sinica, Vol. 40, 1999, pp. 259-265.
Velkovska, S., Marten, M.R., and Ollis, D.F., Kinetic model for batch cellulase production by Trichoderma reesei RUT C30., Journal of Biotechnology, Vol. 54, 1997, pp. 83–94.
Winton, A. L., y Winton, K.B., Técnicas de Análisis de los alimentos, Editorial Agrobios, La Habana, 1944, pp. 84-85.
Ximenes, E., Kim, Y., Mosier, N., Diend, B., and Ladisch, M., Deactivation of cellulases by phenols.,Enzyme and Microbial Technology, Vol. 48, 2011, pp. 54–60.
Recibido: Noviembre 10, 2016
Revisado: Agosto 29, 2017
Aceptado: Octubre 27, 2017