Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Centro Azúcar
versão On-line ISSN 2223-4861
cen. az. vol.45 no.4 Santa Clara oct.-dez. 2018
ARTICULO
Producción de lipasas por fermentación sólida con aspergillus niger: influencia del ph
Lipase production in solid fermentation with aspergillus niger: ph influence
Mario César Cujilema-Quitio1, Gualberto León-Revelo1, Mariela Rizo Porro1, Luis Taramona Ruiz2 y Luis Beltrán Ramos-Sánchez1*
1 Facultad de Ciencias Aplicadas. Departamento de Ingeniería Química. Universidad de Camagüey Ignacio Agramonte Loynaz, Circunvalación Norte, km 5 ½, Camagüey. Cuba.
2 Universidad Le Cordon Bleu. Lima -09. Perú.
*Autor para la correspondencia: Luis B. Ramos, Email: luis.ramos@reduc.edu.cu
RESUMEN
La obtención de lipasas por fermentación en estado sólido empleando Aspergillus niger ha resultado un proceso promisorio. Sin embargo, resulta necesario determinar las condiciones más apropiadas de pH cuando se emplea un medio basado en residuos agroindustriales de origen nacional. Para ello se diseñó un experimento en el que se estudió este factor, así como el tiempo de fermentación en cinco niveles. La variable medida fue la actividad y productividad enzimática. Como resultado se logró que los valores máximos de productividad se alcanzaran a pH inicial bajo y a menor tiempo de fermentación. El pH inicial (5,0) tuvo la mayor actividad y productividad observada. La productividad máxima a pH 5,0 fue de 1,4 UI/h.gMS, lograda a las 72 horas, con una actividad lipolítica de 210,11 UI/gMS.
Palabras clave: Aspergillus niger; fermentación sólida; lipasas; pH.
ABSTRACT
Obtaining lipases by solid-state fermentation using Aspergillus niger has been a promising process. However, is necessary to determine the most appropriate pH conditions using a medium based on national origin agroindustrial residues. An experiment in which this factor was studied, as well as fermentation time in five levels was designed. The response variables to be measured were enzyme activity and productivity. As result, it was achieved that the maximum productivity values were reached at low initial pH and lower fermentation times. The initial pH of 5 had the highest activity and productivity observed. The maximum productivity at pH 5 was 1.4 IU / hr, achieved at 72 hours, with a lipolytic activity of 210.11 IU / gMS.
Key words: Aspergillus niger; solid fermentation; lipases; pH.
INTRODUCCIÓN
Las lipasas son enzimas que hidrolizan los triglicéridos para liberar ácidos grasos y glicerol en la interface agua-aceite (Gupta y col., 2015). Por su amplia variedad de reacciones químicas, son utilizadas en el tratamiento de aguas residuales (Rodrigues y col., 2016), tratamientos del cuero (Fotouh y col., 2016; Kumar y Ray, 2014), producción de bioenergía (Kazancev y col., 2015; Price, 2014), formulación de detergentes (Hasan y col., 2010), medicamentos (Avila-González y col., 2005 ), elaboración de alimentos (Kumar y 2014; Renge y col., 2012), para la generación de maltosas y lactosas como azúcares de ésteres de ácidos grasos (Zhang y col., 2002), formulación de polímeros (Poojari y Clarson, 2010), producción de papel (Hasan y col., 2006)y tratamientos de tumores malignos (Sethi y col., 2016). Sin embargo, sus altos costos de producción, baja productividad, problemas de estabilidad y actividad (Salihu y col., 2012), limitan su aplicación en la industria biotecnológica.
Los procesos de fermentación en estado sólido (FES) son empleados con mayor frecuencia que los sumergidos para alcanzar altas productividades de lipasas (Adinarayana y col., 2004; Rodriguez y col., 2006; Sun y Xu, 2008). Estos procesos poseen un bajo capital de inversión y constituyen la forma más fácil de cultivo de hongos filamentosos productores de enzimas (Rodriguez y col., 2006)
Dentro de estos microorganismos destacan los hongos del género Aspergillus, que encuentran una amplia utilización en la producción de lipasas (Mukhtar y col., 2015; Rodrigues y col., 2016; Sarkar y laha, 2013; Toscano y col., 2016)y especialmente la especie Aspergillus niger, ampliamente reportada en varias aplicaciones industriales (Mukhtar y 2015; Niaz y col., 2013).
El cultivo de un microorganismo se encuentra fuertemente influenciado por factores ambientales de los que depende en gran medida el crecimiento. Dentro de estos factores el pH del medio es uno de los parámetros más importantes durante los procesos de fermentación (Lall y col., 2014). Cada microorganismo posee un pH óptimo para el crecimiento y producción de metabolitos (Toscano y 2016). Los valores de pH estudiados para la producción de lipasas por fermentación en estado sólido se encuentran reportadas en amplios rangos, como 1,5-4,5 (Niaz y 2013), 4,0-9,0 (ul-Haq y col., 2002), 4,0-8,0 (Adinarayana y 2004), 4,0-10,0 (Falony y col., 2006), 5,0-7,0 (Gutarra y col., 2009). Sin embargo, se reportan los mejores resultados de actividad alrededor del valor neutro de pH. Un aumento de pH por encima de7,0 podría disminuir la actividad lipolítica, puesto que un medio alcalino junto con la acumulación de las proteasas produce inestabilidad de la enzima (Gombert y col., 1999). Por el contrario, la disminución de este parámetro provoca una inhibición del crecimiento fúngico. Para evitar una disminución excesiva del pH en la FES, se ha utilizado con éxito como fuente de nitrógeno una mezcla de sulfato de amonio y de urea por su efecto amortiguador del pH (Ramos-Sánchez, 2000).Un cambio de pH en el medio sólido puede conllevar cambios en el estado de ionización de los aminoácidos que define las estructuras secundarias y terciarias de la proteína, causando la desnaturalización de la enzima (Colla y col., 2015).
Por su parte, el empleo de residuos agroindustriales que constituyen materias primas complejas para la producción de lipasas como pueden ser el suero de la leche, el bagazo de caña y la harina de moringa han sido poco investigados en la actualidad y la propia naturaleza compleja del sustrato puede introducir cambios significativos en el pH de los medios empleados. Todas estas incógnitas que se presentan permiten trazar como objetivo de esta investigación determinar las condiciones más apropiadas de pH para la producción de lipasas con Aspergillus nigerUC32 en FES, empleando un medio basado en residuos agroindustriales de origen nacional.
MATERIALES Y MÉTODOS
2.1. Reactivos y medios
El extracto de levadura y peptona de soya, agar, PDA, fueron obtenidos de Deisenhofen, Alemania. El aceite de oliva es procedente de Lesieur, Francia. El bagazo de caña y la miel de caña fueron adquiridas del Central Siboney, Cuba. Todos los demás reactivos son de grado analítico y producido por B.D.H., UK.
1.2. Microorganismo productor de lipasas
Se utilizó la cepaAspergillusnigerUC32 perteneciente a la colección de cultivos de la Universidad de Camagüey. Las cepas se conservaron en tubos inclinados en un medio de cultivo papa-dextrosa-agar (PDA) a una temperatura de 4±1°C.
1.3. Propagación del inóculo
El esquema seguido para la propagación del inóculo consta de dos etapas ampliamente usadas en la síntesis de enzimas, cultivo en placas y propagación en medio líquido. El medio para el cultivo en placas está compuesto por extracto de levadura (10g/L), peptona (10g/L), glucosa (20g/L) y agar (15g/L); mientras que el medio líquido está basado en extracto de levadura (10g/L), peptona (10g/L) y miel de caña (25 g/L). El empleo de este medio permite adaptar a los hongos filamentosos al futuro medio de fermentación. La producción de micelios se llevó a cabo en erlenmeyers de 250 mL con un volumen de medio de 50 mL e inoculados a una concentración de 1x107 esporas/mL durante 16 horas de fermentación a temperatura de 30 oC y 150 rpm.
2.4. Medio de cultivo para la producción de lipasas
Se utilizó un medio sólido denominado ML-Lip01, constituido por materias primas complejas cuya mezcla no se describe por estar sujeta a solicitud de patente.
2.5. Procedimiento de fermentación
La fermentación se realizó según la metodología seguida por (Edwinoliver y col., 2010) con algunas modificaciones y se llevó a cabo en frascos de 250 mL con el medio de cultivo ML-Lip01 e inoculados a una concentración de 4,8x10-3ghifa/gMS a 30 oC y una humedad de 70 %. La masa total del medio húmedo fue de 10 gramos. El muestreo se realizó cada 24 horas en condiciones asépticas.
Los pH iniciales del medio sólido, fueron ajustados con hidróxido de sodio (NaOH) para valores alcalinos y ácido cítrico para valores ácidos.
2.6. Extracción del crudo enzimático
Se estructuró un procedimiento efectivo para la extracción de la enzima basado en la revisión de la literatura (Adinarayana y 2004; Santis-Navarro y col., 2011). El material fermentado fue suspendido en agua destilada en una relación de 1:9. Posteriormente, fue agitado a 200 rpm durante una hora a temperatura ambiente. Seguidamente, el material suspendido y la biomasa fúngica fueron separados por centrifugación a 10000 rpm por 15 minutos. El sobrenadante obtenido en la centrifugación (crudo enzimático) fue empleado para la determinación de la actividad lipolítica.
2.7. Técnicas analíticas
· Análisis del pH del medio sólido: Se utilizó un pH metro de la marca HANNA, de fabricación china. Se pesó 1,0 g de medio sólido y se suspende en 9,0mL de agua destilada, se agita con vortex marca IKA durante 5 minutos, se separa por filtración el sólido y se realiza la medición.
· Actividad enzimática: La actividad enzimática se determinó por el método titrimétrico (Rigo, Ninow, y col., 2010). La reacción enzimática de formación de ácido grasos libres se realizó con la adición del crudo enzimático a una mezcla que contiene una emulsión de agua-aceite y un buffer con pH 7,0. Se realizó la valoración de la cantidad de ácidos grasos formados utilizando NaOH (Gutarra y col., 2009; Rigo, Ninowa, y col., 2010).
2.8. Diseño experimental
Se seleccionó un diseño multifactorial categórico con dos factores y cinco niveles. Los factores fueron el pH y tiempo de fermentación con niveles de 3,0; 4,4; 5,0; 6,0 y 7,0 para el caso del pH y 0; 24; 48; 72 y 96 h para el tiempo de fermentación. El experimento se replicó tres veces, dando un total de 75 corridas experimentales. La variable respuesta a medir fue la actividad y productividad enzimática. Se realizó un análisis de varianza junto a la prueba de diferencia mínima significativa (LSD) con el paquete estadístico STATGRAPHICS®, Centurión XV, versión 15.2.05.
RESULTADOS Y DISCUSIÓN
3.1. Análisis de la influencia del pH
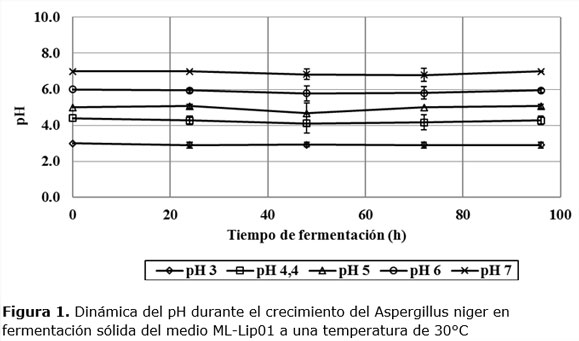
Las dinámicas del pH del medio sólido en los cinco niveles iniciales investigados tuvieron poca variación respecto al tiempo cero, mostrando así la efectividad del efecto tampón del medio usado, ver Figura 1.
Este comportamiento permite afirmar que los efectos inducidos en el microorganismo por los diferentes niveles iniciales de pH se mantienen con poco cambio durante toda la dinámica del crecimiento de hongo, sin confundirse con los otros niveles de pH, algo que permite sacar conclusiones sobre la influencia de este factor en la cinética del proceso.
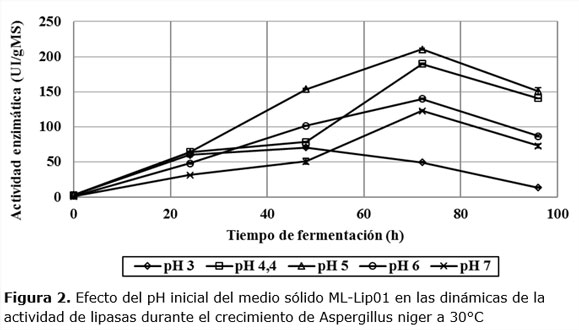
La dinámica de la actividad enzimática muestra una tendencia al incremento paulatino en todos los niveles iniciales de pH, tal como se muestra en la Figura 2.
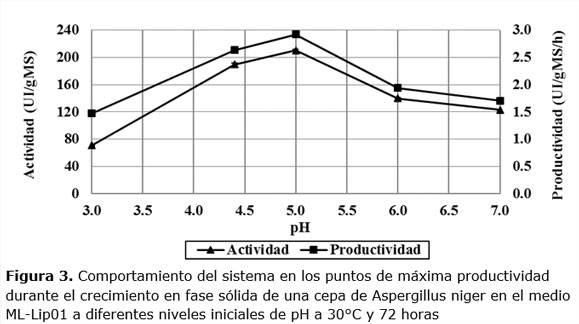
A partir de las 24 horas de fermentación, el microorganismo comienza a secretar las lipasas, hasta alcanzar su máxima actividad a las 72 horas de fermentación en pH de 4,4; 5,0; 6,0; 7,0 y 48 horas en pH 3,0. La máxima actividad es alcanzada a pH 5,0 (210,45 UI/gMS) y una baja activad de 70,5186 UI/gMS a pH 3,0. Esto indica que las lipasas alcanzan mejores resultados en pH ligeramente ácidos, mientras que en medios muy ácidos el microorganismo no se desarrolla favorablemente y por consiguiente la actividad lipolítica disminuye. La máxima actividad alcanzada está por encima de los valores de actividad alcanzadas por algunos autores (Farias y col., 2014; Fleuri y col., 2014; Mahapatra y col., 2010; Silva y col., 2014; Toscano y 2016). Teniendo en cuenta esto se decidió analizar el comportamiento de la actividad de cada dinámica en los puntos de máxima productividad enzimática, ver Figura 3.
En la Figura 3 se observa que la actividad enzimática y la productividad aumentan notablemente al aumentar el pH. Sus máximos valores se observan a pH 5,0. Posterior a esto comienza a disminuir hasta el pH neutro. Los valores de actividad son significativos en estas condiciones y aumentan desde 70,5186 UI/gMS hasta 210,455 UI/gMS. En el caso de las productividades ocurren también en pH ligeramente ácidos con valores que van desde 1,469UI/h gMS hasta 2,923UI/h gMS.
Para maximizar la actividad de lipasas son frecuentes los reportes de pH en niveles óptimos cercanos a los reportados en este trabajo, es decir, en el rango de pH de 4,0-7,0.
3.2. Análisis de varianza para la actividad enzimática
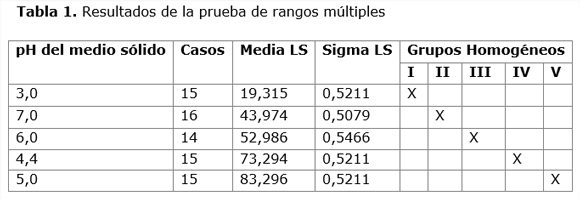
El análisis de varianza realizado determinó que existen diferencias significativas sobre la actividad enzimática entre los dos factores, pH y tiempo de fermentación (p<0,05). En el análisis de la prueba de rangos múltiples se identificaron cinco grupos homogéneos que se muestran en la Tabla 1.
Dentro de estos grupos, se seleccionó el pH 5,0 como el mejor valor para el crecimiento y síntesis de lipasas por presentar la mejor media LS 83,296, según el procedimiento de diferencia mínima significativa (LSD) de Fisher.
CONCLUSIONES
1. La mejor condición de pH para la producción de lipasas se alcanza a un pH inicial de 5,0, a las 72 horas de fermentación, alcanzándose una productividad máxima de 1,4 UI/h gMS, con una actividad enzimática de 210,11 UI/gMS.
2. La prueba de diferencia mínima significativa (LSD) de Fisher arroja una media de 83,296 para un pH inicial de 5,0 e indica que a este nivel se alcanza un mejor crecimiento del microorganismo y de la síntesis de lipasas
AGRADECIMIENTOS
La realización del presente trabajo investigativo ha contado con el apoyo de la Secretaría Nacional de Educación Superior, Ciencia y Tecnología (SENESCYT) de la República de El Ecuador y la Universidad de Camagüey "Ignacio Agramonte Loynaz" de la República de Cuba.
REFERENCIAS
Adinarayana, K., Raju, K.B., Zargar, M.I., Devi, R.B., Lakshmi, P.J., and Ellaiah, P., Optimization of process parameters for production of lipase in solid-state fermentation by newly isolated Aspergillus species., Indian Journal of Biotechnology, Vol. 3, 2004, pp. 65-69.
Ávila-González, R., Pérez-Gilabert, M., López-López, M.A., and García-Carmona, F., Catálisis enzimática aplicada a la obtención de s-propanolol utilizando ciclo-dextrinas modificadas., Revista Cubana de Química, Vol. XVII, No. 3, 2005, pp.139-139.
Colla, L.M., Ficanha, A.M.M., Rizzardi, J., Bertolin, T.E., Reinehr, C.O., and Costa, J.A.V., Production and Characterization of Lipases by Two New Isolates of Aspergillus through Solid-State and Submerged Fermentation., BioMed Research International, Vol. 2015, 2015, pp. 1-9.
Edwinoliver, N.G., Thirunavukarasu, K., Naidu, R.B., Gowthaman, M.K., Kambe, T.N., and Kamini, N.R., Scale up of a novel tri-substrate fermentation for enhanced production of Aspergillus niger lipase for tallow hydrolysis., Bioresource Technology, Vol. 101, 2010, pp. 6791-6796.
Falony, G., Armas, J.C., Mendoza, J.C.D., and Hernández, J.L.M., Production of Extracellular Lipase from Aspergillus niger by Solid-State Fermentation., Food Technol. Biotechnol, Vol. 44, No.2., 2006, pp. 235-240.
Fariasa, M.A., Valoni, E.A., Castro, A.M., and Coelho, M.A.Z., Lipase Production by Yarrowia lipolytica in Solid State Fermentation Using Different Agro Industrial Residues., Chemical Engineering Transactions, Vol. 38, 2014, pp. 301-305.
Fleuri, L.F., Novelli, P.K., Delgado, C.H.O., Pivetta, M.R., Pereira, M.S., Arcuri, M.d.L.C., and Capoville, B.L., Biochemical characterisation and application of lipases produced by Aspergillus sp. on solid-state fermentation using three substrates., International Journal of Food Science and Technology, Vol. 49, 2014, pp. 2585-2591.
Fotouh, D.M.A., Bayoumi, R.A., and Hassan, M.A., Production of Thermoalkaliphilic Lipase from Geobacillus thermoleovorans DA2 and Application in Leather Industry., Enzyme Research, Vol. 3, 2016, pp. 1-9.
Gombert, A.K., Pinto, A.L., Castilho, L.R., and Freire, D.M.G., Lipase production by Penicillium restrictum in solid-state fermentation using babassu oil cake as substrate., Process Biochemistry, Vol. 35, 1999, pp. 85-90.
Gupta, R., Kumari, A., Syal, P., and Singh, Y., Molecular and functional diversity of yeast and fungal lipases: Their role in biotechnology and cellular physiology., Progress in Lipid Research, Vol. 57, 2015, pp. 40-54.
Gutarra, M.L.E., Godoy, M.G., Maugeri, F., Rodrigues, M.I., Freire, D.M.G., and Castilho, L.R., Production of an acidic and thermostable lipase of the mesophilic fungus Penicillium simplicissimum by solid-state fermentation., Bioresource Technology, Vol. 100, 2009, pp. 5249-5254.
Hasan, F., Shah, A.A., and Hameed, A., Industrial applications of microbial lipases., Enzyme and Microbial Technology, Vol. 39, 2006, pp. 235–251.
Hasan, F., Shah, A.A., Javed, S., and Hameed, A., Enzymes used in detergents: Lipases., African Journal of Biotechnology, Vol. 9, No. 31, 2010, pp. 4836-4844.
Rodriguez, J.A., Mateos, J.C., Nungaray, J., González, V., Bhagnagar, T., Roussos, S., and Baratti, J., Improving lipase production by nutrient source modification using Rhizopus homothallicus cultured in solid state fermentation., Process Biochemistry, Vol. 41, 2006, pp. 2264-2269.
Kazancev, K., Sendzikiene, E., and Kazanceva, I., Application of enzymatic process for biodiesel synthesis from vegetable oil with high fatty acid content using butanol., Engineering for rural development, Vol. 5, 2015, pp. 20-22.
Kumar, D.S., and Ray, S., Fungal Lipase Production by Solid State Fermentation-An Overview., Analytical Bioanalytical Techniques, Vol. 6, No. 1, 2014, pp. 1-10.
Lall, W.S., Sirohi, R., and Prakash, V., Process optimization for lipase production by solid state fermentation., World Journal of Pharmacy and Pharmaceutical Sciences, Vol. 3, No. 10, 2014, pp. 703-712.
Mahapatra, P., Kumari, A., Garlapati, V. K., Banerjee, R., and Nag, A., Optimization of Process Variables for Lipase Biosynthesis from Rhizopus oligosporus NRRL 5905 Using Evolutionary Operation Factorial Design Technique., Indian Journal Microbiol, Vol. 50, No. 4, 2010, pp. 396-403.
Mukhtar, H., Hanif, M., Asad-Ur-Rehman, Nawaz, A., and HAQ, I.U., Studies on the lipase production by Aspergillus niger though solid state fermentation., Pak. J. Bot, Vol. 47, 2015, pp. 351-354.
Niaz, M., Iftikhar, T., and Zia, M.A., Effect of nutritional factors on lipase biosynthesis by Aspergillus niger in solid state fermentation., Extensive Journal of Applied Sciences, Vol. 1, No. 1., 2013, pp. 9-16.
Poojari, Y., and Clarson, S.J., Lipase Catalyzed Synthesis and Thermal Properties of Poly(dimethylsiloxane)–Poly(ethylene glycol) Amphiphilic Block Copolymers., Journal Inorg Organomet Polym, Vol 20, 2010, pp. 46–52.
Price, J. A., Woodley, J., Huusom, J.K., and Nordblad, M., Modelling and operation of reactors for enzymatic biodiesel production. Thesis presented in Option to Doctor of Philosophy degree, Specialty Chemical Engineering of theTechnical University of Denmark, Denmark, 2014, pp. 1-191.
Ramos-Sánchez, L.B., Aplicación de la modelación matemática para el desarrollo de la tecnología de fermentación del bagarip., Tesis presentada en Opción al Grado Científico de Doctor en Ciencias Técnicas, Especialidad Ingeniería Química en la Universidad Ignacio Agramonte de Camagüey, Cuba, 2000.
Renge, V.C., Khedkar, S.V., and Nandurkar, N.R., Enzyme synthesis by fermentation method., A review. Sci. Revs. Chem. Commun, Vol. 2, No. 4, 2012, pp. 585-590.
Rigo, E., Ninow, J.L., Luccio, M.D., Oliveira, J.V., Polloni, A.E., Remonatto, D., and Treichel, H., Lipase production by solid fermentation of soybean meal with different supplements., LWT - Food Science and Technology, Vol. 43, 2010, pp. 1132-1137.
Rodrigues, C., Cassini, S.T.A., Antunes, P.W.P., Pinotti, L.M., Keller, R.d.P., and Gonçalves, R.F., Lipase-producing fungi for potential wastewater treatment and bioenergy production., Journal of Biotechnology, Vol. 15, No. 18., 2016, pp. 759-767.
Salihu, A., Alam, M.Z., AbdulKarim, M.I., and Salleh, H.M., Lipase production: An insight in the utilization of renewable agricultural residues., Resources, Conservation and Recycling, Vol. 58, 2012, pp. 36-44.
Santis-Navarro, A., Gea, T., Barrena, R., and Sánchez, A., Production of lipases by solid state fermentation using vegetable oil-refining wastes., Bioresource Technology, Vol. 102, 2011, pp. 10080-10084.
Sarkar, D., and laha, S., Optimization of extracellular lipases enzyme production from Aspergillus niger by submerged and solid-state fermentation process., International Journal of Pharma and Bio Sciences, Vol. 4, No. 4, 2013, pp. 978-985.
Sethi, B.K., Nanda, P.K., and Sahoo, S., Characterization of biotechnologically relevant extracellular lipase produced by Aspergillus terreus NCFT 4269.10., Brazilian Journal of Microbiology, Vol. 47, 2016, pp. 143-149.
Silva, J.N., Godoy, M.G., Gutarra, M.L.E., and Freire, D.M.G., Impact of Extraction Parameters on the Recovery of Lipolytic Activity from Fermented Babassu Cake., PLOS ONE, Vol. 9, No. 8, 2014, pp. 1-9.
Sun, S.Y., and Xu, Y., Solid-state fermentation for ‘whole-cell synthetic lipase’ production from Rhizopus chinensis and identification of the functional enzyme., Process Biochemistry, Vol. 43, 2008, pp. 219-224.
Toscano, L., Montero, G., Stoytcheva, M., Gochev, V., Cervantes, L., Campbell, H., and Gil-Samaniego, M., Lipase Production Through Solid-State Fermentation using Agro-Industrial Residues as Substrates and Newly Isolated Fungal Strains., Biotechnology & Biotechnological Equipment, Vol. 27, No. 5, 2016, pp. 1314-3530.
Ul-Haq, I., Idrees, S., and Rajoka, M.I., Production of lipases by Rhizopus oligosporous by solid-state fermentation., Process Biochemistry, Vol. 37, 2002, pp. 637-641.
Zhang, X., Kobayashi, T., Adachi, S., and Matsuno, R., Lipase-catalyzed synthesis of 6-O-vinyacetyl glucose in acetonitrile. Biotechnology Letters, Vol. 24, 2002, pp. 1097–1100.
Recibido: Marzo 21, 2017
Revisado: Junio 15, 2017
Aceptado: Abril 5, 2018