Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Centro Azúcar
versión impresa ISSN 0253-5777versión On-line ISSN 2223-4861
cen. az. vol.45 no.4 Santa Clara oct.-dic. 2018
ARTICULO
Despigmentación de residuos de camarón con ozono
Shrimp wastes depigmentation using ozone
Caridad Curbelo Hernández1*, Amanda Núñez Sánchez1, Eliet Véliz Lorenzo2 y Sandra Fanego Hernández3
1 Facultad de Ingeniería Química, Instituto Superior Politécnico José Antonio Echeverría, CUJAE. Calle 114 No. 11901, Marianao 19390. La Habana, Cuba
2 Dirección de Investigación, Desarrollo e Innovación, CNIC, avenida 23 y 158, Playa 15340. La Habana, Cuba.
3 Departamento Agroquímico, Laboratorio de Analítica, Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar (ICIDCA). Vía Blanca 804 Esq. Carretera Central. San Miguel del Padrón. La Habana. Cuba.
*Autor para la correspondencia: Caridad Curbelo, Email: cary@quimica.cujae.edu.cu
RESUMEN
El aumento en el cultivo de camarón debido a la demanda de este producto conlleva a un crecimiento de residuos orgánicos, constituidos por la cabeza y el exoesqueleto de estos animales cuando son procesados para obtener el músculo comestible. Se conoce que estos residuos contienen minerales, proteínas, pigmentos y quitina (a partir de la cual se obtiene su derivado funcional, el quitosano), que podrían ser reutilizados en la obtención de productos de gran valor comercial con múltiples aplicaciones en la industria. En la purificación de la quitina se pueden recuperar los pigmentos (fundamentalmente la astaxantina) para la industria farmacéutica y cosmética por su alto poder antioxidante, sin embargo, para la medicina se requiere su eliminación, pues puede presentar efectos adversos para las personas alérgica. En este trabajo se evalúa el uso del ozono como alternativa de despigmentación del exoesqueleto de camarón (especies Farfantepenaeus notialis y Litopennaeus vannamei) en un reactor de cama fija a escala de laboratorio y temperatura ambiente. Mediante la aplicación de la espectroscopía ultravioleta visible se comprobó que el uso del ozono logra una despigmentación del exoesqueleto de las dos especies de camarón superior al 75%, siendo mayor para la especie Litopennaeus vannamei. Mediante la espectroscopía infrarroja se demuestra que el uso del ozono como método de despigmentación no afecta la estructura de la molécula de quitina.
Palabras clave: astaxantina; despigmentación; ozono; residuos de camarón.
ABSTRACT
The increase in shrimp farming, due its demand, leads a growth of organic waste, mainly constituted by their head and the exoskeleton when the animals are processed to obtain edible muscle. It is known that these residues contain minerals, proteins, pigments and chitin (from which their functional derivative, chitosan is produced). These biomolecules could be reused in obtaining products of great commercial value with multiple applications in industry. Some by-products can be recovered from chitin purification, mainly astaxanthin, with important applications in pharmaceutical and cosmetic industry due to its high antioxidant power. However, for medicine, its removal is required since it can have adverse effects for allergic people. In this work, ozone application is evaluated as a depigmentation alternative of shrimp exoskeleton (Farfantepenaeus notialis and Litopennaeus vannamei species) in a fixed bed reactor at laboratory scale at room temperature. Through visible UV spectroscopy application, it was found that ozone application achieves a shrimp exoskeleton wastes depigmentation superior to 75%, being higher for Litopennaeus vannamei specie. Infrared spectroscopy shows that ozone application as a depigmentation method does not affect the structure of chitin molecule.
Key words: astaxanthin; depigmentation; ozone; shrimp waste.
INTRODUCCIÓN
Los camarones son crustáceos decápodos nadadores que habitan en aguas dulces y en mayor diversidad en el medio marino. Su cuerpo está protegido por un exoesqueleto que muda a medida que crece. Los camarones de género Penaeus presentan un enorme potencial de cultivo, motivo por el cual han recibido la mayor atención en cuanto a experiencias de cultivo e investigación científica, siendo por ello los principales crustáceos cultivados en el mundo, Bonilla (2008).
El cultivo de camarón y la producción de residuos debido a su procesamiento, se han visto en incremento a nivel mundial por su valor nutritivo y la exquisitez de los platos elaborados a partir de la masa procedente de la cola. Los desechos representan entre el 45% y el 48% del peso total del camarón, compuesto fundamentalmente por la cabeza y el exoesqueleto, Ortiz (2013).
En su matriz están asociadas numerosas moléculas de gran interés tales como proteínas, sales de magnesio, carbonato de calcio, quitina, lípidos y pigmentos carotenoides, que pueden ser aprovechados como productos de valor agregado. Entre las más comercializadas se encuentran la quitina, biopolímero natural del cual se obtiene su derivado fundamental el quitosano y la astaxantina que es el pigmento en mayor proporción en los camarones. Estas biomoléculas son de gran interés en el mercado mundial debido a sus amplias aplicaciones en disímiles industrias (Osuna y col., 2014); (Dutta y col., 2002).
Teniendo en cuenta que las moléculas antes mencionadas presentes en la estructura de los crustáceos varían dependiendo de la especie, de la estación, parte del organismo, alimentación y del ciclo reproductivo, en la tabla 1 se muestran los valores alrededor de los cuales se mueven estos porcentajes para la especie Penaeus vannamei, Isla (2006); Boone (2016).
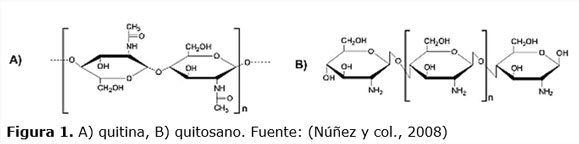
Dentro de estas biomoléculas se destacan por su alto valor en el mercado, propiedades y aplicaciones, la quitina y su derivado funcional el quitosano (ver figura 1). La quitina es un polímero natural que se clasifica dentro del tipo de polisacárido, siendo el segundo de mayor abundancia en la naturaleza después de la celulosa. Está constituida por moléculas de N-acetil-D-glucosamina, con enlaces (3 (b—>4) y forma parte del exoesqueleto de crustáceos, moluscos, insectos y en las paredes celulares de algunos hongos y algas, para defenderse del contacto con el medio externo, Beltrán (2015). Su purificación requiere de varios pasos como son la despigmentación, la desmineralización y la desproteinización.
Una vez purificada mediante la desacetilación se obtiene el quitosano (b—>4)-2-amino-2-deoxy-p-D-glucano, está formado por unidades de D-glucosamina algunas de las cuales se encuentran acetiladas, y unidas todas entre sí por enlaces (3 (1-4) glicosídicos). Este biopolímero es el único polisacárido catiónico natural (Dutta y col., 2002).
La astaxantina cuya fórmula química es C40H52O4, se clasifica como una xantófila, carotenoide que está modificada por grupos funcionales oxigenados (ver figura 2). Se puede encontrar en las microalgas, algas (Haematococcus pluvialis), levadura (Phaffia rhodozyma), salmón, trucha, crustáceos y en las plumas de algunos pájaros. Es sensible a la luz, a la temperatura, a los ácidos, al oxígeno y a la presencia de álcalis. Está compuesta por una larga cadena poliénica de dobles enlaces con un anillo polar de seis carbonos en los extremos, lo que le confiere carácter insoluble en agua y naturaleza lipofílica. Es una molécula activa de origen natural con alta capacidad antioxidante, configurada con grupos funcionales de alcohol y dos cetonas. Es insoluble en solventes acuosos y la mayoría de solventes orgánicos, pero puede disolverse a temperatura ambiente en compuestos orgánicos como diclorometano, cloroformo, acetona, dimetilsulfóxido, disulfuro de carbono, benceno y otros solventes no polares (Astaxantina, 2010).
Fuente: Birkeland y Bjerkeng (2004)
La despigmentación o blanqueo de la quitina solo se realiza cuando es indispensable tener un producto completamente puro para usos médicos (Suárez y col., 2013), ya que el pigmento (astaxantina) no afecta la influencia del comportamiento del polímero en solución, su reactividad o propiedades fisicoquímicas, (Synowlecki y Al-Khateep, 2003); (Percot y col., 2003). La despigmentación puede ser realizada por varios métodos, donde el más utilizado es la extracción con solventes.
El empleo de ozono se justifica al ser altamente reactivo hacia compuestos que presentan dobles enlaces conjugados como la astaxantina, eliminándola de la estructura (Seung, 2006); (García-Cubero y col., 2009). Entre las ventajas de este método se encuentran el corto tiempo de duración de la reacción, que no involucra agua en el sistema de reacción, se realiza a temperatura ambiente, el producto de degradación del ozono es oxígeno y que se obtiene quitina más pura al eliminarse el color. Su principal desventaja en este caso es que con este método se destruye el pigmento.
El objetivo del presente trabajo es evaluar la ozonización como alternativa de despigmentación de exoesqueleto de camarón, para valorar su efectividad y la posible afectación en la estructura de la quitina.
MATERIALES Y MÉTODOS
2.1 Acondicionamiento de la materia prima
En esta investigación se utilizaron los exoesqueletos de dos especies de camarón: Farfantepenaeus notialis (camarón rosado) suministrado por la empresa productora de alimentos (Prodal) ubicada en el municipio Regla, La Habana y Litopenaeus vannamei (camarón blanco del pacífico) cultivado en Ecuador. Fue necesario realizar una limpieza manual con abundante agua para eliminar los restos de músculo y posteriormente fueron cocidos a 100°C durante dos horas para inactivar las enzimas; secados a temperatura ambiente y finalmente molidos hasta convertirlos en harina (300 μm) en un molino de bolas.
1.2. Trabajo experimental
Para este estudio se dispuso de las siguientes muestras con el contenido de humedad en base seca que se reporta:
· Muestra 1 (M1): exoesqueleto de Litopenaeus vannamei en forma de hojuelas de pequeño tamaño, 8,22% ± 0,13. Con esto se perseguía evaluar la influencia de la forma y tamaño de partícula.
· Muestra 2 (M2): exoesqueleto de Litopenaeus vannamei en forma de harina, 7,87% ± 0,25.
· Muestra 3 (M3): exoesqueleto de Farfantepenaeus notialis en forma de harina, 11,73% ± 0,56.
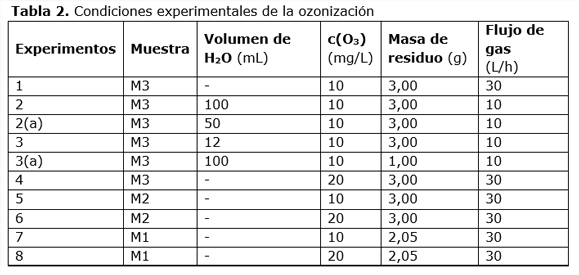
Para la despigmentación con ozono se realizaron varios experimentos para determinar cualitativamente cuál era la mejor forma de aplicar el ozono a las muestras de residuos de camarón. Para ello se tomaron tres muestras cada una por duplicado, dejando una muestra de cada tipo como testigo. Se pesaron 3 gramos de harina, en el caso de las hojuelas 2,05 gramos y las testigos aproximadamente un gramo. Las corridas de ozonización se realizaron durante 1 hora en todos los casos (ver tabla 2).
Los experimentos del 1 al 3 fueron realizados con muestras de camarón cubano por tener mayor disponibilidad y con ellos se persiguió analizar el comportamiento de la ozonización incrementando la humedad del residuo.
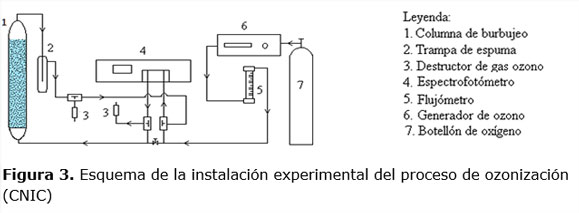
La instalación de ozonización (ver figura 3) consistió una columna de burbujeo de vidrio de 100 mL de capacidad útil (d=23 mm y h=300 mm), la cual dispone de un dispersor poroso de boro silicato en su parte inferior, una entrada y salida de gas ozono. El gas ozono se obtuvo con el empleo de un equipo ozonizador modelo AQOZO-LAB, diseñado y construido en el Centro Nacional de Investigaciones Científicas (CNIC), que permite una producción de ozono de hasta 1,5 g/h. El gas ozono residual que no reaccionó con el residuo de camarón fue destruido catalíticamente a la salida de la columna en un dispositivo denominado destructor de ozono.
El flujo de gas fue medido con un flujómetro modelo Gilmont. Los valores de concentración de ozono en el gas a la entrada y salida de la columna fueron determinados a 256 nm en un espectrofotómetro Ultrospec III, Pharmacia, UK, con una cubeta de flujo de gas de 1 mm de paso óptico.
Posterior a la ozonización se colocaron 0,1 gramos de las muestras y de los testigos en 5 mL de etanol al 96% y fueron asistidas por ultrasonido por 30 minutos para facilitar la disolución de pigmentos remanentes en el exoesqueleto de camarón. Luego se dejaron reposar durante una hora y se repitió el ultrasonido durante el mismo tiempo y se dejaron reposar 20 horas.
Posteriormente, las muestras fueron filtradas y al extracto alcohólico se le midió la absorbancia en un espectrofotómetro marca Rayleigh, Beijing Rayleigh Analytical Instrument Corp. VIS-725G, en el intervalo de 200-700 nm. Las lecturas espectofotométricas se realizaron a 230 nm, 265 nm y 476 nm. A estos valores se les halló una media y con estos se determinó el porcentaje de remoción (Re) por la ecuación 1.
donde:
Absref: absorbancia de la muestra testigo.
Absf: absorbancia de la muestra.
Las muestras ozonizadas fueron analizadas en un espectrofotómetro IR modelo Vector 22 (Brüker Optics) FTIR, en el intervalo de 4000 a 600 cm-1 en unidades de transmitancia, con un aditamento de ATR bajo los siguientes parámetros:
Método: Standard Ajuste de Línea Base: 64 puntos Resolución: 4 cm-1
Compensación: aire Scans: 60 scans Sensitividad: 1%
Procesamiento de los espectros: Software OPUS NT
RESULTADOS Y DISCUSIÓN
3.1 Análisis cualitativo de la ozonización
Es importante señalar que este procedimiento no permite la recuperación de la astaxantina, y que su evaluación como método de despigmentación se realizó para analizar si con su aplicación se afectaba la estructura química del exoesqueleto de camarón, debido al alto poder oxidante del ozono. Para facilitar la discusión de los resultados obtenidos, se presenta el análisis en cada uno de los experimentos.
3.1.1. Experimento 1
Con este caso se produjeron canalizaciones (ver figura 4a) a través del reactor, lo que impidió que el ozono tuviera contacto favorable con toda la masa de residuos de camarón. No obstante, se logró disminuir la pigmentación del material como puede observarse en la figura 5.
3.1.2. Experimentos 2, 2 (a), 3, y 3 (a):
Aquí se perseguía valorar si al humedecer en distintos grados la harina de camarón, pudiera potenciarse que el ozono se transfiera mejor a través de la película líquida adyacente a las partículas sólidas y pueda reaccionar mejor con estas. Además, en fase acuosa el ozono disuelto pudiera llegar más fácil a la matriz sólida, teniendo en cuenta la alta solubilidad del ozono en agua y lo recomendado por (García-Cubero y col., 2009). Se pudo observar que al añadir el agua empezó a formarse espuma (ver figura 4b) debido a la presencia de proteínas en los residuos, lo que es perjudicial ya que parte del residuo en polvo de camarón se arrastró con la misma. En el experimento 3 (a) la espuma provocó sobrepresión dentro de la columna por taponamiento del orificio de salida del gas residual. Por todo lo explicado anteriormente, la incorporación de agua en el reactor de ozonización no resultó favorable.
3.1.3. Experimento 4:
Bajo estas condiciones se produjo una despigmentación parcial de los residuos como puede observarse en la figura 5.
3.1.4. Experimentos 5 y 6:
Estos dos experimentos se corresponden con el residuo de camarón ecuatoriano en forma de un fino polvo, con un tamaño de partícula inferior al exoesqueleto de Farfantepenaeus notialis. Como se observa en la figura 4c el material en el interior de la columna se encuentra en régimen de fluidización, garantizando un mejor contacto con el ozono. Fue difícil determinar un cambio de coloración visualmente, pues las tres muestras originalmente eran casi blancas (ver figura 4c).
3.1.5. Experimentos 7 y 8:
Al comparar los experimentos 7 y 8 se observó que hubo una decoloración con respecto a la muestra de referencia sin ozonizar (ver figura 5).
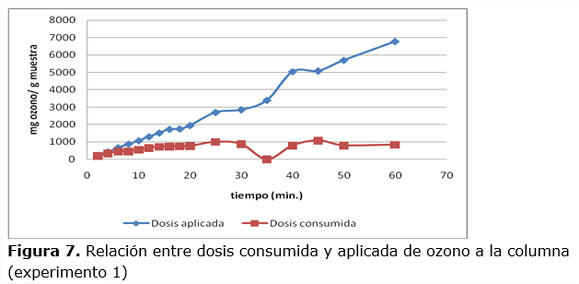
3.2. Determinación de la dosis aplicada y consumida de ozono durante los experimentos.
La dosis de ozono aplicada (DA) y consumida (DC) en la columna durante cada experimento, es un indicador de la cantidad de ozono utilizada en la despigmentación de los residuos de camarón. Fueron determinadas mediante las ecuaciones 2 y 3:
donde:
c(O3)ent: concentración de ozono a la entrada de la columna (mg/L)
c(O3)sal: concentración de ozono a la salida de la columna (mg/L)
Q(O3): flujo de gas aplicado a la columna (L/h)
m (muestra): masa de residuos de camarón añadida a la columna (g)
t: tiempo de ozonización (h)
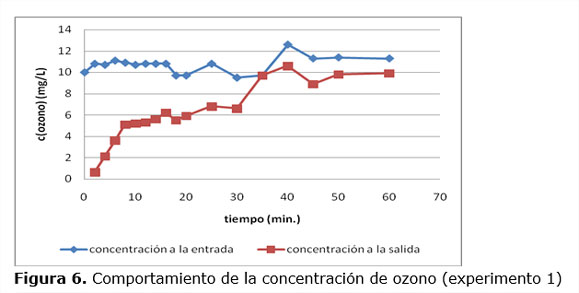
En la figura 6 se representan las concentraciones de ozono a la entrada y salida del reactor para el experimento 1. Para los restantes experimentos el comportamiento fue similar.
Como se observa a partir de los 35 minutos la concentración de ozono a la salida de la columna tiende a estabilizar su concentración, lo que indica que a partir de este instante una pequeña cantidad del ozono que se aplica al reactor continua reaccionando con el residuo sólido y la mayor parte del gas residual sin reaccionar va al dispositivo de destrucción catalítica de ozono colocado a la salida del reactor.
En la figura 7 se muestra la relación entre la dosis aplicada y consumida de ozono en la columna para el experimento 1, desde el inicio hasta los 20 minutos se consume ozono en la reacción, pero a partir de este tiempo prácticamente se mantiene constante el consumo hasta los 35 minutos que se hace cero y luego vuelve a aumentar discretamente por la posible formación de nuevos compuestos que reaccionan con el ozono. Sin embargo, la dosis de ozono aplicada tiene un comportamiento creciente durante todo el tiempo de experimentación.
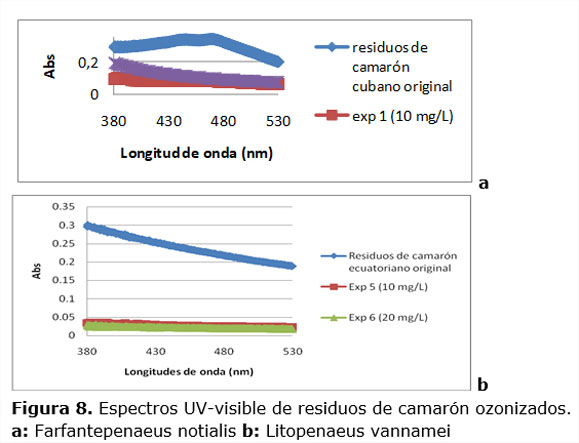
3.3. Análisis de la espectroscopía UV-Visible
La figura 8 (a,b) representa los espectros UV-visible de los extractos obtenidos a partir de los residuos de camarón ozonizados para algunos experimentos y permite visualizar la presencia o no de astaxantina después de la aplicación de ozono. En ambos espectros se presenta una diferencia fundamental asociada al contenido de astaxantina en los residuos de camarón, ya que en el caso del cubano los picos de absorción característicos se encuentran alrededor de 476 nm, y para el ecuatoriano no se obtuvieron picos de absorción, aunque si un máximo a 380 nm para la muestra original. Esta diferencia se justifica teniendo en cuenta que son dos especies de camarón de lugares geográficos diferentes, y a simple vista las muestras analizadas mostraron distinta coloración.
Para ambos residuos la reacción por ozonización ocurrida conllevó a que al realizar la extracción con etanol se obtuviera el comportamiento que ilustran los experimentos 1,4,5 y 6, lo cual indica que la aplicación de ozono logró la despigmentación del exoesqueleto de las dos especies de camarón.
3.4. Determinación del rendimiento de despigmentación
En la tabla 3 se reportan los valores del porcentaje de despigmentación para los experimentos que resultaron favorables. Como se muestra en todos los casos se logró una decoloración superior al 75%. Según se observa los mayores porcentajes de despigmentación se obtuvieron para la especie Litopenaeus vannamei, lo cual es lógico si se tiene en cuenta que el tamaño de partícula era de 200 µm y por lo tanto el área superficial para el contacto con el ozono era mayor que en el caso del camarón cubano. Además, visualmente el exoesqueleto de esta especie presentó menor coloración (casi blanco), lo que puede inferirse que presenta menor cantidad de pigmento, debido a las condiciones de cultivo fundamentalmente las nutricionales.
3.5. Análisis de la espectrofotometría IR
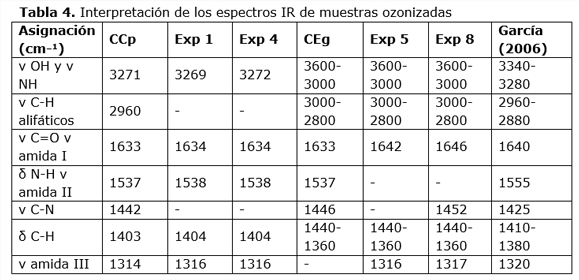
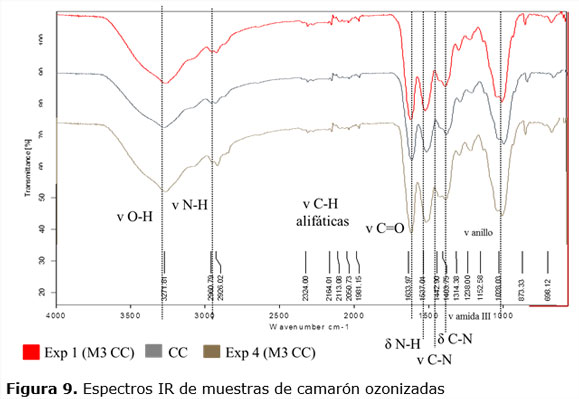
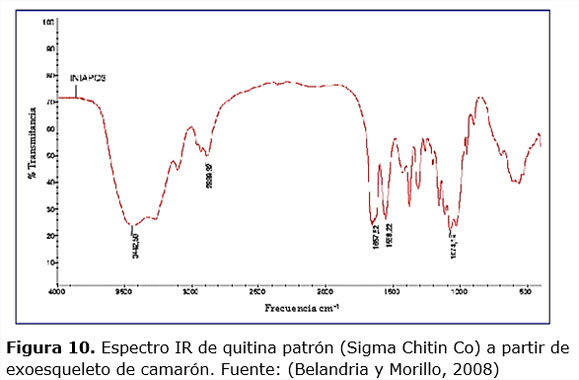
Los espectros IR caracterizan los grupos funcionales presentes en una sustancia. En la figura 9 se muestran los correspondientes a los experimentos 1 y 4 y al residuo de camarón cubano sin ozonizar, el resto de los espectros presentan las mismas bandas (no se presentan). En la tabla 4 se ilustra la interpretación de los espectros IR obtenidos para algunas muestras de residuos de camarón cubano y ecuatoriano ozonizados (experimentos 1, 4, 5 y 8). En los casos donde no aparece el número de onda de la señal, es porque el equipo utilizado no lo detecta como una única banda, sino como un solapamiento de bandas. En la mayoría de los casos las señales obtenidas en esta investigación se corresponden con lo reportado por García (2006).
(cm-1): número de onda o frecuencia
Se observan pequeñas diferencias como desplazamientos en algunas bandas y variación sobre todo en la intensidad de éstas, siendo más marcadas en los exp 5 y exp 8 (en general) que en la muestra MO CEh. Este comportamiento puede deberse a la presencia de impurezas en las muestras, lo que sí queda demostrado en todos los espectros IR es la presencia de las bandas características de la quitina:
·cm-1 v C=O v amida I: 1657 cm-1 δ N-H v amida II: 1568 cm-1
Al comparar el espectro de quitina patrón (Sigma Chitin Co, figura 10) obtenido a partir de exoesqueleto de camarón con los espectros de los residuos ozonizados, se pueden observar las principales bandas presentes y comprobar de esta forma que el ozono no parece afectar la estructura de la molécula de quitina.
CONCLUSIONES
La despigmentación con ozono del exoesqueleto de las dos especies de camarón estudiadas es efectiva, con un rendimiento superior al 75%. Los mayores porcentajes de despigmentación se lograron para la especie Litopenaeus vannamei, debido a que presenta menor contenido inicial de astaxantina y menor tamaño de partícula. A pesar de que la ozonización destruye el pigmento, no modifica la estructura principal de la quitina y pudiera valorarse como etapa dentro de un esquema de obtención de quitosano para usos médicos, pues este pigmento resulta perjudicial para personas alérgicas. Para otras aplicaciones que no requieran la despigmentación total de los residuos de camarón, se recomienda la extracción de la astaxantina con solventes para su recuperación.
REFERENCIAS
Astaxantina., Natural Standard. Monografía. [ref. 23 de abril 2010], disponible en: http://holadoctor.com/es/hierbas-y-suplementos-a-z/astaxantina.
Bonilla, G., Biología del pennaeus vannamei., Revista Ecuacamarón, Vol. 8, No. 1, 2008, pp. 27–32.
Boone, P.V., Programa de información de especies acuáticas., Organización de las Naciones Unidas para la Alimentación y la Agricultura 2016 [ref. marzo, 2017]. disponible en: www.fao.org/fishery/culturedspecies/penaeus_vannamei/es#tcna0019
Beltrán, Y., Monografías.com. journal. [ref. de 17 marzo 2015]. disponible en: http://www.monografias.com/trabajos53/quitina-quitosana/quitina-quitosana.shtml#ixzz3du9dyxgj.
Belandria, J.C., Morillo de Montiel, N., Recuperación de quitina a partir de los residuos sólidos generales del procesamiento industrial de crustáceos., Revista Cubana de Química, Vol. XX, No. 3, 2008, pp. 17-26.
Birkeland, S., Bjerkeng, B., Extractabilities of astaxanthin and protein from muscle tissue of atlantic salmon (salmon salar) as affected by brine concentration and pH., Food Chemistry, Vol. 85, No. 4, 2004, pp. 559–568.
Dutta, P., Ravikumar, M., Dutta, J., Chitin and chitosan for versatile applications., Journal of Macromolecular Science, Vol. c42, No. 3, 2002, pp. 307–315.
García, V., Potencialidades de la quitina cubana en la elaboración de tabletas., Tesis presentada en opción al Grado Científico de Doctor en Ciencias Farmacéuticas, Universidad de la Habana, Cuba, 2006.
García-Cubero, M., González-Benito, E., Indacoechea, I., Coca, M., Bolado, S., Effect of ozonolysis pretreatment on enzymatic digestibility of wheat and rye straw., Bioresource Technology, Vol. 100, No. 4, 2009, pp. 1608–1613.
Isla, M., Manejo sostenible del cultivo de camarón en Cuba. Estudio de caso: camaronera Calisur, provincia Granma., Tesis en opción del título de Máster en Manejo integrado de la zona costera., Universidad de la Habana, Cuba, 2006.
Núñez, C., Argüello, W., Reyes, N., Barragán, C., Fornué, E., Ortega, J., Utilización de residuos de cáscara de camarón para la obtención de quitina blanqueada: Propuesta de una metodología a base de tratamientos alcalino-ácidos y ozono., Avances en la investigación en el Cucba. México, 2008.
Ortiz, A., Tratamiento químico y biotecnológico de residuos de camarón para la obtención de productos de valor agregado. Programa educativo de Ingeniería Ambiental, Monografía, Universidad Veracruzana, Méjico, 2013, pp. 1-63.
Osuna, A., Escobedo, A., Méndez, E., Vázquez, A., Martínez, H., Extracción, caracterización parcial y evaluación de la digestibilidad in vitro de la proteína asociada al exoesqueleto del camarón blanco (litopenaeus vannamei)., Revista Biociencia, Vol. 2, No. 4, 2014, pp. 293-301.
Percot, A., Viton, C., Domard, A., Optimization of chitin extraction from shrimp shells., Biomacromolecules, Vol. 4, 2003, pp. 12-18.
Seung, S., Depolymerization and decolorization of chitosan by ozone treatment., Tesis en opción del título de Máster en Ciencias., Universidad del estado de Louisiana, Estados Unidos, 2006.
Suárez, L., Tulande, J., Mina, J., Peñaranda, J., Desarrollo de apósitos de quitosano para su posible aplicación en la regeneración de tejido epitelial. Primera parte: caracterización mecánica., Revista Colombiana de Materiales, Vol. 5, 2013, pp. 56-63.
Synowlecki, J., Al-Khateep, N., Production properties and some new applications of chitin and its derivatives., Critical Reviews in Food Science and Nutrition, Vol. 43, No. 2, 2003, pp. 145-171.
Recibido: Enero 25, 2018
Revisado: Marzo 29, 2018
Aceptado: Junio 8, 2018