INTRODUCCIÓN
En la actualidad, la necesidad de búsqueda de fuentes de energía renovables es un tema de gran importancia, debido a la disminución de las reservas de petróleo y la crisis medioambiental relacionada con la emisión de gases contaminantes, por el uso de combustibles fósiles, para lo cual los biocombustibles son una buena alternativa (Amini y col., 2017). El biodiesel es producido a partir de una gran variedad de aceites vegetales como el aceite de Jatropha curcas, de soya, de palma, de girasol, entre otros. En la actualidad el uso de aceites no comestibles como el aceite de Jatropha curcas es muy reportado (Rezania y col., 2019; Luque y col., 2016), dada sus buenas propiedades para estos fines. Este aceite es una alternativa muy atractiva. Comparado con el diesel del petróleo, presenta muchos beneficios como: su biodegradabilidad, su menor toxicidad y menor emisión de gases como los óxidos nitrosos y los óxidos de azufre. También, el biodiesel tiene valores aceptables de viscosidad, índice de cetano, poder calórico y punto de inflamación, lo que lo hace un candidato fuerte para reemplazar el diesel convencional sin cambio alguno en los motores (Zarejousheghani y col., 2016).
La transesterificación es la técnica más conveniente para la producción de biodiesel (Borgolov y col., 2016). La misma se lleva a cabo en un sistema de tres reacciones consecutivas que usa los alcoholes como sustratos y un catalizador de naturaleza ácida, básica o enzimática. La reacción es reversible y el exceso de alcohol se usa para favorecer la reacción en el sentido de la producción de biodiesel. Hay varios factores que pueden influenciar la velocidad de la reacción, tales como: la relación molar alcohol/aceite, la carga del catalizador, la temperatura y la agitación mecánica (Zarejousheghani y col., 2016). Los biocatalizadores enzimáticos del tipo lipasas han recibido una amplia atención, debido a que presentan varias ventajas frente a los catalizadores alcalinos y ácidos. Estos procesos operan a temperaturas más bajas, se eliminan los costos asociados a la recuperación del catalizador químico precipitado, la posibilidad del reuso de la enzima es muy deseable, la alta especificidad de la enzima por el sustrato, la habilidad de la enzima de esterificar no sólo ácido grasos libres, sino también, triglicéridos directamente en un solo paso. Muy importante también es la necesidad del uso de una menor relación alcohol/aceite, la eliminación de reacciones colaterales y la minimización de impurezas, lo que la hace el proceso más fácil separación y recuperación del producto. La degradabilidad del biodiesel y su compatibilidad medioambiental es otro aspecto que lo avalan como alternativa más deseable que el de petróleo (Alcala-Galiano y col., 2018).
La mayoría de los estudios reportados de la transesterificación de aceites vegetales catalizados con lipasas, se realizaron con el uso de enzimas comerciales, fundamentalmente, Novozyme 435 (Rezania y col., 2019), pero el principal inconveniente de este tipo de catálisis es el alto precio de la enzima, lo que hace que la producción de biodiesel no sea factible. Desde hace unos años, ha comenzado a reportarse el uso de un sólido fermentado con actividad lipasa (SFAL) para reacciones de esterificación y transesterificación, con resultados interesantes (Soares y col., 2013; Galeano y col., 2017). No se ha encontrado, sin embargo, reportado el uso de SFAL en reacciones de transesterificación del aceite de J. curcas con etanol. En general, los pocos estudios cinéticos reportados, estudian principalmente la influencia de la temperatura en el avance de la reacción (Zarejousheghani y col., 2016). Esto puede ser adecuado, si se usa una enzima comercial pura como biocatalizador, pero para un SFAL, que contiene varias enzimas del tipo lipasas que participan en la reacción, ese enfoque podría no ser correcto. Como cada enzima contenida en un SFAL puede tener condiciones óptimas diferentes, a la que exprese su máxima actividad, entonces, resulta de gran interés estudiar el comportamiento del conjunto de enzimas contenidas en el SFAL, para diferentes condiciones de reacción. Es por ello que, el objetivo del presente trabajo consistió en determinar las mejores condiciones de tamaño de partícula, velocidad de agitación y relación molar etanol/aceite, para la reacción de producción de etil-ésteres, utilizando como sustratos: aceite de Jatropha curcas y etanol y, como biocatalizador, un sólido fermentado con actividad lipasa.
MATERIALES Y MÉTODOS
2.1 Materiales
El aceite de Jatropha curcas comercializado por Jatrobioenergy and Oilseeds S.P.R. de R.L, Morelos, México, con un 5 % de ácidos grasos libres (Cosío-Cuadros y col., 2017), lo cual se corresponde con los valores reportados por (Chua y col., 2020) para este tipo de aceite. El alcohol etílico anhidro, el hexano anhidro, el éter dietílico y el ácido acético al 99 % de pureza, usados fueron de la marca SIGMA, mientras que el iso-octano (2,2,4-trimetil pentano) fueron de la marca FERMONT.
2.2 Selección del biocatalizador
Se estudiaron dos biocatalizadores sólidos, los cuales fueron preparados, empleando técnicas de fermentación en medio sólido para el cultivo de Rhizopus homothallicus y de Aspergillus niger, de acuerdo a lo reportado por Rodríguez y col., (2006) y Cujilema-Quitio y col., (2018).
Para la selección del biocatalizador, se midieron las dinámicas de la producción de lipasas en cultivos sólidos, empleando matraces Erlenmeyer de 250 mL. Cada 12 h, fueron tomados dos matraces por cepa de hongo, para medir por triplicado, la actividad enzimática en hidrólisis (UI/g MS). Se empleó un método colorimétrico reportado por Kwon y Rhee, (1986) con algunas modificaciones (Rodríguez y col., 2006) para medir la actividad enzimática. Este método se basa en la formación de sales de cobre con los ácidos grasos liberados durante la hidrólisis de aceite de oliva.
El biocatalizador escogido, se secó a 50 °C en una estufa marca Shanghai Boxun.
2.3 Establecimiento de las mejores condiciones de la reacción
2.3.1 Tamaño de partículas y velocidad de agitación
En el sistema de reacción de transesterificación, libre de solvente, los aceites vegetales y el etanol son poco miscibles y, el uso de un catalizador heterogéneo, conduce a la formación de tres fases, lo que dificulta la transferencia de masa entre ellos y consecuentemente, reduce la velocidad global de la reacción. La velocidad de agitación del medio de reacción, reduce el espesor de la capa límite y mejora la homogeneidad de la suspensión sólida, minimizando las limitaciones externas, difusionales de transferencia de masa. Por otro lado, una disminución del tamaño de partícula del biocatalizador, reduce la longitud del camino de difusión de los sustratos, en los poros del sólido; por lo tanto, se reduce la resistencia interna a la transferencia de masa. Al mismo tiempo, que con esto, se aumenta el área superficial de contacto, todo lo que contribuye a un aumento de la velocidad de la transferencia de masa (Haigh y col., 2014), (Chowdhury y col., 2017).
Con el objetivo de establecer las condiciones que minimizan las resistencias difusionales antes mencionadas, se estudiaron la velocidad de agitación del sistema de reacción y el tamaño de partícula del sólido fermentado. Se realizó un experimento en el que la velocidad de agitación tuvo tres niveles (200, 250 y 350 rpm) y el tamaño de partícula, cuatro intervalos del SFAL (0,149-0,297; 0,400-0,595; 0,595-0,841; 0,841-2,000 mm). El experimento contó con una réplica, lo que dio un total de 24 experiencias.
Los niveles de las variables de la reacción, se fijaron según experiencias anteriores (Norjannah y col., 2016), (Roque, 2017): temperatura 40 ᵒC, relación molar alcohol/aceite 3:1. La masa de biocatalizador usada en todos los casos fue de 0,5 g (5,5 % peso respecto a la masa de aceite).
Se utilizó como variable respuesta, el porcentaje de conversión de los triglicéridos. Las determinaciones se realizaron en un equipo de cromatografía de capa fina de alta resolución (HPTLC) marca CAMAG, empleando placas de sílica gel en aluminio, como fase móvil, hexano/éter dietílico/ácido acético (85:15:1) y, para revelar, ácido fosfórico y una solución saturada de acetato de cobre (1:1) (Ojeda y col., 2018).
La comparación entre tratamientos se realizó con un análisis de varianza multifactorial, usando el programa Statgraphics Centurion XVI, comprobando la normalidad de los datos por el comportamiento de los residuos y la prueba de bondad del ajuste normal Chi-cuadrado. Finalmente, con vistas a detectar entre qué niveles se establecen las diferencias, se realizó la prueba de diferencia mínima significativa de Fisher (LSD).
2.3.2 Relación molar etanol/aceite
La determinación de la relación molar para la mejor conversión de la mezcla de etanol/aceite en biodiesel, se realizó con un experimento en tres niveles (3:1, 4:1 y 5:1) con dos réplicas, teniendo en cuenta reportes anteriores (Amini et al., 2017). Los parámetros de la reacción fueron: temperatura 40 ᵒC, la masa de catalizador en todos los casos fue de 0,5 g (5,5 % peso respecto a la masa de aceite). Se utilizó como variable respuesta el porcentaje de conversión de triglicéridos. Las determinaciones se realizaron en un equipo de HPTLC como se explicó en el epígrafe anterior.
RESULTADOS Y DISCUSIÓN
3.1 Selección del biocatalizador para la reacción de transesterificación
En un primer experimento, se comparó la producción de lipasas por Fermentación en Medio Sólido (FMS), empleando dos cepas de hongos: una de Aspergillus niger (variante 1) y otra de Rhizopus homothallicus (variante 2); cada una ellas, con su medio y condiciones de cultivo adecuados. En la Figura 1 (a), se observa que la media de la máxima actividad de lipasas (medida en hidrólisis) alcanzada por ambos biocatalizadores fue de 57,79 y 75,39 (UI/gMS), respectivamente. En la Figura 1 (b), se observa que la media de los valores de productividad fue de 0,80 y 4,19 UI/gMS/h, donde se evidencia de manera contundente la superioridad de la variante 2. Esto se debe fundamentalmente a que, para la variante 2, el valor máximo de actividad enzimática se alcanzó a las 18 h de fermentación; mientras que, con la variante 1 se alcanzó a las 72 h.
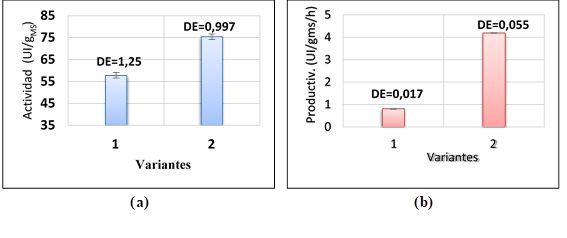
Notar que DE es la desviación estándar de la población
Figura 1 Comparación de las producciones y productividades en lipasas de Aspergillus niger (variante 1) y de Rhizopus homothallicus (variante 2), cultivados por fermentación en medio sólido.
En una compilación realizada por Alcala-Galiano y col., (2018), se reportan los valores de productividad de 13 hongos filamentosos productores de lipasas, donde este valor se encuentra en un intervalo de 0,034-3,08 UI/gMS/h lo cual confirma las potencialidades de este biocatalizador.
Ante esta evidencia, para los estudios posteriores, se decidió trabajar con el biocatalizador de Rhizopus homothallicus, obtenido por fermentación en medio sólido, empleando un medio químicamente definido.
3.2 Condiciones de reacción de la transesterificación de aceite de Jatropha curcas y etanol
3.2.1 Influencia del tamaño de partícula del biocatalizador
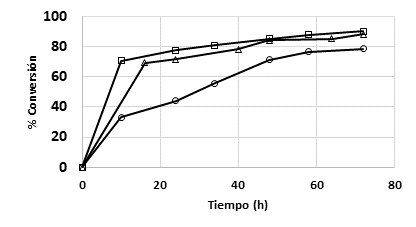
En la Figura 2 se presenta el efecto que tiene el tamaño de partícula del biocatalizador, en la reacción de transesterificación del aceite de Jatropha curcas y etanol.

Las condiciones estándares para estas reacciones fueron: relación molar 1:3, 40 °C, 200 rpm y una adición de biocatalizador de 0,5 g (5,5 % peso respecto a la masa de aceite). A las reacciones no se les adicionó solvente.
Figura 2 Dinámica de la conversión en la reacción de transesterificación del aceite de Jatropha curcas y etanol, empleando diferentes intervalos de tamaños de partícula del biocatalizador (0,149-0,297 (ο); 0,400-0,595 (□); 0,595-0,841 (∆); 0,841-2,000 (◊) mm).
En esta figura, se observa que, para los tamaños de partícula entre los intervalos de 2,000-0,841; 0,841-0,595 y 0,595-0,400 mm, los valores de conversión máximos son cercanos entre ellos (entre 68 % y 78 %) y se obtienen a las 72 h de reacción. Mientras que, para tamaños de 0,149-0,297 mm, que corresponde a un tamaño de partícula más pequeño, se alcanzan conversiones por encima del 95 % a las 34 h de reacción.
En el análisis de la diferencia mínima significativa, realizado al estudio del efecto del tamaño de partícula sobre el porciento de conversión del aceite de Jatropha curcas en biodiesel, se observan tres grupos homogéneos, siendo el intervalo de tamaños de partícula entre 0,149-0,297 mm, el que mostró la mejor conversión en la reacción de transesterificación (Tabla 1). Además, se comprobó la normalidad de los datos experimentales dando el valor de Chi-Cuadrado igual a 0,082, lo que indica que no se puede rechazar la idea de que los datos experimentales provienen de una distribución normal con un 95 % de confianza.
En efecto, el intervalo de menores tamaños de partícula evaluado en este trabajo, redujo la resistencia difusional dentro de los poros e intersticios del biocatalizador, lo que explicó por qué se obtuvieron resultados significativamente superiores. Resultados similares obtuvieron Chowdhury y col., (2017) demostrando que una disminución del tamaño de partícula del biocatalizador, reduce la longitud del camino de difusión y, por lo tanto, la resistencia interna a la transferencia de masa.
Tabla 1 Análisis de diferencia mínima significativa para el intervalo de tamaños de partícula (Tp) del biocatalizador, realizando la reacción de transesterificación
| Tamaño de partícula (mm) | Casos | Media LS | Sigma LS | Grupos Homogéneos |
|---|---|---|---|---|
| 0,149-0,297 | 6 | 86,70 | 2,16037 | XXX |
| 0,400-0,595 | 6 | 69,71 | 2,16037 | XX |
| 0,595-0,841 | 6 | 62,85 | 2,16037 | X |
| 0,841-2,000 | 6 | 59,99 | 2,16037 | X |
3.2.2 Influencia de la velocidad de agitación
En la Figura 3 se presenta el efecto que tiene la velocidad de agitación, en la reacción de transesterificación del aceite de J. curcas y etanol. En esta figura, se observa que, para velocidades de agitación de 200 y 250 rpm, los valores de conversión máximos son cercanos entre ellos (90 %) y se obtienen a las 72 h de reacción. Mientras que, para 350 rpm, se obtuvieron valores inferiores de conversión cercanas a los 80 % a las 72 h.
En el análisis de diferencia mínima significativa, realizado al estudio del efecto de la velocidad de agitación sobre el porcentaje de conversión del aceite de Jatropha curcas en biodiesel, se observan dos grupos homogéneos con diferencias significativas (Tabla 2).
Las condiciones estándares para estas reacciones fueron: relación molar 1:3, 40 °C y una adición de biocatalizador de 0,5 g (5,5 % peso respecto a la masa de aceite). A las reacciones no se les adicionó solvente
Figura 3 Dinámica de la conversión en la reacción de transesterificación del aceite de Jatropha curcas y etanol, empleando diferentes velocidades de agitación (200 (□); 250 (∆); 350 (ο) rpm).
Tabla 2 Análisis de diferencia mínima significativa para la velocidad de agitación (N) del sistema de reacción de transesterificación
| N (rpm) | Casos | Media LS | Sigma LS | Grupos Homogéneos |
|---|---|---|---|---|
| 200 | 8 | 73,9525 | 1,87093 | XX |
| 250 | 8 | 70,8162 | 1,87093 | XX |
| 350 | 8 | 64,68 | 1,87093 | X |
Los grupos que comparten las mismas columnas no tienen diferencias significativas entre ellos, como es el caso de 200 rpm y 250 rpm. En el experimento a 350 rpm, se observó la formación de conglomerados del sólido en el centro del matraz Erlenmeyer. Esto explica la disminución de la conversión, como consecuencia de la limitación en el contacto entre el sólido (el biocatalizador) y las fases líquidas inmiscibles (aceite y etanol).
Teniendo en cuenta el análisis anterior, se seleccionó 200 rpm como velocidad de agitación del sistema de reacción.
3.2.3 Influencia de la relación molar etanol/aceite de J. curcas
En la Figura 4 se observa que, para las relaciones molares 3:1 y 4:1 (etanol/aceite de Jatropha curcas), los valores máximos de conversión en biodiesel (cercanas al 80 %) que fueron obtenidos a las 48 h. Para la relación molar 6:1, los valores de conversión disminuyeron a 37 % (a las 48 h); debido posiblemente a una inhibición de la actividad enzimática en el biocatalizador, por el exceso de etanol, tal como ha sido reportado por otros autores (Amini y col., 2017), (Delgado y Pashova, 2010).

La reacción de transesterificación se llevó a cabo a 40 °C, 200 rpm y una adición de biocatalizador de 0,5 g (5,5 % peso respecto a la masa de aceite) con un intervalo de tamaños de partículas entre 0,149 y 0,297 mm. A las reacciones no se les adicionó solvente
Figura 4 Dinámica de la conversión de aceite de Jatropha curcas en biodiesel, a diferentes valores de relaciones molares de etanol/aceite: 3:1 ((), 4:1 (() y 6:1 (().
En el análisis de diferencia mínima significativa, realizado al estudio del efecto de la relación molar etanol/aceite sobre el porcentaje de conversión del aceite de Jatropha en biodiesel, se observan dos grupos homogéneos con diferencias significativas (Tabla 3). Los grupos que comparten las mismas columnas no tienen diferencias significativas entre ellos, como es el caso de 3:1 y 4:1.
Tabla 3 Análisis de diferencia mínima significativa para la relación molar etanol/aceite (Rm)
| Rm | Casos | Media | Grupos Homogéneos |
|---|---|---|---|
| 3:1 | 3 | 77,69 | XX |
| 4:1 | 3 | 77,69 | XX |
| 6:1 | 3 | 37,27 | X |
Dado que los perfiles en las dinámicas de conversiones de las reacciones de transesterificación fueron muy similares, empleando relaciones molares de 3:1 y 4:1, se seleccionó la relación 3:1 por economía del proceso de síntesis de biodiesel y para minimizar la inhibición enzimática por el etanol.
Se calculó, la productividad (g/kg/h) en función de la cantidad máxima de ésteres sintetizados por kilogramo de la mezcla reactiva obtenida en este trabajo y el tiempo de reacción en el cual se obtuvo (48 h). Este valor se comparó con diferentes publicaciones de años recientes (Fernandes y col., 2007; Liu y col., 2013; Liu y col., 2014; Zago y col., 2014; Todeschini y col., 2016; Galeano y col., 2017 y Aguieiras y col., 2019), como se muestra en la Figura 5.
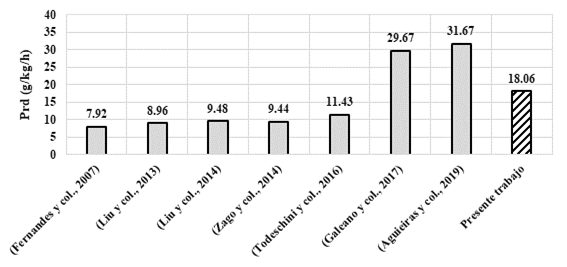
Figura 5 Comparación de productividades (Prd) reportadas del uso directo del sólido fermentado seco en la producción de biodiesel y la alcanzada por el presente trabajo
Se puede observar que la productividad obtenida en este trabajo se encuentra entre los tres valores más altos, lo que es muestra el potencial de este sólido para ser utilizado como biocatalizador en la producción industrial de biodiesel.
CONCLUSIONES
El sólido fermentado seco de Rhizopus homothallicus, con una actividad de lipasas (75,39 UI/g MS, en hidrólisis) fue seleccionado para este estudio, debido a su alta actividad y productividad de síntesis de lipasas (4,19 UI/g MS/h).
Los mejores resultados en los valores de conversión del aceite de Jatropha curcas (por encima del 95 %), fueron alcanzados empleando una velocidad de agitación de 200 rpm, un intervalo de tamaños de partícula del biocatalizador de 0,149-0,297 mm.
Se comprobó que para relación molar 3:1 y 4:1 no hay diferencias significativas en el porcentaje de conversión, obteniéndose valores de 77,69 %. Para la relación 6:1, se afecta la conversión debido a la inhibición de la enzima.
Se estima que el biocatalizador utilizado en las condiciones de reacción establecidas tiene potencialidades para ser usado en la síntesis industrial de biodiesel.















