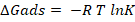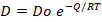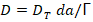INTRODUCCIÓN
Existen diversas fuentes de contaminación por plomo de aguas naturales, siendo la principal la descarga de efluentes industriales directamente a fuentes naturales sin ningún tratamiento previo. Este problema se debe tanto a los altos costos como a la baja eficiencia de muchos de los métodos empleados para la remoción de los metales pesados. En la actualidad se ha desarrollado una diversa gama de tecnologías que apuntan a ser soluciones de bajo costo y ambientalmente amigables empleando bioadsorbentes (Prieto y col., 2019), (Prieto y col., 2020). El presente trabajo tiene por objetivo evaluar la capacidad de biosorción, mediante un estudio cinético de material procedente de residuos de cedro tomando en consideración el tiempo de contacto entre el biosorbente y soluciones modelos de Pb2+.
MATERIALES Y MÉTODOS
2.1. Características de plomo
El plomo es un elemento representativo de número atómico 82 y símbolo Pb, cuya notación espectral es 6p². Su estado de oxidación más estable es 2+. Puede presentar el estado de oxidación 4+, el cual no es muy estable.
2.2. Contaminación con plomo
El plomo es un elemento muy contaminante con un índice de tecnofilidad de 150 solo superado por el cadmio. El vertimiento incontrolado del plomo, sin un adecuado tratamiento de las industrias sidero-mecánica, mineo-metalúrgicas y química, es una fuente de contaminación ambiental severa (ATSDR, 2005).
2.3. Características físicas y químicas del serrín de cedro
En el artículo de (Prieto y col., 2020), se realiza un estudio cinético de la adsorción de iones Níquel (II) en serrín de Cedro (Cedrela Odorata). En el mismo se exponen detalladamente las características físicas y químicas del serrín de cedro, que, por tratarse del mismo material, los autores creen pertinente remitir a la lectura del mismo para esta caracterización.
2.4. Estudio cinético
Se prepara una disolución acuosa de 226 mg/L del ion Ni2+. Se toman 200 mL y se le añaden 1 g de serrín de cedro. Posteriormente, se toman alícuotas de 2 mL en intervalos de 1, 2, 3, 4, 5 y 6 horas a las temperaturas de 298 y 333 y se determina la concentración de iones Pb2+ mediante Espectroscopía de absorción Atómica (EAA) en un equipo Pye Unicam SP 9. Se realizan tres réplicas por cada punto cinético obtenido. A ese conjunto de puntos se le determinan algunos parámetros estadísticos que describen las características de las curvas cinéticas como media, mediana, desviación estándar del gráfico inclusiva, asimetría gráfica inclusiva y la curtosis (Ostle, 1974).
2.5. Modelos cinéticos y difusivos empleados
Los modelos cinéticos y difusivos considerados son los modelos de orden cero (OC) seudoprimer orden (SPO), seudosegundo orden (SSO), Elovich (ME), difusión intrapartícula (DPL), difusión en los poros según Bangham (MB), difusión en la película líquida (DPL), Además, se determina la energía de activación del sistema heterogéneo, la variación de entropía y entalpía "aparente" del complejo activado de adsorción (Fu y Wang, 2011), (Taha et al., 2016), (Prieto y col., 2019), (Prieto y col., 2020).
RESULTADOS Y DISCUSIÓN
3.1 Resultados del estudio cinético
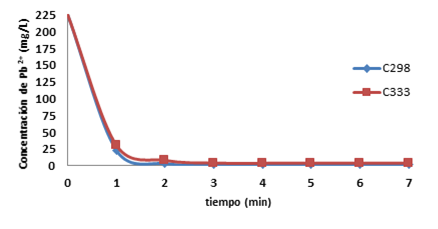
A continuación se muestra la Figura 1 donde se establece la dependencia de la concentración de iones Pb2+ (mg/L) vs. tiempo (min).
Se puede apreciar en el gráfico que las mejores condiciones para la adsorción son a 298 K y que disminuye a 333 K. A continuación en la Tabla 1 se expresan los coeficientes de determinación para los modelos cinéticos y difusivos empleados.
Tabla 1 Coeficientes de determinación de los modelos cinéticos empleados
| 298 | 0,584 | 0,998 | 0,975 | 0,845 | 0,683 | 0,953 | 0,885 | 0,988 |
| 333 | 0,720 | 0,995 | 0,975 | 0,884 | 0,811 | 0,939 | 0,848 | 0,981 |
Donde:
OC. Orden cero, SPO: Seudoprimer orden, SO: Seudosegundo orden, ME: Mecanismo de Elovich, DIP: Difusión intrapartícula, DPL: Difusión en la película de liquido, MB: Mecanismo de Bangham, De: Difusividad efectiva
Se aprecia que el modelo cinético que mejor se ajusta es el de seudoprimer orden. Esto se puede considera como si el ion Pb2+ interactuara con un punto del adsorbente. A partir de los valores de la constante "aparente" específica de velocidad de adsorción (kads) para las temperaturas de 298 y 333 K respectivamente: 2,0002 y 2,445 h-1 se puede establecer la dependencia ln kads vs 1/T y obtener el valor Ea = 5,07 kJ/mol. Este valor bajo de la energía de activación refleja un proceso de adsorción de naturaleza física. A partir de la Ecuación 1 es posible obtener la variación de entalpía y entropía de adsorción.
Donde:
K: constante de equilibrio (adimensional), ∆Hads: Variación de entalpía (J/mol), ∆Sads: Variación de entropía (J/(mol.K)), R: Constante universal de los gases (8,3144 J/(mol. K)), T: Temperatura (K).
Es preciso conocer la relación K= qe/Ce donde K es la constante de equilibrio, qe la capacidad de adsorción (mg/g) y Ce la concentración de equilibrio (mg/L) para cada temperatura, lo cual se muestra en la Tabla 2.
Tabla 2 Constantes de equilibrio a diferentes temperaturas
|
|
|
||
|---|---|---|---|
| 298 | 44,89 | 1,55 | 28,96 |
| 333 | 44,5 | 3,5 | 12,71 |
El empleo de la Ecuación 1 permite obtener los valores:
ΔHads = -19,40 kJ/mol, ΔSads = -0,04 kJ/(mol• K)
El proceso de adsorción trae aparejado una liberación de energía y a una disminución de la aleatoriedad del sistema adsorbente/adsorbato. Al establecer la relación 2 (Ecuación 2):
Donde:
R: Constante universal de los gases 8,314 J/(mol•K), T: Temperatura (K).
Se obtienen los valores mostrados en la Tabla 3 para la variación de energía libre de adsorción.
Tabla 3 Valores de ΔGads a diferentes temperaturas
|
|
|
|---|---|
| 298 | -8,34 |
| 333 | -7,04 |
A partir de los valores de variación de entalpía, entropía y energía libre de adsorción se puede afirmar que el proceso es posible a bajas temperaturas.
Otro aspecto a considerar es la determinación del coeficiente de difusión efectivo, como se muestra en la Tabla 4, muy vinculado a la morfología de grano del bioadsorbente.
Tabla 4 Coeficientes de difusión a las temperaturas de estudio
|
|
|
|---|---|
| 298 | 1,76•10-9 |
| 333 | 1,24 •10-9 |
Es apreciable como un aumento de temperatura provoca una disminución de la difusión en el grano. Lo anterior está relacionado con el aumento de la temperatura en el sistema heterogéneo que provoca dificultades en el traslado de los iones a través de la matriz sólida del adsorbente. La estructura del ion Pb2+ en solución acuosa es compleja, dado que el ion Pb2+ se hidroliza parcialmente, como por ejemplo en soluciones de perclorato se encuentran las especies Pb(OH)+ y [Pb2(OH)4]4+ (Cotton y Wilkinson, 1966).
A partir de la Ecuación 3 es posible obtener el factor pre-exponencial Do:
Donde:
D: Coeficiente de difusión efectivo (m2/s), Do: Factor pre-exponencial (m2/s), Q: Energía de activación del proceso de difusión (kJ/mol), R: 8,314 J/(mol•K), T: Temperatura (K),
Do= 2,1•10-9 m2/s Q= 0,0014 kJ/mol
Lo anterior permite afirmar que se invierte aproximadamente un 28 % de la energía de activación en el proceso difusivo. Conociendo que la tortuosidad es 1,76 es posible obtener la difusividad teórica o coeficiente de difusión teórico para cada temperatura a través de la Ecuación 4. Los resultados se muestran en la Tabla 5.
Donde:
DT: Coeficiente de difusión teórico (m2/s), da: densidad aparente por aprisionamiento (g/mL), Γ: Tortuosidad (adimensional).
Tabla 5 Coeficientes de difusión teóricos a las temperaturas de estudio
|
|
|
|---|---|
| 298 | 1,8•10-8 |
| 333 | 1,2•10-8 |
Se aprecia como la difusión teórica es mayor que la efectiva a las temperaturas de trabajo.
CONCLUSIONES
A partir de los valores de kads para las temperaturas de 298 y 333 K se puede establecer la dependencia ln kads vs 1/T y obtener el valor Ea = 5,07 kJ/mol, refrendando un proceso de naturaleza física.
El proceso de adsorción de iones Pb2+ presenta valores negativos de variación de entropía, entalpía y energía libre, lo que condiciona que el mismo pueda ocurrir a bajas temperaturas.
El proceso difusivo consume el 28% de la energía de activación del proceso.