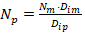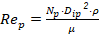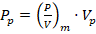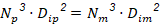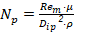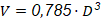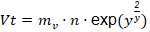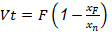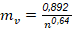INTRODUCCIÓN
La sacarosa es un disacárido formado por glucosa y fructosa, y a su vez el compuesto orgánico de mayor producción en forma pura, que por hidrólisis se descompone en estos monosacáridos para obtener como producto el azúcar invertido (Díaz y col., 2020).
La glucosa constituye un sustituto viable de la sacarosa, permitiendo su uso junto con una variedad de sustancias sólidas secas, sin que afecte otros parámetros importantes tales como el poder edulcorante, contenido de cenizas y acidez (Bueno, 2018). Esta ventaja le otorga un amplio mercado en la industria química, farmacéutica y alimentaria, constituyendo una fuente de materia prima fundamental para otras producciones.
En una instalación industrial, asociada a la industria de derivados de la caña de azúcar se obtiene glucosa y sirope rico en fructosa. Esta fábrica lleva a cabo el proceso productivo con una tecnología de origen cubano, donde se desarrolla la hidrólisis ácida de la sacarosa. Este método de inversión ha reportado elevados consumos de materia prima y bajos rendimientos en el producto final, unido con la generación de productos coloreados con presencia de cenizas y subproductos no deseados, y la aceleración de los procesos corrosivos (Cortés y col., 2020a). Estos inconvenientes, unidos con dificultades operacionales en las diferentes etapas del proceso, han provocado que los niveles productivos de glucosa anuales sean insuficientes para satisfacer la demanda actual de este producto como materia prima para la producción de sorbitol.
Estudios realizados sobre el empleo de la hidrólisis enzimática de la sacarosa demuestran un rendimiento del proceso superior al logrado por hidrolisis ácida (Gómez et al., 2017), además de otorgar una mayor estabilidad química y microbiológica de la glucosa obtenida.
La utilización de la enzima invertasa sumergida, a pesar de reportar resultados satisfactorios en cuanto a la operación de hidrólisis, presenta como principal desventaja económica que no es posible su recuperación por separación del sistema de reacción. Estudios demuestran elevados consumos de esta enzima con vistas a su utilización en procesos industriales (Cortés y col., 2020b).
A diferencia de las precipitaciones de enzimas solubles, la utilización de las enzimas inmovilizadas permite la reutilización continua del biocatalizador, además de presentar una mayor termoestabilidad, fácil separación de las mezclas de reacción y la posibilidad de emplear una alta actividad enzimática por volumen del reactor (Cortés y col., 2020a). Por lo que la implementación de una tecnología enzimática capaz de operar a elevadas temperaturas con una termoestabilidad que permita la reutilización del biocatalizador constituye una alternativa atractiva desde el punto de vista técnico-económico.
Estudios realizados sobre el empleo de la enzima invertasa inmovilizada para la hidrólisis de la sacarosa, demuestran que la β-fructosidasa de Thermotoga maritima (BfrA) expresada en Pichia pastoris e inmovilizada en alginato de calcio (PpABfrA), puede operar a valores de temperaturas comprendidos entre 50-70 ºC (Martínez et al., 2014a), lo que permite hidrolizar soluciones concentradas de sacarosa. La elevada termoactividad y termoestabilidad reportadas para este biocatalizador lo convierten en una alternativa novedosa y atractiva para su implementación a escala industrial.
La determinación de la influencia de las condiciones experimentales óptimas en el porcentaje de hidrólisis, constituye una base fundamental para el diseño tecnológico, donde la aplicación de la Metodología de Superficie de Respuesta (MSR) constituye una propuesta eficaz. Esta permite obtener los niveles óptimos en las variables de control que producen los valores de respuestas máximas (o mínimas) en ciertas regiones de interés, o buscar una solución de compromiso que mejore la calidad del producto o servicio (Acosta y col., 2021).
Atendiendo a ello, el objetivo del trabajo es determinar las condiciones operacionales para el escalado industrial de la hidrólisis enzimática de la sacarosa en una instalación productora de glucosa, a partir de las variables experimentales óptimas y los requerimientos de facilidades auxiliares.
MATERIALES Y MÉTODOS
2.1. Biocatalizador
El estudio se basa en el biocatizador PpABfrA que consiste en células inactivadas de Pichia pastoris, inmovilizadas en perlas de alginato de calcio, que expresan de forma recombinante la β-fructosidasa de Thermotoga maritima (BfrA) (Martínez et al., 2014b).
2.2. Biorreactores
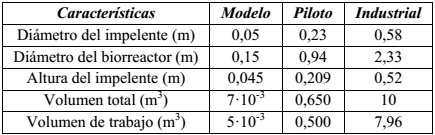
Como modelo para el estudio, se utilizó el reactor de 5 L y los resultados de hidrólisis determinados en él por Martínez et al., (2017). Para el análisis a escala piloto se concibió un reactor con un volumen de trabajo de 500 L. Las evaluaciones a escala industrial se realizaron para las capacidades instaladas y la disponibilidad de tres biorreactores de 10 m3 con un volumen de trabajo de 7,96 m3, para los cuales se determinaron los consumos asociados mediante balances de materiales y energía. La Tabla 1 muestra las características de cada uno de los biorreactores.
2.3. Modelación y optimización del comportamiento de las variables experimentales en el porcentaje de hidrólisis
La evaluación de las condiciones de operación, se basó en el análisis de los resultados obtenidos en el estudio del comportamiento cinético del biocatalizador PpABfrA en un reactor discontinuo tipo tanque agitado (Martínez et al., 2015).
Para la determinación del modelo estadístico que relaciona la influencia de la concentración inicial de sacarosa ( X 1 ) y el tiempo de reacción ( 𝑋 2 ) con la conversión alcanzada, se utilizó un Diseño Experimental Compuesto Central (DCC), desarrollado con el software Statgraphics Centurion XV.II para los dos factores experimentales (𝑘=2). Se consideró un rango de variación de 𝑋 1 entre 1,46 mol/l y 2,04 mol/l, lo que permite el estudio del comportamiento de la reacción para un tiempo que varía desde 6 h hasta 12 h (Martínez et al., 2017). Se generaron cinco puntos centrales en el cubo ( 𝑛 𝑜 ) y 2𝑘 puntos axiales para un total de N puntos en el diseño (Yaguas, 2017). Para 𝑁= 2 𝑘 + 2 𝑘 + 𝑛 𝑜 14 , se obtuvieron 13 puntos con una distancia rotacional (𝛼) igual a 1,41. Se comprobó el ajuste de los coeficientes del modelo cuadrático por análisis de regresión, se determinaron las coordenadas del punto de máximo porcentaje de hidrólisis dentro de la región experimental mediante la MSR y se analizaron los resultados para un valor de 𝑋 1 de 1,75 mol/l como restricción.
2.4. Propuesta de escalado de la reacción biocatalizada por PpABfrA
La similitud geométrica se garantizó para una relación diámetro del impelente ( 𝐷 𝑖 ) dividido diámetro del tanque (𝐷) igual a 0,3 y una relación de altura del impelente (ℎ)/ 𝐷 𝑖 de 0,9 dentro de los rangos establecidos por Kasatkin, (1985). Al mantener igual relación de alimentación (masa de biocatalizador (g) dividido volumen de reacción (ml)) se aseguró la similitud química para iguales valores de pH y temperatura. Garantizada las similitudes geométrica y química se analizaron la aplicación de cinco criterios de escalado sobre los parámetros operacionales. Para igual velocidad en la punta del impulsor (𝑁 𝐷 𝑖 ) m = (𝑁 𝐷 𝑖 ) p , los valores de los parámetros se calculan como:
Para igual potencia volumétrica / se calcula por la ecuación (2), mientras que el resto de los parámetros se determinan como sigue:
Al mantener igual velocidad del impulsor 𝑁 𝑚 = 𝑁 𝑝 , la 𝑃 𝑝 está dada por la ecuación (3) y el 𝑅𝑒 𝑝 se expresa como:
Al consumir igual potencia en la agitación 𝑃 𝑝 𝛼 𝑁 3 𝐷 𝑖 5 , el 𝑅𝑒 𝑝 se calcula por la ecuación (2) y se cumple que:
Para igual régimen de mezclado 𝑅𝑒 𝑝 = 𝑅𝑒 𝑚 , la 𝑃 𝑝 se determina por la ecuación (3) y la 𝑁 𝑝 se expresa como:
Donde: 𝑁 es la velocidad de agitación (rps); 𝑃 es la potencia (W); 𝑅𝑒 es el número de Reynolds de mezclado (adimensional); 𝐾 𝑁 es el número de potencia (adimensional); 𝜌 es la densidad (kg/m3); 𝜇 es la viscosidad (Pa.s) y los subíndices m y p se refieren a los biorreactores modelo y piloto respectivamente.
A partir de la evaluación preliminar de los criterios de escalados sobre los parámetros operacionales, se seleccionó el criterio más adecuado para la operación a escala industrial.
2.4.1. Cálculo de los requerimientos de transferencia de calor en la operación de hidrólisis a escala industrial
Para el diseño de la chaqueta para la circulación del medio de intercambio con régimen de flujo en mezcla perfecta, que permite mantener las condiciones isotérmicas en el reactor, se calculó el calor de reacción mediante el modelo de Kirchoff (Matos y Hing, 2014) a una temperatura constante de 60 ºC. Los calores estándares de formación (∆ 𝐻 𝑓 𝑜 ) y las capacidades caloríficas (𝐶𝑝) de las sustancias participantes, se determinaron mediante el software ChemDraw Ultra 8.0, a partir el principio de contribución de grupos de Joback (Pérez y col., 2022). Además, se tuvo en cuenta que la constante cinética para una concentración inicial de sacarosa de 1,75 mol/l es de 0,1463 h-1 (Martínez et al., 2015). La determinación de los coeficientes de transferencia de calor y el área requerida se realizaron por la metodología reportada para sistemas con estas características (Viera, 2007), (Espinosa y col., 2019).
2.5. Selección tecnológica y consumos auxiliares asociados a la preparación del sustrato y concentración del licor invertido
Encaminado a lograr la homogeneidad del medio de reacción requerida en la operación de hidrólisis a escala industrial, se concibió un sistema de disolución de 2,7 m3 efectivos para disolver la cantidad de sacarosa necesaria para la operación de cada biorreactor. Las características geométricas del tanque con un criterio de diseño de igual diámetro (𝐷) y altura del líquido (𝐻) se relacionan como:
De acuerdo a las propiedades del fluido se seleccionó un agitador de hélice con una relación 𝐷 𝑖 /𝐷 igual a 0,25, una relación ℎ/ 𝐷 𝑖 de 0,6, una velocidad de agitación y consumo de potencia calculados según las ecuaciones 8 y 3, respectivamente.
Para elevar la temperatura del sustrato desde 30 ºC hasta 60 ºC, se propuso un intercambiador de calor de tubos y coraza, que garantiza una elevada superficie de transferencia de calor (Espinosa y col., 2019). El flujo másico de solución alimentada (60ºBx) es de 3,86 kg/s, donde a su vez se hace pasar agua para completar la carga de los birreactores para una concentración requerida por el medio de reacción de 49,1ºBx (1,75 mol/l). La demanda de vapor de escape ( 𝑚 𝑣 ) como medio de calentamiento a 113 ºC y 156040,5 Pa, se calculó mediante el balance energético en esta operación (Núñez y col., 2020).
Además se determinó el consumo de requerimientos auxiliares para la concentración de la solución invertida desde 49,1ºBx ( 𝑥 𝐹 ) hasta 79,0ºBx ( 𝑥 𝑛 ). Este es el valor requerido para lograr la cristalización de la glucosa presente en la misma a una temperatura de aproximadamente 30 ºC (Gómez, 2015).
Para el consumo de vapor ( 𝑚 𝑣 ) según el número de efectos de evaporación (𝑛), se consideró la relación plantada por Ulrich (1990), teniendo en cuenta un rendimiento (𝑦) de 0,83 dada la elevación del punto de ebullición que origina la concentración de sólidos disueltos, expresada como:
Donde 𝑉𝑡 es la evaporación total definida como:
Con un flujo de alimentación (𝐹) de 2,356 kg/s establecido para llevar a cabo esta operación en un tiempo aproximado de 3 h, la 𝑉𝑡 es de 0,892 kg/s, a partir de la cual se estableció la siguiente relación:
El consumo de agua ( 𝑚 𝐻 2 𝑂 ) está directamente vinculado a la evaporación en el último vaso y al calor latente correspondiente, cuyo cálculo se fundamenta en el balance energético en el condensador (Núñez y col., 2020). En este caso se alimenta agua a 30 ºC con una capacidad calorífica (𝐶𝑝) de 4174 J/kg℃. Por requerimientos ambientales se estableció una temperatura de salida de la misma de 48 ºC. Para una presión establecida en el último vaso de 26 plg Hg (13513,73 Pa), el calor latente del vapor es de 2,37·106 J/kg.
RESULTADOS Y DISCUSIÓN
3.1. Modelación y optimización de la etapa de hidrólisis
Los valores experimentales de los factores 𝑋 1 , 𝑋 2 y el porcentaje de hidrólisis (𝑦) como respuesta evaluada, ajustados a un DCC se representan en la Tabla 2. A su vez se observa la matriz de diseño para la ampliación del diseño factorial 2 2 con cuatro puntos axiales y cinco puntos centrales.
El modelo matemático de segundo orden (cuadrático) obtenido para este diseño fue:
Tabla 2 DCC para las variables independientes y variable respuesta de la hidrólisis enzimática a pH 5,5, 60 ºC y agitación 100 rpm

De acuerdo a los valores promedio de los rendimientos observados (Ȳ) y estimados (Ŷ), se aprecia que el porcentaje de hidrólisis oscila entre 40,00 y 99,80 %, obteniéndose el mayor valor para una concentración de 1,16 mol/l en un tiempo de 9 h. Este comportamiento sugiere el efecto de curvatura para un adecuado ajuste y la existencia de un óptimo en la región de estudio.
En la evaluación estadística del grado de ajuste a los valores experimentales, el análisis de varianza indicó que el modelo ajustado es significativo para una 𝑝 de 0,021, donde 𝑋 1 2 no resultó ser significativo. La suma de cuadrados del error puro (0,10) resultó pequeña con respecto a la suma de cuadrados del total (4174,41), lo que indica una buena reproducibilidad en el punto central (Chirinosa y col., 2017).
Respecto al coeficiente de determinación ( 𝑅 2 ), el modelo ajustado explica el 98,65 % de la variabilidad de la respuesta. Además, existió una buena correlación entre los valores experimentales para una 𝑅 2 =0,9865 y los valores estimados para una 𝑅 2 𝑎𝑗𝑢𝑠𝑡𝑎𝑑𝑜 =0,9769. La relación entre ambos factores, se muestra en la Figura 1, donde se representa la superficie de respuesta estimada.
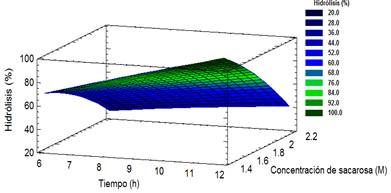
Figura 1 Superficie de respuesta para los efectos tiempo-concentración de sacarosa en el porciento de hidrólisis
La representación obtenida indica un comportamiento lineal del tiempo con pendiente positiva, mientras que la concentración de sacarosa presenta un efecto de curvatura.
De acuerdo a las operaciones posteriores del proceso, donde es necesario lograr una solución sobresaturada para la cristalización, es conveniente trabajar con soluciones de mayor concentración, donde se alcancen porcentajes considerables de inversión en igual período de tiempo. Para ello se optimizó con 1,75 mol/l como restricción, alcanzándose un 85,60 % de inversión en un tiempo de 12 h. Este valor constituye el tiempo óptimo de reacción donde se corrobora un 90 % de inversión alcanzado experimentalmente (Martínez et al., 2017) para iguales valores de 𝑋 1 y 𝑋 2 . El efecto creciente de la respuesta con el tiempo se ha evidenciado en estudios experimentales de la reacción de hidrólisis catalizada para diferentes concentraciones de sacarosa (Martínez et al., 2015).
3.2. Escalado de la reacción biocatalizada por PpABfrA
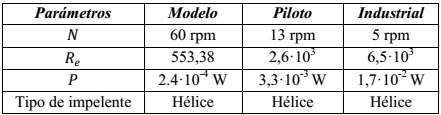
Las operaciones en un sistema discontinuo de reacción permiten establecer un control estricto sobre las variables operacionales (Ceballos y col., 2016), y por otro lado, el sistema agitado para un tiempo de reacción que supera las 6 h asegura la debida interacción enzima sustrato (Martínez et al., 2014b). La selección de uno u otro criterio de escalado para un volumen piloto de 500 l, está sujeto al análisis de las consecuencias de adoptar cada uno de ellos en el sistema de reacción. La determinación de las consecuencias se realizó a través del cálculo teórico de cada uno de los parámetros como se relaciona en las ecuaciones (1, 2, 3, 4, 5, 6, 7 y 8) para una 𝜌= 1 283,85 𝑘𝑔/ 𝑚 3 y 𝜇=0,0058 𝑃𝑎.𝑠. Estos resultados se muestran en la Tabla 3, donde las celdas destacadas indican los valores de los parámetros que se mantuvieron contantes en ambos biorreactores, al considerar cada uno de los criterios de escalados que se representan en la primera columna.
Al analizar los valores obtenidos, se evidencia un comportamiento similar al del escalado de las condiciones experimentales al reactor modelo (Martínez et al., 2017). Si se mantiene como criterio de escalado igual velocidad en la punta del impulsor, el número de Reynolds de mezclado se incrementa 4,6 veces, proporcionalmente al aumento del diámetro del agitador. Al mismo tiempo, disminuye la velocidad de agitación, asegurando un régimen de mezclado, que al igual que el ensayado inicialmente, sea capaz de garantizar la homogeneidad y difusión de la sacarosa como parte de los mecanismos de transferencia de masa. Este criterio a su vez reportó resultados satisfactorios en el escalado de la reacción de biosíntesis de fructooligosacáridos a partir de la sacarosa, catalizada por un biocatalizador conformado por células recombinantes vivas de Pichia pastoris inmovilizadas en alginato de calcio (Pérez y col., 2011). Teniendo en cuenta estos fundamentos, con la aplicación de este criterio se han de lograr resultados satisfactorios en la operación del reactor piloto.
La aplicación de otros criterios de escalado se descartó por el aumento considerable del consumo de potencia al mantener constante la velocidad de agitación o la potencia volumétrica, y una disminución de la turbulencia del medio al aplicar los criterios de igual potencia o igual número de Reynolds de mezclado.
A partir de este análisis, se propuso el sistema de inversión enzimática a escala industrial, manteniendo los criterios de similitud geométrica, química y velocidad en la punta del agitador constante. Como consecuencia de asumir este criterio, la velocidad de agitación reportó una valor de 5 rpm, disminución que se fundamenta en el aumento del régimen de turbulencia en el medio y por otro lado, un consumo de potencia 5,2 veces superior al del reactor piloto. Los parámetros operacionales del reactor modelo, piloto e industrial se muestran en la Tabla 4.
3.2.1. Requerimientos de transferencia de calor en la operación de hidrólisis
La entalpía de hidrólisis a una temperatura de trabajo de 60 ºC arrojó un valor de 108,65 kJ/mol para una variación de la capacidad calorífica de 107,65 kJ/mol. Este resultado muestra que la reacción se desarrolla sin efectos energéticos apreciables, pero con un comportamiento ligeramente endotérmico, que ocasiona el descenso de la temperatura.
En la Tabla 5 se muestran los resultados de la determinación de la demanda de transferencia de calor. Dado el comportamiento de primer orden que presenta la reacción de hidrólisis, con constante cinética de 0,1463 h-1 (Martínez et al., 2015), la conversión teórica alcanzada para las 12 h de reacción es de 0,83. Para el intercambio energético necesario, se calculó un área de transferencia de 16 m2 inferior a 17 m2 de superficie lateral que presentan los biorreactores.
Tabla 5 Resultados de la determinación de los requerimientos de transferencia de calor en la hidrólisis enzimática de la sacarosa
| Coeficiente pelicular de transferencia de calor (J/s m2 ºC) | 75,32 |
| Coeficiente pelicular de transferencia de calor referido al diámetro exterior (J/s m2 ºC) | 73,81 |
| Coeficiente total de transferencia de calor limpio (J/s m2 ºC) | 37,28 |
| Coeficiente total de transferencia de calor sucio (J/s m2 ºC) | 36,80 |
| Área de transferencia de calor (m2) | 16 |
| Calor intercambiado (J/s) | 9213 |
| Temperatura de entrada del medio (ºC) | 78 |
| Temperatura de salida del medio (ºC) | 75,65 |
3.3. Consumos asociados a la operación en los biorreactores y a las tecnologías auxiliares de la preparación de sustrato y concentración del licor invertido
Un tanque agitado con 𝑉 𝑡 de 2,7 m3, un 𝐷 de 1,5 m según la ecuación (9) y agitador de hélice de 0,375 m de 𝐷 𝑖 , garantiza la obtención de una solución concentrada de sacarosa (60 ºBx). Establecido un régimen turbulento de mezclado ( 𝑅 𝑒 ) de 8·104, la velocidad de agitación requerida según la ecuación (8) es de 900 rpm, con un consumo de potencia dado por la ecuación (3) de 9,67 kW para un 𝐾 𝑁 correspondiente de 0,3.
Se seleccionó un doble efecto de evaporación teniendo en cuenta que a mayor número de efectos, mayor es la cantidad de evaporación por kilogramos de vapor de calentamiento admitido en el primer vaso (Kern, 2005), lo que indica menor consumo de vapor y de agua alimentada al condensador y, por tanto, menores costos operacionales. Esto se balancea, sin embargo, por el aumento en el costo inicial de los equipos y los cargos asociados al mantenimiento y limpieza. Este un proceso discontinuo donde los cargos fijos no justifican un número mayor de efectos. Según las relaciones representadas en las ecuaciones (10) - (12) se determinó un consumo de vapor de 0,57 kg/s.
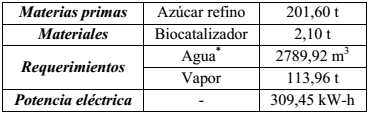
Para un número total de 16 inversiones de reúso del biocatalizador sin pérdida apreciable de actividad (Menéndez et al., 2014) y estableciendo continuidad en el proceso de carga de los biorreactores (Albernas y col., 2010) una vez culminada las 12 h de inversión, para un tiempo de llenado de cada uno de 1 hora y 15 minutos, se estimó un tiempo de reúso del biocatalizador de 11 días. En la Tabla 6 se muestran los consumos asociados a esta etapa del proceso.
CONCLUSIONES
La aplicación de la MSR a los datos experimentales considerados, demostró el efecto creciente del porciento de hidrólisis al aumentar el tiempo de reacción, alcanzando a las 12 h y concentración de 1,75 mol/l un 85,6 % de inversión en correspondencia con los rendimientos experimentales que se registran.
Mantener como criterio de escalado la velocidad en la punta del impulsor constante, ofrece parámetros operacionales satisfactorios para el desarrollo de la reacción biocatalítica.
Los parámetros operacionales determinados a escala industrial para la operación de hidrólisis enzimática y las tecnologías asociadas a la preparación del sustrato y concentración del licor invertido, aseguran el incremento del rendimiento y calidad de la glucosa obtenida, con menores impactos ambientales por la sustitución de sustancias agresivas; lográndose la hidrólisis de 201,6 t de azúcar refino con 2,10 t de biocatalizador en un período de 11 días.