INTRODUCCIÓN
La biomasa de proteína unicelular (SPC por sus siglas en inglés) es un producto biodisponible que se obtiene utilizando principalmente como medio de cultivo diversos sustratos de bajo costo, como desechos agrícolas o industriales. Constituye una fuente de nutrientes valiosos para la alimentación animal (Jach y col., 2022). En este sentido, se destaca la producción de levadura Torula (C. utilis), lo cual resulta de gran importancia para Cuba por ser un producto de alto contenido proteico empleado en la elaboración de alimento animal (García y col., 2014). El empleo de este producto permite disponer de fuentes proteicas nacionales y la sustitución de importaciones de productos similares de altos precios en el mercado.
En el proceso de producción de levadura Torula las sales aportadoras de nitrógeno (sulfato y fosfato de amonio) representan el 60 % aproximadamente del costo de producción. Se reportan diferentes estudios (García y col., 2014; Pérez y col., 2016) donde se evalúa la sustitución de las sales aportadoras de nitrógeno por variantes más económicas (urea y mezclas de urea con sales del esquema tradicional).
Según lo reportado por Shen y colaboradores (Shen y col., 2018) así como Linder (2019), la levadura C.utilis presenta una gran versatilidad ya que posee actividad ureasa, lo cual abre el espectro con respecto a la utilización de fuentes nitrogenadas de fácil asequibilidad por su precio y disponibilidad a nivel industrial. En este sentido, la asimilación del nitrato de amonio como fuente de nitrógeno en la propagación de C.utilis, ha sido abordada por diversos autores (Munawar y col., 2010; Giavasis y Petroto, 2016; Gamarra, 2016; Buerth y col., 2016; Lapeña y col., 2020) empleando como medios residuales de extracto de frutas e hidrolizados, etc., destacándose que esta fuente de nitrógeno no afecta a la levadura.
A partir de lo referido anteriormente, se plantea como objetivo de este trabajo: evaluar el nitrato de amonio de producción nacional como fuente de nitrógeno en el crecimiento de C. utilis en medios miel final y vinazas a escala de laboratorio.
MATERIALES Y MÉTODOS
Fuentes de carbono y sales nutrientes
Como fuentes aportadoras de carbono y energía, se emplearon: miel final y vinazas de destilería. Ambas materias primas fueron conservadas a 4 ºC. Para el balance de los medios se determinaron para la miel final los azúcares reductores totales (ART) y para la vinaza la demanda química de oxígeno (DQO), así como el pH para ambas fuentes de carbono (Pérez y col., 2016).
Microorganismos
La cepa utilizada en todos los estudios fue C. utilis NRRL Y-1084, perteneciente al banco de cepas del Grupo de Enzimas del Centro de Ingeniería Genética y Biotecnología (CIGB), y mantenida a -80 °C en tubos de crio conservación en medio YPG (extracto de levadura 10 g/L; peptona 20 g/L; glucosa 20 g/L) más glicerol a 20 %.
Crecimiento a nivel de laboratorio
Inóculos
Para la preparación de los inóculos, la biomasa obtenida a partir de un criotubo con medio YPG y glicerol se inocula en 10 mL de medio YPG fresco durante 8 horas. Luego se transfiere a matraces invaginados de 500 mL de capacidad nominal con 120 mL del medio de propagación miel final - sales, esterilizado a 121 ºC durante 20 minutos. Este medio fue formulado con un contenido de ART aportados por miel final de 26 g/L, 0,72 g/L de (NH4)2HPO4 y 3,47 g/L de (NH4)2SO4 en grado reactivo, ajustando el pH a 4,5 con solución de hidróxido de sodio (NaOH) 1 M y ácido sulfúrico (H2SO4) 1 N. Los cultivos fueron crecidos en zaranda termostatada GFL® 3033 con agitación rotatoria de 180 rpm a 32 °C hasta alcanzar la fase de crecimiento exponencial (16 horas) (Pérez y col., 2016).
Crecimiento en medios miel final-sales y vinazas-sales
Los cultivos de la etapa de propagación previa se inoculan en matraces invaginados de 250 mL, los cuales contenían 25 mL de los medios a estudiar, manteniendo una razón de 10 % (v/v) para un ajuste en la concentración inicial en aproximadamente 60 × 106 células/mL.
Se formularon tres variantes de medios de cultivo para cada sustrato evaluado. Los medios con sulfato de amonio ((NH4)2SO4), M1(miel) y V1 (vinazas), se consideran los medios de referencia (esquema de producción tradicional).
Debido a que el nitrato de amonio ((NH4)NO3) que se utiliza en la industria es grado fertilizante, se realizó la determinación analítica de su contenido de nitrógeno (Pérez y col., 2016). Se obtuvo que el nitrógeno presente era del 21 %, por debajo del valor reportado por el fabricante (34 %). Por esta razón, se decidió formular un medio considerando el aporte teórico de 34 % (M2 y V2) y otro con 21 % de nitrógeno (M3 y V3).
En todos los casos el fósforo se suministró vía fosfato de amonio ((NH4)2HPO4) grado reactivo para un requerimiento de 3,5 % cuantificado como pentóxido de difósforo (P2O5) en biomasa. El balance de nitrógeno se realizó según aporte de sales (NH4)2SO4 o (NH4)NO3, manteniendo para cada sal un aporte requerido para el 8 % de nitrógeno en biomasa. Fue considerado para este balance el contenido de nitrógeno procedente del (NH4)2HPO4. Una vez formulados y ajustados los medios a pH 4,5 se incubó bajo las mismas condiciones descritas para la propagación.
Para el medio miel-sales se cuantificó la biomasa obtenida mediante determinaciones de la materia seca gravimétrica (MSG), así como el pH y ART a las horas 0 y 24 de crecimiento (Pérez y col., 2016).
Para el medio vinazas-sales, para obtener una concentración de biomasa de 10 g/L y un rendimiento esperado de 0,20, es necesaria una DQO de 50 g/L. En este caso a partir del valor inicial de DQO de la vinaza empleada (39 g/L con una variación de ± 2 g/L), la biomasa esperada en esta variante deberá estar alrededor de 6,5g/L. Se cuantificó la biomasa obtenida mediante determinaciones de MSG y el pH a las horas 0, 16 y 24.
Determinación de indicadores técnicos
El índice de consumo de nitrato de amonio se determinó considerando el balance de nitrógeno realizado para el medio y la concentración de biomasa deseada (10 g/L). Se calcularon los siguientes indicadores técnicos del proceso de producción:
Ganancia neta de biomasa (GB):
Porcentaje de remoción de DQO:
Rendimiento biomasa - sustrato (Y(X/S)):
Análisis microbiológico
Se calculó para cada medio el número total de células expresado en millones de levaduras por mL de caldo fermentado, así como el porcentaje de gemación y viabilidad. El estudio se llevó a cabo a nivel de zaranda con agitación rotatoria de 180 rpm a 30 °C y, se detuvo a las 24 horas. Se tomaron muestras al comienzo (H-0) y a la hora final (H-24) de la fermentación para los análisis de conteo celular. Para corroborar el conteo celular y la viabilidad del cultivo se realizó la siembra superficial en placas Petri medio diferencial Wallerstain Nutrient Agar (WLN).
Análisis estadístico
Para el procesamiento de los datos se empleó el software Statgrahics Centurion XVII utilizando un análisis de ANOVA simple. Las diferencias significativas entre las medias se determinaron mediante la prueba de múltiple rangos LSD de Fisher con un nivel de significación del 5 %. Cada condición experimental se realizó por triplicado y los resultados se presentan como los valores medios ( desviación estándar.
Análisis económico
Se realizó un análisis técnico-económico preliminar y se realiza un análisis comparativo a partir de la ficha de costo de producción de levadura Torula para la tecnología convencional. Las materias primas bajo estudio, se sustentan en índices de consumo previamente establecidos en las fichas de costo elaboradas por el Grupo empresarial AZCUBA en el 2022.
RESULTADOS Y DISCUSIÓN
Crecimiento en medio miel final-sales
En la tabla 1 se muestran los valores medios obtenidos de ganancia neta en biomasa, el rendimiento calculado en base al consumo de ART y el pH final, para cada uno de los medios evaluados en estas corridas experimentales.
Tabla 1 Principales indicadores de crecimiento evaluados en medio miel- sales
| Medio | Indicadores evaluados | |
|---|---|---|
| Ganancia neta de biomasa (g/L)* | Y (x/s) | |
| M1 | 4,50 ± 0,10 | 0,15 ± 0,36 |
| M2 | 5,90 ± 0,46 | 0,22 ± 1,98 |
| M3 | 7,22 ± 0,24 | 0,25 ± 0,64 |
*existen diferencias estadísticamente significativas
En el medio de referencia M1 que emplea sulfato de amonio, el valor de biomasa obtenido (4,50 g/L) es inferior a los obtenidos en los medios M2 y M3 que sustituyen esta fuente por nitrato de amonio (5,90 y 7,22 g/L respectivamente). Los valores de ganancia de biomasa obtenidos para el medio M3 (7,22 g/L) en comparación con M2 (5,90 g/L) demuestran el déficit de nitrógeno en esta última formulación, de ahí la importancia de realizar el análisis de comprobación del contenido de nitrógeno presente en la sal antes de realizar el balance de los medios, para lograr la correcta suplementación al medio.
En todos los medios evaluados la ganancia de biomasa obtenida fue inferior a lo esperado (10 g/L) (Pérez y col., 2016), igualmente estos resultados son inferiores a lo referido por Giavasis y Petroto, (2016) donde se obtuvo que para Candida utilis en condiciones óptimas de temperatura, pH y aireación, una concentración de biomasa máxima de 14,6 g/L; estas diferencias pueden relacionarse con una propagación limitada de oxígeno y por no tener la posibilidad de controlar el pH, típico de los procesos aerobios cuando se desarrollan a escala de zaranda. En el caso del rendimiento biomasa-sustrato, para los medios M2 y M3 se alcanzaron valores superiores a lo esperado (0,20) (Pérez y col., 2016). El análisis de varianza realizado arrojó que existen diferencias significativas entre las medias de la ganancia neta de biomasa en las tres variantes evaluadas, el valor-P fue de 0,0001, con un nivel de confianza de 95 %.
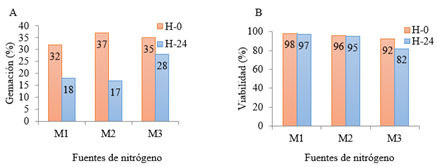
En la figura 1 se presenta el comportamiento de la gemación y viabilidad de C. utilis.
El porcentaje de gemación (Figura 1 A) a las horas iniciales supera ligeramente el valor a la hora 24, mostrando un crecimiento típico para levaduras. El mejor comportamiento se observó en la variante M3 que mantiene el 88 % del valor inicial después de 24 h. Los valores reportados de la viabilidad (Figura 2 B) confirman que el crecimiento de C. utilis cuando se emplea nitrato de amonio es similar al esquema tradicional, lo que indica que puede emplearse sin que se afecte los requerimientos metabólicos de la levadura, resultado que coincide con lo referido por Munawar y col., (2010) en su investigación.
Crecimiento en medio vinaza-sales
En la tabla 2 se muestran los valores medios obtenidos de ganancia neta en biomasa, rendimiento biomasa sustrato, porcentaje de remoción de DQO y pH final para cada una de las corridas experimentales realizadas.
Tabla 2 Principales indicadores de crecimiento evaluados en medio vinaza - sales
| Medio | Indicadores evaluados | |||
|---|---|---|---|---|
| Ganancia neta de biomasa (g/L) | Y (x/s) | % Remoción de DQO | ||
| 16 h* | 24 h* | |||
| V1 | 2,42 ± 0,11 | 4,05 ± 0,59 | 35,95 ± 1,74 | 28,92 ± 1,40 |
| V2 | 2,48 ± 0,25 | 4,45 ± 0,40 | 39,80 ± 8,86 | 29,21 ± 6,36 |
| V3 | 3,07 ± 0,11 | 4,12 ± 0,67 | 31,17 ± 7,48 | 34,39 ± 7,02 |
*existen diferencias estadísticamente significativas
Los valores de remoción de DQO obtenidos fueron inferiores al 50 %, lo que coincide con lo reportado por Pérez y col., (2016). Siendo más favorables en los medios que se formularon con un déficit de nitrógeno (V3) según el aporte real del nitrato de amonio empleado en este estudio.
El análisis de varianza realizado no arrojó diferencias significativas entre las medias de la ganancia neta de biomasa al comparar las tres variantes evaluadas en cada una de las horas experimentales. Sin embargo, se detectaron diferencias significativas entre las medias obtenidas para la hora experimental 16 y 24 con un valor-P de 0,0011, con un nivel de confianza de 95 %. Resultados que fueron corroborados mediante la prueba de múltiples rangos y el procedimiento de diferencia mínima significativa (LSD) de Fisher.
La biomasa alcanzada en todas las variantes fue inferior a lo esperado (6,5 g/L). Se ha reportado (García y col., 2014; Pérez y col., 2016) que, en algunas especies de levadura, para una efectiva utilización de esta fuente de nitrógeno orgánica pudiera requerirse la presencia de biotina u otros factores de crecimiento que están presentes en la miel, en la tecnología a partir de vinazas esta suplementación se realiza con el estimulador de crecimiento QZ-350, el cual no fue empleado en el estudio.
En la figura 2 se presenta el comportamiento de la gemación y viabilidad.
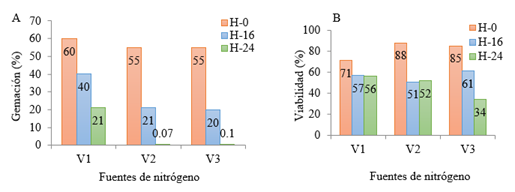
Figura 2 Determinación del porciento de gemación (A) y viabilidad (B) de C. utilis en medios vinaza-sales
Las tres variantes se comportaron de manera similar, por lo que, el nitrato de amonio como fuente de nitrógeno para la producción de levadura Torula en medio vinaza-sales puede ser empleada. Es necesario destacar que el parámetro viabilidad disminuye alrededor de un 25-40 ( para los medios formulados con nitrato de amonio y fosfato de amonio con respecto a los medios formulados con miel final, lo que puede relacionarse a las características de las vinazas como fuente de carbono, ya que es pobre en los nutrientes necesarios para el crecimiento óptimo de la levadura (Pérez y col., 2016).
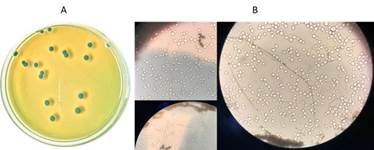
En la (Figura 3A) se muestra la morfología de colonias en medio sólido y las células levaduriformes en el caldo fermentado (Figura 3B). En ambos casos, tanto en el control positivo como para las fuentes alternativas se observó un cultivo de C. utilis homogéneo. La morfología celular de C. utilis empleando como fuente de carbono miel o vinazas, no sufre modificaciones cuando se somete a fuentes de nitrógeno alternativas.
Comportamiento del pH
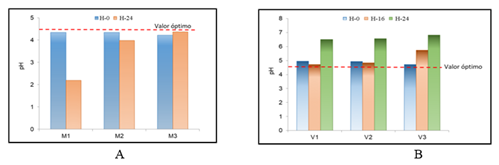
En relación al pH, el valor όptimo para este tipo de proceso es 4,5 (Pérez y col., 2016). En la Figura 4 se muestran los valores promedios de pH al inicio y al final de cada variante estudiada (A: medio miel- sales y B: medio vinaza - sales).
En la Figura 4 se observa la tendencia al incremento del pH en la hora final (24 h) de los medios formulados con nitrato de amonio, comportamiento que se debe a la formación de iones amonio (Munawar y col., 2010; Gamarra, 2016; Buerth y col., 2016; Linder, 2019; Lapeña y col., 2020) debido a la reacción de deaminación, donde el átomo de nitrógeno es separado del enlace de carbono predominantemente en forma de amoníaco (NH3). En el caso de los medios formulados con sulfato en miel, la tendencia fue a la disminución de este parámetro, comportamiento similar a lo reportado para este sistema (Pérez y col., 2016).
En el caso del medio vinaza, tanto para sulfato de amonio y como para nitrato de amonio, se evidencia un incremento del pH con respecto al valor όptimo, lo se debe a que la levadura asimila como fuente de carbono los ácidos orgánicos presentes en la misma (Pérez y col., 2016).
Análisis económico preliminar
En la tabla 4 se presenta el costo de las materias para el proceso de producción de levadura en medio miel final. Se determinó un índice de consumo de nitrato de amonio de 0,2091 t/t de levadura producida.
Tabla 4 Gastos materiales para 1 t de levadura
| Insumos | Sulfato de amonio | Nitrato de amonio | |||
|---|---|---|---|---|---|
| Índice de consumo (t/t) | Costo (CUP) | Índice de consumo (t/t) | Costo (CUP) | ||
| Miel final | 0,9180 | 1 321,92 | 0,918 | 1 321,92 | |
| Fuente de nitrógeno | 0,3500 | 2 410,88 | 0,2091 | 1 526,99 | |
| Fosfato diamónico | 0,0190 | 216,85 | 0,0190 | 216,85 | |
| Urea | 0,0070 | 45,64 | 0,0070 | 45,64 | |
| Antiespumante | 0,0027 | 172,22 | 0,0027 | 172,22 | |
| Ácido nítrico | 0,0001 | 0,93 | 0,0001 | 0,93 | |
| Sosa cáustica | 0,0020 | 4,16 | 0,0020 | 4,16 | |
| Costo (CUP/t) | 4 172,60 | 3 288,71 | |||
Se obtuvo que la sustitución del sulfato de amonio por nitrato amonio de producción nacional de menor costo, posibilita una disminución en el costo de las materias primas por tonelada de levadura producida de 883,89 CUP (21,18 (). En cuanto a los costos de producción totales cuando se emplea el sulfato de amonio tienen un valor de 6 879,42 CUP/t, disminuyendo cuando se sustituye por el nitrato de amonio a 5 823,31 CUP/t (15,35 (), lo que representa ahorro anual de 2 534 654 CUP.
CONCLUSIONES
El empleo de nitrato de amonio como fuente de nitrógeno en los medios evaluados no provoca cambios en la propagación de la cepa C. utilis.
Se observó que C.utilis responde favorablemente desde el punto de vista fisiológico en presencia de nitrato de amonio con valores de ganancia neta de biomasa en medio miel (M2 y M3) de 5,90 ± 0,46 y 7,22 ± 0,24 g/L y en medio vinaza (V2 y V3) de 4,45 ± 0,40 y 4,12 ± 0,67 g/L respectivamente.
La sustitución del sulfato de amonio por nitrato de amonio como fuente de nitrógeno representa un ahorro en los costos de producción de 2 534 654 CUP/año.