Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.26 no.1 Santiago de Cuba jan.-abr. 2014
ARTICULOS
Caracterización físico-química y contenido de proteínas de extractos fluidos del ostión de mangle (Crassostrearizophorae)
Physical-Chemistry Characterization and Protein Content of Fluids Extracts of the Mangrove Oyster (Crassostrea rizophorae)
Ing. Yanira G. Vázquez-Jorge, Dra. Leticia Guerra-Molina, Ing. Jabiel F. Quintana-Tamayo, MSc. J. Ramírez-Arzuaga, Lic. Rafael Fernando-Ballestero, Dra. Yahumara Vázquez- Jorge
Centro de Estudios de Química Aplicada, Universidad de Granma, cubajavier@grm.cubalub.cupet.cu; jramireza@udg.co.cu
RESUMEN
Algunos moluscos marinos, comoel ostión de mangle (Crassostrearizophorae), constituyen reservorios de moléculas con propiedades terapéuticas. En el presente trabajo se caracterizaron extractos fluidos de la masa del ostión de mangle que poseen actividad antimicrobiana. Los extractos se obtuvieron por dos métodos diferentes: a partir de la masa en estado natural y deshidratada. La zona de captura también constituyó una variable experimental. Para la caracterización de los extractos se determinó la densidad relativa, el contenido de sólidos totales, pH, índice de refracción y la concentración de proteínas totales. Se emplearon pruebas cualitativas para la identificación de aminoácidos, péptidos y proteínas. La zona de captura no incidió en las propiedades físico-químicas de los extractos, a diferencia del método de obtención empleado que sí influyó significativamente en ellas. Se demostró la presencia de péptidos, polipéptidos y proteínas; al parecer, los aminoácidos fenilalanina, arginina y lisina son los que aparecen en mayor proporción.
Palabras clave: Crassostrea rizophorae, péptidos antimicrobianos, extractos fluidos.
ABSTRACT
Some marine mollusks such as the mangrove oyster(Crassostrea rizophorae) constitutereservoirs of molecules with therapeutic properties. Fluids extracts from the mass of the mangrove oyster showingantimicrobial activity are characterized in the present work. The extracts were obtained by two different methods: from the mass in its natural state, and dehydrated. The capture zone also constituted an experimental variable. For the extracts characterization therelative density, the total solids content, pH, refraction index and total proteinsconcentrations were determined: Qualitative tests were used for identifying amino acids, peptide and proteins.The capture zone did not have any bearing on the physical-chemistry properties of the extracts, unlike the obtainment method which exerted a significant influence. The presence of peptide, polypeptide and proteins was demonstrated; it seemed that the amino acids phenylalanine, arginine and lysine are those appearing in a higher proportion.
Keywords: Crassostrea rizophorae, antimicrobial peptides, fluid extracts.
INTRODUCCIÓN
El surgimiento de nuevas enfermedades causadas por microorganismos patógenos y la aparición de cepas resistentes a los antibióticos convencionales obligan a la búsqueda incesante de sustancias con actividad antimicrobiana. En este sentido, la obtención de metabolitos a partir de plantas o animales es una línea de investigación importante, pues éstos constituyen verdaderas fábricas vivas de compuestos químicos con actividad biológica.
La diversidad de especies de moluscos, figura entre las más altas de todos los animales. Crassostrea rizophorae, es una de estas especies, conocida en Cuba por el nombre de ostión de mangle1, 2. Este invertebrado marino ha estado muy estrechamente ligado al hombre, el cual lo ha utilizado como alimento y medicina3, 4.
Estudios realizados en animales de la misma especie, han demostrado que estos organismos constituyen un reservorio natural de moléculas con propiedades terapéuticas5. Péptidos con efectos antimicrobianos se han aislado de diversas especies marinas5, 6. Estas moléculas presentan una amplia actividad biológica, exhibiendo propiedades antibacterianas, antiparasitarias, antifúngicas y antivirales6.
El ostión de mangle, es una especie que habita en aguas pobladas de bacterias patógenas. Sin embargo, estas no lo afectan de manera significativa; lo que pudiera estar relacionado con la presencia de sustancias o metabolitos, que contribuyan a su inmunidad innata.
La obtención de extractos fluidos a partir de la masa del ostión es una etapa decisiva para el estudio de su actividad biológica. El diseño de métodos de extracción que posibiliten obtener de manera eficaz la mayor cantidad de metabolitos, es una garantía para el éxito de la investigación.
Una vez demostrada la actividad biológica de estos extractos, resulta imprescindible caracterizarlos mediante la determinación de sus principales propiedades químico-físicas, así como conocer los principales compuestos y familias de compuestos químicos presentes en dichos extractos, presumiblemente responsables de su actividad biológica.
MATERIALES Y MÉTODOS
Obtención de extracto natural
La preparación del extracto natural se realizó a partir del ostión de mangle procesado en el Combinado Pesquero de Manzanillo (EPIGRAM) y evaluado según la norma de proceso establecida: NC832.20117. La zona de procedencia de los ostiones, fue considerada como variable experimental. Los ostiones empleados en la elaboración de los extractos fueron colectados en las zonas: Carena y Cauto, ambas están ubicadas en las inmediaciones de la desembocadura del río Cauto, Provincia Granma, Cuba. Para realizar la extracción de metabolitos, se empleó una solución salina ácida,que demostró ser eficaz en la extracción de péptidos antimicrobianos6. Esta fue preparada a la concentración de 0,6 mol/L de NaCl y 1 % v/v de HCl al 37 %.
Para la obtención del extracto se emplearon 100 g de ostión de mangle, por 150 g de solución salina ácida, proporción 1:1,5 (m/m). Luego se homogeneizó en licuadora, dejándolo en reposo durante 48 h a 4 p C, para lograr que se produzca la extracción. Posteriormente, se centrifugó en una microcentrífuga refrigerada Eppendorff, modelo 5415R, durante 20 min a 10 000 g. Se colectó el sobrenadante y se filtró en papel de filtro. El extracto obtenido se conservó a 4 p C, en un frasco ámbar cerrado herméticamente, para la posterior determinación de sus propiedades y la realización de ensayos biológicos.
Método para la obtención de masa deshidratada del ostión de mangle.
Cerca del 80 % de la composición química del ostión de mangle es agua7, lo que podría afectar la obtención de extractos con concentraciones significativas de metabolitos, desde el punto de vista de su actividad biológica. Por esta razón, se decidió deshidratar la muestra utilizando un método estandarizado8.
La masa de ostión se escurrió en un tamiz y se pesaron 200 g de masa escurrida que se depositaron en una licuadora. Se homogeneizó durante 90 s y a continuación la masa de ostión licuada se depositó en una cápsula de porcelana, previamente tarada. La cantidad de masa depositada en la cápsula fue de 193,781 g. La cápsula con su contenido se depositó en una estufa a 40 oC, durante 96 h. La muestra resultante mostró un aspecto granuloso y una coloración parda-rojiza. El porcentaje de humedad en la muestra deshidratada fue de 16,31%. La muestra fue triturada en un mortero de vidrio con el objetivo de aumentar la eficiencia del proceso de extracción, y envasada en un recipiente hermético.
Obtención de extracto a partir de la masa de ostión deshidratada.
Para obtener el extracto a partir de la masa deshidratada, se procedió de la forma siguiente. En balanza analítica se pesaron 30 g de masa deshidratada y 45 g de solución salina ácida; respetando la proporción sugerida 1:1,5 m/m 6. Se mezclaron ambas partes en un vaso de precipitado; transcurridas 48 h, la mezcla se centrifugó a 20 000 r/min, durante 10 min. Se colectó el sobrenadante y se filtró en papel de filtro. El extracto obtenido se guardó en un frasco ámbar, cerrado herméticamente, para la posterior determinación de sus propiedades y la realización de ensayos biológicos.
La zona de procedencia de los ostiones, fue considerada como variable experimental. Los ostiones empleados en la elaboración de los extractos provienen de las zonas Carena y Cauto, ambas están ubicadas en las inmediaciones de la desembocadura del río Cauto.
Evaluación de la actividad antimicrobiana
Se pesaron 30 g de masa deshidratada en balanza analítica y 45 g de solución salina ácida; respetando la proporción sugerida 1:1,5 m/m 6. Se mezclaron ambas partes en un vaso de precipitado; transcurridas 48 h, la mezcla se centrifugó en una microcentrífuga refrigerada Eppendorff, modelo 5415R, durante 20 min a 10 000 g. Se colectó el sobrenadante y se filtró en papel de filtro. El extracto obtenido se conservó en un frasco ámbar a 4 p C, cerrado herméticamente, para la posterior determinación de sus propiedades y la realización de ensayos biológicos.
Determinación de propiedades físico-químicas.
Las determinaciones de los parámetros físico- químicos, en los extractos obtenidos, se realizaron por métodos y procedimientos estandarizados. Para determinar el pH se realizaron tres mediciones por muestra a 25 0C de temperatura, y humedad de 38 % con pH-metroHanna modelo 211. Se calculó el promedio de las lecturas efectuadas, y el valor obtenido se informó como el pH de cada extracto.
El índice de refracción se determinó según norma NC90-13-119, en refractómetro Abbe WYA-2S, de nacionalidad china, y trabajando con corrección a 25 oC. Se calculó el promedio de las tres lecturas, y el resultado se reportó como índice de refracción nD25, para cada extracto. El ensayo de determinación de los sólidos totales fue desarrollado según NRSP 312 y se repitió tres veces por muestra. El valor promedio se informó como la cantidad de sólidos totales (St) en 100 mL de extracto. La densidad relativa se determinó por método gravimétrico, utilizando un picnómetro estándar ASTM. El ensayo se realizó por triplicado. El valor promedio se informó como la densidad relativa, rr25.
Determinación del contenido de proteínas
La determinación de concentración de proteínas totales, Pt, se realizó mediante el método del reactivo de Biuret. Esta constituye una prueba general parapolipéptidos y proteínas, ya que sirve para reconocer las uniones peptídicas. La positividad se manifiesta por la aparición de una coloración violeta, debido a la formación de un complejo de coordinación entre los cationes cúpricos en medio alcalino con las uniones peptídicas. Para la cuantificación de proteínas totales, las muestras se analizaron en un espectrofotómetro autoanalizador Hitachi 902 modelo AL-600N, según Procedimiento Normalizado de Operaciones Química, número 9 (PNO-Q-09), del Ministerio de Salud Pública de Cuba, MINSAP.
Métodos cualitativo para la identificación de aminoácidos en proteínas y péptidos.
Por la estructura peptídica y la presencia de determinados grupos, las proteínas pueden reaccionar con una variedad de agentes, originándose productos coloreados. Estas reacciones son la base para la determinación cualitativa de proteínas, péptidos, y los aminoácidos que conforman estas estructuras. Por presentarse variaciones en la composición de los aminoácidos en las diferentes proteínas, se manifiestan diferentes colores y grados de intensidad para una misma reacción, íntimamente relacionado con la naturaleza de la proteína analizada. Basado en este principio se han estandarizados pruebas o ensayos cualitativos que permiten la caracterización e identificación de estas estructuras10.
Las pruebas o ensayos empleadas para la identificación de compuestos y grupos funcionales, en esta investigación, se muestran a continuación. Cada una de ellas se realizó según procedimientos descritos, y utilizando los patrones correspondientes10.
Prueba Ninhidrina
Prueba Sulfato de amonio
Prueba Biuret
Prueba Coagulación
Prueba Xantoprotéica
Prueba grupos Azufrados (SH)
Prueba Sakaguchi
Prueba Hopkins-Cole
Prueba Millón.
Prueba de la Ninhidrina (Hidrato de tricetohidrindeno)
Todas aquellas sustancias que presentan al menos un grupo amino y uno carboxilo libre, reaccionan con la ninhidrina. La positividad se manifiesta por la aparición de un color violáceo o amarillo. Debido a que las proteínas y los aminoácidos poseen esta característica, la reacción sirve para identificarlos.
Algunas soluciones de amonio y aminas, dan la coloración característica, aparentemente debido a una oxidación y reducción intermolecular de la ninhidrina en presencia de amoníaco. Los aminoácidos porina e hidroxiprolina, que no poseen grupo amino sino imino (-NH-), dan un color rojo que pasa rápidamente a amarillo10.
Prueba de Biuret
Es una prueba general para polipéptidos y proteínas, ya que sirve para reconocer las uniones peptídicas. La positividad se manifiesta por la aparición de una coloración violeta, debido a la formación de un complejo de coordinación entre los cationes cúpricos en medio alcalino con las uniones peptídicas.
Prueba de coagulación
Es una prueba para identificar: albúminas, globulinas y protaminas. La positividad se manifiesta por la formación de un coágulo. No se conoce exactamente el mecanismo de reacción, se cree que ocurre cierta deshidratación de la molécula proteica.
Prueba de Sulfato de amonio
Las proteínas, como otros coloides, son precipitadas por soluciones concentradas de sales de amonio [NaCl. (NH4)2SO4 y NaSO4]. Aparentemente la precipitación se debe a la neutralización y deshidratación de la molécula, seguida de agregación y precipitación.
Prueba Xantoprotéica
Es una reacción que reconoce los aminoácidos que poseen el grupo bencénico (tirosina, fenilalanina, triptófano). Las proteínas que tienen en su composición estos aminoácidos también darán la reacción. La positividad se reconoce por la aparición de un color amarillo o verde debido a la formación de nitrocompuestos.
Prueba de los grupos azufrados SH
Es una prueba para identificar aminoácidos azufrados y las proteínas que los contienen, se reconocen por la formación de una coloración negra o gris
Prueba de Sakaguchi
Es una prueba para identificar arginina y se usa para identificar proteínas ya que casi todas las proteínas poseen ese aminoácido. El desarrollo de un color rojo marca la reacción positiva y se debe a la presencia del grupo guanidina, que caracteriza la arginina.
Prueba de Hopkins-Cole
Es para identificar el triptófano y las proteínas que lo contienen. La positividad se reconoce por la aparición de un anillo color violeta rojizo.
Prueba de Millón
La reacción es debida a la presencia del grupo hidroxifenílico (C6H4OH) en la molécula proteica. Cualquier compuesto fenólico no sustituido en la posición 3,5 como la tirosina, fenol y timol, dan positiva la reacción. El mecanismo de la reacción es poco conocido, posiblemente por la formación del complejo óxido de mercurio y fenol.
Análisis estadístico
Para comparar los resultados obtenidos, y realizar los análisis estadísticos, se utilizó el programa Statgraphics Plus versión 5.1. Específicamente se empleó el análisis de varianza ANOVA, con un nivel de confianza del 95 %.
RESULTADOS Y DISCUSIÓN
Los resultados de las determinaciones experimentales realizadas, a la solución empleada para realizar la extracción de metabolitos;así comoa los extractos obtenidos, se muestran en la tabla 1. En ella se recogen las medias o valores promedios de cada una de las propiedades evaluadas, y sus desviaciones estándar.
Análisis del comportamiento de las propiedades físico químicas de los extractos
Los valores promedio de pH, que se obtuvieron en el extracto natural, y en el deshidratado, fueron de 1,31 y 1,05, respectivamente. Se puede apreciar, que estos extractos son ácidos, pues en la extracción se utilizó una solución salina ácida con pH promedio de 0,98. El empleo de esta solución se debe a que con ella se han reportado los mejores resultados en la extracción de péptidos antimicrobianos en moluscos marinos5.
Los sólidos totales promedio del deshidratado, son superiores al extracto natural, 7,04 g por cada 100 mL para el deshidratado, por 4,017g por cada 100 mL, para el extracto natural. Esta diferencia en los sólidos totales, quizá sea la causante de las diferencias de dedensidades relativas reportadas. La densidad relativa promedio del extracto deshidratado es de 1,043 3, mientras que para el extracto natural es de 1,037 4.
Los valores promedios de índice de refracción reportados a 25 oC, para el extracto del deshidratado y extracto natural son de 1,346 5 y 1,347 4, respectivamente.
El análisis de varianza empleado, ANOVA, demuestra que existen diferencias significativas entre las medias de cada parámetro cuantificado, cuando se emplean métodos extractivos distintos, para un nivel de confianza del 95 %; lo que evidencia que el método empleado para extraer los metabolitos, es determinante en la composición y características del extracto obtenido. Este resultado está en correspondencia con lo reportado en la bibliografía5.
Al comparar los resultados, por zonas de procedencia, no se evidencian diferencias significativas entre ellos, lo que demuestra que, al parecer, la zona de captura del ostión no ejerce una influencia marcada sobre la composición y características de los extractos obtenidos. Sin embargo, se ha demostrado que las condiciones ambientales, la calidad del agua y los niveles de contaminación son determinantes para el cultivo del ostión de mangle, en cuanto a rendimiento y productividad11.
Los resultados en la determinación de concentración de proteínas totales, Pt, en uno y otro tipo de extracto, y para ambas zonas de procedencia, se muestran en la tabla 2.
Análisis del comportamiento de la concentración de proteínas totales
La concentración promedio de proteínas totales, para los extractos de la masa deshidratada es superior a los extractos naturales. Estos resultados eran esperados de cierta forma, pues cuando se decidió deshidratar, se disminuyó el por ciento de humedad en la muestra de ostión de 79,1 % hasta 16,31 %, buscando, precisamente, aumentar la concentración de proteínas en la masa, lo que pudiera mejorar la eficiencia en la extracción, y obtener extractos con mayor concentración de proteínas, polipéptidos y péptidos, que son, entre otros, parte de los metabolitos de interés para esta investigación.
El análisis estadístico demostró que existen diferencias significativas, entre las medias de cada parámetro cuantificado, cuando se emplean métodos extractivos distintos. Lo que evidencia que el método empleado, para extraer los metabolitos, es determinante en la composición y características del extracto obtenido.
Al comparar los resultados, por zonas de procedencia, no se evidenciaron diferencias significativas entre ellos; lo que demuestra que la zona de captura del ostión, no ejerce una influencia marcada sobre la composición y características de los extractos del ostión.
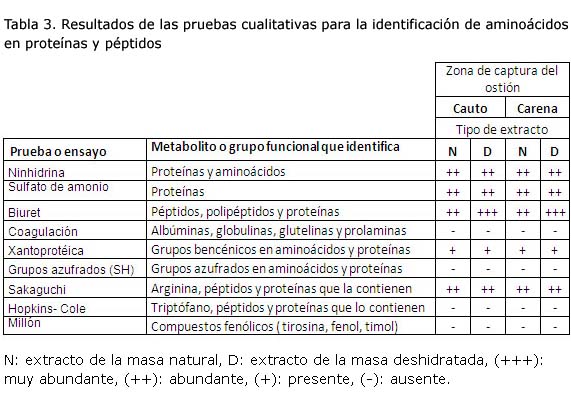
Alrededor del 11,7 % en peso de la masa de los ostiones, son proteínas7. La realización de la prueba de Biuret por método colorimétrico cuantitativo con técnica espectrofotométrica, posibilitó conocer la concentración de proteínas totales en los extractos estudiados. Para la identificación cualitativa de péptidos, polipéptidos, proteínas y los aminoácidos que con mayor probabilidad aparecen en estas estructuras, se realizaron pruebas químicas. Los resultados de estos ensayos se muestran en la tabla 3.
Análisis de los resultados para la identificación de aminoácidos en proteínas y péptidos
Estos ensayos también fueron desarrollados considerando las variables experimentales zona de procedencia del ostión y método de extracción empleado. En todos los casos se obtuvieron resultados similares, lo que demuestra que poseen composiciones similares o que los métodos cualitativos empleados no tienen la sensibilidad suficiente para evidenciar sus diferencias.
Los resultados obtenidos en las pruebas de Ninhidrina, Sulfato de amonio, y Biuret, demuestran la presencia de aminoácidos, péptidos, polipéptidos y proteínas en los extractos. Este resultado confirma los obtenidos en la cuantificación de proteínas totales en los extractos. Además, están en correspondencia con lo reportado en otras investigaciones sobre invertebrados marinos12, 13.
La ligera turbidez originada, y la no formación de un coagulo en la prueba de coagulación, quizá se deba a pequeñas concentraciones de globulina; proteína que frecuentemente se encuentran en animales y vegetales. Por lo que se infiere, protaminas e histonas, proteínas ricas en arginina y lisina, son los metabolitos con estructuras peptídicas que probablemente, en mayor cuantía, aparecen en estos extractos.
La posible presencia de tirosina, fenilalanina o triptófano, como aminoácidos libres o formando parte de estructuras peptídicas o proteínas, quedó demostrado en la reacción Xantoprotéica. La aparición del color amarillo en los tubos de ensayo, así lo evidencian. Sin embargo, al dar negativa la prueba de Hopkins-Cole, y mostrarse incolora para los dos extractos, se descarta la posibilidad de encontrar triptófano en cantidades significativas, prevaleciendo la posibilidad de encontrar, fundamentalmente, tirosina y fenilalanina. La no aparición del color rojo, y mostrarse ambos extractos relativamente incoloros en la prueba de Millón, demuestra que la cuantía de fenilalanina, es superior a la posible presencia de tirosina.
La prueba de Sakaguchi para detectar la presencia de arginina, como aminoácido libre o formando péptidos o proteínas, fue positiva. La aparición de la coloración rojiza para ambos extractos, presupone la presencia de arginina.
El ensayo para detectar grupos azufrados (SH) fue negativo, lo que demuestra que no existen aminoácidos azufrados, como cisteínas, cistina o metionina, en cantidades significativas, formando parte de las estructuras de los péptidos y proteínas presente en los extractos evaluados.
En resumen, la presencia de péptidos, polipéptidos y proteínas en los extractos estudiados, parece significativa. La secuencia analítica empleada, demostró que los aminoácidos: fenilalanina, arginina y lisina están presentes en estas estructuras.
Moléculas de naturaleza peptídica, ricas en los aminoácidos arginina y lisina, presentan actividad biológica y son reconocidas como péptidos antimicrobianos6, 12-14.
Los resultados obtenidos y las pruebas realizadas en esta investigación hacen pensar que la actividad antimicrobiana demostrada por ambos extractos, pudiera deberse, fundamentalmente, a la presencia de péptidos antimicrobianos. Sin embargo, esta afirmación no es concluyente porque en los extractos pueden existir compuestos químicos de otra naturaleza, que tengan responsabilidad parcial en la actividad antibacteriana de los extractos de ostión de mangle.
La no formación de un coagulo en la prueba de coagulación, y la aparición de una ligera turbidez en los extractos, demuestran la poca o nula presencia de albúminas, glutelinas y prolaminas. La ligera turbidez puede deberse a pequeñas concentraciones de globulina; proteína, rica en arginina y lisina, que frecuentemente se encuentran en animales y vegetales.
CONCLUSIONES
Los extractos obtenidos a partir de la masa de ostión están compuestos, fundamentalmente, por péptidos, polipéptidos y proteínas; aunque no se puede descartar la existencia de otros metabolitos de interés biológico.
Los aminoácidos que en mayor cuantía forman estas estructuras, generalmente son: fenilalanina, arginina y lisina. La zona de procedencia de los ostiones no tiene una influencia significativa sobre la composición y naturaleza química de los extractos.
El método de obtención empleado, influye directamente sobre la cuantía y concentración de los metabolitos extraídos; de aquí la importancia de seleccionar el método y procedimiento adecuados.
BIBLIOGRAFÍA
1. Crassostrea. Disponible en Web: <http://www.wikipedia.org/es> . [Consulta: 12 de febrero de 2013].
2. Ostión de Mangle . Características . Disponible en Web: <www.biblioteca digital/ILC/edu/mx/sites/ciencia/,,,/sec-1.1htre> . [Consulta: 12 de febrero de 2013].
3. Historia del ostión. Disponible en Web: <www.Solazul.Com.mx/Expages/historia.Asp> . [Consulta: 14 de febrero de 2013].
4. IBERZABAL, Diana; OROZCO, María. "Conozcamos el mar". Universidad para todos . 1ª ed. La Habana: Editorial Academia, 2006. p. 7-14.
5. ALBA, A.; LÓPEZ, C. «Optimización de la solución de extracción de moléculas de naturaleza peptídica». Revista Cubana de Medicina Tropical [en línea]. 2011, 63, (2) [ref. de 14 de febrero de 2013], p. 171-175. Disponible en Internet: <http://bvs.sld.cu/revistas/mtr/indice.html>.
6. TINCU, J.; TAYLOR, S. "Antimicrobial Peptides from Marine Invertebrates". Antimicrobial Agents . 2004, 48, (10), p.36-54.
7. NC 832.2011. Masa de ostión refrigerada y congelada. Especificaciones. Disponible en: <http://www.nconline.cubaindustria.cu/> . [Consulta: 23 de marzo de 2013].
8. GARCÍA, A.; María, A. Introducción al secado de alimentos . 3ª ed. Valencia: Universidad Politécnica de Valencia, España: 2008, p. 81-125
9. Normas Cubanas. Aseguramiento metrológico . Refractómetros. Reglas generales para efectuar determinaciones refractométricas. No 90-13-11. 2ª ed. La Habana: Normas Cubanas, 2009.
10. BOHLNSKI, T. Bioquímica . 3ª ed. México D.F: 1991. p. 27-38.
11. BETANZOS, A.; ARENCIBIA, G.; DELGADO, G.; NODAR, R. «Caracterización de la calidad del agua al norte de Villa Clara, Cuba, para definir zona de cultivo de ostión de mangle ( Crassostrearhizophorae, Guilding, 1828)». Revista de Ecotoxicología y Contaminación Ambiental [en línea]. 2010, 1,(1) [ref. de 14 de febrero de 2013]. Disponible en Internet: <http://www.aae.org.a>.
12. MÁRQUEZ, F.; DIANAT, M.; GALEANO, J. «Productos naturales con actividad antimicrobiana, Parte II». Revista VITAE. 2004, 11, (1) [ref. de 14 de febrero de 2013], p. 35-41. Disponible en Internet: <http://redalyc.uaemex.mx>.
13. ORDAZ, G.; DE ARMAS, H. «Metabolitos secundarios, letalidad y actividad antimicrobiana de los extractos de tres corales y tres moluscos marinos». Revista biología Tropical . 2010, 58, (2), p. 21-27.
14. LAURA, E.; CASTILLÓN, R.; PALMAS, A. «Péptidos antimicrobianos: Antibióticos naturales de la piel». Revista Dermatología México . 2007, 51, (1), p. 57-67.
Recibido: 15/09/2013
Aceptado: 20/11/2013
Ing. Yanira G. Vázquez-Jorge, Centro de Estudios de Química Aplicada, Universidad de Granma