Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.26 no.2 Santiago de Cuba maio-ago. 2014
ARTICULOS
Complejos de cobre II y cinc II con la 2-(4-cloroanilino)-1,2-difenil-1-etanonatiosemicarbazona: posible competencia por los sitios de coordinación del ligando
Copper (II) and zinc (II) with 2-(4-Chloroaniline)-1,2-Diphenyl-1- Ethanonethiosemicarbazone in Solution: Possible Competition for Ligand Coordination Sites
Lic. Yamilka Salina-AguileraI, Dr. C. Armando Ferrer-SerranoII, MSc. Félix Nápoles-EscutaryII
I Instituto Nacional de Recursos Hidráulicos (INRH), Las Tunas, Cuba.
II Facultad de Ciencias Naturales, Universidad de Oriente, Santiago de Cuba, Cuba, aferrer@cnt.uo.edu.cu
RESUMEN
Se realizó el estudio de formación de complejos en disolución de los sistemas 2-(4-cloroanilino)-1,2-difenil-1-etanonatiosemicarbazona/Cu (II) y Zn (II). Se empleó la valoración potenciométrica con el fin de determinar las constantes estabilidad del ligando y sus complejos con los iones mencionados, en una mezcla acetonitrilo: agua 8:1 (NaCl 0,1 mol · dm-3 como fuerza iónica). Se determinaron cuatro constantes de protonación para el ligando. Posiblemente las protonaciones segunda y tercera ocurran simultáneamente. Del sistema tiosemicarbazona/Cu(II) se encontraron 6 especies complejas mientras que el tiosemicarbazona/Zn (II) exhibe cuatro complejos. Fue posible encontrar complejos mixtos de Cu (II) y Zn (II) con el ligando (L). Del refinamiento de los datos quedaron solo tres especies: ZnCuHL5+, ZnCu2L2(OH)5+ y ZnCuL(OH)5-. Todos los complejos mixtos presentan valores de estabilidad mayores que las especies precedentes mono-complejas.
Palabras clave: cobre, cinc, tiosemicarbazona, estabilidad.
ABSTRACT
The stability study of complexes have been done, using 2-(4-chloroaniline)-1,2-diphenyl-1-ethanone thiosemicarbazone/copper II and zinc II ions, by potentiometric titrations with acetonitrile: water mixture (8:1) and NaCl 0,1M as ionic strength. We determined protonation and complexes formation constants. Four protonation constants have been determinate. the second and third protonation can occur simultaneously. May be, it exist simultaneously. In the same way, 6 copper II complexes and 4 zinc II complexes have been found in the data processing. In addition, it was possible make the study of the competition between Cu (II) and Zn (II) ions for the coordination sites of ligand. From data fit procedure we had only 3 heterodinuclear species: ZnCuHL5+, ZnCu2L2(OH)5+ y ZnCuL(OH)5-. All mixed complexes have stability constant values higher than the preceding mono-complex species.
Keywords: copper, zinc, thiosemicarbazone, stability.
INTRODUCCIÓN
Las tiosemicarbazonas son compuestos derivados de la tiosemicarbazida, y se obtienen por reacción de esta con un compuesto carbonílico en medio etanólico. Comúnmente esta reacción constituye un procedimiento sencillo para la preparación de derivados de aldehídos y cetonas1. Son ligandos versátiles tanto en su forma neutral como aniónica2 y son capaces de formar complejos con una gran variedad de iones metálicos, los cuales potencian la actividad biológica encontrada para dichas moléculas como ligandos libres.
Un aspecto interesante en la estructura de las tiosemicarbazonas es su comportamiento en solución. En estos compuestos se presenta un equilibrio entre tres estructuras tautómeras3.
Las tiosemicarbazonas han sido ampliamente estudiadas por presentar actividad biológica. Su principal aplicación radica en que pueden emplearse como fármacos contra ciertos tipos de tumores4, 5, como antiparasitarios y contra la tuberculosis y la malaria.
Los compuestos de coordinación formados entre las tiosemicarbazonas y diferentes iones metálicos poseen una potente actividad biológica, dentro de la cual se puede destacar tanto su actividad antitumoral6, como antibacteriana y antifúngica7. La actividad antitumoral de estos complejos metálicos es muy variada, pues se reportan estudios en los cuales estos complejos se emplean contra líneas de células humanas leucémicas, el cáncer de mamas y contra células de eritroleucemia, provocando en cada uno de los casos la inhibición del crecimiento celular y algunos complejos llegan a provocar la apoptosis (muerte celular).
En el caso del empleo de estos complejos contra el cáncer de mamas tenemos complejos metálicos del Cu2+ con la naftaquinonatiosemicarbazona8-10 sustituida en posiciones 1 y 2. Estos complejos metálicos también son empleados contra células de eritroleucemia, tal es el caso de los complejos de Cu2+ y Zn2+ con la acenaftenequinona tiosemicarbazona11 y los complejos de Zn2+ con la 2,6-bis diacetilpiridinatiosemicarbazona12.
Además, se han realizado estudios acerca de la formación de complejos con radioisótopos del cobre y se ha probado que los mismos son químicos efectivos en la terapia contra el cáncer. Tal es el caso del cobre-64, el cual fue acomplejado con la diacetil-bis N-4-metil tiosemicarbazona y empleado como un fármaco en este campo de la medicina13.
A pesar de la conocida actividad biológica de las tiosemicarbazonas y sus complejos metálicos, son escasos los estudios relacionados con el comportamiento de las mismas en disolución a distintos valores de pH y en presencia de cantidades equivalentes de los iones mencionados. El grupo de investigación que reporta este trabajo sintetizó una serie de tiosemicarbazonas derivadas de a-aminocetonas. Entre ellas está la 2-(4-cloroanilino)-1,2-difenil-1-etanona tiosemicarbazona (figura 1) que se sintetiza utilizando ácido bórico como catalizador y partiendo de la a-aminocetona correspondiente14.
Con el objetivo de observar el comportamiento de esta tiosemicarbazona en disolución, se procedió a estudiarla de forma libre y en presencia de los cationes de interés cobre II y cinc II, auxiliándose de la valoraciones potenciométricas y los cálculos correspondientes para determinar las constantes de estabilidad de todas las especies formadas.
MÉTODOS EXPERIMENTALES
Las valoraciones potenciométricas se llevaron a cabo a 298 ± 1K (25 ºC) usando NaCl 0,1 mol · dm-3 para mantener la fuerza iónica del medio (agua/acetonitrilo 1/8). Se utilizaron 0,1 mmol del ligando en cada experimento y los correspondientes equivalentes de nitrato de cobre II y nitrato de cinc II. De esta forma se estudiaron los sistemas L, L/Cu, L/ Zn y L/Cu/Zn. La data registrada se graficó con el programa Sigma Plot. El software HYPERQUAD 2000 se utilizó para determinar las constantes de estabilidad15. El rango de pH investigado va desde 2,2 hasta 12,0. Para construir los diagramas de distribución de especies se usó el programa HySS.
RESULTADOS Y DISCUSIÓN
Una vez procesados los datos experimentales, se obtuvieron tres posibles constantes de protonación (tabla 1). Los bajos valores de estas constantes se corresponden a los obtenidos en otros casos para grupos de baja basicidad que contienen átomos de nitrógeno16. Esto ocurre fundamentalmente para grupos amino unidos a grupos carbonilo y tiocarbonilo, tal vez debido a que los electrones libres se conjugan con los dobles enlaces presentes. En la 2-(4-cloroanilino) 1,2-difenil-1-etanona tiosemicarbazona existe una gran conjugación que se complica por los tautómeros de esta molécula.
Las protonaciones segunda y tercera LH2 y LH3 ocurren prácticamente de forma consecutiva detectándose solamente el valor de la tercera. Svobodobá y colaboradores17 encontraron dos casos de disociaciones simultáneas de dos protones tal como ocurre en este caso. Esto podría explicarse por uno de los tautómeros que tiene el ligando estudiado que presenta dos nitrógenos imínicos, que podrían ser los responsables de las disociaciones simultáneas observadas.
Esta hipótesis podría verificarse a través de un experimento de Resonancia Magnética Nuclear de Protones18.
El diagrama de distribución de especies protonadas obtenido para la 2-(4-cloroanilino)-1,2-difenil-1-etanona tiosemicarbazona se representa en la figura 2. Se observa que entre pH 2 y 5 existen todas las especies protonadas. Para valores superiores a 5 es posible encontrar al ligando libre. Esto se puede considerar como un aspecto a favor para la formación de complejos.
La tabla 2 muestra los resultados obtenidos del experimento realizado para determinar las constantes de formación de los complejos de Cu (II). Lo más relevante de este caso es la variedad de complejos encontrada. Sin embargo, no se observa la especie CuL2+. Puede que se trate de una especie muy poco estable para ser determinada por este método.
La detección de una especie binuclear de la forma Cu2L2OH3+ hace interesante este tipo de estudio. En este caso podría pensarse que el grupo hidroxilo se colocaría como puente entre dos iones centrales de dos complejos con la tiosemicarbazona.
Teniendo en cuenta los posibles sitios de coordinación de la 2-(4-cloroanilino)-1,2-difenil-1-etanona tiosemicarbazona y las especies encontradas en este estudio, se propuso el esquema de equilibrio (figura 3).
Los iones OH- van sustituyendo los sitios de coordinación del Cu2+ ocupados por la tiosemicarbazona en cuestión hasta desplazar totalmente el ion metálico y formar los hidroxocomplejos.
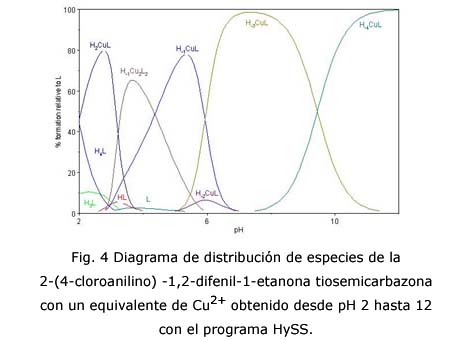
La figura 4 muestra las curvas de especiación del ligando en presencia de un equivalente de cobre II. En este caso la especie CuL(OH)2 no alcanza el 10 % de abundancia. Esta constituye la única especie neutra de las que se forman, por lo que probablemente precipite. Por encima de 7, como el pH es muy básico, predominan las especies CuL(OH)3- y CuL(OH)42-. Al no poseer interferencias, estos complejos pueden ser objetos de estudios cinéticos y cristalográficos. También es posible notar en el diagrama la presencia de ligando libre alrededor de pH 4.
La tabla 3 muestra los valores de las constantes de estabilidad de los complejos de Zn (II) con el ligando estudiado. Contrario al caso de los complejos de Cu (II), es posible encontrar la especie tipo ML, que presenta un valor de log b = 4,16 (log K= 4,16). La entrada de protones en el medio inicialmente no provoca la destrucción del complejo ZnL2+, sino que resulta en la formación de especies complejas mono y biprotonadas (log KZnHL= 2,38 y log KZnH2L= 4,24). Contrario al caso descrito en el epígrafe anterior, la existencia de especies estables hidroxiladas es mucho menor para el Zn (II). Solo se detecta la especie neutra ZnL(OH)2.
La figura 5 muestra el diagrama obtenido para los complejos de cinc detectados en el procesamiento de los datos. En este caso es posible observar que la especie tipo LM existe con más del 90 % de abundancia relativa entre los valores de pH 5 y 7, donde empieza a prevalecer la especie dihidroxilada.
Es importante destacar que existen cantidades remanentes de ligando libre a partir de pH 3,5 para un diagrama representando la relación molar 1:1. Esto podría estar relacionado con la menor estabilidad de los complejos de cinc respecto a los de cobre con la 2-(4-cloroanilino)-1,2-difenil-1-etanona tiosemicarbazona. Aunque se forman especies distintas en ambos casos es posible tener una idea a través de la estabilidad de las especies biprotonadas de ambos iones [log K (ZnH2L4+) = 4,24 y log K (CuH2L4+) = 10,25].
En la figura 6 se propone el posible esquema de equilibrio entre las especies de cinc. Cabe pensar en dos posibles especies monoprotonadas en equilibrio. Tal como se describe anteriormente podría determinarse el sitio de protonación con un experimento de RMN1H. Llegado a este punto de la investigación se propuso indagar en la posible competencia de ambos iones por los sitios de coordinación que ofrece este ligando. Para ello se realizó el experimento descrito en la parte experimental añadiendo a la tiosemicarbazona un equivalente de la sal de cobre II y otro equivalente de la sal de cinc.
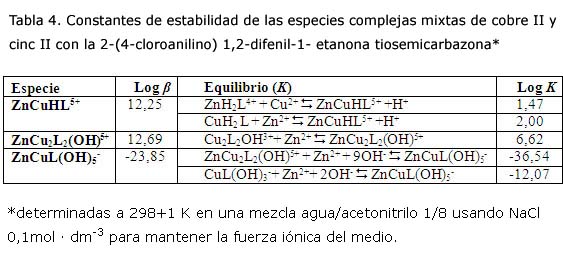
Como resultado de lo planteado anteriormente se obtuvieron los resultados que se muestran en la tabla 4. En este caso fue posible determinar tres especies mixtas estables. De ellas, la más estable es la ZnCu2L2(OH)5+. La fórmula de esta estructura y la obtenida mediante el estudio con cobre II guardan semejanzas. Es posible que el catión Zn2+ se enlace a uno de los nitrógenos de la tiosemicarbazona que no se encuentran coordinados a los iones centrales de cobre II (figura 7).
Si se observa el valor de la constante de estabilidad de la entrada del Zn2+ al complejo binuclear de Cu2+ se aprecia la posibilidad de que este se coloque, en un paso de reacción posterior entre los dos ligandos a través de los nitrógenos de la fracción tiourea de la molécula, lo que podría ser interesante desde el punto de vista cinético.
La existencia de dos puentes entre ambas unidades del complejo a través del catión Zn2+, unido a los nitrógenos de la fracción de tiourea y el hidroxilo entre los dos centros de cobre II, puede estar estéricamente desfavorecida y conducir de manera eventual a una estructura más estable (figura 8).
El diagrama de distribución de especies obtenido muestra la prevalencia de los complejos mixtos frente a los homocomplejos de cobre y cinc (figura 9).
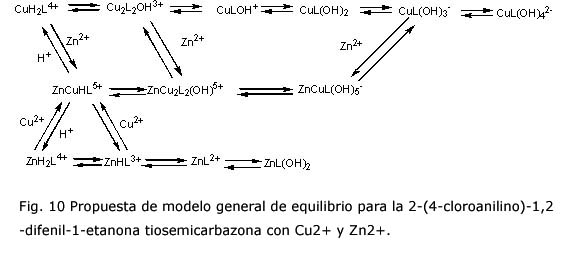
Se propone un esquema general de equilibro entre todas las especies determinadas (figura 10).
CONCLUSIONES
La 2-(4-cloroanilino)-1,2-difenil-1-etanona tiosemicarbazona presenta cuatro protonaciones detectables por este método. No es posible determinar la segunda protonación, ya que la misma ocurre simultáneamente con la tercera.
No se ha encontrado explicación posible para lo anterior. Se le puede adjudicar a la presencia de las diversas formas tautoméricas de la misma. Este ligando forma una gran variedad de complejos de cobre II y cinc II en disolución.
Resulta notable la existencia de un complejo binuclear hidroxilado de cobre II, donde presumiblemente el grupo hidroxilo actúe como puente entre ambos iones metálicos. Sin embargo, al incorporar cinc a la disolución, es probable que el puente de hidroxilo sea reemplazado, de cierta forma, por el Zn, al formarse un enlace de coordinación con los nitrógenos restantes del fragmento tiourea de la tiosemicarbazona. La utilización de distintas técnicas espectroscópicas y algunos cálculos teóricos podrían aclarar más este proceso químico.
Un estudio cinético de formación de complejos aclararía, en mayor medida, la entrada del catión Zn (II) en el complejo binuclear de Cu (II) formado.
BIBLIOGRAFÍA
1. CAMPBELL, M. J. M. "Transition Metal Complexes of Thiosemicarbazide and Thiosemicarbazones". Coord. Chem. Rev. 1975, 15, p. 279-319.
2. CASAS, J. S., et al. "Diorganotin(IV) complexes of Pyridoxal Thiosemicarbazone: Synthesis, SpectroscopicProperties and Biological Activity". J. of Inorg. Biochem. 1998, 69, p. 283.
3. AKINCHAN, N. T., et al. "Synthesis, Nuclear Magnetic Resonance and Infrared Studies of Zinc(II) and Cadmium(II) Complexes of Thiosemicarbazones Derived from Fluorenone and p-Anisaldehyde". Polish J. Chem. 2002, 76, p. 1381-1387.
4. REDDY, B. K., et al. "A Rapid and Sensitive Extractive Spectrophotometric Determination of Copper(II) in Pharmaceutical and Environmental Samples Using Benzildithiosemicarbazone". Analytical Science. 2003, 19, p. 423-428.
5. HALL, I. H., et al. "The Cytotoxicity of Symmetrical and Unsymmetrical bis(Thiosemicarbazones) and their Metal Complexes in Murine and Human Tumor Cells". Arch. Pham. Med. Chem. 2000, 333, p. 217-225.
6. MOHAN, M., et al. "Metal(II) Complexes of 1-Formylisoquinoline Thiosemicarbazone: their Preparation, Characterization and Antitumour Activity". Inorg. Chimica Acta. 1985, 106, p. 197-201.
7. BERALDO, H. "Semicarbazonas e Tiosemicarbazonas: o Amplo Perfil Farmacológico e Usos Clínicos". Quim. Nova. 2004, 27, 3, p. 461-471.
8. AFRASIABI, Z., et al. "Nickel (II) Complexes of Naphthaquinone Thiosemicarbazone and Semicarbazone: Synthesis, Structure, Spectroscopy, and Biological Activity". J. of Inorg. Biochem. 2005, 99, p. 1526-1531.
9. AFRASIABI, S., et al. "Appended 1,2-Naphthoquinones as Anticancer Agents 1: Synthesis, Structural, Spectral and Antitumor Activities of OrthoNaphthaquinone Thiosemicarbazone and its Transition Metal Complexes". Inorg. Chimica Acta. 2004, 357, p. 271-278.
10. CHEN, J., et al. "The Cytotoxicity and Mechanisms of 1,2-Naphthoquinone Thiosemicarbazone and its Metal Derivatives Against MCF-7 Human Breast Cancer Cells". Toxicology and Applied Pharmacology. 2004, 197, p. 40-48.
11. RODRÍGUEZ-ARGÜELLES, M. C., et al. "Acenaphthenequinone Thiosemicarbazone and Its Transition Metal Complexes: Synthesis, Structure, and Biological Activity". J. of Inorg. Biochem. 1997, 66, p. 7-17.
12. RODRÍGUEZ-ARGÜELLES, M. C., et al. "2,6-Diacetylpyridine Bis (Thio -semicarbazones) Zinc Complexes: Synthesis, Structure, and Biological Activity". J. of Inorg. Biochem. 1995, 58, p. 157-175.
13. YOSHI, Y., et al. "Copper-64-Diacetyl-bis (N4-methylthiosemicarbazone) Accumulates in Rich Regions of CD133+ Highly Tumorigenic Cells in Mouse Colon Carcinoma". Nuclear Medicine and Biology. 2010, 37, 4, p. 395-404.
14. NÁPOLES, F., et al. "Synthesis and Characterization of New a-Aminoketones Thiosemicarbazones". Rev. Cub. Quím. 2012, XXIV, 3, p. 261-265.
15. a) GANS, P., et al. "Investigation of Equilibria in Solution. Determination of Equilibrium Constants with the HYPERQUAD Suite of Programs". Talanta. 1996, 43, p. 1739-1750.; b) http://www.hyperquad.co.uk/step_by_step/hyperquad.htm
16. PASHA, A., et al. "Synthesis and Characterization of DOTA-(amide)4 Derivatives: Equilibrium and Kinetic Behavior of Their Lanthanide(III) Complexes". Eur. J. Inorg. Chem. 2007, p. 4340-4349.
17. SVOBODOBÁ, I., et al. "Metal Complexes of 4,11 -Dimethyl-1,4,8,11-Tetraazacyclo Tetradecane-1,8- bis(Methylphosphonic Acid): Thermodynamic and Formation/Decomplexation Kinetic Studies". Eur. J. Inorg. Chem. 2009, p. 3577-3592.
18. MARTÍ, I., et al. "Copper(II) Complexes of bis(Amino Amide) Ligands: Effect of Changes in the Amino Acid Residue". Dalton Trans. 2012, 41, p. 6764- 6776.
Recibido: 05/12/2013
Aceptado: 20/01/2014
Lic. Yamilka Salina-Aguilera, Instituto Nacional de Recursos Hidráulicos (INRH), Las Tunas, Cuba