Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.26 no.2 Santiago de Cuba may.-ago. 2014
ARTICULOS
Diseño, construcción y caracterización de titulaciones microcoulombimétricas ácido-base con monitoreo visual y micropotencimétrico: Aproximación metrológica
Low Cost Microcoulometry Titration System: Metrology Approach
Lic. Alejandro Marín-Medina, Dr. Arturo García-Mendoza, MSc. Adrián de Santiago-Zarate, Dr. Alejandro Baeza-Reyes
Facultad de Química, Ciudad Universitaria, D.F., México, baeza@unam.mx
RESUMEN
Se construyó un microcoulombímetro de mínima instrumentación MIMCoul con materiales locales de bajo costo. Se realizó la titulación microcoulombimétrica de disoluciones estandarizadas de HCl deciformales con indicación visual del tiempo asociado al punto de equivalencia experimental. Se monitoreó el punto de equivalencia potenciométricamente con microelectrodos para pH y de referencia construidos en el laboratorio. Se compararon las incertidumbres asociadas a la microtitulación propuesta con respecto a la determinación en condiciones titulométricas convencionales.
Palabras clave: microcoulombimetría, micropotenciometría, metrología.
ABSTRACT
Low cost equipment with locally materials to perform microcoulometric acid-base titrations with micropotentiometric endpoint detection were developed. Visual detection was also assayed. Statistical analysis was performed comparing results obtained with standard methods as well to evaluate the minimal instrumentation micro coulometer MIMCoul , performance .
Keywords: microISE, microcoulometry, metrology.
INTRODUCCIÓN
Los métodos coulombimétricos se fundamentan en las investigaciones electroquímicas publicadas por Michael Faraday en 1834, principalmente en su primera ley que indica1-4: "la masa de una sustancia alterada en un electrodo durante la electrólisis es directamente proporcional a la cantidad de electricidad transferida al electrodo, si a través de este se hace pasar durante el tiempo una corriente continua de intensidad fija", es decir:

Un aspecto fundamental en la coulombimetría es la determinación de la cantidad de electricidad consumida en el proceso:

Otro aspecto importante de esta técnica es la selectividad de la reacción electroquímica, pues la selección de los electrodos y los medios de reacción únicamente deben transformar la sustancia de interés.
La coulombimetría como técnica electroanalítica titulométrica se basa en la generación por electrolisis in situ del titulante y, como la mayoría de los métodos cuantitativos de análisis, originalmente fue desarrollada en condiciones de escala convencional o a macroescala, lo que encarece la técnica por el uso de macroelectrodos de platino, potenciostatos y amperostatos de elevado costo. Dado que la electrotransformación es exhaustiva los tiempos de operación son largos y se pueden tener análisis de horas, lo que limita la práctica coulombimétrica convencional. Este trabajo muestra que la miniaturización y el microescalamiento son útiles para reducir dichos inconvenientes de la determinación a escala convencional8-13.
Las valoraciones coulombimétricas ácido-base se fundamentan en la electrogeneración de los iones titulantes H+ o bien OH-, apartir de la electrólisis de una disolución acuosa en presencia de un electrolito química y electroquímicamente inerte (conocido como electrolito soporte). El lionio, H+, y el liato, OH-, corresponden a las especies ácidas y básicas más fuertes en el agua por lo que las reacciones operativas de titulación con estas especies presentan un porcentaje de reacción o cuantitatividad mayor al 99.99 % lo que corresponde a reacciones muy cuantitativas5.
La electroxidación del agua produce:
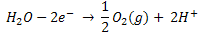
y al reducir la misma, la reacción electroquímica es:

El MIMCoul requiere solo de un electrodo de trabajo, ET, y un electrodo auxiliar, EA. Entre ellos se impone una diferencia de potencial constante, la transferencia de masa constante se garantiza mediante una agitación vigorosa permanente.
En estas condiciones, la corriente de electrólisis es constante y estará limitada por la reacción operativa de titulación acoplada a la electrogeneración del titulante. El ET será el cátodo para la titulación de ácidos, o el ánodo para la titulación de bases:
ET, cátodo, (-):  (reacción electroquímica, E)
(reacción electroquímica, E)
OH- + HA = A - + H2O (reacción química, C)
ET, ánodo, (+): 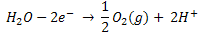 (reacción electroquímica, E)
(reacción electroquímica, E)
H+ + A - = HA + H2O (reacción química, C)
De esta manera las microtitulaciones coulobimétricas se fundamentan en mecanismos EC respectivos en condiciones de transferencia de carga y de masa en estado estacionario. Las reacciones electroquímicas de la celda total deben estar compartamentalizadas, lo cual se logra por aislamiento del EA con un recubrimiento de papel absorbente.
Mediante la construcción de un microcoulombímetro de mínima instrumentación, MIMCoul , con materiales locales de bajo costo se contribuirá a la enseñanza y la práctica de la química analítica instrumental bajo la siguiente premisa: "se aprende más desarrollando la instrumentación, que comprando la misma". Nuestra propuesta está encaminada a aplicar los fundamentos teóricos de la química analítica instrumental y el funcionamiento de los equipos, para posteriormente trabajar con los de manufactura de manera más eficiente y segura.
El objetivo general de este trabajo es desarrollar un microcoulombímetro para realizar valoraciones coulombimétricas, donde se vean involucrados equilibrios químicos de carácter ácido-base, con la mínima instrumentación posible y fácil acceso.
Los objetivos particulares son:
• Determinar la concentración exacta de una disolución de HCl de F= 0,1 mol/L a través de una valoración titulométrica microcoulombimétrica.
Estimar la incertidumbre en la determinación.
• Comparar la concentración exacta del analito y su incertidumbre asociada respecto a aquella obtenida por el método volumétrico oficial utilizando como patrón primario Na2CO3 anhidro.
• Acoplar a la microcelda de titulación microcoulombimétrica un sistema de monitoreo micropotenciométrico de producción local con captura de datos digital en tiempo real.
La miniaturización de la titulación coulombimétrica propuesta no invalida la aplicación de las leyes de Faraday y, por lo tanto, los resultados que arroja son susceptibles de un análisis metrológico.
Metodología
Se desarrolla un sistema electroquímico de acuerdo con los siguientes diagramas esquemáticos de los dos casos de microcoulombímetro a construir:
Caso 1 , con monitoreo visual:

Caso 2 , con monitoreo micropotenciométrico:

Materiales para la construcción del microcoulombímetro
• Frasco de plástico transparente con forma cilíndrica de 2,5 cm de ancho por 3,0 cm de alto, capacidad de 5,0 mL, el cual funcionará como celda (figura 1). Su tapa debe ser bihoradada para colocar los electrodos ET y EA (figura 4).
• Puntas de carbón para lápices de dibujo de 12 · 2 mm HB de la marca STAEDTLER Mars®carbon, que harán el papel de electrodos (figura 3).
• Pila de 9.0 V de la marca Duracell®.
• Caimanes eléctricos.
• Barra de agitación magnética de 7 · 2 mm de la marca Spinbar®.
• Cronómetro (teléfono celular).
• Multímetro de bajo costo con interfase RS232 integrada.
• Jeringa para inyección de insulina de 0,5 mL, marca BD®.
• Jeringa de 3,0 mL, marca SensiMedical®.
• Microagitador-LC (LowCoast) (figura 2).
• Papel secante para cocina Servitoallas.
• Microsensor de pH de W0/WO3 y microreferencia de Ag0/AgCl .
La figura 5 muestra el equipo completo para la realización de la Microtitulación coulombimetrica con monitoreo visual. El multímetro está conectado en serie solamente para corroborar que la corriente impuesta es constante en un primer ensayo, y para posteriores determinaciones puede prescindirse de este.
Una vez construido el equipo, nos enfrentamos al reto de la compartimentación de los electrodos, es decir, cómo separar los iones H+ que se generan en el ánodo para que no interfieran en la titulación, sin encarecer el sistema con una membrana comercial o tener que sintetizarla en nuestro laboratorio.
Después de varios experimentos de prueba y error se cubrió el ánodo con un pedazo de papel servitoalla (figuras 6 y 7) para evitar que los iones H+ generados en el electrodo auxiliar contaminaran la muestra de análisis HCl.
Microcoulombimetría de HCl. Se agregó a la celda de análisis 3,0 mL del electrolito soporte (KNO3 F = 0,5 mol/L) con una jeringa de 3,0 mL, posteriormente se colocaron dos gotas de indicador ácido-base verde de bromocresol (Vire de color amarillo en medio ácido a azul intenso en medio alcalino). Se evaluaron volúmenes de 100, 200, 300, 400 y 500 µL de una disolución de HCl F= 0,1 mol/L en cada ensayo. Se inició la agitación de la disolución a un régimen constante.
El ánodo se cubrió con el papel absorbente, que sirvió como membrana separadora para evitar que los H+ generados por la oxidación de la disolución interfieran con los H+ provenientes de la disociación del HCl, además de evitar la oxidación del Cl- a Cl2(g). Este último presenta una elevada reactividad que puede romper los dobles enlaces del verde de bromocresol y descomponerlo, lo que evitaría observar el vire. La figura 8 muestra esquemáticamente el arreglo experimental. Se conectaron los electrodos a la fuente de poder, en este caso la pila que aplica un potencial nominal de 9.0 V, y con el amperímetro se midió la corriente de electrólisis asociada. Una vez conectados los electrodos a la fuente de poder se inició la medición del tiempo hasta observar el vire del indicador.
Cada ensayo se repitió diez veces para tener un mejor control de la dispersión de los datos. Se realizó una valoración titulométrica clásica a escala convencional para conocer la concentración exacta de nuestro ácido mediante el patrón primario Na2CO3, además, se confrontaron los resultados obtenidos entre la titulación a microescala y la titulación a escala convencional.
Una vez que la microcoulombimetría ácido-base de mínima instrumentación ha sido ensayada y monitoreada utilizando un indicador visual como detector del punto final de la valoración, en este caso verde de bromocresol, se realizó el monitoreo a través de un par de microelectrodos diseñados y caracterizados en nuestro laboratorio para monitorear valoraciones volumétricas potenciométricas (pH= f (V)).
La instrumentación consta de un sistema de un par de microelectrodos, un microsensor a pH de W0/WO3 con una pureza mayor al 99 % y un microelectrodo de referencia de Ag0/AgCl. El monitoreo del potencial se llevó a cabo, en todo momento, con un multímetro de la marca Steren ® modelo MUL-600, el cual incluye un programa igualmente denominado por los fabricantes como MUL-600 y su respectiva interfaz RS232 para conectarse a una PC.
De esta manera fue posible monitorear la evolución del potencial, ya que también se pueden registrar valores de resistencia, corriente y temperatura. El equipo es capaz de registrar el valor de la magnitud medida con respecto al tiempo, con una velocidad de adquisición de hasta tres datos por segundo, además, es posible guardar los datos obtenidos en hojas de cálculo para su posterior análisis.
RESULTADOS
La tabla 1 muestra los tiempos de vire del indicador y la corriente medida durante la microtitulación coulombimétrica, así como la desviación estándar asociada. Se corrobora que la dosificación electroanalítica del titulante es constante toda vez que la corriente impuesta es constante, lo que garantiza la validez de las ecuaciones de Faraday para determinar la masa electrolizada de ácido acoplada a la reacción electroquímica.
Tabla 1. Resultados experimentales para el tiempo de vire en cada adición de masa de HCl
| t promedio vire[s] | HCl [mol] | i promedio [A] | S t (desviación estándar para el tiempo) |
| 14.25 | 0.00001 | 0.242 | 0.015951 |
| 29.52 | 0.00002 | 0.242 | 0.050870 |
| 45.62 | 0.00003 | 0.242 | 0.168584 |
| 58.00 | 0.00004 | 0.241 | 0.066609 |
| 75.72 | 0.00005 | 0.241 | 0.176826 |
La figura 9 muestra la curva de calibración ponderada, mol = f(t vire ), para los diez ensayos realizados. Se observa la validez faradaica de la microtitulación, r2 = 0,997 5.
Una vez verificada la validez faradaica experimental del método, se procedió a realizar el cálculo de la concentración de la disolución de HCl F = 0,1 mol/L, de acuerdo con la ecuación 1.
donde es la intensidad de corriente aplicada, el volumen de HCl agregado a la celda, el número de electrones intercambiados (en este caso 2e-), la constante de Faraday (96 485,34 C/mol) y el tiempo de vire.
Con esta ecuación fueron evaluados los cincuenta datos obtenidos experimentalmente. Se obtuvo un valor de CHCl= 0,180 9 mol/L como concentración exacta de la disolución.
Determinación de las fuentes de incertidumbre "cuantificables", para estimar la incertidumbre de la determinación:
• 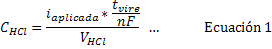 , asociada instrumentalmente al multímetro utilizado.
, asociada instrumentalmente al multímetro utilizado.
• 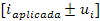 , atribuida al cronómetro empleado.
, atribuida al cronómetro empleado.
• 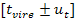 , asociada a la jeringa con la que se tomó la alícuota del ácido.
, asociada a la jeringa con la que se tomó la alícuota del ácido.
• u repetibilidad, la que representa que tan reproducible fue la técnica.
De acuerdo con la Guía para estimar la incertidumbre de una medición, CENAM 2004, tomando en cuenta porcentajes de coeficientes de variación, desviaciones estándar, promedios y qué distribución sigue cada instrumento utilizado, la ecuación final para determinar la incertidumbre relativa de la determinación es6, 7:

El valor de la incertidumbre expandida con un 95,5 % de confianza, K = 2, es:
u c HCl = 0.0054 mol/L
Por lo que la concentración real de la disolución quedó expresada como:
u EXP K=2 = 0.0108 mol/L
u c HCl = 0.0012 mol/L
El valor de la incertidumbre expandida con un 95,5 % de confianza, K = 2, es:
u EXP K=2 = 0.0024 mol/L
Por lo tanto la concentración real de la disolución de este ácido está expresada como:
C HCl = [0.1631 ± 0.0024] mol/L.
Análisis de resultados de la microtitulación con monitoreo visual
Como se puede observar en la figura 9, la curva de calibración arrojó un excelente coeficiente de correlación si tomamos en cuenta el material de bajo costo que se utilizó para la construcción del equipo.
La siguiente tabla compara los resultados obtenidos con ambos métodos:
| Técnica Microcoulombimétrica | Técnica Volumétrica |
| C HCl = [ 0.1809 ± 0.0108] mol/L | C HCl = [0.1631 ± 0.0024] mol/L |
Monitoreo micropotenciométrico alternativo14
La calibración del microsensor de pH tuvo una respuesta lineal en el proceso de calibración:
DE= -52,183 3pH + 100,833
Una vez calibrado el microsensor se realizaron los siguientes experimentos:
Valoraciones microcoulombimétricas de alícuotas 100, 200, 300, 400 y 500 µL de una disolución de HCl F = 0,1 mol/L de acuerdo con las condiciones de la microtitulación con indicador visual, midiendo el potencial del microsensor de pH en función del tiempo de electrólisis.
En la siguiente gráfica se muestran las curvas DE/ER = f (tv) obtenidas para cada experimento.
CONCLUSIONES
• Se desarrolló un sistema microcoulombimétrico de mínima instrumentación MIMCoul , con una precisión aceptable para este tipo de métodos.
• La metodología propuesta demuestra su potencial uso en la cuantificación de diversos analitos de naturaleza ácido-base en química de alimentos, control de medicamentos, química ambiental, método de Karl Fisher para titulación de H2O y entitulometría en general con las ventajas inherentes al microescalamiento en cuanto costos, generación de desechos y tiempos de operación, además del ahorro de disoluciones patrón de NaOH en particular.
• Fue posible detectar cantidades en el intervalo de 10 a 60 de HCl, lo que representa una ventaja en sensibilidad con respecto a la volumetría convencional.
• La introducción del sistema micropotenciométrico acredita la precisión y exactitud de la cuantificación y la posibilidad de caracterización termodinámica del sistema analizado.
• La metodología propuesta hace viable la enseñanza experimental de las Leyes de Faraday y de los métodos coulombimétricos de análisis.
BIBLIOGRAFÍA
1. BOTT, A. W.; HEINEMAN, W. R. "Chronocoulometry". Current Separations.2004, 20, 4, p. 121-126.
2. TOCK, J. T. "CoulometricTriatons in Nonaqueous Media". Journal of Chemical Education.1973, 50, April, p. 268-269.
3. BARD, A. J. "Electroanalysis and Coulometric". Analytical Chemistry. 1966, 38, April, p. 88-92.
4. EHL, R. G.; IHDE, A. "Faraday’s Electrochemical Laws and the Determination of Equivalent Weights". Journal of Chemical Education. 1954, 31, May, p. 226-232.
5. PINGARRÓN, J. M.; SÁNCHEZ BATANERO, P.Química Electroanalítica. Fundamentos y aplicaciones. 2a ed. Madrid: Editorial Síntesis, 2003.
6. WOLFGANG, A.; LAZOS MARTÍNEZ, R. J. GUM Guía para estimar la incertidumbre de una medición. México: CENAM, 2004.
7. VIM (vocabulario internacional de metrología. Conceptos fundamentales y generales, y términos asociados). 3a ed. Madrid: Centro Español de Metrología, 2008.
8. BAEZA, A. "Microbureta a Microescala total para titulometría". Rev. Chil. Educ. Cient. 2003, 1, 2, p. 4-7.
9. BAEZA, A. "Titulaciones ácido-base potenciométricas a microescala total con microsensores de pH y de referencia de bajo costo". Rev. Chil. Educ. Cient. 2003, 1, 2, p. 16-19.
10. VARGAS, J.; BAEZA, A.; URZÚA, T.; RODRÍGUEZ, J.; CÁCERES, L. "Titulaciones ácido-base a microescala química usando microsensores de pH y microelectrodo de referencia: Adquisición de datos con nuevas tecnologías". Rev. Chil. Educ. Cient.2004, 2, 2, p. 25-29.
11. BAEZA, A.; DE SANTIAGO, A.; GALICIA, E."Titulaciones de halogenuros a microescala total con microsensores de Ag y de microreferencia de bajo costo sin puente salino". Rev. Chil. Educ. Cient.2004, 3, 1, p. 22-25.
12. MARTÍNEZ, J. M.; BAEZA, A. "Química Microanalítica, determinación de ácido acetilsalisílico (FEUM) con Microfotocolorímetro de Mínima Instrumentación MIMC, de bajo costo". Revista Cubana de Química. 2004, 16, 3, p. 29-39.
13. CASSANOVA, J.; BAEZA, A. "Estudio integral del cloro en desinfectantes hospitalarias con Micropolarógrafo de Mínima Intrumentación, MIMP". Revista Cubana de Química. 2005, 18, 1, p. 43-51.
14. VIERNA, L.; GARCÍA MENDOZA, A.; BAEZA, A."Microscale Analytical Potentiometry: Experimental Teaching with Locally Produced Low-Cost Instrumentation". Journal of Modern Education Review. 2013, 3, 5, p. 407-415.
Recibido: 05/04/2014
Aceptado: 20/05/2014
Dr. Alejandro Baeza-Reyes. Facultad de Química, Ciudad Universitaria, D.F., México, baeza@unam.mx

























