Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.26 no.3 Santiago de Cuba sep.-dic. 2014
ARTICULOS
Ácido linoleico conjugado: de la naturaleza al uso de la biotecnología
Conjugated linoleic acid: from nature to biotechnological use
Dr. C. José R. León-SánchezI, Dra. C. María de la Paz Salgado-CruzII, Dra. C. María de la Luz Sánchez-MundoIII, Dr. C. Alejandro de Jesús Cortés-SánchezIV
I Facultad de Medicina, Universidad Autónoma del Estado de México, México, D. F. jrleon_94@hotmail.com
II Instituto Politécnico Nacional, Escuela Nacional de Ciencias Biológicas, México, D. F. sacpaz@hotmail.com
III Instituto Tecnológico Superior de las Choapas, Departamento de posgrado e investigación, Veracruz, México. qfbluzsanchez@hotmail.com
IV Comisión Federal para la Protección contra Riesgos Sanitarios, Departamento de Microbiología, México, D.F. alecortes_1@hotmail.com
RESUMEN
Ácido linoleico conjugado (ALC) es el nombre con el que se designa a una mezcla de isómeros posicionales, conjugados con isomería cis-trans del ácido linoleico. Hay evidencia de que estos compuestos presentan propiedades bioactivas benéficas para la salud, tales como efecto inmunomodulador, anticancerígeno, antidiabético, regulador del peso, antiarterioesclerótico, entre otros. El ALC puede ser obtenido de la leche y sus derivados, así como de productos cárnicos de mamíferos rumiantes. Sin embargo, científicos alrededor del mundo se han esforzado en la búsqueda de procesos biotecnológicos para la obtención de este bioactivo, así como de incrementar su presencia en fuentes tradicionales. Por tanto, el objetivo del presente trabajo es proporcionar un panorama general de la naturaleza del ALC, sus fuentes, propiedades biológicas y beneficios saludables debido al consumo, así como su obtención en condiciones in vitro a partir del uso de herramientas biotecnológicas tales como microrganismos y enzimas más allá de fuentes convencionales.
Palabras clave: lípidos, fermentación, ácido linoleico conjugado.
ABSTRACT
Conjugated linoleic acid (CLA) is the name that designates a mixture of positional isomers, conjugated with cis-trans isomerism of linoleic acid. There is evidence that these bioactive compounds have properties beneficial to health, such as effects anticancer, immunomodulatory, anti-diabetic, and weight regulators, anti-arteriosclerotic, among others. CLA can be obtained from milk, dairy products and meat from ruminants mammals. Nevertheless, scientists around the world have struggled in finding biotechnological processes for obtaining this bioactive and increase its presence in traditional sources. Therefore, the aim of this paper is to provide an overview of the nature of the CLA, its sources, biological properties and health benefits, and obtaining in vitro conditions through the use of biotechnological tools such as microorganisms and enzymes beyond conventional sources.
Keywords: lipids, fermentation, conjugated linoleic acid.
INTRODUCCIÓN
Lípidos
Los lípidos son un grupo de compuestos orgánicos de diversas estructuras. Desempeñan un papel importante en la nutrición de animales superiores, entre los que se encuentra el hombre. Se pueden obtener de diferentes fuentes naturales animales y vegetales, como el aceite de cártamo, maíz, soya, girasol, oliva, algodón, pescado, la carne, huevo, productos lácteos e hígado. Algunos de estos compuestos son de naturaleza esencial para los mamíferos, ya que al no poder ser sintetizados debido a la carencia de enzimas capaces de incorporar dobles enlaces en cadenas hidrocarbonadas después del carbono 9, es necesario obtenerlos a partir de fuentes exógenas, tal es el caso de los ácidos grasos polinsaturados, específicamente el ácido linoleico ?-6 (18:2) y el ácido linolénico ?-3 (18:3) /1-3/. Los lípidos tienen como característica principal ser insolubles en agua y solubles en disolventes orgánicos /4/; además, realizan múltiples funciones biológicas. A nivel estructural son componentes principales de membranas celulares, participan en el metabolismo celular como reserva de energía, su aporte energético es mayor al de otras biomoléculas, o como carbohidratos y proteínas. Actúan como vehículos de transporte de vitaminas, facilitando su absorción y, además, poseen actividades hormonales reguladoras y térmicas /4-6/.
Ácidos grasos
Se consideran los constituyentes básicos de los lípidos; presentan un grupo funcional carboxilo y diferentes longitudes de cadena hidrocarbonada (figura 1). Se encuentran en estado libre a bajas concentraciones o de manera más abundante y general, formando múltiples estructuras con otras diferentes moléculas mediante enlaces éster. Los ácidos grasos C16 y C18 (ácido palmítico, oleico, linoleico y esteárico) predominan en los vegetales y animales /4, 7, 8/.
Los ácidos grasos pueden ser clasificados sobre la base del número de los enlaces entre los átomos de carbono constituyentes como: a) ácidos grasos saturados, cuando su cadena estructural hidrocarbonada no presenta dobles enlaces, la mayoría sólidos a temperatura ambiente, a excepción de los de cadena corta, y b) ácidos grasos no saturados o insaturados, cuando presentan uno o más dobles enlaces /4, 8/. Los ácidos grasos insaturados pueden presentar isomería geométrica y exhibir los isómeros cis-trans en sus dobles enlaces. El isómero cis se encuentra en la naturaleza y puede estar conjugado dentro de la cadena o separado por un grupo metileno /6/. En general, los lípidos se localizan en una gran variedad de alimentos de origen animal y vegetal; sin embargo, hay que señalar que la composición nutricional, el contenido y la clase de lípidos pueden variar en función de factores como el clima, suelo, variedades de plantas, cruce y el cuidado de animales /9/.
Componentes bioactivos en los alimentos
Los alimentos contienen nutrimentos o ingredientes que pueden modular algunas funciones fisiológicas específicas en el organismo, de este modo proporcionan efectos benéficos a la salud del consumidor, y contribuyen a disminuir la incidencia de ciertas enfermedades crónicas /10, 11/ catalogadas como no transmisibles (cáncer, aterosclerosis, obesidad, diabetes y osteoporosis) que afectan hoy día a la población mundial, las cuales tienen correspondencia con el exceso y/o con la falta de consumo de ciertos alimentos y la ausencia de actividad física. Estos factores son, al igual que la necesidad de mantener una buena calidad de vida mediante la conservación de la salud, los motivos que han promovido el estudio de los efectos de la dieta alimenticia /12-14/. Al generarse, de manera continua y cada vez mayor, la evidencia de alimentos con beneficios a la salud, este tipo de alimentos denominados funcionales, actualmente ya forma un mercado en constante crecimiento y constituye un factor de promoción del desarrollo de productos diseñados para cubrir necesidades específicas de salud, debido a que la acción de los alimentos funcionales se basa en la presencia de sus ingredientes o compuestos bioactivos /10, 11/.
Los componentes bioactivos en los alimentos funcionales ejercen su actividad en múltiples sistemas, como son: el gastrointestinal, cardiovascular e inmunológico, donde se comportan como potenciadores del desarrollo y la diferenciación, moduladores del metabolismo de nutrientes, la expresión génica, el estrés oxidativo y la esfera síquica. Se han identificado innumerables sustancias con actividad funcional en los alimentos tales como: la fibra soluble e insoluble, fitosteroles, fitoestrógenos, lípidos (ácidos grasos mono insaturados y polinsaturados), péptidos, derivados fenólicos, vitaminas y otros fitoquímicos /15, 16/.
Lípidos como ingredientes funcionales de los alimentos
Los lípidos son considerados macronutrientes y, en la actualidad, las metas nutricionales de todos estos se dirigen no solo a disminuir los riesgos de desnutrición, sino también a reducir el desarrollo de enfermedades crónicas no transmisibles (ECNT) asociadas con la alimentación . Los lípidos de origen vegetal destacan por su interés nutricional y farmacológico, entre los cuales se encuentran los isoprenoides y ácidos grasos esenciales. Los isoprenoides se clasifican en terpenos, esteroides e isoprenoides mixtos. Dentro de los terpenos, los más representativos son los carotenoides y el escualeno, ampliamente distribuidos en vegetales, y a los cuales se les han atribuidon propiedades antioxidantes.
En los esteroides se hallan los fitoesteroles y fitoestanoles como los miembros más significativos, con estructuras semejantes al colesterol animal; han mostrado propiedades inmunomoduladoras y anticancerígenas, y los isoprenoides mixtos como los tocoferoles y tocotrienoles, a los cuales se les han atribuido propiedades antioxidantes. Los tocotrienoles han presentado una mayor actividad farmacológica que los tocoferoles, así como efectos preventivos contra diversos tipos de cáncer y enfermedades cardiovasculares /12/ .
Los ácidos grasos polinsaturados (PUFA) son aquellos que poseen uno o más dobles enlaces en su cadena hidrocarbonada. Los ácidos grasos ?-3 y ?-6, cuyas posiciones de la doble ligadura están en los carbonos 3 y 6 de la cadena hidrocarbonada –se considera como carbono 1 el grupo metileno terminal-, están catalogados como esenciales, ya que no pueden ser sintetizados por el ser humano /17/.
Las fuentes naturales de estos ácidos grasos son el aceite de oliva, girasol, uva, maíz y soya, que contienen ácidos grasos principalmente monoinsaturados ?-9, y polinsaturados ?-6, mientras que los aceites de canola, chía y linaza presentan un contenido elevado de ácidos grasos omega-3. Además, los aceites de origen marino se caracterizan por su alto contenido de ácidos grasos ?-3 y de ácidos grasos polinsaturados ?-3 de cadena larga, como el ácido eicosapentaenoico (EPA)(C20:5) y el ácido docosahexaenoico (DHA)(C22:6). El EPA y DHA son muy valorados por los efectos benéficos en la salud, nutrición humana y animal durante su consumo, ya que el EPA disminuye los triglicéridos y el colesterol sanguíneo, baja la presión vascular, presenta efectos antitrombóticos y antinflamatorios; mientras que el DHA es primordial para la formación y función del sistema nervioso y visual en el hombre y mamíferos en general, ya que contribuye al trabajo neuronal, funciones de aprendizaje y memorización /18/.
Además, se ha encontrado que EPA y DHA aumentan la actividad de drogas anticancerígenas. Otras propiedades atribuidas a los ?-3 son la inhibición de la angiogénesis y citotoxicidad sobre células tumorales /17/. Por otra parte, existen productos de origen animal, específicamente la carne y leche de rumiantes, que presentan intermediarios del metabolismo de ácidos grasos (ácido linoleico), los cuales presentan una importancia nutricional y funcional debido a sus efectos biológicos benéficos a la salud, como es el caso del ácido graso ?-6 denominado ácido linoleico conjugado (ALC) /19, 20/. Por tanto, el objetivo del presente documento es dar a conocer un bosquejo general de la naturaleza del ALC, sus fuentes naturales, propiedades biológicas y beneficios a la salud de sus consumidores, así como de su obtención en condiciones in vitro a partir del uso de herramientas biotecnológicas como son los microrganismos y enzimas.
Naturaleza y origen del ALC
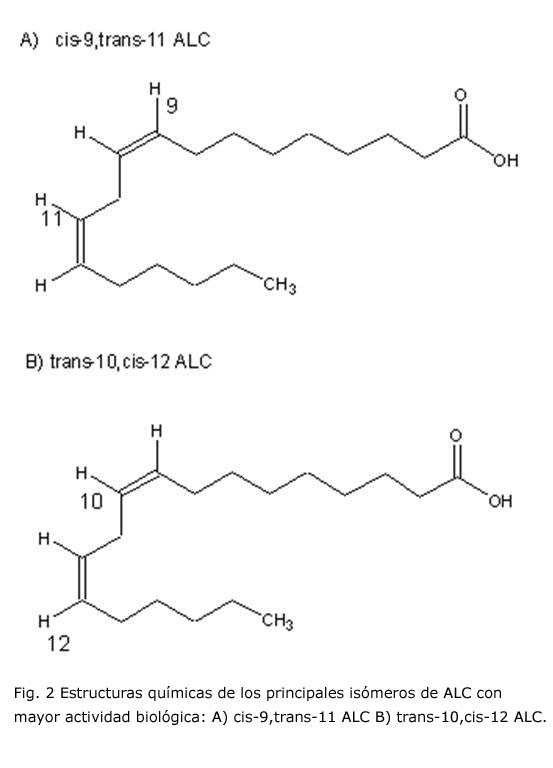
El término "ácido linoleico conjugado" (ALC) designa la mezcla de isómeros geométricos y posicionales del ácido linoleico (C18:2, cis-9,cis-12 ácido octadecadienoico) con dobles enlaces conjugados. Dichos isómeros son cis-9,cis-11 ácido octadecadienoico, cis-10,cis-12 ácido octadecadienoico, cis-10,trans-12 ácido octadecadienoico, cis-11,cis-13 ácido octadecadienoico, trans-9,cis-11 ácido octadecadienoico, trans-9,trans-11 ácido octadecadienoico, trans-10,trans-12 ácido octadecadienoico, cis-9,trans-11 ácido octadecadienoico, trans-10,cis-12 ácido octadecadienoico /21, 22/. Estos dos últimos isómeros destacan por su importancia biológica. Además, el cis-9,trans-11 representa comúnmente del 80 al 90 % del total de ALC, y el trans-10,cis-12 (figura 2) se localiza en pequeñas proporciones que oscilan entre el 3 y el 5 % en los lípidos de la leche y derivados, así como en la carne y grasa del ganado ovino y bovino, las que constituyen sus principales y mayoritarias fuentes, donde factores como la dieta, edad, raza del animal y los estacionales pueden incidir con variaciones en su proporción /23-28/.
Cabe señalar que, a pesar de ser la leche, derivados lácteos y cárnicos de mamíferos rumiantes la mayor fuente de ALC, este ha sido localizado, pero en menores cantidades en diferentes aceites vegetales y cárnicos de origen aviar y porcino /24/.
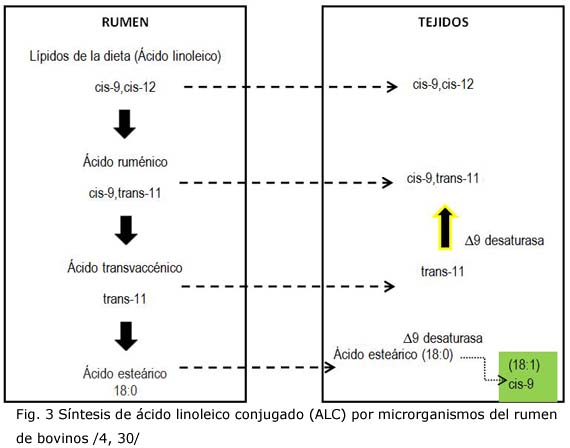
Se estima que la proporción general del ALC en los alimentos se ve habitualmente desarrollada por procesos térmicos a elevadas temperaturas como la pasteurización y fritura de carnes, entre otros, esto explicaría en parte porqué algunos lácteos contienen mayores cantidades /24, 29/. La microflora del rumen en animales rumiantes como bovinos, ovinos y caprinos está relacionada con la generación de ALC y, por ende, su presencia en sus diferentes productos alimenticios; tal es el caso de las bacterias gram negativas como Butyrivibriofibrisolvens y Megasphaera elsdenni, a través de procesos de fermentación donde se involucran etapas de hidrólisis por medio de lipasas, biohidrogenaciones parciales y oxidación de ácidos grasos polinsaturados constituyentes del alimento ingerido por estos animales /22, 30-32/.
El ácido ruménico (isómero cis-9, trans-11), un metabolito intermediario, es el isómero más abundante sintetizado y es absorbido e incorporado a tejidos, o bien sometido a reacciones de biohidrogenación para formar ácido vaccenico (trans-11 octadecanoico). Al absorberse el ácido vaccénico puede acumularse o ser convertido en cis-9, trans-11 por incorporación de un doble enlace cis en posición 9, gracias a la acción de la enzima ?-9 desaturasa presente en el intestino, glándulas mamarias, hígado y tejido adiposo (figura 3) /2, 29/.
Por esta razón, los mamíferos son su principal fuente de origen y, por ende, puedan estar presentes en algunos alimentos derivados como lácteos y cárnicos (tabla 1) /25, 33, 34/. Sin embargo, las cantidades totales y las proporciones de los isómeros del ácido linoleico conjugado estarán igualmente influidas por la naturaleza de la población microbiana del rumen y tipo de alimentación del animal /29/.
Tabla 1. Contenido de ALC en diferentes alimentos /20, 24, 29/
| Alimento | mg/g de lípidos |
| Leche homogeneizada | 5,5 |
| Leche condensada | 7,0 |
| Suero de leche | 5,4 |
| Yogur | 4,8 |
| Mantequilla | 4,7 |
| Requesón | 4,5 |
| Queso riccota | 5,6 |
| Queso mozarella | 4,9 |
| Queso cottage | 4,5 |
| Queso cheddar | 4,1 |
| Carne de cordero | 5,8 |
| Carne de vaca | 4,3 |
| Carne de ternera | 2,7 |
| Pollo | 0,9 |
| Yema de huevo | 0,6 |
| Aceite de oliva | 0,2 |
| Aceite de girasol | 0,4 |
| Aceite de cacahuate | 0,2 |
| Carne de cerdo | 0,6 |
Propiedades biológicas del ALC
Se han reportado de manera continua los efectos benéficos a la salud de la ingesta de ALC, entre los que se encuentran: la reducción de la hipertensión, inflamación /20/, así como de la grasa corporal y un aumento de la masa magra, presenta efectos hipocolesterolémicos y antiaterogénicos, al producir una disminución de los niveles plasmáticos de colesterol a través de modelos experimentales con animales /2, 11, 35, 36/.
El ALC puede presentar efectos estimulantes en el sistema inmunológico, principalmente en la síntesis de inmunoglobulinas IgA, IgG, IgM y a la disminución significativa de los niveles de IgE, por lo que se especula que este compuesto puede presentar resultados favorables en la prevención y/o tratamiento de algunas alergias de origen alimentario /2, 37/. Se ha reportado, además, un efecto anticancerígeno, principalmente en el de tipo mamario y de melanoma colo-rectal, al tener efectos citotóxicos en cultivos de células cancerígenas /2, 38, 39/. Así mismo, este lípido ha mostrado efectos antioxidantes, ya que el estudio de ALC en modelos in vivo produce una disminución de los niveles de peróxidos y de sustancias reactivas al ácido tiobarbitúrico, mientras que estudios realizados in vitro han demostrado una actividad antioxidante por parte de ALC, al presentar una efectiva capacidad para atrapar radicales libres prooxidantes. Sin embargo, aunque existe evidencia sobre los efectos antioxidantes del ALC, la controversia debido a que el ácido graso in vitro oxida con mayor velocidad ácidos grasos de mayor polinsaturación, como los ácidos eicosapentaenoico (20:5) y docosahexaenoico (22:6) /2/. Finalmente, el ALC ha mostrado efectos antimicrobianos en forma de sales de potasio. En diversos estudios se ha verificado una inhibición para el crecimiento de bacterias patógenas gram negativas (P. aeruginosa, S. thyphimurium, V. parahemolyticus, K. pneumoniae y P.mirabilis), así como gram positivas (Bacilluscereus, S. aureus y S. mutants). El efecto de inhibición es más marcado en estas últimas cepas /22/.
Se han postulado teorías para explicar los mecanismos de acción benéfica del ALC. Una de ellas propone que el ALC reduce la cantidad de ácido araquidónico (AA) en los fosfolípidos de membranas celulares, lo que da como resultado una menor proporción de AA y, por ende, una disminución en la generación de productos intermedios de eicosanoides como prostaglandinas E2 (PGE2) y leucotrieno B4 (LTB 4), involucrados en procesos de desinflamación y cáncer. Otra teoría consiste en un modelo que pretende explicar los efectos benéficos del ALC, tomándolo como un regulador de la expresión genética que puede controlar procesos metabólicos de los lípidos, balance energético y la función inmune /20, 40/. Se ha propuesto, además, que el ALC compite con el ácido araquidónico (C20:4) en la reacción bioquímica de la cicloxigenasa, por lo que lleva a cabo una reducción en la concentración de prostaglandinas y tromboxanos de la serie II, además de poder suprimir la expresión génica de la cicloxigenasa y disminuir la liberación de citoquinas proinflamatorias como TNF-alfa e interleukina en animales /40, 41/. Este lípido también parece activar los factores de transcripción PPARs, reducir el paso inicial en la activación del NF-kappa B y minimizar las citoquinas, moléculas de adhesión y de otros tipos de moléculas inducidas por el estrés /40, 42/. Sin embargo, aun se menciona que se requieren más estudios in vivo e in vitro para poder esclarecer detalladamente los mecanismos por los cuales el ALC genera sus efectos benéficos al consumidor /20, 40/.
Por los efectos biológicos benéficos a la salud asociados al consumo de ALC y debido a la baja proporción del mismo en los alimentos, resulta conveniente e interesante la búsqueda y generación de procesos biotecnológicos que permitan la obtención de estos compuestos biológicamente activos en mayor cantidad, ya sea en la fuente lipídica de los alimentos, o como ingredientes funcionales para su posterior incorporación (fortificación) en los mismos, y de alimentos nutracéuticos /25/. Sin embargo, la seguridad es un asunto de vital importancia en el uso de diversas sustancias.
Si alguna sustancia no es segura cuando se usa según lo previsto, no debe ser utilizada o vendida como ingrediente alimentario o suplemento dietético, independientemente de si es fisiológicamente efectiva. Los ensayos en animales son comúnmente empleados en evaluaciones preclínicas de la seguridad de nuevos ingredientes alimentarios. Por lo tanto, el ALC es evaluado en diferentes estudios toxicológicos en animales. No se observan efectos adversos en dichas pruebas. La publicación de estudios en animales y ensayos clínicos indican la posibilidad de que el ALC pueda ser de utilidad en la mejora de la salud humana en diversas áreas (anticarcinogénicas, reducción de la inflamación, hipertensión, aterosclerosis, asma en modelos animales y síntomas de la diabetes en algunos modelos) y, en particular, en la reducción de la ganancia de grasa corporal, mejora de la respuesta inmune contra antígenos virales y mejora de perfil de lípidos en sangre /43/.
Generación y obtención de ALC
En la actualidad el ALC puede ser obtenido para propósitos industriales a partir de aceites vegetales que son procesados a elevadas temperaturas. Para ello se emplea como método básico con enfoque industrial la isomerización del ácido linoleico por catálisis alcalina, mediante el uso de etilenglicol como solvente, e hidróxido de potasio o alcóxido de potasio como catalizador. La separación del catalizador al final de la reacción es realizada por neutralización con ácido ortofosfórico. A través de la catálisis básica la proporción de los isómeros c9,t11 y t10,c12-ALC es casi igual (selectividad 50 %) y se obtiene un rendimiento alto por encima del 80 %. No obstante, este método no se puede aplicar directamente en la transformación de aceites vegetales con triacilgliceroles ricos en ALC debido a que los enlaces éster se hidrolizan, originando ácidos grasos libres, sales o glicerina, además de que es poco compatible desde el punto de vista ambiental /23/.
El ALC puede ser sintetizado químicamente mediante reacciones de deshidratación de ácidos grasos hidroxilados o por fotoisomerización de ácidos grasos polinsaturados, así como por aceites abundantes en estos ácidos grasos. Pero los bajos rendimientos, costosos pasos de purificación e inseparabilidad de los isómeros limitan, de manera comercial, el uso de la mayoría de los métodos químicos de síntesis /44/.
Gangidi y Proctor /45/ realizaron la síntesis de isómeros de ALC mediante la fotoisomerización del ácido linoleico presente en el aceite de soya en razón de su exposición a una lámpara UV de mercurio de 100 W durante 120 h. Se analizaron los productos de la fotoisomerización por CG, ATR-FTIR y H1-RMN, y se reportó una mayor proporción de ALC en su isómero cis-9,trans-11 (c9:t11) del 0,6 % a las 84 h de exposición. Sin embargo, los tiempos prolongados de exposición y bajos rendimientos son limitaciones para el uso de esta técnica. Por tanto, investigadores se han dado a la tarea de buscar nuevas fuentes y metodologías para la obtención de ALC compatibles con el medio ambiente, como la biosíntesis microbiana, una opción potencial, ya que se ha encontrado que existe una variedad de microrganismos con isomerasas específicas capaces de trasformar el ácido linoleico a ALC más allá de los presentes en el rumen de mamíferos rumiantes en condiciones de laboratorio /23/, como son los cultivos lácteos iniciadores /46/. Durante la fermentación de la leche se obtiene una gran variedad de componentes bioactivos y productos derivados de diferentes reacciones de degradación de biomoléculas constituyentes (azúcares y proteínas) /47/: ácidos orgánicos (láctico, pirúvico, fórmico, acético y propionico), acetaldehídos, acetona, acetoina, biacetilos y péptidos.
Cepas de los géneros Bifidobacterium, Enterococcus, Lactococcus, Propionibacterium, Streptococcus y Lactobacillus han sido identificadas como productoras de ALC a partir de ácidos grasos polinsaturados como el ácido linoleico. Se indica, además, que la producción de ALC puede aumentar mediante reacciones de biohidrogenación del ácido linoleico por Bifidobacterias y algunos otros microrganismos.
Por otra parte, se ha reportado que en productos fermentados de la leche se presentan condiciones, como la concentración de sustrato, que limitan la proporción de ALC, donde un elevado nivel de ácidos grasos insaturados de cadena larga inhibe no solo el crecimiento celular, sino también etapas generales de biohidrogenación, especialmente en bacterias gram positivas, al carecer de una membrana externa /20, 28, 46-49/.
Las bacterias del género Propionibacterium son de importancia industrial por sus múltiples aplicaciones esenciales para la elaboración de quesos tipo suizos, responsables del desarrollo de características de sabor y formación de ojos. Estos microrganismos son aptos para utilizarse como sustrato y convertir el ácido linoleico libre presente en ALC extracelular bajo condiciones anaerobias (5 % CO2, 8 % H y 87 % N2) utilizando medio de cultivo Mann-Rogosa-Sharpe (MRS) a 20 °C durante 72 h, en donde P. freudenreichii subsp. f reudenreichii Propioni-6 Wiesby presentó una producción máxima de ALC en su isómero c9,t11-18:2 con 246 µg/mL a una concentración de ácido linoleico libre como sustrato de 750 µg/mL para posteriormente, al incrementar la concentración de sustrato, mostrar inhibición en el crecimiento bacteriano y generación de ALC. Así mismo P. freudenreichii subsp. Shermanii 9093, presentó una generación de ALC c9,t11-18:2 de 100,1 µg/mL a 500 µg/mL de ácido linoleico para que luego, al incrementar la concentración del sustrato, disminuyera el crecimiento microbiano y la generación de ALC /46/.
De igual forma cepas de Propionibacterium freudenreichii ssp. shermanii logran llevar a cabo reacciones de isomerización en el ácido linoleico para generar ALC en fermentaciones tipo batch a pH controlado con temperaturas de 30 °C durante 72 h, en un medio de cultivo constituido por suero de leche suplementado con ácido linoleico (600-2 000 µg/mL/L). La máxima generación ocurre en la fase exponencial de crecimiento. Ello y una producción de ALC aunada al ácido linoleico inicial adicionado dan lugar a concentraciones por encima de 2 000 µg/mL/L /50/.
Por otra parte Conte-Junior y Soncin /48/ reportaron la generación de ALC en un medio suplementado con ácido linoleico fermentado durante 48 h por Lactobacillusgasseri, Lactobacillusfermentum, Lactobacillussalivarius, Lactobacilluscoryniformi, Enterococcusfaecalis, Enterococcusfaecium y Enterococcusfaecium, en condiciones aerobias y anaerobias. Las cepas de Lactobacillus resultaron las mejores en la síntesis de ALC 9-cis,11-trans (c9:t11) y 10-trans,12-cis (10t:12c) en ausencia de oxígeno, mientras que las cepas del género Enterococus fueron las mejores productoras bajo condiciones aeróbicas. Bacterias consideradas probióticas del genero Lactobacillus, Streptococcus y Bifidobacterium, como L. casei, L. plantarum, L. acidophilus, L. delbrueckiisubspbulgaricus, B. infantis, B. breve, B. longum y S. salivarius subsp . Thermophilus son capaces de producir los isómeros de ALC cis-9,trans-11 y trans-10,cis-12 de manera individual durante su crecimiento en medio MRS complementado con 0,5 g/L de ácido linoleico y tween-80 durante 24 h a 37 °C. Su producción es inclusive mayor de manera individual que de manera mixta /51/. Lactobacillusrhamnosus PL60 aislada de heces fecales de infantes y alimentos fermentados y cultivada en medio skimmilk, con un contenido de 0,01 % de ácido linoleico, es capaz de producir los isómeros de ALC c9,t11 y t10,c12 en 2836 y 1602 µg/mg de proteína, y muestra, además, efectos antiobesidad en modelos experimentales de ratones /52/.
Kishino et al. /53/ realizaron una búsqueda de bacterias productoras de ALC, algunas de ellas de origen láctico como: Enterococcus faecium AKU 1021, Pediococcus acidilactici AKU 1059, Propionibacterium shermanii AKU 1254, Lactobacillus acidophilus AKU 1137, L. acidophilus IAM 10074, L. acidophilus AKU 1122, L. brevis IAM 1082, L. paracasei subsp. p aracasei IFO 12004, L. paracasei subsp. paracasei JCM 1109, L. paracasei subsp. paracasei AKU 1142, L. paracasei subsp. paracasei IFO 3533, L. pentosus AKU 1148, L. pentosus IFO 12011, L. plantarum AKU 1138, L. plantarum AKU 1009a, L. plantarum JCM 8341, L. plantarum JCM 1551 y L. rhamnosus AKU 1124.
Las cepas fueron inoculadas y cultivadas en medio MRS complementado con ácido linoleico al 0,06 %, contenido en tubos con tapón de rosca e incubados bajo condiciones limitantes de oxígeno entre 24 y 72 h a 28 °C con agitación de 120 stroke/min. Se reportó que todas las cepas mencionadas fueron productoras de ALC y, entre estas, la de mayor producción correspondió a L. plantarum AKU 1009 con 3,41 mg/mL de ALC total en proporción de isómeros ALC1 y ALC2 de (0,25:3,16), cis-9, trans-11- o trans-9, cis -11-18:2; ALC2 ( trans-9, trans-11-18:2), seguida de L. plantarum JCM 1551 con 2,02 mg/mL de ALC total en proporción de ALC1 y ALC2 (0,10:1,92) y Lactobacillus acidophilus AKU 1137 con 1,50 mg/mL de ALC total y una proporción de ALC1 y ALC2 (0,85:0,65). Se analizó, además, el efecto de la concentración del ácido linoleico como sustrato (0,06:0,1 y 0,2 % (p/v)) en la generación de ALC por L. plantarum AKU 1009. Se indicó que la mayor producción se efectúa a concentraciones de 0,06 %, mientras que a concentraciones menores que 0,06 % no tiene efecto sobre el crecimiento celular, y concentraciones por encima de 0,2 % inhiben el crecimiento y producción de ALC. Así mismo se realizaron estudios del efecto del oxígeno sobre la producción de ALC, que reportaron que, tanto en condiciones aerobias como en atmosferas de oxígeno absorbido, la producción de ALC fue casi la misma.
Por otra parte, al usar como sustrato productos lácteos reducidos en algún ingrediente, Elena et al. /54/ encontraron que L. acidophilus La5 es capaz de convertir ácido linoleico en ácido linoleico conjugado al fermentar leche baja en grasa (0,5 % de grasa) adicionada con 0,2 % de ácido linoleico y 0,4 % de tween 80 a 37 °C, en condiciones atmosféricas de nitrógeno durante 72 h. Se indica que la presencia de ácido linoleico libre es necesaria para la conversión en ALC, el isómero ALC1 (c9,t11) se encuentra presente en las leches sin fermentar y solo la generación de ALC2 (c10,t12) y ALC3 (t11,t13) ocurre durante su fermentación de la leche adicionada con ácido linoleico libre. La cinética máxima de producción es de 8,1; 6,2 y 4,4 µg/g de grasa para ALC1, ALC2 y ALC3, respectivamente, a las 72 h de fermentación.
Hennessy et al. /55/ mencionan que varias bacterias lácticas consideradas probióticas, como los Bifidobacterium, tienen la capacidad de producir ALC en sus isómeros c9,t11 y t9,t11, a partir de la conversión de ácido linoleico. Un estudio relacionado reportó la bioconversión de ácido linoleico en ALC, principalmente en su isómero c9,t11 por Bifidobacterium breve NCIMB 702258, utilizando como medio de cultivo leche descremada reconstituida (20 % p/v) adicionada con 0,35-0,4 mg/mL de ácido linoleico y diferentes suplementos como lactulosa, extracto de levadura, hidrolizado de caseína, triptona, hidrocloruro de cisteína, sacarosa, fructosa, glucosa, maltosa, acetato de sodio, butirato de sodio, propionato de sodio, butilhidroxianisol, butilhidroxitolueno y alfa-tocoferol durante 43 h a 37 °C en condiciones anaeróbicas. Se reportó que los mayores porcentajes de bioconversión en ALC (c9,t11) se obtuvieron con suplementos de acetato de sodio (100 mmol/L) y propionato de sodio (100 mmol/L) con 47,96 y 46,92 %, respectivamente, seguidos del hidrolizado de caseína (20 mg/mL) y extracto de levadura (20 mg/mL) con 42,4 % y 44,56 %, respectivamente. Estos valores fueron mayores que el obtenido en la conversión de ácido linoleico en ALC sin adición de ningún suplemento con 15,52 %.
A partir de este conocimiento se pueden desarrollar medios de cultivo rentables a base de leche, donde concentraciones de ALC (c9,t11) equivalen a las obtenidas en medios sintéticos con tasas de bioconversión del 58,8 %.
Por otra parte, Ramírez Baca /56/ reportó que utilizando leche entera en polvo adicionada con bacterias lácticas liofilizadas de L. acidophilus como cultivo puro, o en asociación (cultivo mixto) con S. thermophilus y L. bulgaricus, en una misma fermentación, no muestran diferencia significativa debida al tipo de microrganismo y el tiempo de incubación. El mismo autor señala que los microrganismos de cultivos tanto puros como mixtos son una alternativa para obtener ALC de forma natural a partir de los alimentos, debido a su alta capacidad de multiplicación y su seguridad microbiana. Ello los convierte en un mecanismo inocuo para la obtención del ALC, por lo que sugiere que es necesario continuar con estudios in vitro sobre su uso para la producción de ALC en alimentos y determinar los mecanismos de acción involucrados en su síntesis con diferentes cepas bacterianas probióticas y tiempos de incubación más prolongados.
Se han realizado estudios de la producción in vitro de ALC no solo por bacterias lácticas y probióticas, sino también organismos fúngicos. Se reporta que existen diversos hongos y levaduras productores de ALC en su isómero cis-9,trans-11 del ácido octadecadienoico a partir del ácido trans-vaccénico (t-VA, ácido trans-11-octadecenoico) mediante reacciones de desaturación de ácidos grasos debido a la alta especificidad de la enzima (?9-desaturasa) responsable de la reacción en el sustrato (tabla 2). La cepa de Delacroixiacoronata mostró una mayor producción de ALC total (ALC1 y ALC2) con 166 µg/mL y ALC1 como su principal isómero 133 µg/mL /57/.
Tabla 2. Organismos fúngicos productores de ALC a partir de t-VA /57/
| Hongo/Levadura | ALC1 µg/mL | ALC2 µg/mL | ALC total µg/mL |
| Delacroixiacoronata IFO 8586 | 133 | 32,7 | 166 |
| Mortierellaisabellina IFO 8572 | 101 | 17,6 | 119 |
| M. alpina CBS 219,35 | 25,2 | 89 | 114 |
| M. hygrophila IFO 5941 | 40,7 | 71,3 | 112 |
| M. bainieri IFO 8569 | 97,7 | 13,7 | 111 |
| M. chlamydospora CBS 529,75 | 18,3 | 84 | 102 |
| M. ramanniana var. ramanniana | 77,1 | 2,9 | 78 |
| Pichia farinosa AKU 4262 | 19,8 | No detectado | 19,8 |
| P. wickerhamii AKU 4258 | 15,4 | No detectado | 15,4 |
| Saccharomycesrouxii AKU 4118 | 13,7 | 1,8 | 15,5 |
Existen factores que afectan la producción de ALC por Delacroixiacoronata como es la naturaleza del sustrato, ya sea en su forma libre t -VA o como ésteres metílicos de t -VA ( t -VAME); la generación de ALC es ligeramente mayor con esta última. Así mismo el uso de agentes surfactantes no iónicos como Triton X-100 (0,04 % p/v) produce grandes cantidades de ALC a partir de t-VAME en medio GY (glucosa 5 %, extracto de levadura 1 %); sin embargo, el uso de surfactantes catiónicos (monohidrato de cloruro de hexadecilpiridinio y monohidrato de cloruro de cetilpiridinio) genera inhibición en la producción de ALC. Mientras que, al analizar el efecto de varias fuentes de carbono por separado, a una concentración de 2,5 % (glucosa, almidón, dextrina, maltosa, fructosa, sorbitol, lactosa), fuentes de nitrógeno inorgánicas (NaNO3, NH4Cl, NH4NO3, CH3COONH4, (NH4)2HPO4, o (NH4)2SO4) y orgánicas (gelatina, extracto de carne, triptosa, triptona, extracto de levadura, polipeptona) al 1,2 %, también de manera individual durante 7 días a 28 °C, usando Tritón X-100 (0,04 %) y como sustrato t-VAME (6,67 mg/mL), se encontró que la mayor producción de ALC total se presentó con dextrina y fuentes de nitrógeno orgánicas como la triptona. Una vez determinada la mejor fuente de carbono y nitrógeno, se reportó que Delacroixiacoronata durante su crecimiento por siete días en un medio constituido de 5 % dextrina y 2 % de triptona y 33,3 mg/mL de t-VAME, el pH de 9 fue el óptimo para la producción de ALC con una temperatura de 28 °C /57/.
Por otra parte, se ha logrado obtener triacilglicéridos (TAG) con un elevado porcentaje de ALC esterificado que forma parte de su estructura, mediante reacciones de poliesterificación enzimática sin disolvente orgánico, que involucran el uso de catalizadores (lipasas) obtenidos de organismos fúngicos como Candida antarctica fracción B (Chyrazyme L-2) y Rhizomucor miehei (Lipozyme IML9), relaciones molares de ALC:glicerol (3:1 y 4:1), condiciones de agitación a 300 rpm y temperaturas de 40, 50, 60 y 70° C durante 48 h. Se encontró una relación proporcional entre la producción de TAGs en el equilibrio y la temperatura de reacción para ambas lipasas y relaciones molares (3:1 y 4:1), con excepción del intervalo de temperatura de 60-70 °C para las dos lipasas y 40-50 °C para R. miehei , mientras que las reacciones con una relación molar 4:1 catalizadas con lipasa de C. antarctica favorecen un mayor porcentaje de ALC esterificado como TAG cercanos al 80 % que la relación 3:1 en todo el resto de las temperaturas de análisis /25/.
Por otra parte, fue obtenido un extracto enzimático de ácido linoleico isomerasa procedente de Lactobacillus acidophilus (CCRC 14079), cultivada en caldo MRS hasta final de su fase Log a 37 °C. Dicho extracto fue ensayado para la producción de ALC; para ello se hizo reaccionar concentraciones de 50 y 75 mg de ácido linoleico libre (AL) con diferentes concentraciones del extracto enzimático (0, 25, 50, y 75 mg proteína) y se incubaron en agitación suave a 50 °C durante 10 min. Al final de los ensayos se detectaron los diferentes isómeros de ALC: t8,t10-, t9,t11-, t10,t12-, t11,t13-,t8,c10-, c9,t11-, t10,c12c-, y c11,t13-ALC.
A lo largo de las diferentes concentraciones enzimáticas empleadas se mostraron incrementos en el ALC total de 8 a 305 µg con 50 mg de AL y de 116 a 439 µg en 75 mg de LA; valores que constituyen los mayores encontrados de ALC total a la mayor concentración del extracto enzimático (75 mg). Además, el porcentaje del isómero c9,t11-ALC de mayor actividad biológica fue de 14 % en los productos de reacción con la catálisis enzimática; sin embargo, los diferentes isómeros presentan una distribución más uniforme en dichas reacciones y presentan porcentajes promedio de cis,trans / trans,cis-CLA: t8,c10-, c9,t11-, t10,c12-, y c11,t13-ALC de 8, 14, 15, y 11 %, respectivamente, lo que indica la actividad de los extractos enzimáticos y la viabilidad para la producción de ALC a través de métodos enzimáticos /58/.
A partir del conocimiento de que de la leche y derivados, así como de la carne de mamíferos rumiantes puede obtenerse ALC, se han realizado estudios para incrementar la proporción en estas fuentes naturales mediante el uso de los microrganismos. Salamon et al. /59/ implementaron un estudio para aumentar el contenido de ALC en productos lácteos mediante la adición de aceite de girasol en concentraciones de 50-1 500 µL/100 mL, y lograron acrecentar el contenido de ALC en leche y leche pasteurizada con la adición de aceite de girasol (alto contenido de ácido linoleico) y posterior fermentación de manera individual con cultivos puros de Lactobacillus acidophilus, Lactobacillus plantarum y Lactobacillus casei durante 24 h a 38 °C. Dicho estudio encontró que a una incorporación de aceite de 100 µL/100 mL la fermentación con Lactobacillus acidophilus y Lactobacillus plantarum genera el mayor incremento de ALC con 178,64 mg/100g y 188,64 mg/100 g, respectivamente, además de que a proporciones mayores a 100 µL/100 mL de aceite incorporado, se presenta una disminución en el contenido de ALC final. Esto con respecto al contenido de ALC en leche cruda (117,92 mg/g) y pasteurizada (116,54 mg/100 g), fermentada sin adición de aceite de girasol, ya sea con Lactobacillus acidophilus, Lactobacillus plantarum o Lactobacillus casei actuando; por tanto, el ácido linoleico contenido en el aceite interviene como inhibidor de crecimiento y producción.
En la fermentación con Lactobacillus casei, el contenido de ALC se incrementó un 20 %, de 116,54 mg/100 g de grasa a 143 mg/100 g. Aparentemente, el rango de concentración de aceite de girasol incorporado de 100 a 1 500 µL/100 mL no mostró ningún efecto en el contenido final de ALC. Rodrigues et al . /47/ investigaron el contenido de ALC (C18:2 c9, t11) en la fermentación a 42 °C (hasta alcanzar un pH de 4,7) de leche orgánica y convencional, utilizando mezclas de cultivos que corresponden a cuatro diferentes cepas de Bifidobacterium animalis subsp . lactis (BL04, B94, BB12 y HN019) y Lactobacillus delbrueckii subsp. bulgaricus LB340, en co-cultivo con Streptococcus thermophilus TA040; se encontró que todas las leches orgánicas fermentadas contenían mayor cantidad de ALC que las mismas leches antes de la fermentación, mientras que en la leche convencional el contenido de ALC no tuvo cambios durante la fermentación. Así mismo menciona que, independientemente del tipo de leche, el contenido de ALC tuvo una correlación significativamente positiva con el ácido trans-vaccénico y una correlación negativa con el ácido linoleico.
La producción de moléculas biológicamente activas como el ALC a través de cultivos microbianos es considerada una manera compatible con el medio ambiente; además de ser estéreo selectiva y utilizar como sustrato ácido linoleico libre en comparación con los procesos de síntesis química alcalina. Uno de los principales inconvenientes del uso de microrganismos es aún su bajo rendimiento de generación, por lo que no pueden ser todavía considerados competitivos con métodos clásicos de síntesis química (isomerización alcalina). Sin embargo, los microrganismos demuestran su relevancia en la obtención de alimentos con alto contenido de ALC en comparación con la producción de ALC puro a gran escala, donde el contenido de ALC en la leche y productos derivados puede ser influenciado por los cambios en la alimentación animal. Del mismo modo, la composición de ALC en productos lácteos fermentados o quesos puede incrementarse con el uso de cepas con alto potencial productor /23/.
CONCLUSIONES
La búsqueda de moléculas biológicamente activas de origen natural para mitigar las enfermedades crónicas degenerativas, actualmente en auge, sigue siendo un punto de enfoque para muchas investigaciones en la industria de los alimentos y el desarrollo de alimentos funcionales.
Con el consumo de una gran variedad de alimentos, el ser humano tiene la posibilidad de recibir un sinnúmero de beneficios a la salud, a través de diversas biomoléculas activas como es el caso del ALC. En diversos estudios se ha demostrado la capacidad de incrementar la producción del ALC a partir de diversas fuentes naturales, así como su producción in vitro por distintas cepas bacterianas, fúngicas, o por el uso de sistemas enzimáticos, más allá de depender de la proporción obtenida de fuentes naturales como la leche y sus derivados, y la carne, procedentes de mamíferos rumiantes.
A pesar de contar con información disponible en este rubro, diversos investigadores sugieren realizar más estudios enfocados a la búsqueda de un mayor número de cepas productoras, conocimiento a profundidad de los mecanismos de regulación de biosíntesis y una optimización de las condiciones de cultivo para una mayor síntesis de ALC en los procesos de fermentación. De esta manera se podrá contar con una mayor disponibilidad de este lípido funcional para el desarrollo de alimentos o suplementos que puedan aportar beneficios a la salud y reducir el riesgo de padecer alguna enfermedad crónico-degenerativa en una población que se encuentra en constante crecimiento.
BIBLIOGRAFIA
1. SIMOPOULOS, A., et al. "Essentiality of and recomended dietary intakes for omega-6 and omega-3 fatty acids". Ann. Nutr. Metab. 1999, 43, 2, p. 127-130.
2. SANHUEZA, C. J., et al. "Conjugated linoleic acid: a trans isomer fatty acid potentially beneficial". Rev. Chil. Nutr. 2002. 29, 2, p. 98-105.
3. DE FERRER, P. A. R. "Importancia de los ácidos grasos poliinsaturados en la alimentación del lactante". Arch. Argent. Pediatr. 2000. 98, 4, p. 231.
4. MAYES, P. A.; BENDER, D. "Lípidos de importancia fisiológica". En: Bioquímica de Harper. 11a ed. México, D. F.: Editorial Manual Moderno, 1988. p. 129-141.
5. VALENZUELA, B. A., et al. "El uso de lípidos estructurados en la nutrición: una tecnología que abre nuevas perspectivas en el desarrollo de productos innovadores". Rev. Chil. Nutr. 2002, 29, 2, p. 106-115.
6. KOOLMAN, J.; RÖHM, K. H. Bioquímica: texto y atlas. 3a ed. Madrid: Editorial Médica Panamericana, 2004.
7. VOET, D.; VOET, J .G.; PRATT, Ch. W. Fundamentos de Bioquímica/Fundamental of Biochemistry. 2a ed. Editorial Médica Panamericana, 2007.
8. NÓVOA VÁZQUEZ, S. "Metabolismo lipídico, ácidos grasos en el cultivo larvario de almeja babosa, Venerupispullastra (Montagu, 1803). Calidad ovocitaria, larvaria y nutricional con una aproximación al uso de la microencapsulación lipídica". Universidad Santiago de Compostela, 2008 .
9. FAO-FINUT. "Grasas y ácidos grasos en la nutrición humana: consulta de expertos". Ginebra, 2008.
10. JIMÉNEZ COLMENERO, F. "Emulsiones múltiples; compuestos bioactivos y alimentos funcionales". Nutr. Hosp. 2013, 28 , 5, p. 1413- 1421.
11. GONZÁLEZ MARTÍNEZ, B. E., et al. "Ácido linoleico conjugado como estrategia para el control de la obesidad". Rev. Salud Pública Nutr. RESPYN. 2010. 11, p. 1-9.
12. LUTZ, M. "III. Alimentos funcionales en la prevención de enfermedades crónicas no transmisibles". En: Aspectos nutricionales y saludables de los productos de panificación. Chile: Editorial Universidad de Valparaíso, 2009. p. 38.
13. DÁVILA, M., et al. "Leguminosas germinadas o fermentadas: alimentos o ingredientes de alimentos funcionales". Arch. Latinoam. Nutr. 2003, 53 , 4, p. 348-354.
14. ALVÍDREZ MORALES, A., et al. "Tendencias en la producción de alimentos: alimentos funcionales". Rev. Salud Pública Nutr . RESPYN . 2002, 3, 3.
15. RODRÍGUEZ, M. B. S., et al. "Alimentos funcionales y nutrición óptima. ¿Cerca o lejos?". Rev. Esp. Salud Pública. 2003, 77, p. 317-331.
16. CARRASCO, C. A.; GUERRA, M. "Lactosuero como fuente de péptidos bioactivos". En: An. Venez. Nutr. 2010, 23, p. 42-49.
17. DRAGO SERRANO, M., et al. "Componentes bioactivos de alimentos funcionales de origen vegetal". Rev. Mex. Cienc. Farm. 2006, 37, p. 58-68.
18. VALENZUELA, B. A.; SANHUEZA, C. J. "Aceites de origen marino; su importancia en la nutrición y en la ciencia de alimentos". Rev. Chil. de Nutr. 2009, 36, p. 246-257.
19. GARCÍA, L. A. "Lípidos dietarios y salud humana". Veterinaria Cuyana. 2009, 4, p. 55-57.
20. PAZ CABRERA, R. A. "Ácido linoleico conjugado-CLA en alimentos conjugated linoleic acid–CLA in foods". Trabajo de grado para optar al título de Especialista en Ciencia y Tecnología de Alimentos. Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Química, 2009.
21. GAMMILL, W., et al. "Comparative study of high-linoleic acid vegetable oils for the production of conjugated linoleic acid". J. Agr. Food Chem. 2010. 58, 5, p. 2952-2957.
22. MERAZ TORRES, L. S.; HERNÁNDEZ SÁNCHEZ, H. "Conjugated linoleic acid dairy products: A Review". Am. J. Food Technol. 2012. 7, p. 176-179.
23. SALAMON, R. V., et al. "Synthetic methods for obtaining conjugated linoleic acids (CLA) by catalysis". Acta Univ. Sapientiae, Alimentaria. 2012, 5, p. 32-51.
24. CRUZ PARDOS, S., et al . "CLA antioxidant or prooxidant?". Grasas y Aceites. 2000, 51, 4, p. 268-274.
25. HUESCA TORAL, A., et al. "Síntesis de triacilglicéridos ricos en ácido linoleico conjugado (CLA) mediante esterificación enzimática en un medio libre de solvente". Rev. Mex. Ing. Quím. 2005, 4, p. 75-87.
26. MARTÍNEZ BORRAZ, et al . "Contenido de ácido linoleico conjugado (CLA) en la leche de ganado lechero Holstein estabulado en el noroeste de México". Revista Mexicana Ciencias Pecuarias. 2010, 1, 3, p. 221-235.
27. AGUEDA, M., et al. "Efecto del ácido linoleico conjugado (CLA) sobre el perfil lipídico en humanos". Arch. Latinoam. Nutr. 2009, 59, 3, p. 245-252.
28. COAKLEY, M., et al. "Conjugated linoleic acid biosynthesis by human-derived Bifidobacterium species". J. Appl. Microbiol. 2003, 94, 1, p. 138-145.
29. FERNÁNDEZ QUINTELA, A., et al . "Ácido linoleico conjugado y grasa corporal". Rev Esp. Obes. 2004, 2, p. 71-79.
30. BAUMAN, D. E., et al. "Biosynthesis of conjugated linoleic acid in ruminants". Proc. Am. Soc. Anim. Sci. [en línea] 1999, p. 1-15. [ref. de 16 de diciembre de 2013]. Disponible en: <http://www.asas.org/jas/symposia/proceedings> .
31. WAHLE, K. W. J ., et al. "Conjugated linoleic acids: are they beneficial or detrimental to health?". Prog. Lipid. Res. 2004, 43, p. 553-587.
32. BARÓN NÚÑEZ, M. R. "Desarrollo de bebidas lácteas funcionales con énfasis en ácido linoleico conjugado (CLA)". Tesis de grado presentada como requisito parcial para optar al título de Magíster en Ingeniería Química. Director: Rubén Darío Godoy Silva. Universidad Nacional de Colombia, Facultad de Ingeniería, Departamento de Ingeniería Química y Ambiental, Bogotá D.C., 2010.
33. OBREGÓN, R. A. M., et al. "Conjugated linoleic acid (alc), lipid metabolism and cardiovascular disease". Rev. Chil. Nutr. 2009, 36, 3, p. 258-268.
34. ROCHE, H., et al. "Conjugated linoleic acid: a novel therapeutic nutrient?". Nutr. Res. Rev. 2001, 14, 1, p. 173-188.
35. MUNDAY, J. S., et al. "Dietary conjugated linoleic acids promote fatty streak formation in the C57BL/6 mouse atherosclerosis model". Br. J. Nutr. 1999, 81, 3, p. 251-255.
36. NICOLISI, R. J., et al. "Dietary conjugated linoleic acid reduces plasma lipoprotein and early aortic atherosclerosis in hypercholesterolemic hamsters". Artery. 1997, 22, 5, p. 266-277.
37. SUGANO, M., et al. "Conjugated linoleic acid modulates tissue levels of chemical mediator and inmune globulins in rats". Lipids. 1998, 33, p. 521-527.
38. IP, C. "Review of the effects of trans fatty acid, oleic acid, n-3 polyunsaturated fatty acids, and conjugated linoleic acid on mammary carcinogenesis in animals". Am. J. Clin. Nutr. 1997, 66(supl), p. 1523-1529.
39. SHULTZ, T. D., et al. "Inhibitory effect of conjugated linoleic acid and beta-carotene on the in vitro Growth of Human cancer cells". Cancer Lett. 1992, 63, p. 125-133.
40. ALCALÁ, M. R. "Lípidos bioactivos en productos lácteos: estrategias para su incremento y efectos del procesado y la conservación" [en línea]. Doctoral dissertation. Universidad Autónoma de Madrid, 2009 [ref. de 9 de diciembre de 2013]. Disponible en: <https://repositorio.uam.es/xmlui/bitstream/handle/10486/4181/28403_rodriguez_alcala_lluismiguel.pdf?sequence=1> .
41. AKAHOSHI, A., et al. "Dietary protein modulates the effect of CLA on lipid metabolism in rats". Lipids. 2004, 39, 1, p. 25-30.
42. CHENG, W. L., et al . "Contribution of Conjugated Linoleic Acid to the Suppression of Inflammatory Responses through the Regulation of the NF-κB Pathway". J. Agr. Food Chem. 2003, 52, 1, p. 71-78.
43. PARIZA, M. W. "Perspective on the safety and effectiveness of conjugated linoleic acid". Am. J. Clin. Nutr. 2004, 79, 6, p. 1132-1136.
44. JAIN, V. P.; PROCTOR, A. "Photocatalytic production and processing of conjugated linoleic acid-rich soy oil". J. Agr. Food Chem. 2006, 54, 15, p. 5590-5596.
45. GANGIDI, R. R.; PROCTOR, A. "Photochemical production of conjugated linoleic acid from soybean oil". Lipids. 2004. 39, 6, p. 577-582.
46. JIANG, J., et al . "Production of conjugated linoleic acid by dairy starter cultures". J. Appl. Microbiol. 1998, 85, 1, p. 95-102.
47. RODRIGUES FLORENCE, A. C., et al. "Increased CLA content in organic milk fermented by Bifidobacteria or yoghurt cultures". Dairy Sci. Technol. 2009, 89, 6, p. 541-553.
48. CONTE JUNIOR, C. A.; SONCIN, S. "Estudio de la producción de ácido linoleico conjugado por cepas de Lactobacillus y Enterococcus de distintos orígenes". RCCV. 2007, 1, 2, p. 482-489.
49. PRANDINI, A. "Different level of conjugated linoleic acid (CLA) in dairy products from Italy". J. Food Compos. Anal. 2007, 20, p. 472-479.
50. RAINIO, A., et al. "Production of conjugated linoleic acid by Propionibacteriumfreudenreichii ssp. shermanii". Le Lait. 2002, 82, 1, p. 91-101.
51. EWASCHUK, J. B., et al . "Bioproduction of conjugated linoleic acid by probiotic bacteria occurs in vitro and in vivo in mice". J. of Nutr. 2006, 136, 6, p. 1483-1487.
52. LEE, H. Y., et al. "Human originated bacteria, Lactobacillus rhamnosus PL60, produce conjugated linoleic acid and show anti-obesity effects in diet-induced obese mice". Biochimica et Biophysica Acta. 2006, 1761, 7, p. 736-744.
53. KISHINO, S., et al. "Conjugated linoleic acid production from linoleic acid by lactic acid bacteria". JAOCS. 2002, 79, p. 159-163.
54. ELENA, P., et al. "Influence of free linoleic acid on the fatty acids profile of fermentation by selected probiotic bacteria". J. Food Nutr. Res. 2006, 45, 4, p. 159-165
55. HENNESSY, A. A., et al . "Optimization of a reconstituted skim milk based medium for enhanced CLA production by bifidobacteria". J. Appl. Microbiol. 2009, 106, 4, p. 1315-1327.
56. RAMÍREZ BACA, P., et al. "Producción de CLA por cultivos mixtos en leche entera de vaca". Revista Salud Pública y Nutrición. RESPYN. 2007, Edición Especial, 12, p. 631-635.
57. ANDO, A., et al. "Selective production of cis-9, trans-11 isomer of conjugated linoleic acid from trans-vaccenic acid methyl ester by Delacroixia coronate". J. Appl. Microbiol . 2009 , 106 , p. 1697-1704.
58. LIN, T. Y., et al. "Production of conjugated linoleic acid by enzyme extract of Lactobacillus acidophilus CCRC 14079". Food Chem. 2003, 83, 1, p. 27-31.
59. SALAMON, R. V., et al. "Increase of conjugated linoleic acid content of dairy products by adding sunflower oil". Acta Univ. Sapientiae. 2009, 2, 2, p. 287-293.
Recibido: 17/06/2014
Aceptado: 31/08/2014
Dr. C. José R. León-Sánchez, Facultad de Medicina, Universidad Autónoma del Estado de México, México, D. F. jrleon_94@hotmail.com