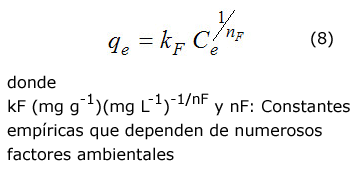Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.27 no.2 Santiago de Cuba maio.-ago. 2015
ARTICULOS
Remoción de azul brillante de remazol R de soluciones acuosas empleando biomasa de levadura
Removal of remazol brilliant blue R dye from aqueous solutions using yeast biomass as biosorbent
Ing. Karen L. Barreda-Reyes, Ing. Jocelyn Ortega-López, Dra. C. Ana E. Ortega-Regules, Dr. C. Luis A. Santiago-Santiago, Dra. C. Alma R. Netzahuatl-Muñoz
Universidad Politécnica de Tlaxcala, Tlaxcala, México, karenlizbeth.barreda@uptlax.edu.mx, jos306@hotmail.com, anaregules@hotmail.com, luisalberto.santiago@uptlax.edu.mx, almarosa.netzahuatl@uptlax.edu.mx
RESUMEN
El propósito principal de este trabajo fue obtener parámetros cinéticos y en equilibrio para el proceso de remoción de colorante de antraquinona azul brillante de remazol R de soluciones acuosas, empleando biomasa de levadura como biosorbente, así como identificar los grupos funcionales responsables de la biosorción por espectrometría de infrarrojo. Las cinéticas de biosorción del colorante a temperaturas de 10 °C, 20 °C, 30 °C y 40 °C se ajustaron correctamente a los modelos de seudo-primer y seudo-segundo orden. Los valores de los parámetros termodinámicos de activación calculados indicaron que el proceso es endotérmico y no espontáneo. Se obtuvo la isoterma de sorción a 20 °C, pH 2,0 y 1,0 g de biomasa L-1, encontrándose un valor de 127,6 mg g-1 para la monocapa saturada de acuerdo al modelo de Langmuir. Los estudios de infrarrojo mostraron que los grupos carboxilo y amida son los principales grupos funcionales responsables de la biosorción del colorante.
Palabras clave: azul brillante de remazol R, biosorción, biomasa de levadura.
ABSTRACT
The main purpose of this study was to obtain kinetic and equilibrium parameters for the anthraquinone dye r emoval of Remazol Brilliant Blue R dye from aqueous solutions using yeast biomass as biosorbent, and identify the functional groups responsible for biosorption by infrared spectrometry. Biosorption dye kinetics at temperatures of 10 °C, 20 °C, 30 °C and 40 °C were fitted correctly by the pseudo-first and pseudo-second order models. The values of thermodynamic activation parameters indicated that the biosorption process is endothermic and no spontaneous. Sorption isotherm at 20 °C, pH 2,0 and a biomass concentration of 1,0 g L-1 was obtained, finding a value of 127,6 mg g-1 for the saturated monolayer according to the Langmuir model. Infrared studies showed that carboxyl and amide are the main functional groups responsible for dye biosorption.
Keywords: remazol R brilliant blue, biosorption, yeast biomass.
INTRODUCCIÓN
La industria textil es una de las actividades económicas más importantes en el estado de Tlaxcala, México; esta industria es bien conocida por generar gran cantidad de agua contaminada con colorantes sintéticos provenientes principalmente de sus unidades de teñido, lavado y acabado. Las principales características por la que estos colorantes son utilizados en la industria textil son porque proporcionan una gama brillante de coloración y pueden ser usados en diferentes métodos de aplicación [1]. Cuando se aplican en fibras dan un color permanente capaz de resistir la decoloración en exposición al sudor, la luz, el agua y a gran cantidad de productos químicos, incluyendo agentes oxidantes y al ataque microbiano [2]. Sin embargo, los colorantes textiles, así como los efluentes de la industria textil tienen efectos tóxicos y pueden ser carcinogénicos, mutagénicos o teratogénicos en varios organismos [3]. Por lo tanto, el tratamiento de efluentes industriales que contienen colorantes y sus metabolitos es necesario para su descarga final al medio ambiente.
Existen diversos métodos fisicoquímicos empleados para la remoción de colorantes en los efluentes, como son la coagulación-floculación, oxidación, filtración en membrana, fotólisis y procesos electroquímicos, entre otros. La principal desventaja de los métodos fisicoquímicos radica en la adquisición continua de agentes químicos, la generación de gran cantidad de lodo químico o bien los altos costos de equipo especializado [4, 5]. En años recientes se ha incrementado el interés por el uso de métodos biológicos, en particular, la biosorción se considera uno de los métodos más promisorios para la remoción de colorantes de aguas residuales, debido principalmente a su buen desempeño y a su bajo costo [4, 6, 7]; por otra parte, debido a la diversidad genética, versatilidad metabólica y amplia distribución de los microorganismos, se considera que el uso de su biomasa como material adsorbente es una alternativa viable para remediar los problemas de contaminación causados por los colorantes [8].
El colorante de antraquinona azul brillante de remazol R (RBBR por sus siglas en inglés) es uno de los más colorantes más importantes en la industria textil [9]. En estudios anteriores se determinó que el empleo de biomasa de la levadura KB-a1 puede ser apta para la remoción de colorantes sintéticos azoicos y antraquinoides [10]; para el caso del RBBR se determinó que las condiciones de pH óptimas para el proceso es 2,0, ya que bajo estas condiciones ambientales el colorante presenta carga negativa, debido a los grupos sulfonato que contiene. Por otra parte, el punto de carga cero de la biomasa de levadura presentó un valor de 6,5, por lo que se encuentra cargada positivamente a valores bajos de pH, favoreciendo la biosorción del colorante [10].
El objetivo de este trabajo fue obtener parámetros cinéticos y en equilibrio para el proceso de remoción de colorante azul brillante de remazol R de soluciones acuosas a pH 2,0 por la biomasa de la levadura KB-a1, así como identificar los grupos funcionales responsables de la biosorción mediante espectrometría de infrarrojo.
MATERIALES Y MÉTODOS
Métodos experimentales
Material biológico
La levadura empleada en este trabajo, denominada KB-a1, se aisló de un lote de muestras de suelo contaminado con residuos de una industria textil provenientes de la localidad de San Mateo Ayecatl, municipio de Tepetitla de Lardizabal, en el Estado de Tlaxcala, México. La biomasa para los experimentos de biosorción se obtuvo al crecer la levadura en un medio de cultivo conteniendo glucosa (1,0 g L-1), NH4 NO3 (1,0 g L-1), K2 HPO4 (0,9 g L-1), KCl (0,2 g L-1), MgSO4 (0,2 g L-1), FeSO4 (0,002 g L-1), MnSO4 (0,002 g L-1) y ZnSO 4 (0,002 g L-1); el cultivo se mantuvo en agitación durante 48 h, posteriormente la biomasa se cosechó por centrifugación, se lavó, se deshidrató en un horno a 60 °C por 24 h y se trituró.
Colorante
Se utilizó el reactivo del colorante azul brillante de remazol R con 50 % de pureza (Sigma Aldrich) para preparar una solución de 1 000 mg L-1, a partir de la cual se prepararon las soluciones de concentración menor al diluirla con agua desionizada.
Estudios de remoción de colorante azul brillante de remazol R
Los estudios cinéticos se realizaron empleando soluciones de colorante a concentración inicial de 90 mg L-1 a pH 2,0 y 1,0 g L-1 de biomasa de levadura en agitación constante a temperaturas de 10 °C, 20 °C, 30 °C y 40 °C; en estos estudios se obtuvieron 15 muestras durante 24 min de contacto. En los estudios en equilibrio se pusieron en contacto soluciones de colorante entre 10 mg L-1 y 500 mg L-1 a pH 2,0 y 20 °C con biomasa a una concentración de 1,0 g L-1 durante 2 h.
Métodos análiticos
Las muestras se filtraron a través de membranas de fibra de vidrio (poro de 1,6 µm) y al filtrado se le determinó la concentración final de colorante empleando un espectrofotómetro Cary 300 (Varian Inc.) a 592 nm. El pH se midió con un potenciómetro (Conductronic). Los espectros de infrarrojo se obtuvieron en un espectrofotómetro Perkin Elmer (Spectrum 2000 FTIR) en el intervalo de 400 cm-1 a 4 000 cm-1 y con una resolución de 4 cm-1 empleando un aditamento de reflectancia difusa.
Cálculo de la capacidad de biosorción de colorante
La cantidad de colorante removido por cada gramo de biomasa de levadura en peso seco q (mg g-1) se calculó utilizando la ecuación (1):
Modelado de las cinéticas de biosorción
Los datos experimentales de las cinéticas de biosorción fueron analizados empleando los modelos de pseudo-primer y pseudo-segundo orden.
El modelo de pseudo-segundo orden tiene la forma integrada y no lineal representada en la ecuación (3) [12]:
Estudio termodinámico
La energía de activación se obtuvo a través de la expresión de la ley de Arrhenius que relaciona la constante de velocidad k con la temperatura (4):
Los valores de los Ea y A se obtuvieron por regresión no lineal de k vs. T empleando el software GraphPad Prism 6 (GraphPad Software Inc.).
Los valores de los parámetros de activación se obtuvieron por regresión no lineal de k/T vs. T empleando el software GraphPad Prism 6 (GraphPad Software Inc.).
Modelado de las isotermas de biosorción
Los datos experimentales fueron analizados empleando los modelos de Langmuir y de Freundlich. El modelo de Langmuir asume que todos los sitios de sorción son idénticos, que cada sitio retiene una molécula y que todos los sitios son energética y estéricamente independientes de la cantidad de soluto adsorbido [14]. La expresión matemática del modelo se representa mediante la ecuación (7):
La isoterma de Freundlich se expresa mediante la ecuación (8):
Los valores de las constantes de los modelos de biosorción en el equilibrio se obtuvieron por regresión no lineal de qe vs. Ce empleando el software GraphPad Prism 6 (GraphPad Software Inc.).
RESULTADOS Y DISCUSIÓN
Estudios cinéticos
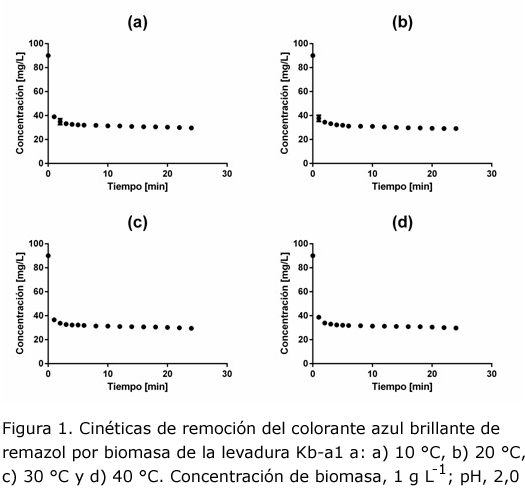
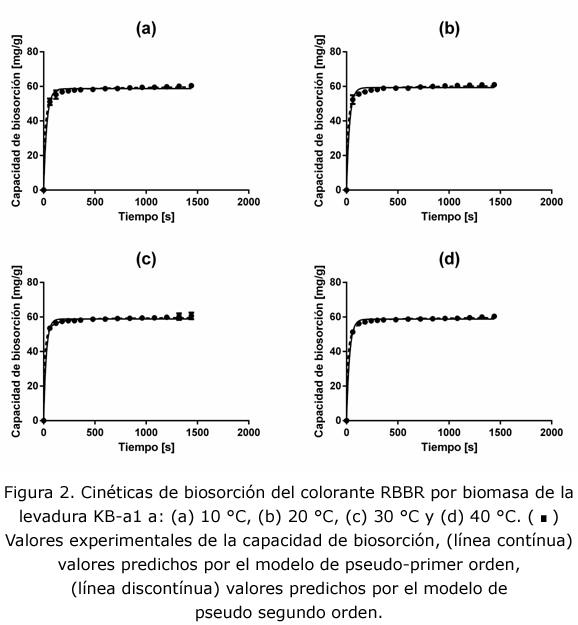
Las cinéticas de remoción del RBBR a temperaturas de 10 °C, 20 °C, 30 °C y 40 °C se presentan en la figura 1. Como puede observarse, la disminución de la concentración de colorante en la solución por la biomasa de la levadura KB-a1 se llevó a cabo rápidamente, después del primer minuto de contacto la concentraciones se encontraban entre 36 mg L-1 y 39 mg L-1 para todas las condiciones de temperataura ensayadas. Hay que señalar que en el experimento llevado a cabo a 40 °C se observó que la biomasa formaba agregados que no se dispersaban fácilmente, este fenómeno podría haber dificultado la transferencia del colorante hacia los sitios activos del material biológico. El descenso de la concentración de colorante después del primer minuto fue pequeña y a partir del minuto 10 y hasta el final del experimento puede considerarse prácticamente constante, es decir, que el sistema alcanzó el equilibrio aproximadamente a los 10 min, las concentraciones finales de colorante se encontraron entre 29 mg L-1 y 30 mg L-1. En la figura 2 se aprecia claramente que la capacidad de biosorción alcanzada fue similar para las cuatro condiciones de temperatura con valores entre 60,3 mg g-1 y 60,9 mg g-1, estos valores se encuentran reportados en la tabla 1 como capacidad experimental en el equilibrio ( qexp).
Se llevó a cabo el análisis de las cinéticas de biosorción empleando los modelos cinéticos de biosorción de pseudo-primer y pseudo-segundo orden. En la tabla 1 se aprecia que ambos modelos presentan coeficientes de correlación con valores superiores a 0,98; en cuanto a los valores de las capacidades en el equilibrio (qe) que predijeron los modelos, ambos mostraron valores muy cercanos a los valores máximos alcanzados experimentalmente. En relación con el valor de la constante velocidad, ambos modelos mostraron un incremento al aumentar la temperatura entre 10 °C y 30 °C; sin embargo, se observó un ligero descenso a 40 °C, debido a posibles problemas de transferencia de masa causados por la aglomeración del biomaterial. En la figura 2 se presentan las líneas de tendencia de ambos modelos y se comprueba el buen ajuste que hacen de los datos experimentales.
TABLA 1. CONSTANTES CINÉTICAS DE LOS MODELOS DE PSEUDO-PRIMER Y
PSEUDO-SEGUNDO ORDEN PARA LA BIOSORCIÓN DE RBBR POR BIOMASA DE LA LEVADURA
KB-a1 A DIFERENTES CONDICIONES DE TEMPERATURA
| Temperatura (°C) | qexp | Pseudo-primer orden | Pseudo-segundo orden | |||||
|
|
| qe | k1 | R2 | qe (mg g-1) | h (mg g-1 h -1) | k2 (g mg-1 h-1) | R2 |
| 10 | 60,4 | 58,59 | 116,8 | 0,992 5 | 60,08 | 20120 | 5,574 | 0,995 6 |
| 20 | 60,9 | 59,29 | 122,2 | 0,988 3 | 60,71 | 20944 | 5,682 | 0,995 5 |
| 30 | 60,5 | 58,86 | 139,3 | 0,991 6 | 59,90 | 28375 | 7,908 | 0,999 0 |
| 40 | 60,3 | 58,74 | 123,5 | 0,996 0 | 59,98 | 22341 | 6,210 | 0,998 0 |
Para el cálculo de los parámetros termodinámicos de activación se consideraron únicamente los datos correspondientes a las constantes de velocidad obtenidas a temperaturas de 10 °C, 20 °C y 30 °C. En la tabla 2 se reportan los resultados obtenidos al ajustar los valores de las constantes de velocidad obtenidas con el modelo de pseudo-primer orden, ya que fueron con los que se obtuvo un mayor coeficiente de correlación (R2 = 0,92). El valor de Ea para el proceso de biosorción del colorante (6,443 kJ mol-1) sugiere que la adsorción es de tipo químico, ya que en la adsorción física la Ea no es superior a 4,2 kJ mol-1 [15]. El valor positivo de ΔH* (6,443 kJ mol-1) indica que la reacción es endotérmica, mientras que el valor negativo de ΔS* (-0,203 4 kJ mol-1 K-1) refleja que no ocurren cambios significativos en la estructura del biosorbente durante el proceso de biosorción [16]. En cuanto a ΔG*, este presentó valores positivos entre 64,03 y 68,10 kJ mol-1, lo que indica que la reacción no es espontánea.
TABLA 2. PARÁMETROS TERMODINÁMICOS DE ACTIVACIÓN PARA LA REMOCIÓN
DE RBBR POR BIOMASA DE LA LEVADURA KB-a1
| T (°C) | Ea (kJ mol-1) | A (s-1) | ΔH* (kJ mol-1) | ΔS* (kJ mol-1 K-1) | ΔG* (kJ mol-1) |
| 10 |
|
|
|
| 64,03 |
| 20 | 6,443 | 0,492 3 | 6,443 | -0,203 4 | 66,07 |
| 30 |
|
|
|
| 68,10 |
Estudios en equilibrio
En la figura 3 se muestra la isoterma de sorción de RBBR obtenida por la biomasa de levadura a pH 2,0 y 20 °C; a bajas concentraciones de colorante en el equilibrio se observó una relación lineal entre la capacidad de biosorción y la concentarción de colorante; sin embargo, a partir de 60 mg L-1 la proporción del incremento de la capacidad de biosorción es menor en relación con el incremento de la concentración del colorante, lo cual sugiere la posible saturación de los sitios activos de biosorción. La isoterma se analizó con los modelos de Langmuir y Freundlich; en la tabla 3 se presentan los valores de las constantes correspondientes. Ambos modelos presentaron coeficientes de correlación altos (R2 = 0,95), las curvas correspondientes se presentan en la figura 3 y al compararlas con los valores experimentales se observa que el modelo de Langmuir se ajusta mejor a los datos experimentales a bajas concentraciones de colorante, mientras que el modelo de Freundlich lo hace mejor a concentraciones altas de colorante. Estos resultados podrían deberse a la presencia de gran variedad de sitios activos en el material biológico con distinta afinidad al colorante. Un parámetro importante obtenido para los estudios de biosorción en el equilibrio es el valor de la monocapa saturada; para el proceso de remoción de RBBR por biomasa de la levadura KB-a1 este valor alcanzó 127,6 mg g-1, superior a 95,2 mg g-1 correspondiente a la reportada para la biosorción de RBBR por biomasa de Scenedesmus quadricauda inactivada con calor e inmovilizada en alginato [9].
TABLA 3. CONSTANTES DEL MODELADO DE LAS ISOTERMAS DE SORCIÓN DEL
COLORANTE RBBR POR BIOMASA DE LA LEVADURA KB-a1
| Langmuir |
| Freundlich | ||||
| Q0 | b | R2 |
| kF | nF
| R2
|
| 127,6 | 0,039 86 | 0,963 3 |
| 21,50 | 3,371 | 0,953 5 |
Estudios de espectroscopía de infrarrojo
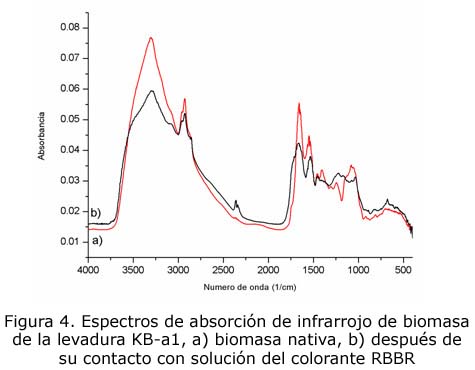
En la figura 4 se presentan los espectros de absorción obtenidos de la región infrarroja de la biomasa de levadura antes y después del proceso de biosorción. Los picos más representativos de ambos espectros con su asignación correspondiente se reportan en la tabla 4. Los cambios más notables del espectro de la biomasa con colorante respecto al obtenido en su estado nativo fueron: a) la desaparición del pico a 1 409 cm-1 correspondiente a las vibraciones simétricas de estiramiento del C=O del carboxilato; b) el corrimiento del pico correspondiente al estiramiento de grupos CH2 OH, C-O y P-O2 presentes en los glicopéptidos y en la ribosa de 1 080 cm-1 a 1 032 cm-1; c) la disminución de la banda a 1 659 cm-1, que indicaría la participación de los grupos amida I en el proceso de biosorción y d) el ensanchamiento de la región entre 1 219 cm-1 y 1 171 cm-1 correspondiente al estiramiento del enlace C-O en los ácidos carboxílicos. Estos resultados sugieren que varios grupos funcionales participan en el proceso de biosorción del colorante RBBR por la biomasa de levadura KB-a1, entre los que destacan los grupos amida, carboxilo y posiblemente fosforilo. Reportes anteriores en la biosorción de colorantes han sugerido la participación de una gran variedad de grupos funcionales en el proceso de remoción correspondiente [4, 8].
TABLA 4. RESUMEN DE LAS BANDAS DE INFRARROJO ENCONTRADAS EN LA BIOMASA DE
LA LEVADURA KB-a1 ANTES Y DESPUÉS DEL CONTACTO CON SOLUCIÓN DEL COLORANTE RBBR.
| Banda de frecuencia del infrarrojo (cm-1) | Grupo funcional asignado | Referencia | |
| Biomasa de levadura | Biomasa de levadura |
|
|
| 3 300 | 3 293 | Estiramiento de O–H | [17] |
| 2 959 | 2 959 | Estiramiento asimétrico de C–H del metileno. Radicales alquilo y otros grupos alifáticos saturados | [18] |
| 1 659 | 1 668 | Estiramiento del C=O del grupo amida I | [4], [19] |
| 1 548 | 1 533 | Doblamiento del grupo NH2 y estiramiento C=N de la amida II | [4], [19] |
| 1 453 | 1 455 | Radicales alquilo y otros grupos alifáticos saturados | [17] |
| 1 409 |
| Vibraciones simétricas de estiramiento C=O del carboxilato | [7] |
| 1 246 | 1 219-1 171 | Estiramiento de C-O en los ácidos carboxílicos. | [18] |
|
|
| Estiramiento C-N (amida III) y estiramiento asimétrico PO2 - y en menor medida de fosfolípidos | [19] |
| 1 080 | 1 032 | Estiramiento de los grupos CH2 OH, C-O o P-O2 presentes en los glicopétidos y en la ribosa | [20] |
CONCLUSIONES
El proceso de biosorción del colorante de antraquinona azul brillante de remazol R a pH 2,0 es un proceso endotérmico y no espontáneo que alcanza capacidades de biosorción de saturación de 127,6 mg g-1, lo que lo hace un material atractivo para su uso en el tratamiento de aguas residuales contaminadas con el colorante. En el proceso de biosorción se encuentran involucrados principalmente grupos carboxilo y amida.
REFERENCIAS BIBLIOGRÁFICAS
1. PEARCE, C. I.; LLOYD, J. R.; GUTHRIE, J. T., "The removal of color from textil wastewater using whole bacterial cells: A review", Dyes Pigments, 2003, 58(3), 179-196.
2. RAI, H. S.; BAHATTACHARYYA, M. S., SHING, J., BANSAL, T. K., VATS, P., BANERJEE, U. C., "Removal of dyes from the effluent of textile and dyestuff manufacturing industry: A review of emerging techniques with reference to biological treatment", Crit. Rev. Environ. Sci. Technol., 2005, 35(3), 219-238.
3. RATNA; PADHI, B., "Pollution due to synthetic dyes toxicity & carcinogenicity studies and remediation", Int. J. Environ. Sci., 2012, 3(3), 940-946.
4. CHARUMATHI, D.; DAS, N., "Packed bed column studies for the removal of synthetic dyes from textile wastewater using immobilised dead C. tropicalis", Desalination, 2012, 285(31), 22-30.
5. ASGHER, M., "Biosorption of Reactive Dyes: A Review", Water Air Soil Poll., 2011, 223(5), 2417–2435.
6. KHAMBHATY, Y.; MODY, K.; BASHA, S., "Efficient removal of Brilliant Blue G (BBG) from aqueous solutions by marine Aspergillus wentii: Kinetics, equilibrium and process design", Ecol. Eng., 2012, 41, 74-83.
7. GAO, J. F.; ZHANG, J. H.; WANG, J. H.; WU, X. L.; WANG, S. Y.; PENG, Y. Z., "Contributions of functional groups and extracellular polymeric substances on the biosorption of dyes by aerobic granules", Biores. Technol., 2011, 102(2), 805-813.
8. MONA, S.; KAUSHIK, A.; KAUSHIK, C. P., "Biosorption of reactive dye by waste biomass of Nostoc linckia", Ecol. Eng., 2011, 37(10), 1589-1594.
9. ERGENE, A.; ADA, K.; TAN, S.; KATIRCIOGLU, H., "Removal of Remazol Brilliant Blue R dye from aqueous solutions by adsorption onto immobilized Scenedesmus quadricauda: Equilibrium and kinetic modeling studies", Desalination, 2009, 249(3), 1308–1314.
10. BARREDA REYES, K. L.; MENDOZA CALDERÓN, E. I.; ORTEGA LÓPEZ, J.; CRUZ HUERTA, M.; ORTEGA REGULES, A. E.; NETZAHUATL MUÑOZ, A. R., "Efecto del pH en la biosorción de colorantes sintéticos empleando biomasa de una levadura aislada de suelo contaminado", en VÁZQUEZ GARCÍA, Gloria Verónica; MARTÍNEZ GARCÍA, Amalia; SOLANO SOSA, Cristina E.; SÁNCHEZ MORALES, María Eugenia (ed.), Memorias del XI encuentro participación de la mujer en la ciencia (14-16 mayo, 2014), Guanajuato, México, Centro de Investigaciones en Óptica, A. C., 2014, p. 1-5.
11. VIJAYARAGHAVAN, K.; YUN, Y., "Bacterial biosorbents and biosorption", Biotechnol. Advances, 2008, 26(3), 266–291.
12. HO, Y. S., "Review of second-order models for adsorption systems", J. Hazard. Mat., 2006, 136(3), 681–689.
13. LEÓN TORRES, A.; CUERDA CORREA, E. M.; FERNÁNDEZ GONZÁLEZ, C., ALEXANDRE FRANCO, M. F., GÓMEZ SERRANO, V., "On the use of a natural peat for the removal of Cr(VI) from aqueous solutions", J. Colloid Interface Sci., 2012, 386(1), 325–332.
14. LIMOUSIN, G.; GAUDET, J. P.; CHARLET, L.; SZENKNECT, S.; BARTHÈS, V.; KRIMISSA, M., "Sorption isotherms: A review on physical bases, modeling and measurement", Appl. Geochem., 2007, 22(2), 249–275.
15. AKSU, Z., "Determination of the equilibrium, kinetic and thermodynamic parameters of the batch biosorption of nickel (II) ions onto Chlorella vulgaris", Process Biochem., 2002, 38(1), 89–99.
16. FLORES GARNICA, J. G.; MORALES BARRERA, L.; PINEDA CAMACHO, G., "Biosorption of Ni (II) from aqueous solutions by Litchi chinensis seeds", Biores. Technol., 2013, 136, 635–643.
17. COATES, J., "Infrared Spectra, a practical approach", en MEYERS, R. A. (ed.), Encyclopedia of Analytical Chemistry, Chinchester, John Wiley & Sons, 2000., p. 10815-10837, ISBN 978-0-471-97670-7.
18. STUART, B., Infrared spectroscopy: fundamentals and applications, Chichester, John Wiley & Sons, 2004, ISBN 0-470-85427-8.
19. TIAN, Y.; JI, C.; ZHAO, M.; XU, M.; ZHANG, Y.; WANG, R., "Preparation and characterization of baker's yeast modified by nano-Fe3O4: Application of biosorption of methyl violet in aqueous solution", Chem. Eng. J., 2010, 165, 474–481.
20. DU, L. N.; WANG, B.; LI, G.; WANG, S.; CROWLEY, D. E.; ZHAO, Y. H., "Biosorption of the metal-complex dye Acid Black 172 by live and heat-treated biomass of Pseudomonas sp. strain DY1: kinetics and sorption mechanisms", J. Hazard. Mat., 2012, 127(0), 47–54.
Recibido: 15/09/2014
Aceptado: 19/12/2014
Ing. Karen L. Barreda-Reyes, Universidad Politécnica de Tlaxcala, Tlaxcala, México, karenlizbeth.barreda@uptlax.edu.mx