My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Química
On-line version ISSN 2224-5421
Rev Cub Quim vol.27 no.3 Santiago de Cuba Sept.-Dec. 2015
ARTICULOS
Biosorción de colorante naranja ácido 10 por biomasa de levadura aislada de suelo contaminado
Acid orange 10 dye biosorption by yeast isolated from polluted soil biomass
Ing. Karen Lizbeth Barreda-Reyes, Est. Eduardo Iván Mendoza-Calderón, Dra. C. Ana Eugenia Ortega-Regules, MSc. María de Lourdes Martínez-de-Santos, Dra. C. Alma Rosa Netzahuatl-Muñoz
Universidad Politécnica de Tlaxcala, Tlaxcala, México, karenlizbeth.barreda@uptlax.edu.mx, mc_ivan06@hotmail.com, anaregules@hotmail.com, mariadelourdes.martinez@uptlax.edu.mx, almarosa.netzahuatl@uptlax.edu.mx
RESUMEN
El propósito de este trabajo fue evaluar la capacidad de biosorción de colorante azoico naranja ácido 10 de la biomasa de una levadura aislada de suelo contaminado con aguas residuales de la industria textil. En los estudios de equilibrio se empleó 1,0 g L-1 de biomasa a 20 °C y pH 2,0 a concentraciones iniciales de colorante entre 10 mg L-1 y 500 mg L-1. La isoterma de biosorción se ajustó al modelo de Langmuir obteniéndose un valor de 87,40 mg g-1 para la mococapa saturada. Para estimar los parámetros cinéticos se consideró una concentración inicial de 100 mg L-1 a 10 °C, 20 °C, 30 °C y 40 °C, el modelo de pseudo primer orden describió correctamente las cinéticas de biosorción. Estudios de infrarrojo por reflectancia difusa mostraron que los grupos amida fueron los principales responsables de la biosorción.
Palabras clave: biosorción, colorantes azo, aguas residuales, naranja ácido 10.
ABSTRACT
The aim of this paper was to evaluate the ability of biosorption azo dye acid orange 10 of the biomass of a yeast isolated from soil contaminated with wastewater from the textile industry. In equilibrium studies was used 1,0 g L-1 of biomass, at 20 °C and pH 2,0 at initial concentrations between 10 mg L-1 and 500 mg L-1. The biosorption isotherm was fitted by Langmuir model resulting in a value of 87,40 mg g-1 for saturated monolayer. To estimate the kinetic parameters, was considered an initial concentration of 100 mg L-1 at 10 °C, 20 °C, 30 °C to 40 °C, biosorption kinetics were well described by the kinetic model of pseudo-first order. Studies of diffuse reflectance infrared spectroscopy showed that the amide groups were mainly responsible for the biosorption.
Keywords: biosorption, azo dyes, wastewaters, acid orange 10.
INTRODUCCIÓN
Los colorantes azo son ampliamente utilizados en diferentes sectores industriales como la fabricación de textiles, alimentos, cosméticos y fármacos [1]. Se estima que del 10 % al 15 % de los colorantes son descargadas en las aguas de proceso [2]. La descarga de los colorantes azo al ambiente representa un serio problema por las implicaciones que tiene tanto para la salud pública como para los ecosistemas.
El sector textil es una de las industrias que requiere mayor cantidad de agua para los procesos de producción. Para la fabricación de telas de algodón, por ejemplo, la demanda de agua varía entre 120 m3/ton y 750 m3/ton, mientras que para la elaboración de fibras de nylon y de poliéster, la demanda es entre 100-150 m3/ton y 60-130 m3/ton, respectivamente [3]. Considerando lo anterior, es evidente que este sector industrial requiere de sistemas de tratamiento de agua eficientes que permitan reutilizar sus efluentes a través de circuitos cerrados. Los sistemas biológicos han emergido como una alternativa viable para el tratamiento de efluentes del sector textil.
La biosorción surge como una estrategia innovadora, eficiente, económica y con impacto ambiental favorable. La biosorción es la captación de compuestos por medio de una biomasa (viva o muerta), a través de mecanismos fisicoquímicos como la adsorción o el intercambio iónico, involucrando una fase sólida (adsorbente) y una fase líquida (disolvente) que contiene las especies que van a ser adsorbidas (adsorbato). Algunas variables que influyen en la adsorción son: la relación adsorbente/disolución, el tamaño de partícula y el pH [4]. En estudios anteriores se encontró que la biomasa de la levadura KB-a1 biosorbe algunos colorantes de tipo azo y antraquinonas; este proceso se favorece a pH 2,0 [5].
El presente trabajo tiene como objetivo primordial obtener datos de capacidad máxima de adsorción en condiciones de equilibrio y parámetros cinéticos para los procesos de biosorción e identificar los grupos funcionales de la biomasa de levadura que intervienen en la adsorción del colorante empleando espectroscopia de infrarrojo por reflectancia difusa.
MATERIALES Y MÉTODOS
Métodos experimentales
Acondicionamiento del material biológico
Se utilizó la biomasa de la levadura denominada KB-a1 como material biosorbente, aislada de muestras de suelo contaminado con aguas residuales de la industria textil en el Estado de Tlaxcala, México. Para la propagación de la levadura se procedió a inocular en medio líquido, el cual se mantuvo en agitación constante durante 48 h. El medio de cultivo se compone de: 10 g L-1 de glucosa, 1,0 g L-1 de NH4NO3, 0,9 g L-1 de K2HPO4, 0,2 g L-1 de KCl, 0,2 g L-1 de MgSO4 y (0,002 g L-1 de FeSO4, MnSO4, ZnSO4). Cumplido el tiempo de propagación, la biomasa se cosechó por centrifugación y se secó a 60 °C durante 24 h, posteriormente se trituró.
Colorante
Se utilizó el colorante naranja ácido 10 (también conocido como Orange G), marca J.T Baker con un 89 % de pureza, sus propiedades fisicoquímicas se muestran en la tabla 1.
TABLA 1 PROPIEDADES FISICOQUÍMICAS DEL COLORANTE NARANJA ÁCIDO 10 [6]
| Colorante | Estructura química | Fórmula molecular | Peso molar | Máx (nm) |
| Naranja ácido 10 |
|
C16H10N2Na2O7S2 | 452 | 478 |
Estudios de remoción de colorante naranja ácido 10
Los estudios de biosorción se realizaron empleando soluciones del colorante a pH 2,0 con una concentración inicial de 100 mg L-1, las cuales se pusieron en contacto con la biomasa de levadura KB-a1 (1,0 g L-1) en agitación constante. En los estudios en equilibrio se empleó una temperatura de 20 °C con concentraciones iniciales de colorante entre 10 mg L-1 y 500 mg L-1 a pH 2,0 y 2 h de contacto. Para los estudios cinéticos se ensayaron condiciones de temperatura de 10 °C, 20 °C, 30 °C y 40 °C con una concentración inicial de colorante de 100 mg L-1; se tomaron 15 muestras durante 24 min.
Métodos análiticos
Se utilizaron membranas de fibra de vidrio (poro de 1,6 µm marca Whatman GF/A) para la filtración de las muestras recolectadas. Al filtrado se le determinó la concentración final de colorante espectrofotométricamente a 475 nm, empleando un espectrofotómetro Cary 300 (Varian Inc.). El pH se midió en un potenciómetro (Orion, All Star 211). Para la identificación de los grupos funcionales se obtuvieron espectros de infrarojo del colorante, la biomasa y la biomasa con colorante en un espectrofotómetro Perkin Elmer (Spectrum 2000 FTIR) empleando un accesorio de reflectancia difusa.
RESULTADOS Y DISCUSIÓN
Estudios en equilibrio
En la figura 1 se presenta la isoterma de biosorción del colorante. Se observó que la capacidad de biosorción aumentó proporcionalmente a la concentración de colorante en el equilibrio a bajas concentraciones de colorante, sin embargo a concentraciones superiores a 100 mg L-1, la capacidad de biosorción fue incrementándose en menor proporción y tendiendo hacia un valor máximo.
Los datos experimentales fueron analizados empleando el modelo de Langmuir. La teoría asume que todos los sitios de sorción son idénticos, lo que significa que retiene una molécula y que todos los sitios son energéticamente independientes de la cantidad de soluto adsorbidos [7, 8].
La expresión matemática del modelo se representa mediante la ecuación 1:
Para la obtención de los valores de las constantes de la isoterma de Langmuir se realizó la regresión no lineal de qe vs. Ce empleándose el software GraphPad Prism 6 (GraphPad Software Inc.); los resultados se muestran en la tabla 2. Los datos experimentales fueron bien descritos por la tendencia de la isoterma obteniendo una R2 de 0,9.
TABLA 2. CONSTANTES DE LAS ISOTERMAS DE BIOSORCIÓN DEL COLORANTE
NARANJA ÁCIDO 10 MODELADO POR LANGMUIR
| Langmuir | ||
| Q0 | b | R2 |
| 87,40 | 0,062 21 | 0,926 1 |
Cinéticas de biosorción de colorante naranja ácido 10
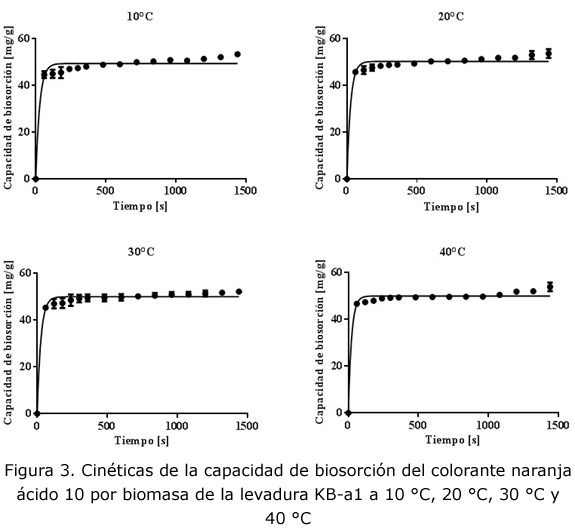
Los estudios cinéticos de biosorción de n aranja ácido 10 a 10 °C, 20 °C, 30 °C y 40 °C se presentan en la figura 2. Cada una de las gráficas muestra que la biomasa de levadura KB-a1 ocasionó la disminución de la concentración de colorante principalmente durante los primeros 2 min de contacto. En las gráficas se muestra que a partir del minuto 10 se alcanza el equilibrio ya que las concentraciones alcanzaron valores estables. Es importante señalar que durante la realización de estos experimentos se observó que la biomasa formaba agregados que no se dispersaban fácilmente a 40 °C, fenómeno que podría haber dificultado la transferencia del colorante hacia los sitios de biosorción de la biomasa.
Para el análisis de las cinéticas de biosorción se empleó el modelo cinético de pseudo-primer orden, la expresión no lineal está representada por la ecuación 2 [9]:
Los valores de las constantes cinéticas del proceso de biosorción se presentan en la tabla 3. Los índices de correlación presentaron valores altos entre 0,96 y 0,98; además, los valores de las capacidades en equilibrio (qe) se encontraron muy cercanos a los valores encontrados de manera experimental. Al analizar las constantes de velocidad se observó un incremento en su valor debido al aumento de la temperatura entre los 10 °C y los 30 °C; sin embargo, a 40 °C el valor de la constante muestra un descenso, debido posiblemente a problemas de tranferencia de masa por la aglomeración ya mencionada del material biológico.
TABLA 3. CONSTANTES CINÉTICAS DEL MODELO DE PSEUDO-PRIMER
ORDEN A DIFERENTES CONDICIONES DE TEMPERATURA
| Temperatura | qexp | Pseudo-primer orden | ||
|
|
| qe(mg g-1) | k1(h-1) | R2 |
| 10 | 53,3 | 49,39 | 214,2 | 0,965 5 |
| 20 | 53,6 | 50,29 | 226,1 | 0,976 1 |
| 30 | 52,2 | 50,02 | 225,1 | 0,981 3 |
| 40 | 53,9 | 50,05 | 260,9 | 0,983 5 |
En la figura 3 se presentan las líneas de tendencia del modelo comprobando el buen ajuste de los valores predichos con los experimentales.
Estudio termodinámico
La energía de activación se obtuvo a través de la expresión de la Ley de Arrhenius que relaciona la constante de velocidad k con la temperatura (3):
Los valores de Ea y A se obtuvieron por regresión no lineal de k vs. T empleando el software GraphPad Prism 6 (GraphPad Software Inc.); de la misma forma se calcularon la entalpía y entropía de activación (ΔH* y ΔS*) empleando la ecuación de la teoría del estado de transición (4) [10]:
Los valores de los parámetros de activación se obtuvieron por regresión no lineal de k/T vs. T empleando el software GraphPad Prism 6. La energía libre de activación (ΔG*) del proceso de sorción se calculó considerando únicamente los datos de las constantes de velocidad obtenidas a temperaturas de 10 °C, 20 °C y 30 °C.
En la tabla 4 se reportan los resultados obtenidos al ajustar los valores de las constantes de velocidad obtenidas con el modelo de pseudo-primer orden. El valor positivo de ΔH* (1,764 kJ mol-1) indica que la reacción es endotérmica, mientras que el valor negativo de ΔS* (-0,218 9 kJ mol-1 K-1) refleja que no hay cambios significativos en la estructura del material biológico durante el proceso de biosorción [10]. El valor de Ea para el proceso de biosorción del colorante (1,764 kJ mol-1) sugiere que la adsorción es de tipo físico, ya que en la adsorción física la Ea no es superior a 4,2 kJ mol-1 [11]. En cuanto a ΔG*, este presentó valores positivos entre 63,74 kJ mol-1 y 68,12 kJ mol-1, lo que indica que la reacción no es espontánea.
TABLA 4. PARÁMETROS TERMODINÁMICOS DE LA BIOSORCIÓN DE NARANJA ÁCIDO 10
| T (°C) | Ea (kJ mol-1) | A (s-1) | ΔH* (kJ mol-1) | ΔS* (kJ mol-1 K-1) | ΔG* (kJ mol-1) |
| 10 |
|
|
|
| 63,74 |
| 20 | 1,764 | 0,076 26 | 1,764 | -0,218 9 | 65,93 |
| 30 |
|
|
|
| 68,12 |
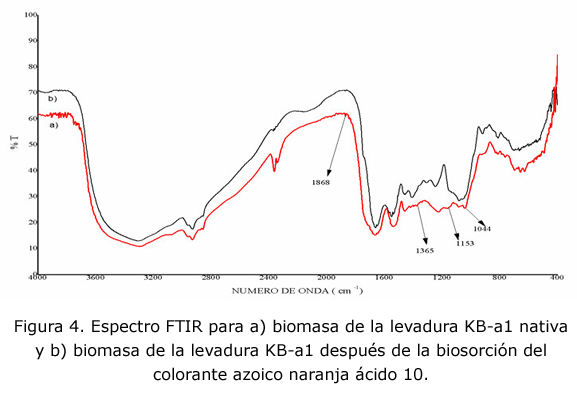
Análisis espectroscópico
En la figura 4 se compara el espectro de transmitancia obtenido en la región del infrarrojo para la biomasa de levadura KB-a1 antes y después de su contacto con la solución de colorante. Es evidente que la presencia del colorante azoico provocó cambios importantes en espectro, los cambios más notables se reportan en la tabla 5. Sobresale la aparición del pico a 1 162 cm-1 correspondiente al doblamiento del enlace C-H aromático, posiblemente debido a la presencia del colorante azoico, el cual presenta anillos aromáticos. En cuanto a los grupos funcionales que pudieran ser responsables del proceso de biosorción se presenta un desplazamiento de la banda de 1 246 cm-1 a 1 227 cm-1, lo que indica la participación de grupos carboxilo, o bien grupos amida, en la biosorción del colorante.
TABLA 5. RESUMEN DE LAS BANDAS DE INFRARROJO ENCONTRADAS
EN LA BIOMASA DE LEVADURA KB-a1 ANTES Y DESPUÉS DEL CONTACTO
CON SOLUCIÓN DEL COLORANTE NARANJA ÁCIDO 10
| Banda de frecuencia del infrarrojo (cm-1) | Grupo funcional asignado | Referencia | |
| Biomasa de levadura KB-a1 nativa | Biomasa de levadura después del contacto con solución de RBBR |
|
|
| 1 548 | 1 542 | Doblamiento del grupo NH2 y estiramiento C=N de la amida II | [12, 13] |
| 1 453 | 1 456 | Radicales alquilo y otros grupos alifáticos saturados | [14] |
| 1 409 | 1 418 | Vibraciones simétricas de estiramiento C=O del carboxilato | [15] |
| 1 246 | 1 227 | Estiramiento de C-O en los ácidos carboxílicos Estiramiento C-N (amida III) y estiramiento asimétrico PO2- y en menor medida de fosfolípidos | [16]
[13] |
| - | 1 162 | Doblamiento en un plano de C-H aromático | [14] |
CONCLUSIONES
La biomasa de la levadura KB-a1 es capaz de biosorber el colorante azoico naranja ácido 10 a pH 2,0, alcanzado capacidades de biosorción en la saturación de 87,4 mg g-1 de acuerdo con la isoterma de Langmuir y siguiendo cinéticas de pseudo-primer orden. El proceso es de tipo físico, endotérmico y no espontáneo; además, en el proceso de biosorción se encuentran involucrados principalmente grupos funcionales carboxilo y amida.
REFERENCIAS BIBLIOGRÁFICAS
1. DOS SANTOS, A. B.; CERVANTES, F. J.; VAN LIER, J. B., "Review paper on current technologies for decolourisation of textile wastewaters: perspectives for anaerobic biotechnology", Biores. Technol., 2007, 98(12), 2369-2385.
2. ESMAEILI, A.; KALANTARI, M., "Bioremoval of an azo textile dye, Reactive Red 198, by Aspergillus flavus", World J. Microbiol. Biotechnol., 2011, 28(3), 1125-1131.
3. CERVANTES, F. J.; ENRÍQUEZ, J. E.; MENDOZA HERNÁNDEZ, M. R.; RAZO FLORES, E.; FIELD, J. A., "The role of sulphate reduction on the reductive decolorization of the azo dye reactive orange 14", Water Sci. Technol., 2006, 54(2), 171-177.
4. GADD, G. M., "Biosorption: critical review of scientific rationale, environmental importance and significance for pollution treatment", J. Chem. Technol. Biotechnol., 2009, 84(1), 13–28.
5. BARREDA REYES, K. L.; MENDOZA CALDERÓN, E. I.; ORTEGA LÓPEZ, J.; CRUZ HUERTA, M.; ORTEGA REGULES, A. E.; NETZAHUATL MUÑOZ, A. R., "Efecto del pH en la biosorción de colorantes sintéticos empleando biomasa de una levadura aislada de suelo contaminado", en XI Encuentro Participación de la Mujer en la Ciencia (14-16 mayo, 2014), León, Guanajuato, Centro de Investigaciones en Óptica, A. C., 2014, S5-BCA13.
6. XU, X.-R; ZHONG, L., "Degradation of azo dye Orange G in aqueus solutions by persulfate with ferrous ion", Separation and Purification Technology, 2010, 72(1), 105-111.
7. LIMOUSIN, G.; GAUDET, J. P.; CHARLET, L.; SZENKNECT, S.; BARTHÈS, V.; KRISMISSA, M., "Sorption isotherms: a review on physical bases, modeling and measurement", Applied Geochemistry, 2007, 22(2), 249–275.
8. TAMER, A.; SAFA OZCAN, A.; TUNALI, S.; OZCAN, A., "Biosortion of a textile dye (Acid Blue 40) by cone biomass of Thuja orientalis: Estimation of equilibrium, thermodynamic and kinetic parameters", Biores. Technol., 2007, 99(8), 3057-3065.
9. EL-KHAIARY, M. I., "Kinetics and mechanism of adsorption of methylene blue from aqueous solution by nitric-acid treated water-hyacinth", J. Hazard. Mater, 2007, 147(1-2), 28–36.
10. LEÓN TORRES, A.; CUERDA CORREA, E. M.; FERNÁNDEZ GONZÁLEZ, C.; ALEXANDRE FRANCO, M. F; GÓMEZ SERRANO, V., "On the use of a natural peat for the removal of Cr(VI) from aqueous solutions", Journal of Colloid and Interface Science, 2012, 386(1), 325-332.
11. AKSU, Z.; ACIKEL, U.; KABASAKAL, E.; TEZER, S., "Equilibrium modeling of individual and simultaneous biosorption of chromium(IV) and nickel(II) onto dried activated sludge", Water Res, 2002, 36(12), 3063-3073.
12. CHARUMATHI, D.; DAS, N., "Packed bed column studies for the removal of synthetic dyes from textile wastewater using immobilised dead C. tropicalis", Desalination, 2012, 285(31), 22-30.
13. TIAN, Y.; JI, C.; ZHAO, M.; XU, M.; ZHANG, Y.; WANG, R., "Preparation an characterization of baker's yeast modified by nano-Fe3O4: Application of biosorption of methyl violet in aqueous solution", Chemical Engineering Journal, 2010, 165(2), 474-481.
14. COATES, J., "Interpretation of Infrared Spectra, A Practical Approach", in Meyers, R. A. (ed.), Encyclopedia of Analytical Chemistry, Chichester, John Wiley & Sons, 2000, 10815–10837.
15. GAO, J. F.; ZHANG, J. H.; WANG, J. H.; WU, X. L.; WANG, S. Y; PENG, Y. Z., "Contributions of functional groups and extracellular polymeric substances on the biosorption of dyes by aerobic granules", Bioresource Technology, 2011, 102(2), 805-813.
16. STUART, B., Infrared spectroscopy: fundamentals and applications, Chichester, John Wiley & Sons, 2004.
Recibido: 15/09/2014
Aceptado: 07/01/2014
Dra. C. Alma Rosa Netzahuatl-Muñoz, Universidad Politécnica de Tlaxcala, Tlaxcala, México, almarosa.netzahuatl@uptlax.edu.mx