Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.27 no.3 Santiago de Cuba set.-dez. 2015
ARTICULOS
Evaluación de diferentes aroiltioureas como ionóforos en sensores de plomo (II)
Evaluation of different aroylthioureas as ionophores in sensor of lead (II)
Dr. C. Ana R. Lazo-Fraga, Aimée Vasconcelos-Pacheco, Dr. C. Alicia Díaz-García, MSc. Marcia Bustamante-Sánchez, Dr. C. Osvaldo Estévez-Hernández
Universidad de La Habana, La Habana, Cuba, rosa@imre.oc.uh.cu, adg@fq.uh.cu, marcia@imre.oc.uh.cu, osvaldo@imre.oc.uh.cu
RESUMEN
En el presente trabajo se construyen electrodos de estado sólido y naturaleza potenciométrica para la determinación de iones Pb(II), sobre la base de membranas de PVC con aroiltioureas disustituidas como ionóforos. Los electrodos que utilizan 1-furoil-3,3-dietiltiourea y 1-benzoil-3,3-dietiltiourea, manifiestan un comportamiento que denota una relación logarítmica del tipo Nernst, con un intervalo de linealidad de 10-6-10-3 mol/L y muestran una buena sensibilidad al catión Pb(II) con límites de detección de 10-6 mol/L. Estos dispositivos presentan tiempos de respuesta menor de 20 s y tiempos de vida útil de 30 y 90 días respectivamente. En ambos electrodos resultan interferentes los cationes Cu(II), Hg(II), Ag(I) y en menor proporción Cd(II).
Palabras clave: electrodo selectivo a ion Pb(II), 1-Furoil-3,3-dietiltiourea y 1-benzoil-3,3-dietiltiourea.
ABSTRACT
A solid state electrodes for potentiometric determination of Pb(II) ions were constructed. For this purpose PVC membranes that contained disubstituted aroylthiourea as ionophore were employed. When 1-furoyl-3,3-diethylthiourea and 1-benzoyl-3,3-diethylthiourea were use in the electrode have a logarithmic relationship of the Nernst type. In both case, the linear rage are between 10-6-10-3 mol /L and also were observed a good sensitivity to Pb(II) ion, and a detection limits of 10-6 mol / L. These devices have lower response times than 20 seconds and lifetimes of 30 and 90 days, respectively. In both electrodes, Cu(II), Hg(II), Ag(I) are interferences. The Cd(II) cation is an interference in a lesser extent.
Keywords: ion selective electrode Pb ( II), 1-furoyl-3,3-diethylthiourea and 1-benzoyl-3,3-diethylthiourea.
INTRODUCCIÓN
Los electrodos selectivos a iones (ESI) son considerados herramientas muy versátiles en la medición de especies químicas, ya que su selectividad puede ser químicamente modificada al incorporar diferentes moléculas "reconocedoras" en la membrana o fase sensora, lo que amplía el número de analitos de interés que puedan ser detectados por esta técnica.
En general, se han estudiado como ionóforos en ESI a metales pesados diversos compuestos desde éteres corona [1], los calixarenos [2], así como otros compuestos orgánicos más simples y de fácil preparación, para ser aplicados como ionóforos en electrodos selectivos a iones de metales pesados. Sin embargo, los derivados de tiourea [3-7] han sido poco empleados para este propósito. Estas últimas, al contener un átomo de azufre donor en su estructura, coordinan preferentemente con metales de transición y metales pesados [8, 9].
En este trabajo se construyen y evalúan ESI a Pb(II) con diferentes derivados de tiourea como ionóforo, esto es: 1-furoil-3,3-dietiltiourea (FDE), 1-benzoil-3,3-dietiltiourea (BDE), 1-furoil-3,3-difeniltiourea (FDF) y 1-benzoil-3,3-difeniltiourea (BDF). Las características analíticas de estos sensores, permiten esclarecer el equilibrio de respuesta de estos dispositivos.
MATERIALES Y MÉTODOS
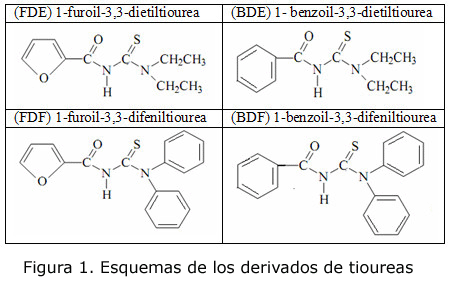
El trabajo experimental se realizó en el Laboratorio Universitario de Caracterización y Estructura de la Sustancia (LUCES) en el Instituto de Ciencia y Tecnología de Materiales de la Universidad de La Habana (IMRE-UH). Los derivados de tiourea utilizados como ionóforo fueron sintetizados y caracterizados por el Laboratorio de Síntesis Orgánica de la Facultad de Química de la propia entidad (figura 1).
Los reactivos utilizados en la evaluación de los electrodos fueron suministrados por las firmas: Sigma-Aldrich, BDH y Merck, con calidad analítica. Se empleó agua bidestilada de conductividad 1,98 µS, la que se obtuvo en un bidestilador Aquatron modelo A4D.
La construcción de los ESI se realizó según la técnica reportada por Lima y Machado (1986) [10]. Para el cuerpo del electrodo se emplearon tubos de polimetacrilato de 10-12 cm de longitud y 8 mm de diámetro interno, anillos de PVC flexible de 8 mm de diámetro externo, y láminas de cobre de 0,1 mm de espesor de pureza 99,9 % de la firma Merck.
En la preparación del compuesto conductor Grafito Epoxi se utilizó polvo de grafito de 1-2 µm de tamaño de partícula, de la firma Merck y una resina epoxi compuesta por Araldita M y Endurecedor HR, ambos de la firma Ciba-Geigy.
Se emplearon como disolventes mediadores o plastificantes: Tris-2-etilhexil fosfato (TEHP), 3-nitro-o-xileno (3-NOX), Bis-2-etilhexil-sebacato (BEHS) y Dibutilftalato (DBPh) de la firma Aldrich; Dioctilftalato (DOPh) y 2-nitro fenil octil éter (2-NPOE) de la firma Merck y Tributilfosfato (TBP) de la Fluka.
Las membranas líquidas o fases sensoras se prepararon en matriz de cloruro de polivinilo (PVC) de la firma Aldrich y se disolvieron en Tetrahidrofurano (THF) de calidad puro para análisis de la firma Merck.
Se utilizó como electrodo de referencia el Ag/AgCl de doble unión líquida de la marca RUSELL (modelo 90-00-29), saturado con una disolución de referencia de AgCl; el compartimiento externo empleó una disolución de referencia de KNO3 al 10 %.
Las calibraciones se efectuaron en una celda abierta de 40 mL con agitación constante. En todas las experiencias se trabajó a una temperatura de 25,0 ± 0,5 ºC. La composición de la celda electroquímica es la siguiente: Ag/AgCl | KCl 0,1 mol/L |KNO3 10 % || disolución de trabajo || membrana de PVC | soporte conductor | Cu(s).
En la determinación de los diagramas de Reilly se trabajó en un pH-metro digital HANNA (HI-931402), con precisión ± 0,01.
La determinación de los coeficientes de selectividad potenciométrica (KPOTAB) se realizó a través del método de las soluciones mezcladas [11].
RESULTADOS Y DISCUSIÓN
Preparación de la fase sensora
La construcción de los electrodos objeto de estudio se fundamenta en los resultados obtenidos por Pérez Marín y colaboradores [3-6] a finales de la década de los 90. Dichos resultados en aquel momento sugirieron que la variación en la respuesta de los electrodos podía ser debida, entre otras causas, a factores estructurales de los derivados de tiourea que fueron utilizados como ionóforos. Por esta razón, en el desarrollo de los sensores estudiados se utilizaron cuatro ionóforos basados en aroiltioureas disustituidas. Estos derivados de tiourea difieren estructuralmente en la naturaleza alifática (etilo) o aromática (fenilo) del fragmento 3,3-disustituido y en el grupo 1-aroilo (benzoilo y furoilo), tal como se aprecia en la figura 1.
Un aspecto importante en la preparación de la fase sensora o membrana líquida es la solubilidad del ionóforo en el disolvente mediador o plastificante, ya que esto influye en la respuesta del sensor. La selección del mejor plastificante para el desarrollo de la membrana polimérica se realiza con el objetivo de encontrar la combinación plastificante/ionóforo, con la que se obtienen las mejores características de respuesta (pendiente, intervalo de linealidad y selectividad) de los electrodos, por lo que el plastificante debe ser compatible con el polímero y con el ionóforo. Por esta razón, previa construcción de los electrodos, se realiza una prueba cualitativa de solubilidad de los cuatro ionóforos en siete de los plastificantes comerciales más utilizados en la preparación de este tipo de membrana (figura 2).
La tabla 1 muestra los resultados de la prueba de solubilidad de los cuatro ionóforos en siete de los plastificantes comerciales más utilizados en la preparación de este tipo de membrana.
TABLA 1. RESULTADOS DE LA SOLUBILIDAD DE LAS AROILTIOUREAS EN
LOS DIFERENTES DISOLVENTES MEDIADORES
| Inóforo | TBP | TEHP | 3-NOX | DOPh | DBPh | BEHS | 2-NPOE |
| FDE | + | + | + | | | | |
| BDE | + | + | + | | + | | |
| FDF | + | | + | | | | |
| BDF | + | + | | + | | | |
| cristales no disueltos | |||||||
Los resultados muestran que los plastificantes más efectivos son el TBP, TEHP y 3-NOX y que, en particular, el TBP es el único que disuelve a los cuatro ionóforos. No obstante se estudian las doce combinaciones plastificante/ionóforo en las que se logró la disolución total de los cristales.
Calibración de los electrodos
Sobre la base del resultado anterior se construyen doce electrodos (FDE-TBP, FDE-TEHP, FDE-3NOX, BDE-TBP, BDE-TEHP, BDE-3NOX, BDE-DBPh, FDF-TBP, FDF-3NOX, BDF-TBP, BDF-TEHP y BDF-DOPh) con sus respectivas réplicas. Estos se calibran mediante el método de las adiciones y metodología de cálculo reportada en trabajos anteriores [7, 12].
La figura 3 muestra los gráficos representativos de las sucesivas calibraciones de los ESI construidos. Los ESI FDE-TBP, BDE-TEHP, BDF-TEHP y BDE-TBP manifiestan un comportamiento que denota una relación logarítmica del tipo Nernst, con un intervalo de linealidad de 10-6-10-3 mol/L para los tres primeros casos, mientras que el ESI BDE-TBP exhibe un intervalo de linealidad de 10-5-10-3 mol/L. El resto de los electrodos no mostraron buena sensibilidad en su respuesta al ion Pb(II).
Estos resultados sugieren que tanto la elevada lipofilicidad (presencia de largas cadenas carbonadas) de los plastificantes como la presencia de grupos básicos (fosfatos) capaces de interactuar con los NH acídicos de los derivados de tiourea utilizados contribuyen al adecuado establecimiento del equilibrio en que se basa la respuesta de estos sensores. En trabajos anteriores con otros derivados de tiourea, se demostró que la interacción de los plastificantes con los NH acídicos favorece la solubilidad e incrementa el carácter nucleofílico del átomo de azufre vecino (resonancia tioamídica) [9].
En las tablas 2 y 3 se muestran los valores promedio de los diferentes parámetros de calibración de los doce electrodos construidos. Los resultados obtenidos permiten apreciar el comportamiento de la respuesta de cada sensor al catión metálico. Se puede observar que los mejores valores de pendiente (sensibilidad del electrodo) lo exhiben los ESI FDE-TBP, BDE-TEHP, BDE-TBP y BDF-TEHP; dichos valores se acercan al valor teórico según lo reportado por Nernst para un ion divalente (29,53 mV/dec), con un coeficiente de correlación de 0,99 en todos los casos. Estos electrodos presentan bajos límites de detección.
TABLA 2. PARÁMETROS DE CALIBRACIÓN DE LOS ELECTRODOS CONSTRUIDOS
CON LA FDE Y BDE COMO IONÓFOROS
| Parámetros | FDE | BDE | |||||
| TBP | 3-NOX | TEHP | TBP | TEHP | 3-NOX | DBPh | |
| S(mV/ dec) | 29,61±0,56 | 12,94±0,47 | 22,89 ±0,73 | 30,00±0,52 | 28,86±0,51 | 16,42 ±0,73 | 9,62 ± ,29 |
| R | 0,998 | 0,990 | 0,992 | 0,996 | 0,999 | 0,983 | 0,992 |
| Sd | 1,668 | 2,157 | 2,42 | 1,992 | 1,405 | 2,779 | 1,201 |
| LPD(mol/L) | 2,6 · 10-6 | 6,7 · 10-7 | 7,3 · 10-6 | 1,0 · 10-5 | 1,8 · 10-6 | 4,0 · 10-5 | 1,8 · 10-5 |
| LIRL(mol/L) | 3,1 · 10-6 | 7,8 · 10-7 | 2,1 · 10-5 | 2,2 · 10-5 | 2,7 · 10-6 | 2,7 · 10-5 | 1,1 · 10-5 |
| Sd: desviación estándar de la pendiente | |||||||
TABLA 3. PARÁMETROS DE CALIBRACIÓN DE LOS ELECTRODOS CONSTRUIDOS
CON LA FDF Y BDF COMO IONÓFOROS
| Parámetros | FDF | BDF | |||
| TBP | 3-NOX | TEHP | TBP | BEHPh | |
| S(mV/dec) | 25,17 ± 0,89 | 7,54 ± 0,47 | 28,63 ± 0,37 | 15,68 ± 0,26 | 6,48 ± 0,40 |
| R | 0,996 | 0,980 7 | 0,998 | 0,997 | 0,964 |
| Sd | 1,890 | 4,419 | 1,668 | 1,290 | 1,831 |
| LPD(mol/L) | 8,0 · 10-6 | 2,8 · 10-7 | 1,6 · 10-6 | 1,6 · 10-6 | 7,81 · 10-7 |
| LIRL(mol/L) | 2,2 · 10-5 | 4,7 · 10-7 | 1,8 · 10-6 | 3,0 · 10-6 | 2,8 · 10-7 |
| Sd: desviación estándar de la pendiente. | |||||
Caracterización analítica de los electrodos
La sensibilidad de los electrodos según la IUPAC [11], dada por los valores de pendiente de la recta de calibrado, es de hecho el parámetro que más se utiliza para establecer el tiempo de vida útil de los ESI. De acuerdo con lo anterior, se analiza el comportamiento de la pendiente de los electrodos (FDE-TBP, BDE-TEHP, BDF-TEHP y BDE-TBP) en el tiempo. Un criterio similar se adoptó para el análisis del tiempo de vida medio de otros electrodos selectivos de membrana líquida [3-7, 12].
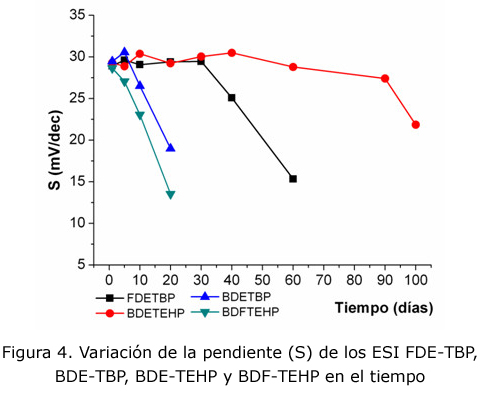
En la figura 4 se muestra el comportamiento de la sensibilidad de los electrodos en el tiempo. Se puede apreciar que los ESI BDE-TEHP y FDE-TBP muestran los mejores tiempos de vida: 90 y 34 días, respectivamente, lo que permite su caracterización analítica. No así para el caso de los ESI BDE-TBP y BDF-TEHP que, aunque manifiestan buena respuesta al catión metálico durante un tiempo menor de cinco días, la brevedad de su respuesta invalida la caracterización analítica.
Los resultados alcanzados, hasta el momento, indican que en las membranas con derivados de tioureas alquil disustituidas (BDE-TEHP y FDE-TBP) se establece de manera más efectiva el equilibrio de formación del complejo en el cual se basa el funcionamiento de estos sensores; no ocurre así en las membranas que poseen derivados de tioureas aril disustituidas (FDF-TBP y BDF-TEHP). La causa de esta diferencia podría deberse a la distinta naturaleza estructural de los grupos 3,3-disustituyentes, que pueden afectar el establecimiento del equilibrio en dos direcciones: por una parte, el carácter nucleofílico de los centros de coordinación (átomos de azufre y oxígeno) debido a los factores estereoelectrónicos diferentes que provocan los grupos etilo y fenilo; pero, además, a una compatibilidad entre el ionóforo y el disolvente mediador debido a la lipofilicidad de los ionóforos. Es un hecho demostrado en la literatura [8, 13] que una mayor lipofilicidad del ionóforo es un aspecto que contribuye favorablemente en el funcionamiento de estos sensores, pues beneficia una mejor interacción química con el plastificante, y disminuye la posibilidad de salida de la membrana. En este caso, los ionóforos BDE y FDE contienen grupos etilo que favorecen la lipofilicidad de los mismos, en comparación con sus análogos BDF y FDF.
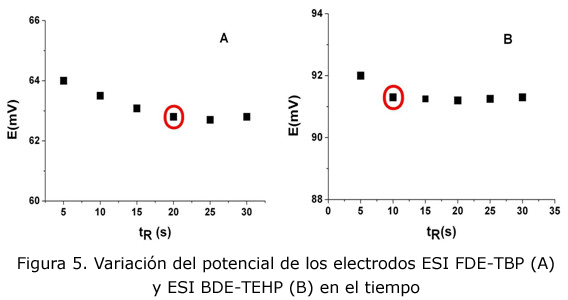
En la figura 5 se observa que los ESI sensibles al catión Pb(II), FDE-TBP (figura 5-A) y BDE-TEHP (figura 5-B) tienen un tiempo de respuesta inferior a los 20 s, por lo que pueden ser considerados electrodos de respuesta rápida, lo que es ventajoso en las determinaciones analíticas.
La figura 6 muestra la variación del potencial del ESI BDE-TBP (figura 6-A) y FDE-TEHP (figura 6-B) con el pH del medio; en ambas se aprecian tres regiones. La región II corresponde a un intervalo estrecho de pH donde el potencial se mantiene constante, que sería la zona de respuesta y, por tanto, de trabajo de los sensores.
Para el sensor FDE-TBP esta zona se encuentra entre 4,8 y 6,0; en el caso del sensor BDE-TEHP la zona se amplía ligeramente entre 4,0 y 6,0, lo que indica que para realizar cualquier determinación con los ESI construidos se requiere un control de pH del medio en el cual se lleva a cabo la determinación analítica.
Uno de los parámetros más importantes a considerar en un sensor potenciométrico es su selectividad, debido a que nunca son completamente específicos a un único ion. Por ello, se hace necesaria la determinación del coeficiente de selectividad potenciométrico. En la tabla 4 se presentan los valores de los coeficientes de selectividad calculados para los iones Na+, Zn2+, Ni2+, Ca2+, Cd2+, Cu2+, Ag+, Co2+ y Hg2+ a una concentración de 10-2 mol/L. Estos son los iones que con mayor frecuencia aparecen en la literatura para el estudio de interferencias en la determinación del ion Pb(II) [14, 15]. L os resultados que aparecen en la tabla anterior indican que los cationes Cu2+, Ag+ y Hg2+ interfieren la determinación del ión Pb2+ con ambos electrodos, mientras que el catión Cd2+ es medianamente interferente. Esto es coherente con lo reportado por otros autores [16, 17] incluso para electrodos selectivos a iones Pb2+ comerciales.
TABLA 4. COEFICIENTE DE SELECTIVIDAD POTENCIOMÉTRICO DE LOS ELECTRODOS
AL CATIÓN Pb2+, EMPLEANDO EL MÉTODO DE LAS SOLUCIONES MEZCLADAS
| Iones interferentes | FDE-TBP BDE-TEHP | |
| KPOTAB | KPOTAB | |
| Ni2+ | 0,000 1 | 0,000 8 |
| Co2+ | 0,000 1 | 0,000 1 |
| Na+ | 0,008 | 0,001 |
| Zn2+ | 0,03 | 0,001 |
| Ca2+ | 0,02 | 0,003 |
| Cd2+ | 0,15 | 0,02 |
| Cu2+ | 2,95 | > 3 |
| Ag+ | > 3 | > 3 |
| Hg2+ | > 3 | > 3 |
Relacionado con lo anterior, los fabricantes de ESI a Pb(II) recomiendan que para el correcto funcionamiento de los electrodos comerciales, estén ausentes en la disolución de medida los iones Cu2+ y Hg2+, y que las concentraciones de los iones Cd2+ no superen a la del ion principal.
La gran interferencia de los cationes Ag+, Hg2+ y Cd2+ pudiera explicarse atendiendo a la teoría de ácidos y bases duros y blandos (TABDB) de Pearson [18]. Estos cationes se clasifican como ácidos blandos, por lo que tienden a formar complejos muy estables con los compuestos que contengan azufre, lo que explica su interferencia en la determinación de Pb2+. Además, tanto el Cu2+ como el Pb2+ son clasificados como ácidos de dureza intermedia, sin embargo, la mayor estabilidad de los complejos de tioureas con Cu2+ tiene su origen en una mayor relación carga/radio para el Cu2+. Este catión también presenta orbitales "d" incompletos 3d9 que, debido al efecto del campo de ligandos, provocan una energía de estabilización adicional [19, 20].
Por otra parte, los valores de constantes de estabilidad reportados [21] para complejos de tiourea con estos iones pueden ofrecer un punto de partida en cuanto a la fortaleza de la interacción entre estas especies y los derivados de tiourea utilizados, como los ionóforos en este trabajo. Los valores de log ß4 para los complejos de tiourea con Hg2+, Cu2+ y Cd2+ son 15,4; 8,3 y 4,6, respectivamente, mucho mayores que el valor de log ß1 (0,63) obtenido en el caso del Pb2+. Estos resultados muestran un comportamiento análogo al observado para las KPOTAB de los iones interferentes.
CONCLUSIONES
Los electrodos construidos FDE-TBP y BDE-TEHP exhiben un comportamiento nernstiano con buena reproducibilidad en las características de respuesta, un LPD del orden de 10-6 mol/L, estabilidad rápida en la respuesta (20 s), tiempos de vida de 34 y 90 días, respectivamente. En ambos casos resultan interferentes los cationes Cd2+, Cu2+, Hg2+ y Ag+.
La respuesta de los electrodos se encuentra relacionada con la interacción de los átomos de S y O de los derivados de tiourea con el catión Pb(II) y de la naturaleza alifática o aromática de los grupos 3,3-disustituyentes.
REFERENCIAS BIBLIOGRÁFICAS
1. ZAMANI, A., et al ., "Crown Ethers Bearing 18C6 Unit; Sensory Molecules for Fabricating PVC Membrane Lead Ion-selective Electrodes", Journal Chinese Chemical So., 2011, 58(5), 673-680.
2. YAFTIAN, M. R.; RAYATI, S.; EMADI, D.; MATT, D., "A coated wire-type lead (II) ion-selective electrode based on a phosphorylated calix[4]arene derivative", Anal. Sci., 2006, 22(8), 1075-1078.
3. PÉREZ MARÍN, L., et al., "Electrodo de membrana líquida sensible a iones cadmio (II), usando como ionóforo la 1-furoil-3-bencil-3-feniltiourea", Afinidad, 1999, 56(484), 397-401.
4. ARIAS, O., et al., "Lead ion selective Chemfet based on a new synthetic ionophore", Afinidad, 2001, 58(495), 363-366.
5. MARÍN PÉREZ, L., et al., "The 1-furoyl-3-ciclohexylthiourea as ionophore Mercury (II) ion-selective electrode. Twice Nernstian response", Afinidad, 2002, 59(501), 581-585.
6. MARÍN PÉREZ, L., et al., "Mercury (II) ion-selective electrode. Study of 1,3-diphenylthiourea as ionophore", Analyst, 2000, 125(10), 1787-1790.
7. WILSON, D., et al., "Lead (II) ion selective electrodes with PVC membranes based on two bis-thioureas as ionophores: 1,3-bis(N' benzoylthioureido)benzene and 1,3-bis(N'-furoylthioureido)benzene", J. Hazard Mater, 2010, 181(1-3), 140-146.
8. SÁNCHEZ OTAZO, E., et al., "Aroylthioureas: new organic ionophores for heavy-metal ion selective electrodes", J. Chem. Soc. Perkin Trans., 2001, 2, 2211-2218.
9. SÁNCHEZ OTAZO, E., et al., "Aroylthioureas: new organic ionophores for heavy metal ion selective electrodes. A nuclear magnetic resonance study", Spectrochim. Acta A., 2002, 58, 2281-2290.
10. LIMA, J., et al., "Procedure for the Construction of All-solid-state PVC Membrane Electrodes", Analyst, 1986, 111, 799-802.
11. BUCK, R.; Lindneri, E., "Recomendations for Nomenclature of ion-selective electrodes", Pure Appl. Chem., 1994, 66(12), 2527-2536.
12. ARADA, M. DE LOS Á., et al., "Influence of different plasticizers on the response of chemical sensors based on polymeric membranes for nitrate ion determination", Sensors and Actuators B., 2003, 89(3), 262-268.
13. MIHALI, C.; VAUM, N., Use of Plasticizers for Electrochemical Sensors, Recent Advances in Plasticizers, InTech, 2012 [consulta: 2014-09-26]. Disponible en: <http://www.intechopen.com/books/recent-advances-in-plasticizers/use-of-plasticizers-for-electrochemicalsensors> .
14. BHAT, V., et al., "Coated wire lead(II) selective potentiometric sensor based on 4-tert-butylcalix[6]arene", Sensors and Actuators B-chemical, 2004, 99(1), 98-105.
15. BAKKER, E.; BÜHLMANN, P.; PRETSCH, E., "Carried based ion-selective electrodes and bulk optodes 1. General characteristics", Chemical Reviews, 1997, 97(8), 3083-3132.
16. GUZINSKI, M., et al., "Solid-Contact Ion-Selective Electrodes with Highly Selective Thioamide Derivatives of p-tert-Butylcalix[4]arene for the Determination of Lead(II) in Environmental Samples", Anal. Chem., 2013, 85(3), 1555-1561.
17. ORTIZ FONSECA, O., "Desarrollo de un analizador automático para la determinación del ion plomo en muestras medioambi entales" [tesis doctoral], Barcelona, Universidad Autónoma de Barcelona, 2003.
18. PEARSON, R., "Absolute electronegativity and hardeness: aplications to Inorganic Chemistry", Inorganic Chemistry, 1988, 27(4), 734-740.
19. GISPERT, J., Química de Coordinación, Barcelona, Universidad de Barcelona, 2000.
20. CAO, R.; FERNÁNDEZ, N.; ALEMÁN, J., Compuestos de Coordinación, La Habana, Editorial Pueblo y Educación, 1988.
21. KOTRLY, S.; SUCHA, L., Handbook of Chemic al Equilibria in Analytical Chemistry, New York, John Wiley & Sons, 1985.
Recibido: 14/12/2014
Aceptado: 17/01/2015
Dr. C. Ana R. Lazo-Fraga, Universidad de La Habana, La Habana, Cuba, rosa@imre.oc.uh.cu