Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.1 Santiago de Cuba jan.-abr. 2016
ARTICULOS
Separación y clasificación de los alcaloides presentes en las hojas y flores de la especie Spilanthes urens Jacq
Separation and Classification of Alkaloids Present in the Leaves and Flowers of the Specie Spilanthes urens Jacq
Lic. Laritza Espada-DomínguezI, Dr. Armando Ferrer-SerranoI, Lic. Yosmari Batista-KingII, Lic. Annarelis Bandera-NápolesIII, Lic. Yulianis Almeida-AcostaIV
IDepartamento de Química, Facultad de Ciencias Naturales, Universidad de Oriente, Cuba, larytza@cnt.uo.edu.cu, aferrer@cnt.uo.edu.cu
IIFarmacia Principal, Municipio Holguín, Holguín, Cuba
IIIFarmacia del Hospital Oncológico "Conrado Benítez" de Santiago de Cuba, Cuba
IVEmpresa Distribuidora y Comercializadora de Medicamentos (EMCOMED), Santiago de Cuba, Cuba
RESUMEN
La planta conocida como "botón de plata" (Spilanthes urens Jacq) es una especie silvestre de las Antillas (Cuba, República Dominicana y Puerto Rico); en el Oriente de Cuba se utiliza por los campesinos para aliviar las dolencias dentales. El órgano de la planta empleado por los campesinos es la flor. Algunas encuestas demostraron la utilidad también de las hojas, pero no refieren indicios anestésicos, sí con el uso de las flores. Se realizó una caracterización cualitativa a las hojas y flores mediante tamizaje fitoquímico. Se encontraron distintos tipos de metabolitos: triterpenos, esteroides, cumarinas, azúcares reductores, aminoácidos libres, aminas, saponinas, flavonoides, poliurónidos y alcaloides, en ambos órganos de la planta. Se realizó una extracción de los alcaloides, obteniéndose sólidos amarillos en los dos casos, aunque en mayor cantidad para las flores. Se aplicó la Marcha Sistemática de Banford para clasificar estos alcaloides, dando positiva la prueba que clasifica al compuesto (o los compuestos) como derivados del indol. Se empleó la cromatografía de placa delgada para tener indicios del grado de pureza de los productos. Finalmente, se registraron los espectros ultravioleta-visibles para tener una idea de la presencia del anillo indólico.
Palabras clave: Spilanthes urens Jacq, estudio fitoquímico, extractos, alcaloides.
ABSTRACT
The plant known as "silver button" (Spilanthes urens Jacq) is a wild species from Las Antillas: Cuba, Dominican Republic and Puerto Rico. In the East of Cuba is used by farmers in some places to ease dental ailments. The organ of the plant used by farmers is the flower. Some surveys made to effect also demonstrated the utility of the leaves, but do not refer to anesthetic indications. However, it argues that using flowers the effect is numbing, almost anesthetic. Qualitative characterization leaves and flowers of this species by phytochemical screening were performed. Different types of metabolites are found: triterpenoids, steroids, coumarins, reducing sugars, free amino acids, amines, saponins, flavonoids, alkaloids and polyuronides. Due to the versatile properties including anesthetic, an alkaloids extracting process was carried out, and yield yellow solids but in greater quantity for the flowers. After was applied Banford Systematic March to classify these alkaloids. The result gave positive for test that classifies the compound (or compounds) as indole derivatives. Thin layer chromatography for clues to the degree of purity of the product was applied. Finally the UV-visible spectroscopy to get an idea of the presence of the indole ring spectra was recorded.
Keywords: Spilanthes urens Jacq, phytochemical study, extracts, alkaloids.
INTRODUCCIÓN
Así, de la especie Spilanthes acmella, los nativos quichuas de la Amazonia utilizan las hojas para calmar el dolor de muelas al igual que en algunas áreas de la India y Bangladesh, donde también emplean las flores /7/. En la región India de Saurashitra, Gujarat, la población usa el polvo de las flores de la especie Spilanthes acmella Murr. para calmar los dolores de muelas, colocándolo en las gritas dentales dicho polvo /8/. No solo estas especies " acmella" han mostrado cualidades odontálgicas. Las especies Spilanthes clava L. y Spilanthes clava DC. también han sido utilizadas con estos fines /9, 10/. Los Sionas del Perú llaman "remedio de los dientes" o "guhi-siri" a la especie Spilanthes alba, y los Tukinas de Colombia utilizan el "botoncillo" (Spilanthes ocymilofia) para dolores dentales, mientras que los capítulos florales de Spilanthes ciliata adormecen la lengua al masticarlos y se emplean como odontálgicos /11/.
En Cuba existe una especie con características semejantes a las antes mencionadas, cuyo nombre popular es botón de plata, Spilanthes urens Jacq. Los campesinos cubanos y mucha población urbana la utilizan para aliviar los dolores de muelas describiéndose un efecto adormecedor. Este efecto está estrechamente relacionado con la presencia de metabolitos, cuya estructura sea similar a la de un anestésico local /12/. Dentro de los compuestos químicos que puede presentar una planta de este tipo, los mejores candidatos de ser los responsables de la actividad anestésica son los alcaloides, debido a que en sus estructuras aparecen grupos amino al igual que los anestésicos locales /13/. Sin embargo, no son los únicos; hay que tener en cuenta otros metabolitos que puedan ejercer dicha actividad.
Hasta el momento no se ha descrito la composición fitoquímica acerca de la Spilanthes urens Jacq, incluso son muy escasos los estudios relacionados con esta especie. Por otro lado, García Simón y colaboradores realizaron un estudio fármaco-toxicológico del aceite esencial obtenido de la flor del "botón de plata", plantando que la misma posee un efecto anestésico local. En este estudio se determinaron los tiempos de anestesia y se calculó la potencia relativa frente a la lidocaína al 2 %, y la lidocaína al 2 % con epinefrina (1:50000). Se determinaron los posibles efectos adversos sobre la mucosa oral, rectal ocular y sobre la piel después de la aplicación del aceite esencial /14/.
En nuestro trabajo se propone un tamizaje fitoquímico preliminar con el objetivo principal de detectar la presencia de alcaloides u otras especies que puedan ejercer la actividad biológica antes mencionada. Luego se propone un método de extracción de los mismos basado en sus propiedades básicas y cumpliendo, en lo posible, con los principios de la Química Sostenible /15/. Finalmente se realiza una clasificación de los alcaloides mediante la combinación de la Marcha de Banford para clasificación de alcaloides /16/ y técnicas espectroscópicas y cromatográficas.
MÉTODOS EXPERIMENTALES
Se recolectó la especie (hojas y flores) según la Norma Ramal 309 (NR309) del Ministerio de Salud Pública de la República de Cuba /17/, en los alrededores de la Escuela Primaria "Guillermo Granados Lara", situada en la carretera de El Caney, km 1 ½, La Caridad, Santiago de Cuba. La planta se encontraba aproximadamente a 80 m alejada de la carretera. La muestra se tomó en horas de la mañana en un lugar claramente alejado del tránsito de los vehículos, para evitar la contaminación con el plomo y otros contaminantes derivados de la combustión de la gasolina o el petróleo.
Se procedió al secado utilizando la NR 310 mediante el método de secado a la sombra /17/ (en presencia de un deshumidificador SENKEY). Los extractos para el tamizaje fitoquímico se obtuvieron por extracción continua hasta agotamiento y por orden creciente de polaridad, usando éter dietílico, etanol y agua /18/.
Los ensayos realizados para la identificación de cada metabolito son los tradicionales descritos en la literatura sobre productos naturales /19, 20/. El método de extracción empleado para los alcaloides se basó, fundamentalmente, en las propiedades ácido-base de los mismos.
Los espectros UV-visible se registraron en un espectrofotómetro Rayleigh UV-2601 (fabricado en la República Popular China), dotado de un ordenador para controlar la entrada y salida de datos.
RESULTADOS Y DISCUSIÓN
Clasificación taxonómica. Descripción botánica. Hábitat
Reino: Plantae (vegetal)
Subreino: Cormobionta
Subdivisión: Magnoliophitina = Angiospermae
Clase: Magnoliopsida = Dicotyledoneae
Subclase: Asteridae
Corte: Asteranae
Orden: Asterales
Familia: Asteraceae = Compositae
Género: Spilanthes
Especie: Spilanthes urens Jacq /21/ (figura 1).
Nombre vulgar: Botón de plata.
Sinónimos: Cabecita de muerto, botón de chaleco (Puerto Padre, Cuba), pigeoncoop (en español: jaula de paloma, USA).
Esta especie se describe como una hierba ramificada decumbente, a veces estoloníferas, glabra o casí; con hojas sésiles o corto-pecioladas, lanceoladas o abobadas, de 4-12 por 1-2,5 cm, estrechadas hacia la base, agudas a obtusas en el ápice, glabras o pelosas en la base en el margen, enteras, 3-nervios; con pedúnculos de hasta 20 cm, cabezuelas homógamas, discoideas, solitarias, subglobosas, de 1cm, invólucro biseriado de 5 mm, brácteas aovado-oblongas, obtusas, ciliolatas; con receptáculo cónico, palmáceo; corolas tubulares, blancuzcas, de 2,5-3 mm, pelositas en la base, aquenios negros, aplanados, cicliolados en las márgenes y poco pelosos en el centro, de 2-3 mm; y vilano de 2 aristas de 1-2 mm1.
La especie estudiada ( Spilanthes urens Jacq) es una planta silvestre presente en la diversidad biológica cubana, inclusive la caribeña: República Dominicana, Haití y Puerto Rico, según el Centro Nacional de Biodiversidad y otras fuentes /21/. Aunque, se reporta la existencia en otros países como México, Argentina, Bolivia, Perú, Estados Unidos, entre otros /22/. Algunas fuentes bibliográficas asocian su presencia a entornos geográficos de humedales y deltas de grandes ríos, como parte de herbazales densos que en ocasiones convive con otras especies como Eleocharis aff. mutata y Cyperus articulatus /23/.
Tamizaje fitoquímico. Extracción y clasificación de alcaloides: Marcha de Banford, cromatografía de placa delgada y espectroscopía UV-visible
Inicialmente, mediante un tamizaje fitoquímico, se realizó una exploración de los metabolitos presentes en las hojas de la Spilanthes urens Jacq, analizando los extractos etéreo, alcohólico y acuoso. Las tablas siguientes muestran, de forma resumida, los resultados obtenidos para los distintos extractos de este órgano de la planta (tablas 1-3).
_______________________________
1 Identificada y descrita para este grupo de Investigación por el Ing. Florentino Bermúdez. Especialista Principal Herbario BSC, Centro Oriental de Ecosistemas y Biodiversidad (BIOECO), Museo de Historia Natural "Tomás Romay", calle Enramadas no. 601, Santiago de Cuba, Ministerio de Ciencia, Tecnología y Medio Ambiente (CITMA), República de Cuba (2008, 2010, 2012).
TABLA 1. TAMIZAJE FITOQUÍMICO REALIZADO AL EXTRACTO ETÉREO DE LAS HOJAS
DE LA Spilanthes urens Jacq
| Metabolito | Ensayo | Observaciones | Resultados* |
| Alcaloides | Dragendorf | Se observaron dos capas y | - |
| Mayer | No hubo aparición de color ni precipitado | - | |
| Wagner | Separación de fases, no precipitado. | - | |
| Triterpenos y | Solkowski | Separación de fases y no hubo aparición de coloración | - |
| Lieberman-burchad | No hubo cambio de color | - | |
| Cumarinas | Baljet | No hubo precipitado ni coloración | - |
| Saponinas | Espumas | No hubo formación de espuma | - |
| Azúcares reductores | Fehling | No hubo precipitado ni coloración | - |
| Benedict | No hubo aparición de precipitado | - | |
| Poliurónidos | Poliurónidos | No hubo precipitación | - |
| Flavonoides | Shinoda | No hubo coloración | - |
| H2SO4[conc] | anaranjado | +++ | |
| Álcalis | Separación de fases | - | |
| Aceites esenciales y | C/papel blanco | No hubo transparencia | - |
| Sudán III | Aparición de gotas oleosas de color rojo | +++ | |
| Quinonas | Borntragner | No hubo aparición de color | - |
| a.a libres y aminas | Ninhidrina | No hubo aparición de color | - |
| Glicósidos cardíacos | Kedde | No hubo aparición de color | - |
*La escala empleada en cuanto a las evidencias es la siguiente: +++ muy evidente, ++ evidente, + posible o dudoso, - negativo, / no realizado.
TABLA 2. TAMIZAJE FITOQUÍMICO REALIZADO AL EXTRACTO ETANÓLICO DE LAS HOJAS
DE LA Spilanthes urens Jacq
| Metabolito | Ensayo | Observaciones | Resultados |
| Alcaloides | Dragendorf | Turbidez marrón oscuro y formación | ++ |
| Mayer | No aparición de precipitado | - | |
| Wagner | Turbio | + | |
| Triterpenos y | solkowski | Separación de fases, verde claro abajo y | + |
| Lieberman–burchard | No hubo cambio de coloración | - | |
| Roseimheim | No hubo aparición de color | - | |
| Quinonas | Borntrager | No hubo aparición de color | - |
| Cumarinas | Baljet | Aparición de un precipitado amarillo |
|
| Saponinas | Espuma | No hubo formación de espumas | - |
| Azúcares | Felhing | No hubo aparición de color ni precipitado | - |
| Benedict | No hubo aparición de precipitado | - | |
| Glicósidos | Kedde | No hubo aparición de color | - |
| Fenoles | FeCl3 | Formación de un precipitado | + |
| a.a libres y aminas | Ninhidrina | No hubo coloración | - |
| Aceites esenciales y sustancias grasas | Sudán III | No hubo aparición de | - |
| C/papel blanco sin reactivo | No hubo transparencia | - | |
| Flavonoides | Shinoda | No hubo aparición de color | - |
| H2SO4[conc] | Carmelita-marrón | + | |
| Álcalis | Formación de un precipitado | - | |
| Rosemheim | No hubo aparición de color | - | |
| Resinas | Resinas | Formación de un precipitado | + |
| Poliurónidos | Poliurónidos | No hubo precipitación | - |
TABLA 3. TAMIZAJE FITOQUÍMICO REALIZADO AL EXTRACTO ACUOSO DE LAS HOJAS
DE LA Spilanthes urens Jacq
| Metabolito | Ensayo | Observaciones | Resultados |
| Alcaloides | Dragendorf | Aparición de un precipitado rojo ladrillo | +++ |
| Mayer | turbidez | ++ | |
| Wagner | Formación de un precipitado carmelita | +++ | |
| Triterpenos y esteroides
| Solkowski | Separación de fases, precipitado abajo | +++ |
| Lieberman –burchard | Separación de fases, amarillo abajo | - | |
| Quinonas | Borntrager | No hubo aparición de color | - |
| Cumarinas | Baljet | Aparición de un precipitado rojo | +++ |
| Saponinas | Espuma | Formación de espuma pero sin estabilidad | ++ |
| Azúcares reductores | Felhing | Aparición de un precipitado rojo | +++ |
| Benedict | No hubo aparición de precipitado | - | |
| Glicósidos cardíacos | Kedde | No hubo aparición de color | - |
| a.a libres y aminas en general | Nimhidrina | No hubo coloración | - |
| Aceites esenciales y sustancias grasas | Sudán III | No hubo aparición de gotas oleosas | - |
| C/papel blanco | No hubo transparencia | - | |
| Carbohidratos | Molish | Formación de un anillo rojizo | - |
| Flavonoides | Shinoda | Coloración naranja clara | +++ |
| H2SO4[conc] | Coloración anaranjada | +++ | |
| Álcalis | Coloración amarillo-naranja | +++ | |
| Mucílagos |
| Se congeló | - |
| Poliurónidos | Poliurónidos | Evidencia de un precipitado | +++ |
Como se observa, al comparar entre las tablas anteriores, la mayoría de los metabolitos presentes en las hojas parecen ser solubles en agua. Solo se detectó la presencia de aceites esenciales y flavonoides en el extracto etéreo de las hojas. La coloración amarilla observada en el experimento con ácido sulfúrico concentrado para revelar la presencia de flavonoides indica, que estos son de tipo flavonas y flavonoles. Sin embargo, en el extracto etanólico aparecen metabolitos secundarios como alcaloides, triterpenos y esteroides y resinas.
La coloración observada para los flavonoides, en este caso, no coincide con la descrita para el extracto etéreo. La coloración marrón oscuro puede deberse a la presencia de clorofila, cuyo color verde puede interferir en la observación. La fracción más rica en metabolitos resultó ser la acuosa, donde se encontraron, de forma general, alcaloides, triterpenos y esteroides, cumarinas, saponinas, azúcares reductores, flavonoides y poliurónidos. Los alcaloides respondieron a los tres ensayos realizados de manera evidente. Por otro lado, los flavonoides frente a ácido sulfúrico concentrado, dieron una coloración naranja correspondiente a la posible existencia de flavanonas. Sin embargo, frente a álcalis la coloración fue amarillo-naranja que sugiere flavanonas y/o flavonoles.
El mismo procedimiento seguido para las hojas se llevó a cabo para las flores obteniéndose los siguientes resultados.
TABLA 4. TAMIZAJE FITOQUÍMICO REALIZADO AL EXTRACTO ETÉREO DE LAS FLORES
DE LA Spilanthes urens Jacq
| Metabolito | Ensayo | Observaciones | Resultados |
| Alcaloides | Dragendorf | Se observaron dos | - |
| Mayer | No hubo aparición | - | |
| Wagner | Separación de fases, color carmelita, no precipitado | - | |
| Triterpenos y esteroides | Solkowski | Separación de fases y | - |
| Lieberman- | No hubo cambio de color | - | |
| Cumarinas | Baljet | No hubo precipitado | - |
| Saponinas | Espumas | No hubo formación | - |
| Azúcares reductores | Fehling | No hubo precipitado | - |
| Benedict | No hubo aparición | - | |
| Poliurónidos | Poliurónidos | No hubo precipitación | - |
| Flavonoides | Shinoda | No hubo coloración | - |
| H2SO4[conc] | Rojo guinda | +++ | |
| Álcalis | Separación de fases | - | |
| Aceites esenciales y sustancias grasas. | C/papel blanco | No hubo transparencia | - |
| Sudán III | Aparición de gotas | +++ | |
| Quinonas | Borntragner | No hubo aparición | - |
| a.a libres y aminas en general. | Nimhidrina | No hubo aparición | - |
| Glicósidos cardíacos | kedde | No hubo aparición | - |
TABLA 5. TAMIZAJE FITOQUÍMICO REALIZADO AL EXTRACTO ETANÓLICO DE LAS FLORES
DE LA Spilanthes urens Jacq
| Metabolito | Ensayo | Observaciones | Resultados |
| Alcaloides | Dragendorf | Solución rojo ladrillo, formación de precipitado | ++ |
| Mayer | No aparición de precipitado ni de coloración | - | |
| Wagner | Turbio | + | |
| Triterpenos y esteroides | solkowski | Separación de fases, verde fuerte abajo y coloración amarilla rojiza arriba | + |
| Lieberman –burchard | No hubo cambio de color | - | |
| Roseimheim | No hubo aparición de color | - | |
| Quinonas | Borntrager | No hubo aparición de color | - |
| Cumarinas | Baljet | Aparición de un precipitado amarillo | |
| Saponinas | Espuma | No hubo formación de espumas | - |
| Azúcares reductores | Felhing | No hubo aparición de color ni precipitado | - |
| Benedict | No hubo aparición de precipitado | - | |
| Glicósidos cardíacos | Kedde | No hubo aparición de color | - |
| Fenoles y Taninos | FeCl3 | Formación de un precipitado abundante de color verde oscuro | +++ |
| a.a libres y aminas en general | Ninhidrina | No hubo coloración | - |
| Aceites esenciales y sustancias grasas | Sudán III | No hubo aparición de gotas oleosas | - |
| C/papel blanco sin reactivo | No hubo transparencia | - | |
| Flavonoides | Shinoda | No hubo aparición de color | - |
| H2SO4[conc] | Coloración rojiza | +++ | |
| Álcalis | Formación de un precipitado | - | |
| Rosemheim | No hubo aparición de color | - | |
| Resinas | Resinas | Formación de un precipitado | + |
| Poliurónidos | Poliurónidos | No hubo precipitación | - |
TABLA 6. TAMIZAJE FITOQUÍMICO REALIZADO AL EXTRACTO ACUOSO DE LAS FLORES
DE LA Spilanthes urens Jacq
| Metabolito | Ensayo | Observaciones | Resultados |
| Alcaloides | Dragendorf | Aparición de un precipitado rojo ladrillo | +++ |
| Mayer | turbidez | ++ | |
| Wagner | Formación de un precipitado carmelita | +++ | |
| Triterpenos y esteroides | Solkowski | Separación de fases, precipitado abajo y coloración amarilla rojiza fuerte arriba | +++ |
| Lieberman –burchard | Separación de fases, amarillo abajo | - | |
| Quinonas | Borntrager | No hubo aparición de color | - |
| Cumarinas | Baljet | Aparición de un precipitado rojo | +++ |
| Saponinas | Espuma | Espuma de más de 2 mm de altura con estabilidad | +++ |
| Azúcares reductores | Felhing | Aparición de un precipitado rojo | +++ |
| Benedict | No hubo aparición de precipitado | - | |
| Glicósidos cardíacos | Kedde | No hubo aparición de color | - |
| a.a libres y aminas en general | Nimhidrina | Color azul violáceo | +++ |
| Aceites esenciales y sustancias grasas | Sudán III | No hubo aparición de gotas oleosas. | - |
| C/papel blanco sin reactivo | No hubo transparencia
| - | |
| Carbohidratos | Molish | Formación de un anillo rojizo
| - |
| Flavonoides | Shinoda | Coloración naranja fuerte | +++ |
| H2SO4[conc] | Coloración rojo guinda | +++ | |
| Álcalis | Coloración naranja-rojo (calconas) | +++ | |
| Mucílagos |
| Se congeló | |
| Poliurónidos | Poliurónidos | Evidencia de un precipitado carmelita abundante | +++ |
Los resultados del tamizaje fitoquímico realizado a los extractos de las flores son muy semejantes a lo observado para las hojas. Inicialmente se nota la detección de menor cantidad de metabolitos en el extracto etéreo, donde solo se evidencia la presencia de flavonoides y aceites esenciales. Lo interesante en este caso es que la coloración obtenida en la reacción con ácido sulfúrico es rojo guinda, sugiriendo la existencia de calconas o auronas en lugar de flavonas y flavonoles, descrito para las hojas. En el extracto etanólico de las flores fue posible agrupar evidencias de los metabolitos siguientes: alcaloides, triterpenos y esteroides, fenoles y taninos, flavonoides y resinas. Mientras que al igual a las hojas, la mayor cantidad y variedad de sustancias se detectaron en el extracto acuoso (alcaloides, triterpenos y esteroides, cumarinas, saponinas, azúcares reductores, aminoácidos libres y aminas, flavonoides y poliurónidos). Se observó con el ensayo de ninhidrina un color azul violáceo indicando la presencia de aminoácidos libres y aminas en general, mientras que para las hojas no hubo aparición de este color; y la presencia de aminas libres en la fracción de las flores podrían interferir en el proceso para de extracción de alcaloides ya que estos últimos presentan en su estructura grupos amino y su comportamiento básico es similar al de las aminas.
Otra diferencia entre hojas y flores en la fracción acuosa, es el ensayo de saponinas, en ambos casos hubo formación de espuma pero en la parte de las flores eran de más de 2 mm de altura con gran estabilidad. Sin embargo, en las hojas las espumas observadas no tenían estabilidad suficiente porque desaparecían inmediatamente (menos de 1 minuto) luego de dejar de agitar el tubo de ensayo. Esto puede sugerir que las cantidades de saponinas presentes en las flores claramente podrían ser superiores a las de las hojas.
De forma general, los ensayos en la fracción acuosa demostraron lo esperado al comenzar la realización de este trabajo: encontrar indicios de alcaloides como potenciales responsables de la actividad odontálgica, analgésica e incluso anestésica de las hojas y flores de la especie Spilanthes urens Jacq. Es importante recordar que en la bibliografía aparecen reportes del uso de hojas y flores de otras especies Spilanthes con fines odontálgicos /7-10/.
Sin embargo, la presencia de otros metabolitos con posible actividad analgésica y/o anestésica abre el espectro de posibilidades y al mismo tiempo reduce las probabilidades de que los alcaloides sean los únicos responsables de este uso terapéutico.
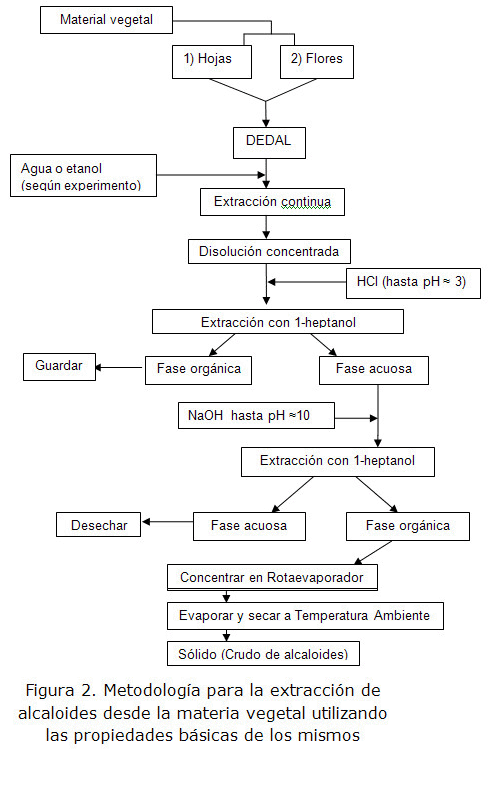
Una vez conocida la composición aproximada de los órganos seleccionados de la especie en estudio, se realizó una extracción continua a las hojas y las flores por separado usando como solvente el alcohol y el agua, obteniéndose 4 disoluciones, las cuales fueron tratadas con ácido clorhídrico, aprovechando las propiedades básicas de los alcaloides en una primera etapa, y luego con hidróxido de sodio, previas extracciones con 1-heptanol en la segunda. El procedimiento fue diseñado de esta forma debido a que los resultados del tamizaje fitoquímico arrojaron que había presencia de alcaloides en ambos disolventes, tanto en agua como en etanol (figura 2).
El disolvente orgánico utilizado inicialmente fue el n-octano, pero los resultados no fueron satisfactorios. Se supone que las características apolares del n-octano no son las adecuadas para extraer la fracción alcaloídica esperada. Lógicamente, no aparecen alcaloides en la fase etérea durante el tamizaje fitoquímico, lo que indica la naturaleza polar de los alcaloides presentes en el "botón de plata". Se intentó el mismo procedimiento con 1-heptanol. En este caso, se obtuvieron cuatro sólidos de aspecto amorfo, tres de color amarillo, y uno de color verde, correspondiente a la extracción continua de las hojas con etanol. Lógicamente, debe corresponderse a un arrastre de clorofila, como el principal responsable de esta coloración en las hojas.
Para comprobar si se habían extraído alcaloides, se repitieron los ensayos de Dragendorf, Mayer y Wagner, disolviendo una pequeña parte de los sólidos amorfos en agua y etanol para hojas y flores, respectivamente (tabla 7).
TABLA 7. RESULTADO DE LOS CUATRO PROCESOS DE EXTRACCIÓN Y EVIDENCIAS OBSERVADAS
AL COMPROBAR LA PRESENCIA DE ALCALOIDES EN LOS SÓLIDOS OBTENIDOS
|
| Hojas | Flores | ||
| Disolvente usado en la extracción continua | agua | etanol | agua | etanol |
| Aspecto físico del sólido | amorfo | amorfo | amorfo | amorfo |
| Color | amarillo | verde | amarillo | amarillo |
| Ensayo de Dragendorf | +++ precipitado rojo ladrillo | ++ precipitado rojo ladrillo | +++ precipitado rojo ladrillo | +++ precipitado rojo ladrillo |
| Ensayo de Mayer | + | + | ++ | ++ |
| Ensayo de Wagner | +++ precipitado carmelita | ++ precipitado carmelita | +++ precipitado carmelita | +++ precipitado carmelita |
La marcha sistemática de Banford se utilizó para tratar de clasificar los sólidos resultantes de la extracción anterior /16/. Este procedimiento divide un grupo conocido de alcaloides en seis grupos y se basa en reacciones químicas en partes importantes de las distintas moléculas (tabla 8). Para los cuatro crudos obtenidos, el resultado fue el mismo, correspondiendo a alcaloides con núcleo indólico derivados de la yohimbina.
A primera vista parece ser un resultado que pudiera conducir a la elucidación estructural, pero las limitaciones de la marcha de Banford frente a la gran diversidad de alcaloides conocidos es notable. Para asegurar el conocimiento de la estructura química de la sustancia problema, es necesario recurrir a técnicas espectroscópicas y métodos de separación cromatográficos. Para comprobar de alguna forma la existencia de uno o varios metabolitos en el sólido obtenido, se sometieron las muestras a una cromatografía de capa delgada, utilizando como fase móvil CH2Cl2:MeOH en relación 4:1. Los resultados se muestran en la figura 3.
TABLA 8. RESULTADO DE LA MARCHA SISTEMÁTICA DE BANFORD PARA ALCALOIDES
| Grupos | Alcaloides1 | Ensayo | Resultado / Evidencia |
| Grupo I | Tebaina | H2SO4 | (-) coloración parda |
| Narcotina | (-) coloración parda | ||
| Grupo II | Morfeolicos (morfina, | Marquis | (-) incoloro |
| Sintéticos (diluadid, | - | No realizado, por ser | |
| Morfina, heroína | Oliver | (-) azul, debía ser rojo | |
| FeCl3 1% | (-) no cambios | ||
| Grupo III | brucina | HNO3 fumante | (-) incoloro |
| eserina | (-) incoloro | ||
| Atropina, hiosciamina, escopolamina | Ensayo de Vitali | (-) no cambios | |
| Grupo IV | Estricnina | H2SO4 / K2Cr2O7 | (-) no hay cambio de coloración |
| Yohimbina | (+++) se observo la presencia | ||
| Curare | (-) no cambio de coloración | ||
| Grupo V | Novocaína, nicotina, mezcalina | Alcohol-ácido | (-) no cambios |
| Grupo VI | Cafeína, Quinina | Cl2 y vapores de NH3 | (-) no cambios |
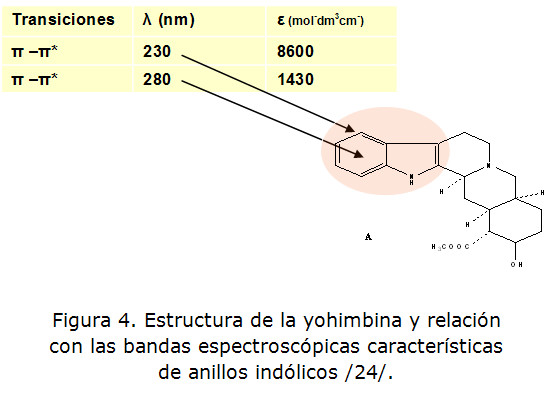
La sospecha de un alcaloide derivado del indol como son los tipo yohimbina abre la posibilidad de usar la espectroscopía UV-visible como herramienta para tener indicios sobre la estructura del mismo. Aunque es conocido que esta técnica no es suficiente por si sola para determinar la estructura de un compuesto, sí constituye una ayuda importante para compuestos que contienen instauraciones conjugadas o anillos aromáticos. Los derivados del indol presentan un anillo bencénico que muestra dos bandas de absorción en la región ultravioleta (figura 4).
1 Se refiere al tipo de alcaloide con estructuras semejantes a los que se plantean.
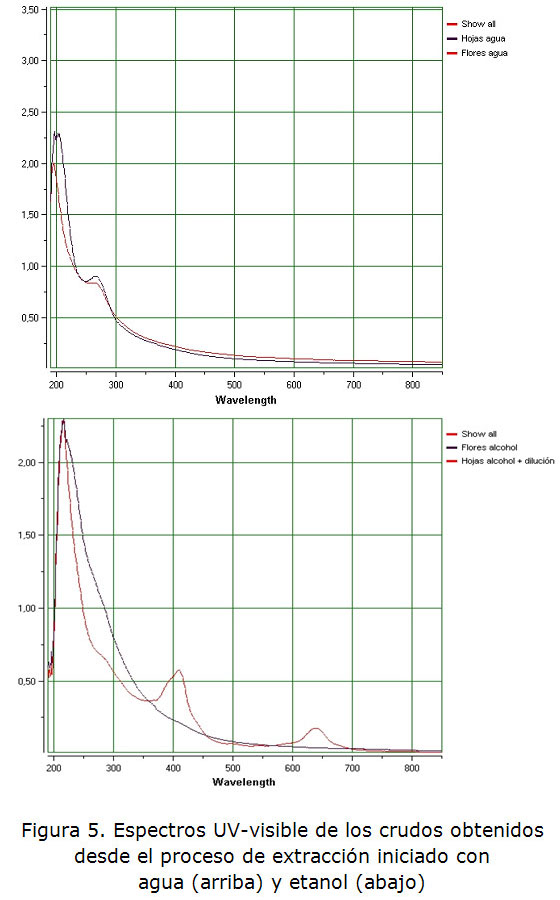
Los anillos bencénicos sustituidos por grupos amino, como es el caso del indol, presentan dos bandas fundamentales provocadas por transiciones ∏-∏*. Estas bandas aparecen a los 230 nm y 280 nm, con valores de absortividades molares de 8 600 y 1 430, respectivamente (figura 3.2). Al registrar el espectro del sólido obtenido de los extractos acuosos (flores y hojas) se observan dos bandas en la zona ultravioleta del espectro a 200 nm y 260 nm, con valores de absorbancia de 2,25 y 0,8, respectivamente (figura 5).
En el caso de los sólidos obtenidos desde extractos etanólicos, los resultados no parecen tan claros. En primer lugar aparecen dos bandas en la región del visible (más de 400 nm) para la fracción obtenida de las hojas que no se corresponden a lo observado para la fracción acuosa. Una de las bandas situada a 640 nm aproximadamente corresponde al color observado verde /24/. La otra banda a 410 nm que podría deberse a la absorción de luz violeta, lo que daría como color resultante al amarillo verdoso. Tal como se mencionó anteriormente, podría corresponder la potencial presencia de clorofila afecta la claridad del espectro y no permite realizar las comparaciones pertinentes.
Para completar la identificación de los alcaloides presentes en la Spilanthes urens Jacq tendría que continuarse el estudio mediante HPLC y otras técnicas espectroscópicas con el fin de elucidar la estructura del principio activo responsable de la actividad anestésica y/o analgésica.
CONCLUSIONES
Se realizó el tamizaje fitoquímico de la especie Spilanthes urens Jacq encontrándose de forma general los siguientes metabolitos: alcaloides, triterpenos y esteroides, flavonoides, fenoles y taninos, aminoácidos y aminas, glucósidos y poliurónidos. El método de extracción utilizado permitió la obtención de alcaloides, corroborándose a través de los ensayos para los mismos. La combinación de la Marcha Sistemática de Banford, la cromatografía de placa delgada y la espectroscopía UV-visible dejan entrever que el(los) alcaloide(s) presente(s) en hojas y flores del "botón de plata" corresponden, al parecer, a los derivados del indol, que clasifican como familia de la yohimbina. No es posible aun definir la estructura del o de los alcaloide(s), ni saber con exactitud la cantidad de los mismos, ya que se requieren técnicas más avanzadas como HPLC, cromatografía de gases, RMN, Espectrometría de masas, etcétera. Sin embargo, un conjunto de técnicas más simples han permitido avanzar en este aspecto.
AGRADECIMIENTO
Al Grupo de Investigación "Productos Bioactivos y Química Sostenible" de la Facultad de Ciencias Naturales, Universidad de Oriente; a los colegas de BIOECO, Santiago de Cuba y en especial a Eduardo Domínguez Lores, de la ciudad de Baracoa.
REFERENCIAS BIBLIOGRÁFICAS
1. PAULRAJ, J.; GOVINDARAJAN, R.; PALPU, P., "The genus Spilanthes Ethnopharmacology, Phytochemistry, and Pharmacological Properties: A Review", Advances in Pharmacological Sciences. Hindawi Publishing Corporation. 2003. Review Article with ID 510298. http://dx.doi.org/10.1155/2013/510298.
2. LEE, S.; XIAO, C.; PEI, S. "Ethnobotanical survey of medicinal plants at periodic markets of Honghe Prefecture in Yunnan Province, SWChina". Journal of Ethnopharmacology, 2008, 117(2), 362-377.
3. KONG, Y. C.; XIE, J. X.; BUT, P.P.-H. "Fertility regulating agents from traditional Chinese medicines". Journal of Ethnopharmacology, 1986, 15(1), 1-44.
4. SANTESSON, C. G. "Einige Drogen aus dem Kamerungebiet und ihreeinheimische verwendung". Arkiv för Botanik, 1926, 20, 1-34.
5. KALA, C. P. "Ethnomedicinal botany of the Apatani in the Eastern Himalayan region of India". Journal of Ethnobiology and Ethnomedicine, 2005, 1(11), 1-8.
6. ABBIW, D. Useful Plants of Ghana, Intermediate Technology. London, UK, 1990.
7. NAKATANI, N.; NAGASHIMA, M. "Pungent alkamides from Spilanthes acmella var. oleracea Clarke" Bioscience, Biotechnology, and Biochemistry, 1992, 56(5), 759-762.
8. ONG, H. C.; NORDIANA, M. "Malay ethno-medico botany in Machang, Kelantan, Malaysia". Fitoterapia, 1999, 70(5), 502-513.
9. RAHMATULLAH, M. et al. "A comparative analysis of medicinal plants used by folk medicinal healers in villages adjoining the Ghaghot, Bangali and Padma rivers of Bangladesh". American-Eurasian Journal of Sustainable Agriculture, 2010, 4(1), 70-85.
10. IGNACIMUTHU, S.; AYYANAR, M.; SANKARASIVARAMAN, K. "Ethnobotanical study of medicinal plants used by Paliyar tribals in Theni district of Tamil Nadu, India". Fitoterapia, 2008, 79(7-8), 562-568.
11. VEGA, M. Etnobotánica de la Amazonia peruana. Ediciones Abya-Yala. Quito-Ecuador. 2001.
12. DE CARLO, J. M.; VIAMONTE, M. A. Farmacología de los anestésicos locales, ANALES. 1999.
13. PELLITIER, S. W. Alkaloids: Chemical and Biological perspectives. Vol. 1. John Wiley & Sons, 1983.
14. GARCÍA, G. "Estudio fármaco-toxicológico del aceite esencial obtenido a partir de la flor del Spilanthes urens Jacq". Anuario Toxicología, 2001, 1(1), 120-125.
15. VALAVANIDIS, A.; VLACHOGIANNI, T. Green Chemistry and Green Engineering. Synchrona Themata. ISBN: 978-960-9695-00-8. Athenas, 2012.
16. MURILLO, E.; LOMBO, O.; MÉNDEZ, J. J. "Química y Funcionalidad biológica de Mollinedia racemosa (Monimiceae)". Información Tecnológica, 2011, 22(2), 3-14.
17. Normas Ramales del Ministerio de Salud Pública de la República de Cuba (NRSP) 309 y 310. MINSAP; 301, 1991.
18. AHMED, I.; AQIL, F.; OWAIS, M. Modern Phytomedicine: turning medicinal plants into drugs. Wiley-VCH, Weinheim, 2006.
19. MIRANDA, M. M.; CUELLAR, A. C. Manual de prácticas de laboratorio de Análisis Farmacognóstico. Universidad de La Habana, Instituto de Farmacia y Alimentos (IFAL), pp. 58-68, 1992.
20. FARNSWORTH, N. R. "Biological and Phytochemical Screening of Plants" Journal of Pharmaceutical Sciences, 1966, 55(3), 262.
21. GONZÁLEZ, P. A.; VERDECIA, J. L.; LEIVA, O.; MATOS, A.; PEÑA, R. "Apuntes sobre la flora y la vegetación del sector costero Corinthia-Barrederas, Frank País, Holguín". Revista del Jardín Botánico Nacional. (Cuba), 2006, 27, 33-45.
22. BRICKELL, Ch. (Editor-in-chief): RHS A-Z Encyclopedia of Garden Plants. Third edition. Dorling Kindersley. London, 2003, ISBN 0-7513-3738-2.
23. REYES, O. J.; ACOSTA, F. "Principales fitocenosis en el humedal del delta del río Cauto, Cuba Oriental. I. Vegetación Lacustre y Herbazal de Humedad". Foresta Veracruzana, 2007, 9(1), 15-22.
24. PRETSCH, E.; CLERC, T.; SEIBI, J.; SIMON, W. Tablas para la Elucidación Estructural de Compuestos Orgánicos por Métodos Espectroscópicos. Ed. Alhambra, 1985.
Recibido: 17/01/2015
Aceptado: 03/05/2015
Dr. Armando Ferrer-Serrano, Departamento de Química, Facultad de Ciencias Naturales, Universidad de Oriente, Cuba, aferrer@cnt.uo.edu.cu