Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.1 Santiago de Cuba ene.-abr. 2016
ARTICULOS
Influencia del medio de extracción en la composición de sustancias volátiles de las hojas de Zanthoxylum pistacifolium Griseb
Influence of Extraction Composition of volatile substances from the leaves of Zanthoxylum pistacifolium Griseb
MSc. Yamilé Heredia-DíazI, Lic. Rosalia González-FernándezII, Dr. Julio C. Escalona-ArranzI, Lic. Jesús García-DíazI, Lic. Jorge de la Vega-AcostaI
IFacultad de Ciencias Naturales, Universidad de Oriente, Santiago de Cuba, Cuba, yheredia@cnt.uo.edu.cu.
IICentro de Toxicología y Biomedicina (TOXIMED), Universidad de Ciencias Médicas, Santiago de Cuba.
RESUMEN
El Zanthoxylum pistacifolium Griseb, es una planta endémica de Cuba, que crece en los montes y montañas cercanas a la costa sur-oriental. En la bibliografía consultada no se hallaron reportes ni de su composición química ni de su uso etnobotánico y/o farmacológico. Por ello en este trabajo se desarrolló la extracción e identificación de los compuestos volátiles de las hojas (colectadas en la localidad del Palenque, playa Siboney, Santiago de Cuba), empleando el método de extracción por hidrodestilación-cohobación en tres medios diferentes: neutro, ácido y básico. La identificación de los componentes químicos se realizó empleando la Cromatografía Gaseosa acoplada a la Espectrometría de Masas. Los medios ácido y básico, a pesar de aumentar el rendimiento extractivo, condujeron a la modificación estructural de los compuestos volátiles, por lo que la extracción en medio neutro resultó la más útil. Un total de 82 compuestos fueron identificados en el medio neutro (97,76 % del total extraído) con predominio de derivados terpenoides, resultando como compuestos mayoritarios el a-Pineno (12,35 %), Linalol (6,68 %), 2,6-dimetil-2,4,6-Octatrieno (6,50 %), Limoneno (6,19 %) y Fitol (6,06 %).
Palabras clave: Zanthoxylum pistacifolium Griseb, extracción, compuestos volátiles.
ABSTRACT
Zanthoxylum pistacifolium Griseb is an endemic plant that grows in the forests and hills of the south-Eastern cost of Cuba. In the reviewed bibliography none report regarding to the chemical composition, ethnobotanic and/or pharmacological information was find out. That is why the intention of this experimental work was to extract and to identify the volatile components of leaves collected in the locality of "el Palenque", Siboney beach, Santiago de Cuba. The hydrodistillation-cohobation extraction method in three different mediums: neutral, acid and basic was used, while Gas Chromatography coupled to a Mass Spectrometry was considered for the chemical separation and characterization of the volatile compounds extracted.The acid and basic mediums increases the extraction yield but attempts against the structural integrity of the volatile compounds, that is why the conventional method was selected as the most effective. In neutral medium, 82 compounds (97,76 % of the total extracted) were identified, most of them belonging to terpene type. The main compounds isolated were a-Pinene (12,35 %), Linalool (6,68 %), (4E,6Z)-2,6-dimethyl-2,4,6-Octatriene (6,50 %), Limonene (6,19 %) and Phytol (6,06 %).
Keywords: Zanthoxylum pistacifolium Griseb, extraction, volatile compounds.
INTRODUCCIÓN
La familia Rutaceae es muy rica en la producción de aceites esenciales y medicinales, que se extraen de los diferentes géneros y especies que la conforman /1/. Uno de los géneros que posee mayor riqueza en aceites esenciales es el Zanthoxylum, acumulándose principalmente en las hojas, flores, semillas y frutos.
Existen reportes de estudios de los aceites esenciales de hojas del Z. acanthopodium, donde los constituyentes más abundantes fueron el sabineno, limoneno, 1.8-cineol y el germacreno D /2/. Se reportan como constituyentes mayoritarios de las hojas de Z. rhetsa, el óxido de cariofileno, cariofileno, ß-copaeno y el espatuneol /3/. En el aceite esencial de las hojas de Z. rhoifolium los componentes más abundantes fueron: el germacreno D, limoneno, trans-2-hexenal, ß elemeno, 2-undecanone, mirceno, biciclogermacreno y germacreno A /4/.
En los frutos, se han realizado estudios con especies de este género (Z. monophyllum, Z. rhoifolium, Z. fagara, Z. xanthoxyloides y Z. leprieurii), para determinar la composición química de aceites esenciales aislados por destilación a vapor. A través de la Cromatografía Gaseosa acoplada a Espectrometría de Masas (CG/MS) se pudieron identificar los componentes principales del aceite de Z. monophyllum (Sabineno, 1.8-Cineol, y cis-4- Thujanol), Z. rhoifolium (ß- Mirceno, ß- Felandreno, y D-Germacreno); Z. fagara (D-Germacren-4-ol,Elemol y a-Cadinol) /5/; Z. xanthoxyloides (citronelol, geraniol, citronelol acetato, limoneno y citronelal; y de Z. leprieurii ((E)-b-ocimeno, mirceno, limoneno y b pineno) /6/.
Estudios de la composición de aceites esenciales, en especies costarricenses del género Zanthoxylum (Z. fagar a, Z. acuminatu m, Z .melanostictu m, Z. monophyllum), revelaron la presencia de un gran número de terpenos, principalmente monoterpenoides, tales como Linalol, 4-Terpineol, a-Terpineol, y tran s-2-Hexenol /7/.
El aceite esencial obtenido a partir de semillas del Z. bungeanum, el extracto etanólico de frutas del Z. alatum y los extractos hexánico, etéreo, metanólico y de acetato de etilo obtenidos a partir de frutos del Z. piperitum, demostraron tener propiedades antioxidantes /8/.
El género Zanthoxylum en Cuba está representado por 25 especies, de ellas 15 endémicas. En la costa sur de la región oriental de Cuba abunda la especie Zanthoxylum pistacifolium Griseb, y de acuerdo con la literatura consultada, no existen reportes de estudios de los constituyentes volátiles de las hojas de esta especie. Atendiendo a esta abundancia de reportes referentes a los aceites esenciales del género Zanthoxylum sp. y la ausencia de información respecto a la especie Zanthoxylum pistacifolium Griseb, en el presente trabajo nos proponemos, como objetivo, la extracción e identificación de compuestos volátiles de las hojas de la especie Zanthoxylum pistacifolium Griseb.
MATERIALES Y MÉTODOS
Material vegetal
Las hojas de la especie vegetal Zanthoxylum pistacifolium Griseb, se recolectaron, en horas de la mañana, en el Palenque (poblado de Siboney), en Santiago de Cuba. La identificación taxonómica se llevó a cabo por especialistas del Centro Oriental de Ecosistemas y Biodiversidad (BIOECO), en el Museo Tomás Romay de Santiago de Cuba. Un ejemplar de la planta fue depositado en BIOECO con el número de ficha 21660.
El material colectado fue pesado en una balanza técnica marca Nagema de procedencia alemana y se empleó en su forma fresca para la extracción directa de sus compuestos volátiles.
Extracción de los compuestos volátiles de las hojas
La extracción de los compuestos volátiles se realizó por el método de hidrodestilación-cohobación auxiliado de un aparato tipo Clevenger /9/. Para ello se emplearon 200 g de droga fresca en 1 600 mL de agua, ácido sulfúrico [H2SO4 (4 %)] y carbonato de [Na2CO3 (10%)].
Determinación de la composición química de las sustancias volátiles por Cromatografía de Gases acoplada a Espectrometría de Masas (CG/EM)
El análisis cualitativo y cuantitativo del aceite esencial obtenido de las hojas se realizó por cromatografía gaseosa acoplada a espectrometría de masas empleando un equipo SHIMADZU GC/MS-QP500 de procedencia japonesa, constituido por un cromatógrafo de gases mega 2 series acoplado a un espectrómetro de masas cuadrupolar de impacto electrónico positivo (modo de ionización) y una columna capilar DB-5 MS, de 30 m · 0,32 mm y un diámetro interno = 1µm, bajo las siguientes condiciones: gas portador, He; velocidad de flujo, 1 mL/min.; temperatura de inyección, 270 ºC (razón de separación 100:1); temperatura de detección 250 ºC.
El programa de temperatura fue 30 ºC (3 min), 40 ºC/min hasta 250 ºC (10 min). La adquisición de los datos fue realizada en el intervalo de masas entre 10 y 500 u.m.a. /10, 11/. Todos los espectros de masas fueron adquiridos en el modo de impacto electrónico con un voltaje de ionización de 70 eV. Las muestras de aceite fueron diluidas en n-hexano y el volumen de inyección fue de 1 µl.
La identificación de los compuestos se realizó comparando los espectros de masas y los índices de retención, obtenidos con los existentes en la base de datos "National Institute of Standards " (NIST). Algunos espectros de masa se compararon con la bibliografía especializada del tema /12/.
Para determinar los índices de retención de Kovats, las muestras se analizaron conjuntamente con patrones de alcanos lineales en el intervalo desde C-6 hasta C-32, con incremento de dos átomos de carbono. La ecuación empleada fue la siguiente:
RESULTADOS Y DISCUSIÓN
Extracción de los compuestos volátiles de las hojas
Muchas especies de la familia Rutaceae contienen glándulas que secretan sustancias volátiles en diferentes órganos de las plantas tales como los frutos, hojas, corteza, raíces, semillas, rizomas y tallos. El género Zanthoxylum acumula aceites volátiles en hojas, flores y fruto /13/.
Los compuestos volátiles de las hojas de Zanthoxylum pistacifolium Griseb fueron obtenidos empleando el método de extracción hidrodestilación-cohobación auxiliado de un aparato tipo Clevenger en medio neutro. El aceite presentó un aspecto transparente, de color verde limón y un olor penetrante característico al de las hojas de la especie. La extracción en medio neutro permitió obtener un rendimiento de 0,05 % (v/m), resultando superior al reportado para otras especies del género, donde los rendimientos para las hojas son incluso inferiores, por ejemplo 0,019 % (v/m) y 0,017 % (v/m) para Zanthoxylum acanthopodium en verano e invierno respectivamente /2/.
Con el propósito de obtener rendimientos superiores, se realizó la extracción de compuestos volátiles variando el pH del medio. Esta experiencia había sido desarrollada con anterioridad para la extracción de los compuestos volátiles de semillas de Zanthoxylum rhetsa por Reddy y Beena en el 2011, logrando diferencias en sus resultados en relación con el rendimiento y la actividad farmacológica medida /9/.
En este experimento se comprobó, que en el medio básico el rendimiento resultó similar al obtenido en medio neutro, o sea 0,05 % (v/m), mientras que para la extracción en medio ácido este triplicó rendimiento hasta un valor de 0,15 % (v/m). Las hojas del Zanthoxylum pistacifolium Griseb resultan marcadamente xeromórficas, debido a la zona de estrés hídrico donde fue colectada, por lo que sus estructuras almacenadoras y secretoras de aceites esenciales se podrían encontrar protegidas por la gruesa epidermis. De hecho, una cutícula prominente rodeaba ambas superficies de las hojas colectadas. Es por ello que resulta probable que el medio ácido influyera en la ruptura de estas capas protectoras, haciendo más viable el acceso del agua al interior de las estructuras almacenadoras y/o secretoras, facilitando así la salida de los compuestos volátiles de la especie.
Determinación de la composición química de los compuestos volátiles por Cromatografía de Gases acoplada a Espectrometría de Masas (CG/EM)
Cada uno de los tres destilados (medio neutro, ácido y básico) fue sometido a un análisis de la composición química de sus compuestos volátiles. Para el medio neutro se logró extraer y separar un total de 89 compuestos, 82 de los cuales lograron ser identificados, para un 97,76 %. Los compuestos volátiles extraídos en medio neutro con sus índices de retención y masas moleculares se muestran en la tabla 1.
TABLA 1. COMPUESTOS VOLÁTILES EXTRAÍDOS DE LAS HOJAS DE
Z. pistacifolium EN MEDIO NEUTRO
| Nº | Compuesto | IR | A (%) | Nº | Compuesto | IR | A (%) |
| 1 | (3 E)-Hexenol | 842 | 0,21 | 46 | γ-Gurjuneno | 1475 | 0,39 |
| 2 | (3 Z)-Hexenol | 852 | 0,12 | 47 | D-Germacreno | 1479 | 0,48 |
| 3 | n-Hexanol | 855 | 0,10 | 48 | ß-Selineno | 1489 | 1,27 |
| 4 | α-Pineno | 925 | 12,34 | 49 | α-Selineno | 1496 | 1,21 |
| 5 | α–Fencheno | 949 | 0,76 | 50 | ( E,E )-α-Farneseno | 1505 | 1,11 |
| 6 | Benzaldehído | 961 | 0,95 | 51 | γ-Cadineno | 1510 | 0,08 |
| 7 | Sabineno | 970 | 0,21 | 52 | δ-Cadineno | 1517 | 0,54 |
| 8 | ß-Pineno | 978 | 1,28 | 53 | (E)-α-Bisabolene | 1538 | 0,13 |
| 9 | Mirceno | 993 | 3,08 | 54 | α-Elemol | 1546 | 0,09 |
| 10 | α-Felandreno | 1005 | 0,11 | 55 | Nerolidol (E) | 1559 | 0,13 |
| 11 | α-Terpineno | 1015 | 0,26 | 56 | Benzoate (3Z)-hexenyl | 1570 | 0,64 |
| 12 | Limoneno | 1034 | 6,19 | 57 | ¿No identificado? | 1571 | 0,12 |
| 13 | Eucalyptol | 1036 | 0,45 | 58 | Óxido de Cariofileno | 1578 | 0,34 |
| 14 | (Z)-ß-Ocimeno | 1040 | 2,36 | 59 | ¿No identificado? | 1585 | 0,20 |
| 15 | ( E )-ß-Ocimeno | 1049 | 2,80 | 60 | Viridiflorol | 1593 | 0,50 |
| 16 | g -Terpineno | 1058 | 0,60 | 61 | Guaiol | 1603 | 0,18 |
| 17 | Óxido de cis-Linalol | 1070 | 0,22 | 62 | Humuleno epóxido II | 1605 | 0,30 |
| 18 | Terpinoleno | 1083 | 0,95 | 63 | Copaborneol | 1616 | 1,05 |
| 19 | Linalol | 1108 | 6,68 | 64 | Epicubenol | 1630 | 3,87 |
| 20 | 2( E ),6( Z )- | 1133 | 6,50 | 65 | γ-Eudesmol | 1633 | 0,12 |
| 21 | ¿No identificado? | 1140 | 0,23 | 66 | 1,2,3,4,4a,7,8,8a-octahidro-, | 1641 | 0,71 |
| 22 | 2-metil-Propanoato | 1143 | 0,20 | 67 | 10-OH-4-Cadineno | 1643 | 0,19 |
| 23 | Alcanfor | 1147 | 0,13 | 68 | Acetato de (Z)-Nerolidilo | 1661 | 1,81 |
| 24 | Borneol | 1171 | 0,26 | 69 | Intermedeol | 1664 | 0,93 |
| 25 | 4-Terpineol | 1181 | 1,05 | 70 | (9Z)-Tetradecenol | 1676 | 0,25 |
| 26 | 3-Decanona | 1187 | 0,58 | 71 | a -Bisabolol | 1685 | 0,09 |
| 27 | Salicilato de Metilo | 1189 | 0,10 | 72 | ¿No identificado? | 1704 | 0,09 |
| 28 | γ-Terpineol | 1201 | 4,29 | 73 | (Z,Z)-Farnesol | 1712 | 0,23 |
| 29 | Nerol | 1225 | 0,14 | 74 | Biciclo [10.1.0] trideca-4,8- | 1726 | 0,18 |
| 30 | 2-metil-Butanoato | 1232 | 0,85 | 75 | ¿No identificado? | 1765 | 0,12 |
| 31 | 2-metil-Butanoato | 1237 | 0,35 | 76 | Ácidon-Tetradecanóico | 1769 | 0,17 |
| 32 | 3-metil-Butanoato | 1238 | 0,24 | 77 | Fitona | 1839 | 0,14 |
| 33 | Geraniol | 1252 | 0,26 | 78 | 14-metil -(8Z)- | 1860 | 0,30 |
| 34 | Geranial | 1268 | 0,10 | 79 | Isofitol | 1938 | 0,35 |
| 35 | Tiglato de (3Z)-hexenilo | 1323 | 0,13 | 80 | Ácido Hexadecanóico | 1972 | 2,64 |
| 36 | Acetato de | 1330 | 0,25 | 81 | 13- Z -Octadecenal | 2016 | 1,50 |
| 37 | δ-Elemeno | 1335 | 1,04 | 82 | Fitol | 2110 | 6,06 |
| 38 | Eugenol | 1355 | 2,07 | 83 | Ácido Oleico | 2135 | 0,60 |
| 39 | α-Copaeno | 1372 | 0,19 | 84 | Ácido Octadecanóico | 2157 | 0,22 |
| 40 | ¿No identificado? | 1379 | 0,43 | 85 | Heptacosano | 2694 | 0,05 |
| 41 | ß-Elemeno | 1391 | 4,61 | 86 | n-Pentacosanol | 2766 | 0,05 |
| 42 | (E)-Cariofileno | 1419 | 2,62 | 87 | ¿No identificado? | 2789 | 1,05 |
| 43 | γ-Elemeno | 1426 | 0,30 | 88 | Nonacosano | 2894 | 0,78 |
| 44 | α-Humuleno | 1454 | 0,80 | 89 | Hentriacontano | 3081 | 0,86 |
| 45 | 4,11-Selindieno | 1471 | 0,49 |
|
|
|
|
Leyenda: IR -> Índice de Retención; A -> Área relativa; en negrita -> mayoritarios
Del análisis de la naturaleza química de los componentes extraídos por este medio neutro se puede deducir que estos compuestos volátiles son tanto de naturaleza terpenoide como no terpenoide (figura 1), resultando mayoritarios el grupo de los sesquiterpenos. No existen antecedentes en el estudio de los compuestos volátiles de las hojas del Z. pistacifolium, por lo que todos los compuestos reportados en esta tabla constituyen un primer informe para la especie.
Desde el punto de vista cuantitativo, el análisis mostró (tabla 2), que el α-Pineno, Linalol, 2,6-dimetil-2,4,6-Octatrieno, Limoneno y el Fitol fueron los constituyentes más abundantes en el medio acuoso neutro. La literatura reporta que el a-Pineno fue identificado como una de las sustancias mayoritarias para el aceite extraído de las semillas de Z. rhetsa en medio acuoso /9/. El Limoneno se ha reportado como compuesto mayoritario en la especie Z. acanthopodium /2/ y el Mirceno como mayoritario de hojas de Z. rhoifolium /5/.
TABLA 2. COMPUESTOS VOLÁTILES MAYORITARIOS EXTRAÍDOS EN LOS
MEDIOS NEUTRO, ÁCIDO Y BÁSICO
| Neutro | Ácido | Básico | |||
| Compuestos | % | Compuestos | % | Compuestos | % |
| α-Pineno | 12,34 | 1,4-Cineol | 8,53 | Epicubenol | 10,43 |
| Linalol | 6,68 | Terpinoleno | 5,88 | Hentriacontanol | 8,52 |
| 2,6-dimetil 2,4,6-Octatrieno | 6,50 | p- Cymeno | 5,27 | E- Cariofileno | 7,06 |
| Limoneno | 6,19 | α-Terpineol | 3,66 | 13- óxido -epi-Manoilo | 6,38 |
| Fitol | 6,06 | γ-Terpineno | 3,51 | Fitol | 6,76 |
Adicionalmente al α-Pineno y al Limoneno, o tros compuestos volátiles del tipo monoterpénicos han sido identificados en otras especies del género, y ellos son: el Sabineno (Z. monophyllum /5/, Z. acanthopodium /2/, Z. gilletii /14/, Z. alatum /15/, Z. armatum /16/, Zanthoxylum rhetsa /17/); ß-Pineno, y Linalol (Z. acanthopodium /2/, Z. alatum /15/, Z. armatum /16/; γ-Terpineno (Z. acanthopodium /2/ y Z. gilletii /14/); α.-Terpineno, (Z)-ß-Ocimeno, (E)-ß-Ocimeno, Terpinoleno y Nerol en las especies Z. acanthopodium /2/ y Z. armatum /16/. Esto hace que de 25 monoterpenos aislados de las hojas de Z. pistacifolium solamente 12 se hayan reportado con anterioridad para especies del género, resultando los 13 restantes novedosos, incluso para el género.
Terpenoides del tipo sesquiterpenos aislados para otras especies del género, son el a-Copaeno, D-Germacreno, ß-Selineno y δ-Cadineno (Z. alatum /15/ y Z. gilletii /14/). El óxido de Cariofileno y el α-Selineno se han reportado en el Z. alatum /15/, mientras que en Z. acanthopodium se han aislado el ß-Elemeno, el (E)-Cariofileno, el a-Humuleno, el δ-Cadineno y el (E)-Nerolidol /2/. Por su parte, el α-Elemol ha sido informado como compuesto mayoritario del Z. fagara /5/ y el Geraniol en el Z. armatum /16/. De este tipo de sustancias, se aislaron de las hojas en estudio, un total de 31 compuestos, y como antecedentes genéricos solo existen estos anteriormente informados, por lo que los restantes 19 sesquiterpenos no mencionados, también resultan de un primer informe incluso para el género.
Compuestos de naturaleza no terpenoide también han sido informados en esencias de diversos órganos de especies de Zanthoxylum. Ácidos orgánicos como el palmítico y el oleico forman parte de los compuestos volátiles determinados en Z. armatum /16/, mientras que el Nonacosano ha sido aislado del Z. gilleti /14/. En estas dos especies también han sido aislados derivados aromáticos, pero ninguno coincide con los aislados en el presente trabajo.
En sentido general, el número de compuestos volátiles extraídos de las hojas del Zanthoxylum pistacifolium Griseb que nunca antes había sido reportado para especies del género es relativamente alto; no obstante la presencia de determinados marcadores, como las sustancias mayoritarias α-Pineno y Linalol, constituyen una evidencia adicional de que la planta estudiada se trata de una especie del género Zanthoxylum.
Extracción en medio ácido
Cuando se empleó este medio se logró no solo triplicar el rendimiento del proceso extractivo, sino que también se incrementó el número de compuestos extraídos, llegando a la cifra de 100. De ellos, un total de 91 fueron correctamente identificados, representando un 96,39 % del total extraído (figura 2). Cuando se realizó el análisis de la influencia de este medio con respecto al valor de rendimiento obtenido, se planteó la probable influencia del ácido sobre la destrucción de las estructuras celulares y subcelulares. Esta misma condición pudiera ser ahora la responsable del hecho de que se obtenga un mayor número de compuestos químicos, pues los mismos, al igual que las estructuras celulares, podrían estar expuestos a la acción hidrolítica y químicamente agresiva de estos ácidos.
Si se observa detenidamente la tabla 2 se comprobará, que ninguno de los componentes mayoritarios detectados en la extracción en medio neutro coincide con los identificados en el medio ácido. Esta evidencia, unido al hecho de que los niveles de concentración de esos compuestos mayoritarios son notablemente menores que los del método extractivo previo, pudieran explicar el posible efecto degradante que implica el empleo de ácidos como solventes extractivos.
La figura 2 muestra, además, la clasificación según la naturaleza química de los compuestos aislados en este medio. En ella se aprecia un incremento en número de compuestos, y el aporte al rendimiento relativo radica, esencialmente, en los compuestos monoterpénicos, precisamente las unidades estructurales más sencillas, las cuales pudieran ser el resultado de procesos degradativos y/o oxidativos. En su defecto, los compuestos hidrocarbonados no terpenoides son los que sufren una mayor disminución, tanto en número de compuestos, como en el por ciento relativo en el que se encuentran con respecto al resto de los componentes.
No obstante a lo anteriormente planteado, cincuenta compuestos resultan coincidentes entre ambos métodos, evidenciando que al menos uno de cada dos compuestos aislados por cualquiera de los medios resulta en común. Los compuestos en común son los representados en la tabla 3, así como el área relativa de esos compuestos en el medio ácido y la diferencia de áreas entre el medio ácido y neutro. Como se observa en esta tabla, los cinco compuestos mayoritarios del medio neutro son también aislados en el medio ácido, sin embargo todos ellos sufren importantes disminuciones en sus abundancias relativas. Adicionalmente, si se comparan los compuestos mayoritarios declarados para el medio de extracción ácido (tabla 2) con los compuestos en común con el medio neutro (tabla 3) observaremos que tres de ellos aparecen solamente en la extracción con ácido (1-4-Cineol, p- Cymeno y α-Terpineol) mientras que los dos compuestos que coinciden son el γ-Terpineno y el Terpinoleno.
TABLA 3. COMPUESTOS EXTRAÍDOS EN MEDIO NEUTRO Y MEDIO ÁCIDO. VALORES DE ABUNDANCIA
RELATIVA MEDIOS ÁCIDOS Y DIFERENCIAS DE ÁREAS ENTRE AMBOS MEDIOS
| Nº | Compuesto | A (%) | Aac-An | Nº | Compuesto | A (%) | Aac-An |
| 1 | (3E)-Hexenol | 0,15 | -0,06 | 38 | Eugenol | 0,89 | -1,18 |
| 2 | (3Z)-Hexenol | 0,07 | -0,05 | 39 | α-Copaeno | 0,18 | -0,01 |
| 4 | α-Pineno | 2,79 | -9,55 | 41 | ß-Elemeno | 0,14 | -4,47 |
| 5 | α–Fencheno | 1,31 | 0,55 | 42 | (E)-Cariofileno | 2,50 | -0,12 |
| 6 | Benzaldehído | 0,35 | -0,60 | 43 | γ-Elemeno | 0,08 | -0,22 |
| 9 | Mirceno | 3,00 | -0,08 | 45 | 4,11-Selindieno | 0,39 | -0,10 |
| 10 | α-Felandreno | 0,83 | 0,72 | 46 | γ-Gurjuneno | 1,40 | 1,01 |
| 11 | α-Terpineno | 0,88 | 0,62 | 47 | D-Germacreno | 0,41 | -0,07 |
| 12 | Limoneno | 2,50 | -3,69 | 49 | α-Selineno | 0,52 | -0,69 |
| 13 | Eucalyptol | 2,17 | 1,72 | 51 | γ-Cadineno | 0,08 | 0,00 |
| 15 | (E)-ß-Ocimeno | 0,20 | -2,60 | 52 | δ-Cadineno | 0,43 | -0,11 |
| 16 | γ-Terpineno | 3,51 | 2,91 | 54 | α-Elemol | 0,22 | 0,13 |
| 18 | Terpinoleno | 5,88 | 4,93 | 56 | Benzoate (3Z)-hexenyl | 0,40 | -0,24 |
| 19 | Linalol | 0,45 | -6,23 | 58 | Óxido de Cariofileno | 0,27 | -0,07 |
| 20 | 2(E),6(Z)- dimetil-2,4,6-Octatrieno | 1,04 | -5,46 | 61 | Guaiol | 0,68 | 0,50 |
| 22 | 2-metil-Propanoato de (3Z)- hexenilo | 0,35 | 0,15 | 63 | Copaborneol | 0,31 | -0,74 |
| 24 | Borneol | 1,52 | 1,26 | 64 | Epicubenol | 1,54 | -2,33 |
| 25 | 4-Terpineol | 0,60 | -0,45 | 65 | γ-Eudesmol | 0,34 | 0,22 |
| 26 | 3-Decanona | 0,34 | -0,24 | 67 | 10-OH-4-Cadineno | 0,25 | 0,06 |
| 27 | Salicilato de Metilo | 0,05 | -0,05 | 76 | Ácido n-Tetradecanóico | 0,17 | 0,00 |
| 28 | γ-Terpineol | 0,66 | -3,63 | 79 | Isofitol | 1,64 | 1,29 |
| 30 | 2-metil-Butanoato de (3Z)- hexenilo | 0,11 | -0,74 | 80 | Ácido Hexadecanóico | 2,59 | -0,05 |
| 31 | 2-metil-Butanoato de hexilo | 0,30 | -0,05 | 82 | Fitol | 1,35 | -4,71 |
| 33 | Geraniol | 0,09 | -0,17 | 88 | Nonacosano | 0,23 | -0,55 |
| 37 | δ-Elemeno | 1,14 | 0,10 | 89 | Hentriacontano | 0,22 | -0,64 |
Leyenda: A -> Área relativa; Aac-An -> Diferencias de Áreas entre el medio ácido (Aac) y el neutro (An); en cursiva -> mayores diferencias, en negrita -> mayoritarios.
Estos dos compuestos mayoritarios (para el medio ácido) en común se lograron identificar en el medio neutro con valores muy bajos de área relativa (ver tabla 1), aspecto este que hace volver sobre la hipótesis del porqué el medio ácido favorece el proceso extractivo y las posibles consecuencias de su empleo en la especie en estudio. Por ello, el incremento significativo del área relativa de estos dos compuestos puede estar determinado por dos factores: primero que los mismos se encuentran almacenados en zonas de las hojas poco expuestas al exterior, a las cuales solo se puede acceder cuando agentes externos (medio ácido) son capaces de romper las estructuras celulares de almacenamiento; y segundo que sean el resultado de una reacción química provocada por el ácido en su proceso de reflujo (4 h).
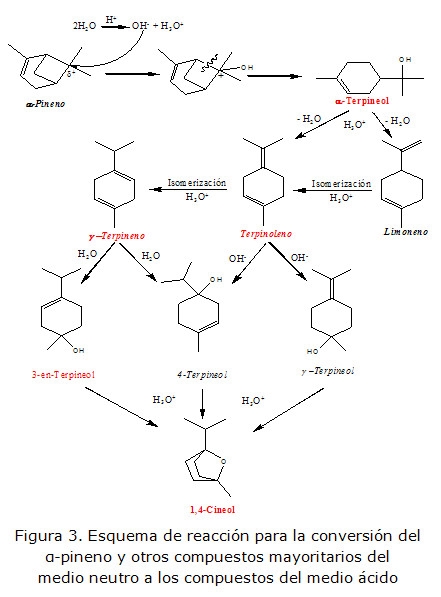
Para que se cumpla esta segunda hipótesis, sería necesario que algún o alguno de los metabolitos presentes en el medio neutro (natural), haya sufrido modificaciones químicas, disminuyendo su concentración a expensas de la creación de nuevos compuestos. El ejemplo más ilustrativo de esto sería el α-Pineno (compuesto mayoritario en medio neutro), el cual disminuye su abundancia relativa en casi seis veces en el medio ácido, probablemente para la formación del α-Terpineol (compuesto en abundancia obtenido exclusivamente en medio ácido), el cual a su vez se convierte en otros compuestos del medio ácido, según el esquema de reacción propuesto en la figura 3.
Leyenda: En cursiva compuestos en común (2), en negrita compuestos mayoritarios (6), en rojo compuestos exclusivos del medio ácido (1).
Extracción en medio básico
A diferencia de la modificación del medio anterior, en este caso el número de compuestos extraídos resultó menor no solo con respecto al medio ácido, sino también con respecto al medio neutro. Se logró identificar un total de 63 compuestos del total de 69 que se aislaron, representando un 96,81 % de abundancia relativa del total extraído. De los 63 compuestos identificados un total de 42, resultaron comunes con los extraídos en el medio neutro, evidenciado una vez más que el mismo fue menos agresivo tanto para las estructuras celulares de las hojas como para los compuestos presentes en la misma. No obstante, la tabla 4 muestra cómo sí existen diferencias apreciables en cuanto a las abundancias que para el medio neutro presentaban los compuestos mayoritarios.
TABLA 4. COMPUESTOS EXTRAÍDOS TANTO EN MEDIO NEUTRO COMO BÁSICO. VALORES DE ABUNDANCIA
RELATIVA EN MEDIO BÁSICO Y DIFERENCIAS DE ÁREAS ENTRE AMBOS MEDIOS
| Nº | Compuesto | A (%) | Ab-An | Nº | Compuesto | A (%) | Ab-An |
| 1 | (3E)-Hexenol | 0,30 | 0,09 | 48 | ß-Selineno | 1,14 | -0,13 |
| 4 | α-Pineno | 3,91 | -8,43 | 49 | α–Selineno | 1,86 | 0,65 |
| 6 | Benzaldehído | 3,21 | 2,26 | 50 | ( E,E)-α -Farneseno | 1,39 | 0,28 |
| 9 | Mirceno | 0,65 | -2,43 | 51 | γ-Cadineno | 0,38 | 0,30 |
| 12 | Limoneno | 0,41 | -5,78 | 52 | δ-Cadineno | 0,60 | 0,06 |
| 14 | (Z)-ß-Ocimeno | 0,33 | -2,03 | 55 | Nerolidol (E) | 0,44 | 0,31 |
| 15 | (E)-ß-Ocimeno | 0,62 | -2,18 | 56 | Benzoate (3Z)-hexenyl | 0,19 | -0,45 |
| 17 | Óxido de cis-Linalol | 0,16 | -0,06 | 58 | Óxido de Cariofileno | 1,67 | 1,33 |
| 19 | Linalol | 0,55 | -6,13 | 60 | Viridiflorol | 1,09 | 0,59 |
| 20 | 2(E),6(Z)- dimetil-2,4,6-Octatrieno | 1,28 | -5,22 | 61 | Guaiol | 0,34 | 0,16 |
| 30 | 2-metil-Butanoato de (3Z)- hexenilo | 0,12 | -0,73 | 62 | Humuleno epóxido II | 0,56 | 0,26 |
| 36 | Acetato de Dihidrocarvylo | 0,67 | 0,42 | 63 | Copaborneol | 0,42 | -0,63 |
| 37 | δ-Elemeno | 4,42 | 3,38 | 64 | Epicubenol | 10,43 | 6,56 |
| 38 | Eugenol | 0,73 | -1,34 | 67 | 10-OH-4-Cadineno | 1,19 | 1,00 |
| 41 | ß-Elemeno | 1,96 | -2,65 | 69 | Intermedeol | 1,87 | 0,94 |
| 42 | (E)-Cariofileno | 7,06 | 4,44 | 73 | (Z,Z)-Farnesol | 0,22 | -0,01 |
| 43 | γ-Elemeno | 0,84 | 0,54 | 76 | ácido n-Tetradecanóico | 0,29 | 0,12 |
| 44 | α–Humuleno | 1,24 | 0,44 | 80 | ácido Hexadecanóico | 0,60 | -2,04 |
| 45 | 4,11-Selindieno | 0,38 | -0,11 | 82 | Fitol | 6,76 | 0,70 |
| 46 | γ-Gurjuneno | 2,22 | 1,83 | 88 | Nonacosano | 5,53 | 4,75 |
| 47 | D-Germacreno | 0,61 | 0,13 | 89 | Hentriacontano | 1,10 | 0,24 |
Leyenda: A -> Área relativa; Ab-An -> Diferencias de Áreas entre el medio básico (Ab) y el neutro (An); en rojo -> mayores diferencias, resaltados -> mayoritarios.
La figura 4 muestra la clasificación estructural de los 63 compuestos identificados en la extracción por este medio.
Otra diferencia apreciable entre este medio básico y el resto de los medios empleados (neutro y ácido) radica en que los compuestos mayoritarios son esencialmente del tipo sesquiterpénico, algo no evidenciado anteriormente. Por ello, la hipótesis de que la extracción en medio básico no influye en la composición química de los compuestos volátiles resulta en esencia descartable (ver tabla 4).
A manera de resumen se puede notar, que en todos los medios empleados para la extracción de compuestos volátiles, se identificaron compuestos de naturaleza terpenoide y no terpenoide. Los que más prevalecieron en los tres medios fueron los terpenoides, 56 en el medio neutro para un 55,09 %; 71 compuestos en el medio ácido para un 83,84 %, y el medio básico se identificaron 46 para un 67,89 %. Si se consideraran los compuestos comunes en los tres medios de extracción, la cifra alcanzada sería 31, los cuales se muestran en la tabla 5.
Considerando las posibles modificaciones a las estructuras de los compuestos volátiles presentes en las hojas del Zanthoxylum pistacifolium Griseb, el método tradicional de extracción de compuestos volátiles empleando agua destilada resulta ser el más efectivo para la extracción de los mismos.
TABLA 5. COMPUESTOS VOLÁTILES EXTRAÍDOS EN LOS TRES MEDIOS
(ÁCIDO, BÁSICO Y NEUTRO)
| Nº | Compuesto | Nº | Compuesto |
| 1 | (3E)-Hexenol | 47 | D-Germacreno |
| 4 | α-Pineno | 49 | α–Selineno |
| 6 | Benzaldehído | 51 | g -Cadineno |
| 9 | Mirceno | 52 | d -Cadineno |
| 12 | Limoneno | 56 | Benzoate (3Z)-hexenyl |
| 15 | (E)-ß-Ocimeno | 58 | Óxido de Cariofileno |
| 19 | Linalol | 61 | Guaiol |
| 20 | 2(E),6(Z)- dimetil-2,4,6-Octatrieno | 63 | Copaborneol |
| 30 | 2-metil-Butanoato de (3Z)- hexenilo | 64 | Epicubenol |
| 37 | δ-Elemeno | 67 | 10-OH-4-Cadineno |
| 38 | Eugenol | 76 | Ácido n-Tetradecanóico |
| 41 | ß-Elemeno | 80 | Ácido Hexadecanóico |
| 42 | (E)-Cariofileno | 82 | Fitol |
| 43 | γ-Elemeno | 88 | Nonacosano |
| 45 | 4,11-Selindieno | 89 | Hentriacontano |
| 46 | γ-Gurjuneno |
|
|
CONCLUSIONES
El medio ácido favoreció el rendimiento total de compuestos volátiles, sin embargo, afectó la naturaleza química cualitativa del aceite; por lo que se propone el método de extracción en medio neutro como el más efectivo en la extracción de compuestos volátiles de las hojas de Zanthoxylum pistacifolium Griseb, identificando como compuestos mayoritarios el a-Pineno, Linalol, 2,6-dimetil-2,4,6-Octatrieno, L imoneno y Fitol.
REFERENCIAS BIBLIOGRÁFICAS
1. MANCEBO, F.; HILJE, L.; MORA, G. A.; CASTRO, V. H.; SALAZAR, R. Biological activity of Rutachalepensis (Rutaceae) and Sechiumpittieri (Cucurbitaceae) extracts on Hypsipylagrandella (Lepidoptera: Pyralidae) larvae. Revista de Biología Tropical, 2001, 49, 501-508.
2. RAKIC, T.; INAR, J.; FILIPOVIC, B.; TADIC, V.; STEVANOVIC, B.; TAN, K. Ecophysiological and Anatomical Characteristics of the Subtropical Shrub Zanthoxylum acanthopodium (Rutaceae) in Conditions of a Temperate Continental Climate (Serbia). Archives of Biological Science Belgrade, 2009, 61, 2, 249-260.
3. ARUN KUMAR, K. V.; PARIDHAVI, M. "An Etnobotanical, Phytochemical and Pharmacological utilization of widely distributed species Zhanthoxylum: A comprehensive over view". International Journal of Pharmaceutical Invention, 2012, enero 2, 1, 24-35.
4. BOEHME, A. K.; NOLETTO, J. A.; HABER, W. A.; SETZER, W. N. "Bioactivity and chemical composition of the leaf essential oils of Zanthoxylum rhoifolium and Zanthoxylum setulosum from Monteverde, Costa Rica". Natural Product Research, 2008, 22(1), 31-36.
5. PRIETO, J. A.; PATIÑO, O. J.; DELGADO, W. A.; MORENO, J. P.; CUCA, L. E. "Chemical Composition, Insecticide and Antifungal Activities of the Essential Oils of Fruits of three Zanthoxylum Species from Colombia". Chilean Journal of Agricultural Research, 2011, 71, 73-82.
6. FOGANG, H. P. D. et al. "Characterization and biological activity of essential oils from fruits of Zanthoxylum xanthoxyloides Lam. and Z. leprieurii Guill. &Perr., two culinary plants from Cameroon". Flavour Fragrance Journal, 2012, 27, 171–179.
7. ADESINA, S. K. "The Nigerian Zanthoxylum: Chemical and Biological Values". African Journal of Traditional, Complementary and Alternative Medicines, 2005, 2, 282-301.
8. LEE, S. J., LIM, K. T. "Glycoprotein of Zanthoxylum piperitum DC has a hepatoprotective effect via anti-oxidative character in vivo and in vitro". Toxicology in Vitro, 2008, 22, 376-385.
9. JOJI, R. L., BEENA, J. "Statistical analysis of the antibacterial activity of Zanthoxylum rhetsa seed essential oil". Journal Chemical and Pharmaceutical Research, 2011, 3, 1, 440-444.
10. SENATORE, F.; LANDOLFI, S.; CELIK, S.; BRUNO, M. "Volatile components of Centaurea calcitrapa L. and Centaurea sphaerocephala L. ssp. sphaerocephala, two Asteraceae growing wild in Sicily". Flavour Fragrance Journal, 2006, 21, 282-285.
11. PINO, J. A.; MESA, J.; MUÑOZ, Y.; MARTÍ, M. P.; MARBOT, R. "Volatile components from mango (Mangiferaindica L.) cultivars". Journal of Agricultural and Food Chemistry, 2005, 53, 2213-2223.
12. ADAMS, R. P. Identification of essential oil by Gas Chromatography/Mass Spectroscopy. Illinois: Carol Stream. Allured publisher Corp. 1995.
13. PATIÑO, O. J.; PRIETO, J. A.; CUCA, L. E. Zanthoxylum Genus as Potential Source of Bioactive Compounds, Bioactive Compounds in Phytomedicine. Prof. Iraj Rasooli (Editor.). Rijeka: In Tech, 2012. p. 185-217.ISBN978-953-307-805-2. Disponible en: http: www.intechopen.com.
14. OMBITO, O.; MATASYOH, C.; VULULE, M. "Chemical composition and larvicidal activity of Zanthoxylum gilletii essencial oils against Anopheles gambiae". African Journal of Biotechnology, 2014, 13(21), 2175-2180.
15. SANJAY, G.; TIKU, A. K.; KOUL, A.; SAHIL, G.; SINGH, G.; RAZDAN V. K. Antioxidant and Antimicrobial Properties of the Essential Oil and Extracts of Zanthoxylum alatum Grown in North-Western Himalaya". The Scientific World Journal, 2013, abril, 9. Disponible en: http://dx.doi.org/10.1155/2013/790580.
16. BARKATULLAH, Ibar M. et al. "Chemical Composition and biological screening of essential oils of Zanthoxylum armatum from leaves". Journal of Clinical Toxicology, 2013, 3(5), 1-6. Disponible en: http://dx. Doi.org: 10.4172/2161-0495.1000172.
17. SHAFI, M. P.; JOSE, B.; JIROVETZ, L. "Conversion of sabinene to phellandral via p-menthane-1,2,7-triol". Indian Journal of Chemistry, 2008, 20(47), 1731-1734.
Recibido: 10/02/2015
Aceptado: 28/05/2015
MSc. Yamilé Heredia-Díaz, Facultad de Ciencias Naturales, Universidad de Oriente, Santiago de Cuba, Cuba, yheredia@cnt.uo.edu.cu