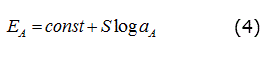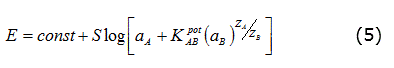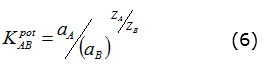Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.2 Santiago de Cuba maio.-ago. 2016
ARTICULOS
Reconocimiento al ion Ag+ con un electrodo selectivo "all solid stated"
Recognition to the ion Ag+ with a selective electrode "all solid stated"
Dra. C. María de los A. Arada-Pérez, Lic. Yoanys Pacheco-Ramírez, MSc. Leandro León-Duharte
Universidad de Oriente, Santiago de Cuba, Cuba, mayarada@uo.edu.cu
RESUMEN
Ha sido preparado un electrodo sensible al catión plata para lo cual se empleó 5-(4-dimetilaminobenciliden)rodanina disuelto en dibutilftalato (DBP) e inmovilizado en cloruro de polivinilo (PVC) sobre un soporte de resina conductora. Los resultados muestran que el electrodo presenta una respuesta lineal en el rango de 10-2 a 10-6 mol/L con una pendiente de 69,90 ± 1,73 mV.déc-1 respectivamente en el periodo de tiempo que fue analizado. Se determinó el tiempo de respuesta del electrodo (25 s) y se calculó el coeficiente de selectividad para diversos iones. Este estudio ha mostrado para los iones estudiados (Cu2+, Pb2+ y Cd2+) que el valor de la KPotAB está en el orden de 10-3 mol/L, no resultando fuertes interferentes por los valores obtenidos.
Palabras clave: sensor, sensor potenciométrico, electrodo ion selectivo, 5-(4-dimetilaminobenciliden)rodanina.
ABSTRACT
Has been prepared a sensitive electrode to the silver cation for that which was used 5-(4-dimethylaminobenzylidene)rhodanine dissolved in dibutylphthalate (DBP) and immobilized in polylvinyl chloride (PVC) on a support of conductive resin. The results show that the electrode presents a lineal answer in the range from 10-2 to 10-6 mol/L with a slope of 69,90 ± 1,73 mV.dec-1 respectively in the range of time that was analyzed. The time of answer of the electrode was determined (25 s) and the selectivity coefficient was calculated for diverse ions. This study has shown for the studied ions (Cu2+, Pb2+ and Cd2+) that the value of KPotAB is in the order of 10-3 mol/L, not being strong interferents for the values obtained.
Keywords: sensor; Potentiometric sensors; Ion-selective electrode, 5-(4-dimethylamino benzylidine)rhodanine.
INTRODUCCIÓN
Los sensores químicos representan un área muy interesante y en expansión dentro de la investigación en Química Analítica [1]. Están formados por dos partes bien diferenciadas: un elemento de reconocimiento molecular o iónico (receptor) que interacciona selectivamente con un determinado componente de la muestra (analito) y un elemento instrumental (transductor) que traduce la interacción en una señal procesable. Esta configuración tan simple permite el diseño de sensores caracterizados por pequeñas dimensiones, bajo costo, fácil utilización y generación de la información en tiempo real. Dentro de los sensores químicos, los electrodos selectivos a iones (ESIs) han tenido un auge vertiginoso, que a través del método potenciométrico de análisis, han permitido la determinación de muchos iones [2-11] cuyos métodos clásicos de determinación resultan costosos, tanto por los precios de los equipos necesarios, como por los reactivos a emplear; además de requerir un tiempo más largo de análisis por el tratamiento de la muestra.
El ion Ag+ es uno de los beneficiados en estas determinaciones con ESIs. Diversos ionóforos han sido empleados en el reconocimiento de este, entre los cuales se puede citar: tiazoeter de corona [12], cyclam [13], 3-(2-piridiletilimino)-2-butanonaoxina [14], benzo tiazolilace.tamidoalcoxicalix arenos (9-12) [15].
En este trabajo es caracterizado un ESI a ion Ag+, empleando la 5-(4-dimethylamino benzylidene)rhodanina como ionóforo, en una matriz de cloruro de polivinilo (PVC) y dibutilftalato (DBP) como plastificante (disolvente mediador). La membrana sensora fue depositada en un composite conductor resina-epoxi con base grafito.
MATERIALES Y MÉTODOS
Todos los reactivos químicos empleados fueron puros para análisis. Para la preparación de las soluciones fueron secados en estufa a 105 o C y llevado a temperatura ambiente en una desecadora, luego pesados en balanza analítica Sartorios modelo BP 61S con sensibilidad de 0,1 mg, las soluciones más diluidas se prepararon por dilución de las más concentradas. Se empleó en la preparación de la membrana cloruro de polivinilo (PVC) de Fluka, Tetrahidrofurano (THF) de Merck, Dibutylftalato (DBP) de la Merck, Resina-epoxi (de Ciba-Geigy) con base grafito (de Merck). La Resina-epoxi conductora se preparó mediante la mezcla de Araldite M y Endurecedor HR y grafito en polvo.
El agua empleada fue bidestilada. La resistencia eléctrica del contacto epoxi: grafito se midió con un multímetro digital YFE modelo YF-2100. Las medidas de potencial se realizaron en un microprocesador pH /ion Meter pMX 3000 digital, con una precisión de 0,1mV. Las determinaciones se efectuaron en una celda abierta bajo agitación constante y a temperatura ambiente. Se utilizó un electrodo de Ag/AgCl como referencia (HI 5311) de doble unión líquida, saturado con cloruro de potasio (KCl); el compartimiento externo utiliza una solución de K2SO4 0,1 mol/L.
La composición de la celda electroquímica fue la siguiente:
Ag/AgCl |KCl (0.1 mol/L) |K2SO4 (0.1 mol/L) ||disolución de trabajo||membrana PVC |soporte conductor| Cu(s)
Preparación del electrodo y la membrana
La preparación del cuerpo del electrodo y la posterior aplicación de la membrana se llevó a cabo de una manera similar al método usado en la construcción de los electrodos selectivos "all-solid-state" [16]. La variación del potencial que se origina en la celda electroquímica cuando cambia la actividad del ion estudiado, se determina a través de la ecuación de Nernst (1).
La composición de la membrana líquida en porcentaje en peso es la siguiente: PVC-35 %, Plastificante-60 % y el ionóforo-5 %.
Calibración y parámetros de calibración
Para la calibración de los electrodos se parte de 25 mL de agua bidestilada exactamente medidos, a los que se le adicionan volúmenes pequeños (µL) de las disoluciones del ion primario de 10-5 – 1,0 mol/L; para obtener un intervalo de actividad del ion primario de 10-9 – 10-2 mol/L. El método utilizado fue el de la adición [17] y la actividad del ion principal se determina por la ecuación de Debye-Hückel (2).
La representación gráfica de los valores de potencial frente al log αA permitió obtener la curva de calibración del mismo. De las sucesivas calibraciones se calcularon los parámetros de calibración establecidos por la IUPAC [17]: S, LIRL y el LPD (pendiente, límite inferior de respuesta lineal y límite práctico de detección).
Estabilidad de la respuesta en el tiempo
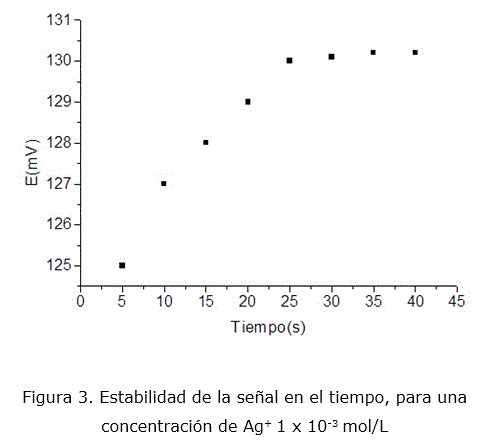
Se empleó el método directo [17] para lo cual se partió de 25 mL del ion primario a una concentración de 10-2 mol/L; se introdujeron los electrodos de trabajo en la celda de calibración y se accionó un cronómetro para medir el valor de potencial cada cinco segundos.
Estudio de la influencia del pH en el potencial de respuesta del electrodo
La influencia del pH en la respuesta del electrodo se estudió mediante los diagramas de Reilley [17] en los que se representa la variación del potencial del electrodo en función del pH de la disolución con la que está en contacto. Se eligió HNO3 para acidificar el medio, ya que la especie nitrato está presente en el mismo, y como base NaOH para ajustar el pH.
Para este experimento se procedió a calibrar el equipo medidor de pH haciendo uso de un electrodo combinado por el método habitual de Potenciometría Directa. Se partió de 250 mL de solución de ion Ag+ (10-3 mol/L), se introdujeron los electrodos (vidrio, de referencia y en estudio), se ajustó pH hasta un valor cercano a 2 con solución de HNO3 y luego se añadió solución de NaOH para así obtener valores de pH y potencial respectivamente después de cada adición.
Determinación de los coeficientes de selectividad potenciométricos
El cálculo de los coeficientes de selectividad KPotAB se realizó por el método de las soluciones mezcladas [17] basada en la ecuación de Nicolsky-Eisenman, definida en una situación en la que la actividad del ion interferente (αB), en ausencia del ion principal, provoca una diferencia de potencial (EB) igual a la diferencia de potencial (EA) que originaría una disolución del ion principal de actividad (αA). Según esto se cumple que:
siendo
Igualando las ecuaciones 4 y 5 puede obtenerse la ecuación 6:
La actividad del ion Ag+ (αA) se calculó gráficamente de la curva de calibrado, obtenida al representar las variaciones de potencial después de cada adición vs. logaritmo de la actividad del ion principal. El valor de αA es el correspondiente al punto de intercepción de la prolongación de las zonas lineales de las curvas de calibrado, es decir la zona horizontal y la zona lineal de comportamiento Nerstiano (debida al ion principal).
El otro parámetro necesario para conocer KPotAB es la actividad del ion interferente, término que se obtiene con la ayuda de la ecuación de Debye-Hückel (2).
Todas las datas para obtener los parámetros de calibración fueron procesadas con el programa Origin 5.0; los resultados estadísticos por el Origin 8.0 y Statgraphics Plus for Windows.
RESULTADOS Y DISCUSIÓN
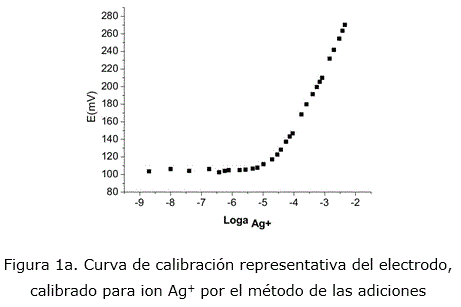
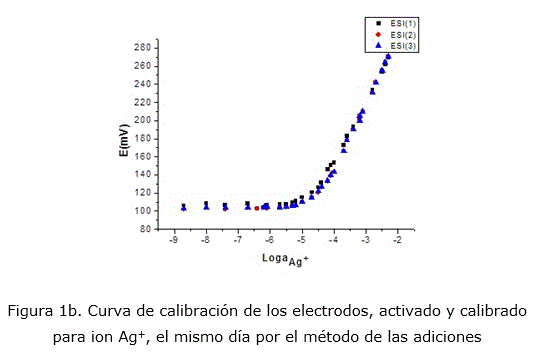
Los ESIs construidos fueron calibrados a través del método de las adiciones [17] para el ión primario Ag+. En la siguiente figura 1a puede observarse una curva de calibración representativa de los mismos. Se muestra un amplio rango de linealidad comprendido entre 1x10-2 a 10-6 mol/L, con pendientes nernstiana al ion Ag+. En la siguiente figura 1b se puede observar la reproducibilidad en las respuestas de los ESIs construidos. En la tabla 1 se reportan los parámetros de calibración del ESI construido.
TABLA 1. PARÁMETROS DE CALIBRACIÓN DEL ESI SENSIBLE A AG (I)
| Parámetros | DBP | DOP20 |
| S (mV·déc-1) | 69,90 ± 1,73 | 58,2 ± 0,8 |
| R2 | 0,996 14 | - |
| LPD (mol/L) | 2,41 x10-5 | 9,77 x 10-7 |
| LIRL (mol/L) | 6,07 x 10-5 | 2,02 x 10-6 |
| T. vida (días) | 25 | >30 |
| SD (S) | 2,910 6 | 1,03 |
| CV (S) | 4,163 9 | - |
| T. resp.(s) | 25 | 20 |
| pH | 2,0 – 4,0 | 2,0 – 4,0 |
Leyenda: S: pendiente; LPD: Límite práctico de detección; LIRL: Límite inferior de respuesta lineal; SD: desviación estándar de la pendiente; CV: coeficiente de variación de la pendiente; T. resp.: Tiempo de respuesta.
Como se muestra en la figura 1b, el ESI mostró respuesta al ion primario, con pendiente overnernstiana, con muy buena reproducibilidad en sus resultados.
Se realizó un Análisis de Varianza (ANOVA, por sus siglas en inglés) para comparar las pendientes de los tres ESIs. En la siguiente tabla 2 se pueden observar los resultados. Previamente a la comparación, se realizó un contraste para verificar si existía homogeneidad entre las varianzas. El p-Valor de la prueba de Levene fue 0,956 932 teniendo en cuenta que es superior al nivel de significación (α=0,05), no existen diferencias estadísticamente significativas entre las varianzas para un nivel de confianza del 95 %.
TABLA 2. ANÁLISIS DE VARIANZA REALIZADO A LOS ESIS
| Fuente | S.C. | g.l. | C.M. | Cociente-F | Valor p |
| Entre grupos | 80,431 5 | 7 | 11,490 2 | 0,69 | 0,682 7 |
| Intra grupos | 268,043 | 16 | 16,752 7 |
|
|
| Total (Corr.) | 348,474 | 23 |
|
|
|
S.C.: Suma de cuadrados, g.l.: grados de libertad, C.M.: cuadrado medio
Como se puede observar en la tabla 2 ANOVA, el p-Valor es mayor que el nivel de significación (α=0, 05), lo que indica que no existen diferencias estadísticas entre las medias de los tres ESIs construidos para un nivel de confianza del 95 %, por lo cual se pueden emplear indistintamente los ESIs para evaluar su respuesta a plata.
Estudio de la linealidad
TABLA 3. DATOS PARA LA LINEALIDAD DEL MÉTODO
| Cf (mol/L) | Log a | E(mV) | E(mV) | E(mV) | Promedio (mV) | DS(S) |
| 5,94·10-5 | -4,253 08 | 146 | 132,5 | 133,5 | 137,3 | 2,9106 |
| 7,88·10-5 | -4,134 36 | 150,5 | 139 | 140 | 143,2 |
|
| 9,81·10-5 | -4,041 04 | 153,5 | 143,3 | 143,3 | 146,7 |
|
| 1,95·10-4 | -3,758 14 | 172,4 | 166,1 | 166,3 | 168,3 |
|
| 2,92·10-4 | -3,593 25 | 183 | 178,1 | 178,5 | 179,9 |
|
| 4,86·10-4 | -3,388 39 | 193,1 | 190,4 | 190,4 | 191,3 |
|
| 6,78·10-4 | -3,256 79 | 200 | 199,2 | 199,2 | 199,5 |
|
| 8,68·10-4 | -3,160 52 | 205,5 | 205,2 | 205,2 | 205,3 |
|
| 1,06·10-3 | -3,083 58 | 209,7 | 210 | 210 | 209,9 |
|
| 2,02·10-3 | -2,841 97 | 233,5 | 230,8 | 230,8 | 231,7 |
|
| 2,97·10-3 | -2,701 99 | 241,3 | 242 | 242 | 241,7 |
|
| 4,89·10-3 | -2,531 06 | 253,4 | 255 | 255 | 254,5 |
|
| 6,79·10-3 | -2,422 89 | 262 | 264,2 | 264,2 | 263,5 |
|
| 8,69·10-3 | -2,344 54 | 268,9 | 270,9 | 270,9 | 270,2 |
|
Para determinar la linealidad de la respuesta del electrodo frente a diferentes actividades del ion primario, se elaboró la recta de regresión lineal como se muestra en la figura 2, a partir de los datos que se muestran en la tabla 3.
En la figura 2, a partir del rango de actividades finales y el valor promedio del potencial medido, se obtuvo el coeficiente de determinación (R2) igual a 0, 996 11, el cual debe ser al menos 0,99 para ser aceptado; una pendiente de 69,90; un intercepto de 430,30 y un coeficiente de correlación (r) de 0,99 805.
La relación entre la variable dependiente (actividad) y la variable independiente (potencial) se expresa matemáticamente haciendo una estadística de regresión, tal como se expresa en la tabla 4.
TABLA 4. DETERMINACIÓN DE LA LINEALIDAD POR LOS DATOS DE LA GRÁFICA DE REGRESIÓN
| Estadística de Regresión | |
| Coeficiente de correlación (r) | 0,998 05 |
| Coeficiente de determinación(R2) | 0,996 11 |
| R2 ajustado | 0,995 79 |
| SD(S) | 2,910 62 |
| Observaciones | 8 |
El resultado del análisis de varianza realizado se expresa en la siguiente tabla 5.
Como se puede observar en la siguiente tabla 5 ANOVA, el p-Valor es inferior al nivel de significación (α=0,01), lo cual indica una relación estadísticamente significativa entre el potencial de respuesta E (mV) y la actividad del ion plata para un nivel de confianza del 99 %, además el coeficiente de correlación reportado en la tabla 4 corrobora una relación fuerte entre el potencial de respuesta y la actividad del ion primario.
TABLA 5. ANÁLISIS DE VARIANZA REALIZADO PARA LA DETERMINACIÓN DE LA LINEALIDAD
| Fuente | S.C. | g.l. | C.M. | Cociente-F | Valor p |
| Modelo | 26 055,837 6 | 1 | 26 055,837 6 | 3 075,636 5 | 7,771 5.10-16 |
| Residuo | 101,660 27 | 12 | 8,471 69 |
|
|
| Total | 26 157,497 5 | 13 |
|
|
|
S.C.: Suma de cuadrados, g.l.: grados de libertad, C.M.: cuadrado medio
Tiempo de vida. Su relación con las propiedades físico químicas del plastificante
El tiempo de vida del ESI construido (25 días) es menor que el reportado por Duharte y Arada Pérez [20] (> 30 días). Al tener en cuenta que este es un parámetro de máximo interés en aplicaciones analíticas. Arada Pérez M. de los A. y colaboradores [21] demostraron que el deterioro de la respuesta de la membrana selectiva es debido ante todo, a la pérdida de los componentes de la membrana de la fase acuosa. Dinten et al. [22] han señalado la importancia de la lipofilidad de los componentes de la membrana en lo que se refiere al tiempo de vida.
Al buscar la explicación química al fenómeno, se percibe que la pérdida de los componentes de la membrana debe estar relacionada solo con la distribución en el equilibrio y los ritmos de difusión en esta fase; sin embargo, se encuentra frecuentemente que la exudación de componentes a partir del PVC plastificado, es un proceso prácticamente impredecible y muy relacionado con el tiempo de vida, por lo que se debe ser muy cuidadoso al abordar el tema.
En nuestro caso, si se comparan los tiempos de vida (tabla 1) para los electrodos con los plastificantes DOP [20] y DBP (en este estudio), en PVC con igual ionóforo y relación de componentes (60:35:5 %); puede apreciarse que el menor tiempo de vida fue obtenido con el plastificante menos lipofílico (el más polar). Mientras más lipofílico sea el plastificante, mayor tiempo será retenido el ionóforo en la fase membrana, de ahí que presente mayor tiempo de vida.
Por otra parte, al presentar el plastificante menor viscosidad, mayor será la difusión en la fase membrana, mejorando la respuesta del mismo.
Tiempo de respuesta
Se determinó el tiempo de respuesta del electrodo a través del método directo [17], obteniéndose la estabilidad de la respuesta, rápidamente, a los 25 segundos (figura 3).
Estudio del pH
Al realizar este estudio, se debe tener la precaución de no usar electrodos de pH combinados simples, debido a que llevan un electrodo de referencia Ag/AgCl sumergido en una solución de ion cloruro (habitualmente 3 mol/L), podría existir una difusión de ion cloruro hacia la solución de trabajo, pudiendo provocando interferencias en la solución.
Además, ha de tenerse en cuenta la variación de potencial de unión líquida entre el electrodo de referencia y la solución de trabajo. Esta variación puede ocurrir, sobre todo, en la zona ácida, debido a la elevada movilidad del ion hidronio y puede minimizarse si la naturaleza de las especies iónicas presentes en solución no varían.
En el estudio se obtuvieron tres regiones definidas:
Región 1: pH (2,0-4,0): el potencial se mantiene constante en este rango, mostrando una pendiente nernstiana.
Región 2: pH (4,5-6,0): entre la primera región y esta se muestra un ligero incremento del potencial después del cual se mantiene constante.
Región 3: pH (6,0-8,0): A valores de pH mayores que 6 el potencial se incrementa a causa de la hidrólisis del ion Ag+ y formación del hidróxido de plata en solución. A partir de un valor de pH igual a 8 se observa la formación del Ag2O, precipitado de color marrón; cuestión esta, acorde a lo reportado en la literatura [23].
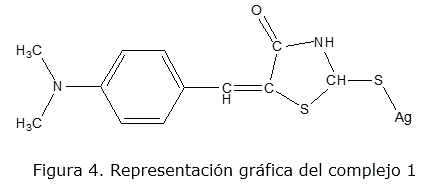
En la región de pH entre 2 y 4 se vuelve muy difícil la desprotonación del nitrógeno imínico lo que lo hace muy poco disponible para coordinar, favoreciéndose la coordinación a través del azufre exocíclico formando un complejo de Ag+ responsable de la respuesta electródica en esta región de pH. La posible estructura del complejo se muestra en la figura 4.
Se obtuvieron curvas de calibración en la región de pH entre 4,5 y 6. La pendiente de respuesta electródica fue de 30 mV.déc-1. Esto podría indicar la existencia de otra reacción química que compita en la misma magnitud que la reacción del ionóforo con el ion Ag+ en un equilibrio redox y el electrodo se comportaría como un electrodo bifuncional [24]. Pero este equilibrio dependería del pH y sería demostrado si hubiese variación del potencial de electrodo con respecto a la variación del pH, pero como los valores del potencial se mantienen constantes se descarta esta hipótesis.
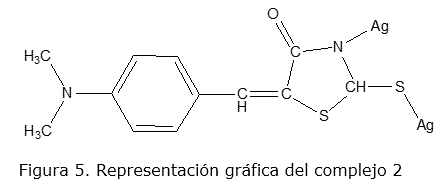
Otra hipótesis es que el valor de la pendiente electródica en esta región sería una forma de coordinación diferente entre el ionóforo y el ion Ag+ debido a la desprotonación del nitrógeno imínico haciéndolo disponible para coordinar. En este caso la coordinación pudiera ser utilizando el nitrógeno imínico y el azufre exocíclico simultáneamente, formando un complejo con dos iones Ag+ y transferencia de dos electrones. La posible estructura del complejo se muestra en la figura 5.
De este análisis se deriva que el intervalo de pH de trabajo para el sensor sería entre (2–4).
Estudio de Interferencias
La selección de los iones para el estudio de la interferencia se realizó teniendo en cuenta el poder contaminante.
Los metales que presentan una mayor toxicidad y son, por tanto, contaminantes de interés prioritario, pertenecen al grupo de los metales pesados, como el cadmio y plomo. Además, otros elementos como el cobre y el cinc, aunque no poseen el carácter altamente tóxico de los anteriores, se vierten en grandes cantidades al medio ambiente y por tanto son de usual investigación en el estudio de procesos de contaminación.
En la tabla 6 se muestran los valores de los coeficientes de selectividad potenciométricos obtenidos por el método de las soluciones mezcladas.
TABLA 6. COEFICIENTES DE SELECTIVIDAD POTENCIOMÉTRICOS, OBTENIDO EN ESTE
ESTUDIO EMPLEANDO EL MÉTODO DE LAS SOLUCIONES MEZCLADAS
| Ion Interferente | KPotAB en este estudio | KPotAB Ref 20 |
| Zn2+ | 1,8 x10-2 | 7,2 x10-3 |
| Cu2+ | 2,5 x10-3 | 3,1 x10-3 |
| Pb2+ | 2,3 x10-3 | 1,9 x10-3 |
| Cd2+ | 0,8 x10-3 | 1,5 x10-3 |
Al comparar los valores de los coeficientes de selectividad obtenido en este trabajo a los obtenidos con un sensor a Ag+ de igual ionóforo y con plastificante DOP, se observó que para el ion Zn2+ se obtiene una mayor interferencia en el ESI con el plastificante DBP, en cambio para el caso de los otros iones estudiados están en el mismo orden.
CONCLUSIONES
Los electrodos construidos empleando la 5-(4-dimetilaminobenciliden)rodanina como ionóforo, dibutilftalato (DBP) como plastificante en una matriz de PVC, exhiben una sensibilidad alta y una buena reproducibilidad, con una pendiente overnernstiana al ion Ag+ de 69,90 ±1,73 mV.déc-1, con límites de detección en el orden de 10-6 mol/L y límites inferiores de respuesta lineal en el orden de 10-5 mol/L. Mostraron un tiempo de respuesta rápido (25 s). El pH óptimo, en el cual no se ve afectada la respuesta del electrodo está en el rango 2- 4 unidades. Fueron obtenidos valores de coeficientes de selectividad que muestran que los iones (Cu2+, Pb2+ y Cd2+) no resultan fuertes interferentes, excepto el Zn2+ con interferencia moderada.
REFERENCIAS BIBLIOGRÁFICAS
1. GÓMEZ MOLINÉ, M. R., ALEGRET, S., "Los sensores químicos: una aportación a la instrumentación analítica", Edu. Quím., 1997, 8(4), 191-196.
2. SINGH, A. K., MEHTAB, S., "Polymeric Membrane Sensors Based on Cd(II) Schiff Base Complexes for Selective Iodide Determination in Environmental and Medicinal Samples", Talanta, 2008, (74), 806–814.
3. BABU, J. N., BHALLA, V., KUMAR, M., PURI, R. K., MAHAJAN, R. K., "Chloride Ion Recognition Using Thiourea/Urea Based Receptors Incorporated into 1,3-disubstituted Calixarenesw", New J. Chem., 2009, (33), 675–681.
4. XU, W. J., CHAI, Y. Q., YUAN, R., XU, L., LIU, S. L., "Highly Selective Iodide Electrode Based on the Copper(II)-N,N'-bis(salicylidene)-1,2-bis-(p-aminophenoxy)Ethane Tetradentate Complex", Anal. Sci., 2006, (22), 1345–1350.
5. SHAMSIPUR, M., ROUHANI, S., MOHAJERI, A., GANJALI, M. R., RASHIDI, R. P., "A Bromide Ion-Selective Polymeric Membrane Electrode Based on a Benzo-Derivative Xanthenium Bromide Salt", Anal. Chim. Acta., 2000, 418, 197–203.
6. ARADA PÉREZ. M. DE LOS Á., LUIS, S. V., ALTAVA- B., GALINDO, F. "Construction and evaluation of ion selective electrodes for Chloride", Rev. Cub. de Quím., 2015, 27(2), 119-130.
7. ARADA PÉREZ. M. DE LOS A., YAZDANI PEDRAM, M., "Chemical sensor based on tetradecil ammonium nitrate", J. Chil. Chem. Soc. 2013, 58(1), 1415-1418.
8. WILSON, D., ARADA, M. DE LOS A., ALEGRET, S., DEL VALLE, M., "Lead (II) ion selective electrodes with PVC membranes based on t wo bis-thioureas as ionophores: 1,3-bis(N'-benzoylthioureido)benzene and 1,3-bis(N'-furoylthioureido)benzene", J. of Hazar. Mat., 2010, (181), 140-146.
9. ARADA PÉREZ, M. DE LOS A., YAZDANI PEDRAM, M., "Copper II-Selective Electrodes based on 1-furoyl-3,3-diethylthiourea as a Neutral Carrier", J. Chil. Chem. Soc., 2010, 55(3), 283-285.
10. WATTS, A. S., GAVALAS, V. G., CAMMERS, A., ANDRADA, P. S., ALAJARIN, M., BACHAS, L. G., "Nitrate-Selective Electrode Based on a Cyclic Bis-Thiourea Ionophore", Sens. Actuat. B., 2007, (121), 200–207.
11. SELID, P. D., XU, H., MICHAEL COLLINS, E., FACE COLLINS, M. S., XIAOJUN ZHAO, J., "Sensing mercury for biomedical and environmental monitoring", Sensors., 2009, (9), 5446-5459.
12. SANG, S., YU, C., LI, N., JI, Y., ZHANG, J., "Characterization of a New Ag Selective Electrode with Lower Detection Limit", Int. J. Electrochem. Sci., 2012, (7), 3306–3313.
13. SIL, A., IJERI, V. S., SRIVASTAVA, A. K., "Coated-Wire Silver Ion-Selective Electrode Based in Silver Complex if Cyclamen", Anal. Sci., 2001, (17), 477-479.
14. VEDA, M., SAITO, T., FUJIMORI, K., MORIUCHI, T., SHIBUTAN, Y., "Potentiometric performace of silver ion selective electrodes based on tridentate Schiff base derivatives", Anal. Sci., 2004, (20), 1649-1653.
15. MORAKOT, N., NGEONTAE, W., AEUNGMAITREPIROM, W., TUNTULANI, T., "Synthesis of Novel Calixarenes Having Benzothiazolylacetamidoalkoxy Pendants and Their Potential Application as Ag+-selective Electrodes", Bull. Korean Chem. Soc., 2008, 29(1), 221-224.
16. MARTÍNEZ, E., "Sensores potenciométricos all-solid-state de urea (construcción, evaluación y aplicación)", tesis doctoral, Universidad Autónoma de Barcelona, 1989.
17. I.U.P.A.C., Compendium of Analytical Nomenclature, Oxford, Pergamon Press, 1975.
18. Origin version 8.0.Pro SRO, v8.0724 (B724) copyright, 1991-2007, Origin, Lab Corporation.
19. Statgraphics Plus for Windows. Version 3.1., Statistical Graphics Corp., 1997.
20. ARADA PÉREZ, M. DE LOS A., LEÓN DUHARTE, L., PACHECO RAMÍREZ, Y., LANDAZURI YÁNEZ, S., "Highly selective PVC-membrane electrodes based on 5-(4-dimethylamino) benzylidene) Rhodanine for determination of silver ion", Rev. Cub. Quím., 2010, 22(1), 17-21.
21. ARADA PÉREZ, M. DE LOS A., PÉREZ MARÍN, L., CALVO QUINTANA, J., YAZDANI PEDRAM , M., "Influence of different plasticizers on the response of chemical sensors based on polymeric membranes for nitrate ion determination", Sens. Actuat. B., 2003, 89(3), 262-268.
22. DINTEN, O., SPICHGER, U. E., CHANIOTAKIS, N., GEHRIG, P., RUSTERHOLZ, B., MORF, W.E., SIMON. W., "Life-time of neutral carrier based liquid membranes in aqueous samples and blood and the lipophilicity of membrane components", Anal. Chem., 1991, (63), 596-603.
23. KLOPMAN, G., "Chemical reactivity and the concept of charge-and frontier-controlled reactions", J. Am. Chem. Soc., 1968, (90), 223-234.
24. POURBAIX, M. J. N., Atlas of electrochemical equilibrium in aqueous solution, 1er English Edition, Pergamon Press, Oxford, 396 p.
Recibido: 19/04/2015
Aceptado: 03/12/2015
Dra.C. María de los A. Arada-Pérez, Universidad de Oriente, Santiago de Cuba, Cuba, mayarada@uo.edu.cu