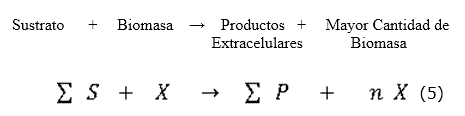Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.2 Santiago de Cuba maio.-ago. 2016
ARTICULOS
Biocatalizadores fúngicos hidrocarbonoclásticos del genero Aspergillus para la descontaminación de agua con Hidrocarburos Policíclicos Aromáticos (HPAs)
Fungal hidrocarbonoclastic biocatalysts of the genere Aspergillus for water descontamination with Polycyclic Aromatic Hydrocarbons(PAHs)
MSc. José AraujoI,II,III, Dr.C. Francisco YegresIV, Dr.C. Guillermo BarretoV, Lic. A. Angel AntequeraI, Lic. Belkys DepoolI, Lic. Yarubit RojasI,II,III
IUnidad de Microbiología Ambiental UNEFM, jaab19@gmail.com
IIUnidad de Biotecnología Ambiental
IIIUnidad de Microscopía Electrónica UNEFM
IVLaboratorio LIADSA/CIB, Universidad Nacional Experimental Francisco de Miranda, Coro, Estado Falcón, Venezuela
VUniversidad de Camagüey "Ignacio Agramonte Loynaz"
RESUMEN
El uso de hongos como catalizadores para la descontaminación del agua es una herramienta útil en la biotecnología ambiental pues permite el desarrollo de tecnologías que pueden ser usadas en la recuperación de ecosistemas acuáticos impactados por hidrocarburos. Se evaluó la capacidad para remover hidrocarburos policíclicos aromáticos (HPAs) del agua con catalizadores fúngicos del género Aspergillus de las especies Aspergillus niger y Aspergillus flavus aislados de La Bahía de Amuay, propagando inóculos que fueron utilizados para medir la capacidad hidrocarbonoclástica determinando el aumento de la biomasa por peso seco y la disminución de la concentración de los HPAs por espectrofotometría en microcosmos. Los catalizadores fúngicos presentaron porcentajes de remoción de 70 %-80 % entre uno y tres meses y 100 % al año. Finalmente, se propone un esquema tecnológico del proceso para la disminución de los pasivos ambientales en base a la química verde.
Palabras clave: Aspergillus niger, Aspegillus flavus, HPAs, biotecnología ambiental, La Bahía de Amuay.
ABSTRACT
The use of fungi as catalysts for the decontamination of water is a useful tool in environmental biotechnology, since it allows the development of technologies that can be used in the recovery of aquatic ecosystems impacted by oil. The ability to remove polycyclic aromatic hydrocarbons (PAHs) from water with fungal catalysts Aspergillus species Aspergillus niger and Aspergillus flavus isolates Bay Amuay, spreading inoculums were used to measure the hidrocarbonoclastic capacity by determining the increase in assessed biomass dry weight and by decreasing the concentration of PAHs microcosms spectrophotometrically. Fungal removal percentages catalysts showed 70 % -80 % between one and three months and 100 % per year. Finally a technological process scheme for reducing environmental liabilities based on green chemistry is proposed.
Keywords: Aspergillus niger, Aspegillus flavus, PAHs, environmental biotechnology, Amuay Bay.
INTRODUCCIÓN
Uno de los retos de la biotecnología ambiental es la recuperación de áreas impactadas con hidrocarburos, promoviendo la restauración de ambientes acuáticos utilizando tratamientos biológicos y desarrollando diversas estrategias con el fin de mejorar la calidad ambiental, de acuerdo con las necesidades y dimensiones del problema [1]. Efectivamente, el crudo de petróleo se caracteriza por ser una matriz energética que contiene una elevada diversidad de compuestos potencialmente contaminantes, la revisión sobre el tema demuestra que la manera más factible de descontaminación del ambiente con respecto al crudo y los derivados del petróleo es la que se lleva a cabo mediante el uso de los métodos basados en la actividad metabólica de microorganismos. Haciendo así mismo a la biodegradación el método más factible, puesto que es menos costoso al ser comparado con los medios físicos, mecánicos y químicos utilizados en la eliminación de contaminantes de hidrocarburos, como el petróleo crudo, el cual es una mezcla compleja de hidrocarburos de origen natural y que poseen fracciones con una toxicidad que puede afectar los sistemas vivos [2].
La dispersión de petróleo en el agua expone diversas partes que conforman a los hidrocarburos en este componente, desde compuestos saturados y aromáticos hastaresinas y asfáltenos. Las primeras fracciones corresponden a cadenas lineales y ramificadas que son susceptibles a degradación por diversos efectos físico-químicos y también por microorganismos; de igual manera, la fracción de resinas y asfáltenos pueden ser removidos con relativa facilidad de medios como el suelo y el agua, pero los hidrocarburos policíclicos aromáticos, a los que se denominarán en adelante (HPAs), son de difícil remoción, considerados contaminantes de interés, tanto para el ambiente como para la salud humana pues son compuestos recalcitrantes y potencialmente carcinogénicos con alta capacidad de bioacumulación en las cadenas tróficas [3]. Investigaciones realizadas sobre la biodegradación microbiana de hidrocarburos presentes en agua, muestran como los HPAs son susceptibles a ser degradados por la flora autóctona microbiana, por lo que son de elección para ser usados en la remoción de estos espacios [4]. Además, dado que las especies de hongos forman parte de la microflora en el agua, es posible establecer el papel individual de los hongos en la degradación de los hidrocarburos policílcicos aromáticos.
Los mayores progresos efectuados en cuanto al entendimiento de las capacidades degradadoras de los hongos del género Aspergillus han sido el resultado de 30 años de observaciones y experimentos [5], entre los que destaca el género Aspergillus quien ha demostrado ser uno de los hongos con capacidad de degradación de hidrocarburos en diversos estudios, de hecho el bioaumento de Aspergillus sp. mejora la velocidad y magnitud de degradación de los hidrocarburos policíclicos aromáticos en comparación con otros microorganismos presentes en un consorcio microbiano [6, 7]. Por otro lado, es uno de los géneros más comunes, aislados del agua en espacios tropicales con varias especies representantes que degradan hidrocarburos policíclicos aromáticos en condiciones de laboratorio. El aporte que brinda esta investigación conduce a utilizar a los hongos autóctonos del género Aspergillus con mayores capacidades de remover HPAs como catalizadores hidrocarbonoclásticos de los HPAs para la disminución de los problemas la presencia de estos en el ambiente marino.
FUNDAMENTACIÓN TEÓRICA
El interés de recuperar áreas impactadas con crudo, ha promovido investigaciones enfocadas hacia la restauración de estas, utilizando catalizadores biológicos [8] . Es por ello que el petróleo se caracteriza por ser un contaminante que contiene una elevada diversidad de compuestos cuya base son polímeros carbonatados, que van desde alcanos o hidrocarburos de cadena lineal saturados, pasando por los cicloalcanos con anillos de carbono que forman a los hidrocarburos aromáticos y los policíclicos aromáticos, hasta aumentar la complicación molecular como las resinas, parafinas y asfáltenos. En total son un conjunto de compuestos carbonados capaces de ser un sustrato ideal para la bioconversión inducida por catalizadores fúngicos que poseen enzimas capaces romper enlaces carbono-carbono por procesos de oxidación, útiles para la biorremediación [7] y descontaminación de matrices como suelo y agua [9].
Hidrocarburos
Se considera como hidrocarburo a una gran familia de compuestos formados por cadenas de átomos de carbono e hidrogeno, con una estructura química disímil la cual determina su clasificación. Estos incluyen a los hidrocarburos alifáticos que básicamente poseen cadenas lineales o ramificadas y pueden encontrase saturados (alcanos) o insaturados (alquenos y alquinos). Otros hidrocarburos poseen una o varias cadenas cíclicas, y pueden ser saturados (ciclo alcanos) o con uno o más anillos bencénicos (aromáticos) [10]. Estos compuestos son abundantes en la naturaleza y posee diversos orígenes pero el de mayor interés para el hombre es el petróleo [11].
Contaminación del agua por hidrocarburos
En la actualidad existen diversas actividades que contaminan el medio marítimo, entre estas pueden encontrarse las que derivan de la actividad petrolera, la cual pueden verter a los espacios acuáticos petróleo crudo o petróleo refinado, diésel, gasolina, kerosén, y otros productos obtenidos por destilación fraccionada y procesamiento químico del petróleo crudo generado, bien sea de forma accidental o deliberadamente. Su origen puede provenir de diferentes fuentes, de buques-tanques, de fugas de los equipos de perforación marina u otra fuente proveniente de tierra firme que es arrojada al suelo en las ciudades y en zonas industriales que, posteriormente, es arrastrada por corrientes fluviales terminando en los diversos cuerpos de agua de gran importancia.
No obstante, es evidente que la contaminación se ha intensificado al mismo ritmo en que se desarrollan las actividades de uso del petróleo como recurso energético con aumento de los transportes marítimos y de las actividades de perforación, lo cual ha provocado el aumento de accidentes ambientales que varían en escala. Uno de los más recientes y nefastos fue el producido en la plataforma Deepwater Horizon en el Golfo de México por una explosión, la cual fue estimada conservadoramente en 800 mil litros de petróleo que fueron vertidos al Golfo de México por lo cual se considerada, actualmente, el accidente de derrame de petróleo más importante después del Exxon Valdez [12].
Hidrocarburos Aromáticos Policíclicos (HAPs) y estructura
La naturaleza de los átomos de carbono propone la posibilidad de poder enlazar su estructura tetraédrica para formar diversos compuestos mediante enlaces entre átomos de la misma especie; esto permite la generación de diversas moléculas que pueden ir saturándose con hidrógenos como átomos periféricos. Trae como resultado cadenas de compuestos hidrocarbonados cuya naturaleza inicial es lineal; sin embargo, la estabilidad de estas cadenas debido a las interacciones moleculares induce sobre estas estructuras la posibilidad de crear figuras geométricas como el rombo de seis puntas de naturaleza aromática el cual se clasifica como una de las estructuras más estables desde las escalas moleculares extrapolándose a otras escalas como se observa en las células de las plantas que poseen estructuras disimiles de seis puntas formando diversos tejidos vegetales con pared celular, en los panales de las abejas, los quelonios de tortugas, entre otras representaciones como el grafeno cuya estructura posee alta flexibilidad y dureza. Esto se debe a que todos estos elementos mencionados poseen una figura matemática y geométricamente compatible consigo misma, de modo que los diversos agregados de estas estructuras generan nuevas estructuras o metaestructuras aún más estables.
Los hidrocarburos policíclicos aromáticos Polycyclic Aromatic Hydrocarbons (HPAs) son un conjunto de compuestos orgánicos formados por carbono e hidrógeno, que se caracterizan por contener dos o más anillos de benceno unidos entre sí, que pueden existir en varias disposiciones isoméricas, y son siempre estructuras polinucleares de tipo aromático (también se les conoce con el nombre de hidrocarburos polinucleares). Un HPA resulta de la fusión de dos moléculas de benceno entre los que se conocen unos 100 miembros diferentes con una elevada cantidad de isómeros y 16 de interés ambiental por la agencia EPA.
Su estructura es estable termodinámicamente, gracias a su resonancia negativa proporcionada por sus seis orbitales p por solapamiento cíclico como elemento fundamental, esto hace que todo compuesto con sistema electrónico p sea catalogado como aromático [13]. En la actualidad, la diversidad geométrica de un compuesto aromático es imitada por los ingenieros y arquitectos para la construcción de estructuras y edificios, es por ello que los hidrocarburos policíclicos aromáticos son tan estables y sus diversas especies son difíciles de degradar por su alta estabilidad. De hecho, no son una forma ajena en el universo, ya el telescopio Spitzer ha permitido detectar la presencia de HAPs en el espacio los cuales son estudiados pasar conocer cómo era el universo cuando este apenas tenía una cuarta parte de su edad actual de alrededor de 14 mil millones de años. Es, además, una de las mayores formas del carbono en el espacio entre las estrellas, ampliamente observadas por los astrónomos dentro de nuestra propia galaxia [14].
Biodegradación de hidrocarburos
Existen varios métodos para la biodegradación de hidrocarburos pero, en general, es posible usar dos métodos para la biodegradación de hidrocarburos. El primero incluye el uso de microorganismos autóctonos, y el segundo consiste en adicionar poblaciones foráneas de microorganismos que son escogidos por sus capacidades de degradar diversas fracciones del petróleo. Este método de siembra de microorganismos requiere que sea agregando una cantidad de inoculo mayor a la biomasa que está presente en el medio para asegurar la supervivencia del inoculo y su efectividad; sin embargo, ha probado ser menos eficiente. Estos procesos pueden ser acelerados al aplicar fertilización y aeración la cual son la base de los procesos de bioaumentación y bioestimulación [15].
Homólogamente, los hongos capaces de degradar la lignina, conocidos comúnmente como ligninolíticos o lignolíticos, también pueden degradar e incluso mineralizar HPAs, pues la lignina es una estructura química presente en plantas que posee anillos aromáticos. Este proceso es posible gracias a un conjunto de enzimas constitutivas e inducibles que logran utilizar estas fuentes de carbono [16-20]. Este tipo de molécula son compuestos complejos formados por anillos aromáticos, en especial los de tipo polinuclear condensados, poseen una degradación más lenta que los alcanos, mientras que los compuestos alicíclicos normalmente no son usados como fuente de carbono para el crecimiento microbiano -bacterias- a no ser que tenga cadenas laterales alifáticas suficientemente largas.
Por otro lado, estos compuestos pueden ser degradados en consorcios y gremios bacterianos, que actúan en cooperación [21]. Sin embargo, no siempre es posible generar la biodegradación y conversión completa de este tipo de compuestos por parte de las bacterias; no obstante, este proceso puede ser realizado por los hongos quienes poseen una mayor maquinaria enzimática con capacidad hidrocarbonoclástica. Este proceso de degradación de los HPAs puede ser acelerado mediante la manipulación de sustratos, del microambiente, y el yergue del estatus aeróbico [22, 23].
Los HPAs en el ambiente
Los HPAs tienen diversos orígenes, básicamente las fuentes de estos se resumen en tres: diagénesis, petrogénica y pirolítica. Los hidrocarburos que se generan por diagénesis son producto de una fuente natural o biosíntesis aunque por esta vía se producen cantidades muy pequeñas de hidrocarburos policíclicos aromáticos, por lo tanto, el aporte al ambiente es minoritario. Los hidrocarburos policíclicos aromáticos generados por el petróleo son de origen petrogénico, estos se generan a temperaturas entre 100 y 150° C, junto a elevadas presiones durante millones de años depositados en sedimentos, la liberación de este tipo de hidrocarburo es producto de actividades antropogénicas.
Los hidrocarburos de origen pirolítico (pirosíntesis o pirólisis) son liberados al ambiente como producto de actividades antropogénicas por la combustión de fósiles, madera y erupciones, entre otros. Este tipo de hidrocarburo es generado por diversos factores tales como altas temperaturas, cantidad de combustible, duración de la combustión y disponibilidad de oxígeno, factores que determinan la naturaleza y el grado de formación de los hidrocarburos policíclicos aromáticos. Una forma de diferenciar a los HPAs de origen pirolítico del petrogénico es que los de origen pirolítico tienden a poseer mayor número de compuestos alquilados debido a la temperatura de formación [24-26]. Tanto las fuentes naturales como las antropogénicas, son de interés ambiental: incendios, erupciones volcánicas, emisiones vehiculares, reacciones catalíticas e industriales, combustibles fósiles, sistemas de cocina con leña, estufa de queroseno y gas butano contribuyen a la liberación de los hidrocarburos policíclicos aromáticos al ambiente [26, 27]. Recientemente se ha demostrado que la combustión para cocinar o calentar es una de las fuentes de emisión más importantes para la producción de HPAs en los países que no son productores de petróleo [28].
Los HPAs están presentes en la atmósfera, litósfera y la hidrósfera, su comportamiento de los HPAs en el ambiente está íntimamente relacionado con las características fisicoquímicas y estructura de cada HPAs. De la misma manera, es posible establecer una relación entre el transporte atmosférico y los sistemas biológicos que son afectados por los HPAs y sus intermediarios [29]. Los HPAs son incluidos como contaminantes de interés prioritario, esto se debe a la peligrosidad intrínseca que presentan por su toxicidad aguda y a la capacidad de efecto teratogénico, mutagénico y carcinogénico que presentan [13, 30, 31].
La deposición atmosférica de los HPAs en espacios específicos de la litósfera puede ser usada para contar parte de la historia de los efectos antropogénicos. Además, en el agua los HPAs se encuentran presentes producto de diversas fuentes, su acumulación, dispersión y distribución es producto de la hidrodinámica, ciclo hidrológico, propiedades fisicoquímicas y origen de formación del cuerpo de agua, entre las que se encuentran las de origen volcánico, aludes o glacial, en esta última, se han encontrado hidrocarburos policíclicos aromáticos de diversas fuentes en especial de origen petrogénico, de hecho eventos del deshielo en cuencas urbanas muestran grandes cantidades de HPAs en aguas superficiales y subterráneas [32]. Un aspecto de interés de los HPAs en el agua, es que tienden a ser hidrofóbicos, y esta propiedad aumenta cuanto mayor es el número de anillos en los HPAs, lo que sugiere que los HPAs de mayor peso molecular suelen reaccionar con la biota por precipitación, mientras que los de bajo peso molecular tienden estar más tiempo en la columna de agua y algunos por su bajo peso molecular pueden volatilizarse. Por otro lado, las temperaturas bajas por debajo de los 30° C, generan un cambio de solubilidad que favorece la adsorción de los HPAs a los sedimentos y las plantas acuáticas, esta tendencia de adsorción a las superficies dificulta su biodegradación, así como su acumulación en la cadena trófica [33-35].
Hongos y su capacidad catalítica hidrocarbonoclástica
La ruptura de enlace carbono-carbono es una propiedad que poseen los hongos para transformar una gran variedad de compuestos orgánicos, logrando su conversión a CO2 y H2O lo que ofrece un gran potencial para ser utilizados en procesos de descontaminación o remoción de agentes contaminantes. Estas características son producto del sistema enzimático pues cuenta con una combinación de enzimas que participan en el proceso como la lignina peroxidasa (LiP), peroxidasa dependiente de Mn (MnP); lacasa, una fenoloxidasa que contiene principalmente cobre, y otras oxidasas como las glioxal oxidasa y superóxidodismutasa [36, 37] la capacidad altamente oxidante de estas enzimas les otorga una considerable capacidad de degradar diferentes compuestos orgánicos polinucleares, así como diversos compuestos xenobióticos que pueden ser transformados por hongos; entre estos se encuentran, fundamentalmente, pesticidas, hidrocarburos aromáticos (benzo-pireno, fenantreno, pireno), compuestos orgánicos clorados (pentaclorofenoles, cloroanilinas, bifenilospoliclorados) azocolorantes,entre otros [38].
Factores que afectan la biodegradación de los contaminantes: la biodegradación es un proceso que requiere de tiempo para el logro de la bioremediación, para ello es necesario tomar en cuenta diversos factores que afectan la biodegradación. Los principales factores que influyen este proceso son los abióticos y bióticos en un tiempo finito en horas, días, meses o años que pueden ser evaluados. Igualmente, los factores abióticos o fisicoquímicos agrupan aquellos que se relacionan con el contaminante (estructura química, concentración y biodisponibilidad) y las condiciones medioambientales (pH, humedad, temperatura, disponibilidad de oxígeno y nutrientes); mientras que los bióticos dependen de los microorganismos (población microbiana y cometabolismo) [21].
Biodisponibilidad: los hidrocarburos son sustratos atractivos para la maquinaria metabólica de los microorganismos porque de ellos es posible extraer carbono y energía a partir de su estructura molecular. Sin embargo, su catálisis y posterior anabolismo está condicionada a la disponibilidad, lo cual requiere que estos pasen al interior de las células transfiriendo su integridad molecular a las células microbianas en procesos metabólicos necesarios para las funciones vegetativas celulares. Por tanto, el término biodisponibilidad se refiere al contacto entre el hidrocarburo que en el ambiente es un contaminante y produce efectos nocivos [39]. Pero para el microorganismo es un sustrato aprovechable que tiene como requisito estar accesibles para su aprovechamiento; esto se logra con la solubilización. Por lo tanto, el aumento de la solubilización del hidrocarburo también aumenta la biodisponibilidad. Si el contaminante a ser biotransformado posee una barrera física o química que impide la introducción de la molécula al interior del microorganismo para ser metabolizado se afirma que la biodisponibilidad es limitada. Si por el contario la molécula puede ser introducida con facilidad al sistema metabólico celular microbiano se considera que la biodisponiblidad es positiva. Sin embargo, un exceso de biodisponibilidad positiva puede aumentar su concentración interior e inducir toxicidad. Una estrategia comúnmente utilizada para aumentar la solubilidad y biodisponibilidad de los contaminantes poco solubles en el sistema de cultivo es la utilización de tensoactivos, de esta manera la molécula orgánica penetra al medio intracelular a través de las micelas del tensoactivo [18], el cual puede ser sintético como: etoxilados, bencenosulfonatos y microbiano (ramnolípidos, lipopéptidos y emulsanos), estrategia que ha sido frecuentemente utilizada en el caso de hidrocarburos.
Estructura química y concentración del contaminante: la naturaleza de los hidrocarburos los hacen ser compuestos orgánicos que varían en complejidad y su biodegradabilidad se debe a que es utilizado por los microorganismos como fuente de carbono [13]. Si el contaminante se encuentra en altas concentraciones su degradación es muy pues a ese nivel es toxico para los sistemas biológicos microbianos. Sin embargo, la posibilidad de dispersión y solubilización son elementos que disminuyen la concentración y, con ello, el aumento a ser propensos para ser biotransformados. Si el sitio de acción o ataque de la enzima degradativa se encuentra bloqueado (isoprenoides o moléculas sustituidas con grupos voluminosos COOH, CH3), la reacción no tendrá lugar, disminuyendo entonces la actividad biodegradativa. Los compuestos alifáticos se degradan fácilmente por oxidaciones sucesivas, pero cuando se incluyen como sustituyentes alcanos de cadena larga se forman estructuras ramificadas estéricamente inaccesibles a la degradación. De la misma forma, los compuestos alifáticos insaturados se degradan más lentamente que los saturados debido al impedimento estérico formado por la nube de hidrógenos. Los compuestos cíclicos y aromáticos se degradan a partir de la ruptura del anillo, pero la incorporación de halógenos disminuye la degradabilidad por estabilización del anillo aromático [13, 40]. De esta manera, la degradación de PCBs (bifenilopoliclorado) es más compleja y mayor aún cuando se encuentra acomplejada con diversos grupos funcionales que hace menos accesible la ruptura de los enlaces carbónicos. Por lo tanto, se tiene el siguiente orden creciente de biodegradación, n-alcanos >isoprenoides> aromáticos de bajo peso molecular > cicloalcanos> poliaromáticos> moléculas polares [40]. Otro aspecto de interés es que en una mezcla de hidrocarburos la degradación sigue el orden SARA, primero son biodegradados hidrocarburos saturados (S), luego los aromáticos (A), y por ultimo las resinas (S) y asfáltenos (A).
Hidrocarburos del petróleo como contaminantes: la transformación anaeróbica de materia orgánica en condiciones elevadas de temperatura y presión originan al petróleo que sale a la superficie por fallas naturales, por lo que siempre ha mantenido contacto con la biosfera. Pero este fenómeno, por lo general, es de baja magnitud al ser comparado con las actividades de extracción de crudo en perforaciones petrolíferas la cual se calcula en 2000 millones de toneladas anuales [41]. Aunque la mayoría de los componentes del petróleo son biodegradables este es un proceso lento. Las actividades de obtención, transporte, refinado y eliminación de residuos arrojan al mar, en estimaciones conservadoras, 3,2 millones de toneladas de petróleo y sus derivados [42]. Esto se concentra, básicamente, en las zonas de extracción en los espacios acuáticos y en las principales rutas de navegación y proximidades de las refinerías. Estas actividades producen vertidos que, en ocasiones, exceden la capacidad de autopurificación del ecosistema local; además, el petróleo que flota en el agua es difícil de contener y de recoger. Y es un contaminante para la biota marina causando graves perjuicios económicos, estéticos sobre la costa. El costo de limpieza de estos vertidos es elevado, y a menudo la limpieza alcanza los 2,5 a 4 millones de dólares por litro de petróleo derramado. Con frecuencia, las condiciones climatológicas impiden la contención y limpieza de la marea negra. La dispersión del petróleo mediante el uso de detergentes, o haciéndolo ir al fondo con caliza o arena siliconada son esencialmente medidas de carácter estético. Estos tratamientos eliminan el petróleo de la superficie pero aumentan la exposición de los organismos marinos al contaminante y, por lo tanto, es mejor evitarlos. La contaminación con petróleo y sus componentes aromáticos alteran la biota marina aun en concentraciones bajas en partes por millón (ppm), pues son capaces de alterar los mecanismos de quimiorrecepción de estos; este efecto es importancia pues la quimiorrecepción es fundamental en la búsqueda de alimento y en la reproducción y generación de nueva prole [43]. Otro efecto de interés es que algunos componentes polinucleados condesados del petróleo son cancerígenos y relativamente resistentes a la biodegradación, y pueden ascender por la cadena trófica, contaminando peces y mariscos [44]. El petróleo es una mezcla compleja de hidrocarburos alifáticos, alicíclicos (estructuras ciclo alifáticas saturadas) y aromáticos. También contienen una menor proporción de compuestos que no son hidrocarburos como ácidos naftalenicos y fenoles, oles, compuestos heterocíclicos de nitrógeno, compuestos de azufre y metaloporfirina, cada tipo de crudo tiene varios cientos de componentes diferentes; la composición además varía según la procedencia del petróleo [45].
Biorremediación y biodegradación
La biorremediación es considerada como la más deseable aproximación a la remediación de ambientes contaminados con el uso de seres vivos en contraste a alternativas más costosas. Estos procesos incluyen tratamientos biológicos de degradación de compuestos que afectan un ambiente; son eficientes y económicos si las condiciones son optimizadas. Es por ello que la biorremediación es el resultado del uso de técnicas que permiten la biodegradación de los contaminantes. De igual manera, la biorremediación incluye la digestión, asimilación y metalización de un compuesto orgánico llevado a cabo por bacterias, hongos, protozoos y otros microorganismos. La biorremediación es una técnica puede ser aplicada in situ, en el lugar donde se encuentra la contaminación, o ex situ, cuando el contaminante es trasladado a una instalación para su tratamiento. La actividad de los organismos presentes en el sitio contaminado se puede favorecer mejorando determinadas condiciones: edáficas, añadiendo nutrientes, agua, oxígeno y modificando el pH. Otra forma es la introducción de nuevas especies para aumentar la concentración de microbiota presente. La biodegradación es un proceso natural, ventajoso no solo por permitir la eliminación de compuestos nocivos impidiendo su concentración, sino que es indispensable para el reciclaje de los elementos en la biosfera, permitiendo la restitución de elementos (carbohidratos, lípidos, proteínas) esenciales en la formación y crecimiento de los organismos [46]. Los microorganismos utilizados pueden ser los ya existentes (autóctonos) en el sitio contaminado o pueden provenir de otros ecosistemas (alóctonos), en cuyo caso deben ser agregados o inoculados [47].
Genero Aspergillus y su capacidad catalítica frente a los HPAs
Las diversas especies de genero Aspergillus pertenecen a la familia Trichocomaceae, en el orden Eurotiales de la clase Eurotimycetes, del Phylum Ascomicota; Reino Fungi, Dominio Eukaria. Descubiertos en 1729 por Antonio Micheli. El nombre "Aspergillum" fue colocado por parecerse el hongo al instrumento usado para dispersar agua bendita. El género Aspergillus comprende unas doscientas especies con gran cantidad de variedades, tienen una distribución amplia en la naturaleza y se encuentran en todo el mundo. Parece adaptarse a un amplio espectro de condiciones ambientales y poseen conidios resistentes a la variación de la temperatura, lo cual le proporcionan un buen mecanismo para su dispersión [1]. Las especies del género Aspergillus se encuentran en la naturaleza con una alta distribución pudiéndose aislar de una gran variedad de substratos. Gracias a la facilidad de dispersión de sus conidios y a su pequeño tamaño, estos pueden permanecer en suspensión en el ambiente durante un largo periodo de tiempo. Estas especies fúngicas poseen crecimiento, las especies se definen con base en las diferencias de la estructura del conidióforo y la disposición de los conidios, tales como el color, la forma y textura de las esporas, lo que han permitido agruparlos en secciones o grupos. Su morfología y el color son características macroscópicas de las colonias a tomar en cuenta para la descripción de las diferentes especies de Aspergillus. Presentan distintos tonos de verde, pardo, amarillo, blanco, gris y negro [1]. Microscópicamente el género se caracteriza por cadenas de conidios pequeños u ovales a esféricas sostenidas en cadenas en las puntas de fiálides radialmente ubicadas sobre la superficie del ápice dilatado del conidióforo, que se denominan vesículas [48].
El género Aspergillus es capaz de utilizar las diversas fracciones de los hidrocarburos desde los TPH hasta las fracciones de resinas y asfáltenos. El género Aspergillus constituye un complejo de especies [1] de las cuales se ha probado sus propiedades para utilizar a los hidrocarburos como fuente de carbono y energía [49]. Este género es común encontrarlo en aguas contaminadas con hidrocarburos [50, 51]. El género Aspergillus es capaz de degradar compuestos derivados del petróleo, como el diésel, gasolina, y kerosén del cual extrae carbono y energía [ 49, 50, 52, 53]. De igual manera, ha probado estar presente como un agente degradador en refinerías y en los sistemas de distribución de diésel [54], así como también ser capaz de degradar el óleo diésel. El género posee altas propiedades para la degradación de crudo y sus fracciones SARA (Saturados, Aromáticos, Resinas y Asfáltenos) [55]. Frente a la fracción de saturados son capaces de generar conversiones en los n-alcanos, 70-84 % en poco tiempo [56] así como isoprenoides y cicloalcanos logrando en esta fracción hasta la máxima degradación comenzando por las cadenas más cortas y livianos siguiendo por las de cadena más larga y ramificados disminuyendo el porcentaje de degradación a medida que aumenta la presencia de sustituciones de metilos [57].
Para la fracción de los aromáticos los representantes de este género son capaces de degradar fenol en 72 horas (58) y diversos HPAs para crecer y utilizar para su metabolismo energético [57]. Algunos estudios muestran que el género Aspergillus es capaz de generar mayores degradaciones con HPAs de alto peso molecular 4-7 anillos [7]. Los hongos del genero Aspergillus poseen propiedades catalíticas con las que es posible degradar compuestos como los HPAs degradando los anillos que constituyen a estos compuestos por medio de enzimas. Este género ha sido encontrado en las primeras fases de extracción y manipulación de petróleo como un microorganismo oportunista capaz de degradar HPAs. Esta capacidad de degradación de HPAs presenta porcentajes de eficiencia que varían entre el 60 y 83 %, en especial para degradar antraceno, las investigaciones sobre la degradación de los HPAs por hongos del género Aspergillus muestran que es un proceso dinámico de incluye adsorción extracelular con implicaciones de compuestos intracelulares, y los productos transformados no muestran aparente toxicidad [4, 56, 59, 60]. Otros reportes del tema han mostrado que miembros del género de Aspergillus pueden producir la conversión de diversos HPAs desde 54 % hasta 73 % [61], e incluso conseguir degradar 100 % de la fracción aromática [49]. De las fracciones del petróleo como las resinas y los asfaltenos se ha aislado al género Aspergillus y, de igual manera, se ha reportado su capacidad para degradar a estos en un rango de 15-28 % y 15-40 % en consorcio con otros hongos [62]. El género Aspergillus, es capaz de utilizar activamente crudo [57, 50] y se encuentra dentro del grupo con mayor capacidad de degradarlo [49, 56, 62].
Las Citocromo P450, es una súper familia de monooxigenasas, que incluyen enzimas clave para los hongos y está presente en el género Aspergillus. Estas pueden estar presentes en las mitocondrias y en reticulo endoplasmático hacia el citosol. El complejo enzimático P450 presente en hongos que permite la oxidación catalítica de HAPs de hecho se han identificado un sistema sensible de seis genes inducibles por HAPs de diversos anillos [63]. En la actualidad se estudia la fracción microsomal con técnicas proteómicas y post-genómicas avanzadas para su uso en la biotransformación que incluye compuestos como los HAPs [64]. Por otro lado, se sugiere que ciertos residuos de amino ácidos juegan un papel clave en el posicionamiento de la región de selectividad específica para la oxidación de los HAPs [63]. Esta región es conocida como "región K" la cual es característica estructural común de HAP cancerígenos [65] y son críticos para la unión entre el sustrato y su oxidación.
MATERIALES Y MÉTODOS
Zona de estudio y toma de muestra
Las especies para el estudio fueron colectadas de en La Bahía de Amuay, la zona se caracteriza por ser un espacio acuático cerúleo donde entran barcos de gran calado, limitando por una zona playera y turística. Por otro lado, existe una zona donde se encuentran manglares en crecimiento de las especies Avicenniagerminans L., que están muy cerca de la zona de estudio. Las muestras fueron seleccionadas en cuatro estaciones mediante el GPS Garmin 60, según las siguientes coordenadas UTM, (E1) 19P368089-1301096; (E2) 19P368403 -1301096; (E3) 19P368701-1300389; (E4) 19P36708-1299912. Se aplicó un muestreo en cuatro estaciones realizando un muestreo aleatorio por triplicado en la línea de costa recolectando las muestras en embaces de vidrio de 125 mL previamente esterilizados para posteriormente ser refrigeradas a una temperatura de 20 °C para los ensayos en el laboratorio.
Aislamiento y caracterización
Los catalizadores fueron aislados a partir de un medio de enriquecimiento Czapek-CzapekDox modificado, a una concentración de K2HPO4 1g, NaNO3 2g, KCl 0,5g, MgSO47H2O 0,5g, FeSO47H2O 0,001g [ 66], esterilizado en autoclave a 121ºC a 1 atmósfera extra de presión, el medio fue ajustando a pH 5,5 con una solución de HCl más la adición de un HPA de referencia, antraceno a 400 ppm diluido n-hexano. Las diversas cepas resultantes fueron utilizadas para la caracterización macro y micromorfológica. Los diversos caracteres fueron agrupados en tablas descriptivas para su análisis y comparación.
Preparación del catalizador
Las diversas cepas aisladas y caracterizadas del genero Aspergillus fueron propagadas por triplicado en medio solido Sabouraud preparado a una concentración de 5 g de peptona de caseína, 5 g de digerido pancreático de tejido animal, 40 g de dextrosa, 15 g de agar bacteriológico 15 g disuelto en un 1 L de agua destilada, a pH 5,6 ± 0,2 a temperatura ambiente 25 °C y, posteriormente, esterilizados por calor húmedo en autoclave a 15 libras de presión a 120 °C, dispensado en envases de vidrio previamente esterilizados de forma inclinada, e incubado a 30 °C por 10 días. Cada envase fue resembrado por el método de estría con asa. De las diversas cepas se colectaron esporas vivaces en una solución salina estéril al 0,9 %; en una pipeta Pasteur, la suspensión de esporas se vació a un matraz tomando 5 mL de estas y aforando a 50 mL con agua destilada, logrando una dilución de 5:50 con un factor de dilución de 10 x, posteriormente se contó la concentración de esporas a través del microscopio aplicando el método de conteo con cámara de Neubauer, se contaron las esporas en la cámara utilizando la dilución adecuada, y la concentración de esporas se determinó aplicando la ecuación 1:
Para determinar el número de esporas por µL-1, se contaron las esporas, y el número resultante fue dividido entre la superficie recontada en cuadro de grupo en 4 cuadrados (4 x 1 mm2) = 4 mm2. La profundidad de la cámara utilizada fue de 0,1 mm y la dilución fue de 5:50. Los valores resultantes fueron ajustados a una concentración deseada, para ello se aplicó la ecuación 2 de balance de masas:
Evaluación de la capacidad carbonoclástica de los catalizadores fúngicos
Se aplicó un ensayo para probar la capacidad de los catalizadores fúngicos de crecer y usar HPA, se probaron varios tratamientos, dos controles positivos como fuente de carbono en medio Czapeck, uno con sacarosa (CS) y otro con glucosa (CG), un control negativo el cual consistió de medio Czapeck sin fuente de carbono (C), de igual manera se prepararon dos tratamientos a los que se les adicionó como fuente de carbono, antraceno a 400 ppm diluido n-hexano, uno en medio Czapeck (CH) y otro en agua destilada de La Bahía de Amuay (CH2O). Para cada tratamiento se sembró por triplicado 0,5 mL de inóculos de Aspergillusflavus y Aspergillus niger por separado, previamente ajustados en tubos de ensayos 16x150 mL con 10 mL en medio líquido, para 8, 15, 30, 90, 180, 360 días incubadas a 30 °C con agitación a 150 rpm en una incubadora marca LAB-LINE modelo AMBI-Hi-LO CHAMBLB.
Determinación de HPAs
El análisis de hidrocarburos se realizó por espectrofotometría, los HPAs totales fueron analizados por el método EPA 418.1 modificado, este se logró con una extracción líquido-líquido con 25 mL con solventes de extracción en un embudo de separación, después de ser agitada la fase acuosa fue separada de la fase orgánica, posteriormente se realizó una segunda extracción con otros 25 mL de solvente, la fase orgánica se evaporó al vacío en un equipo Büchi ® Rotavapor R-205 para obtener una solución concentrada de hidrocarburos que fue posteriormente cuantificada por espectrofotometría según el método normalizado [67].
Análisis matemático del crecimiento fúngico
Se evaluó la cinética de los biocatalizadores determinando, la biomasa o concentración celular y la disminución de HPAs como sustratos, estos datos permitieron el cálculo de la constante de crecimiento de microorganismos en función de la concentración de sustratos (µ) de forma experimental. La eficiencia de degradación se evaluó por el consumo del sustrato calculando el (%) de degradación. Según las ecuaciones 3 y 4:
Propuesta del esquema tecnológico
Se estableció un esquema tecnológico en base al siguiente balance energético (ecuación 5):
Se tomó en cuenta la preparación previa del biocatalizador, y las variables finales para la representación del esquema tecnológico.
Análisis estadístico
Los datos obtenidos de la cinética fueron agrupados en tablas de contingencia, y sometidos a una prueba de varianza. Se consideraron las diferencias significativas cuando el valor de p<0,05 para los datos estudiados. De igual manera, las unidades experimentales, se aplicó un examen mediante la técnica de evaluación multivariada. Esta data fue procesada con un algoritmo aglomerativo de encadenamiento promedio, para establecer un conjunto jerárquico de conglomerados, analizando los cluster y estableciendo diferencias entre las distancias euclideas promedio.
RESULTADOS Y DISCUSIÓN
Caracterización Microbiana
Las diversas muestras colectadas en la zona de estudio nos permitieron aislar y caracterizar cepas fúngicas autóctonas del género Aspergillus. Se aislaron dos especies y tres cepas, dos de Aspergillus flavus y una de Aspergillus niger (tabla 1). Las cepas de Aspergillus flavus presentaron variantes macroscópicas características que oscilaron entre las dos cepas con formas redondas o irregulares al ser evaluadas en placa, con elevaciones en su crecimiento máximo dentro de la placa, se presentaron dos colores superiores verde y amarillo, los cuales son una característica macroscópica distintiva de la especie y micelio de color blanco con reversos incoloros [1]. Las cepas de Aspergillus niger presentaron características macromorfológicas de cuerpos fructíferos elevados con bordes ramificados de color negro característico y distintivito de la especie, presentaron un micelio poco visible con una faz incolora [1], las diversas especies evaluadas del género Aspergillus fueron preparadas como catalizadores fúngicos probando su capacidad carbonoclástica sobre HPAs para el desarrollo de tecnologías que permitan la recuperación de ecosistemas marinos impactados por hidrocarburos policíclicos aromáticos HPAs.
TABLA 1. CARACTERIZACIÓN MACRO Y MICROSCÓPICA DE ESPECIES DE Aspergillus AISLADAS
| N | Cepa | Micromorfología | Macromorfología | |||
| Borde | Elevación | Color | Forma | |||
| 2 | M1234 | Aspergillus niger | Ramificado | Elevado | Negro | Algodonoso |
| 3 | M23 | Aspergillus flavus | Entero | Elevado | Verde | Redondo |
| 5 | M1234 | Aspergillus flavus | Entero | Elevado | Amarillo | Irregular |
Los resultados mostraron caracteres distintivos para el género Aspergillus con estructuras mitospóricas e hifas especializadas o conidioforos, los cuales son las hifas reproductoras. Sobre estas estructuras se encontraron células conidiogénicas que dan origen a esporas asexuales o conidios que son el medio por el cual el hongo se propaga y da origen a otros clones de la misma especie cuando consigue condiciones ambientales y de nutrientes favorables para su crecimiento. Los diversos conidióforos fueron característicos de las especies del género Aspergillus, las cuales fueron unicelulares y poseían tres zonas bien diferenciadas, el estipe, la vesícula y las fiálides.
Todos los aislados presentaron características y tamaños estructurales en sus cuerpos fructíferos propios de cada especie (tabla 2) las cepas de Aspergillus flavus presentaron características morfotaxonómicas microscópicas con cabezas conidialesuniseriadas radiales, vesículas esféricas, con métulas cuya estructura abarcó toda la superficie de la vesícula [1], uno de los aspectos de interés de esta especie es que la identificación de la sección Flavi aún está basada en criterios únicamente morfológico ya que los aspectos de identificación polifásica evidencian diferencias tan pequeñas en las que aún no existe consenso para definirlo como una subespecie o variedad por lo que aún se considera como una especie [70].
TABLA 2. DIÁMETRO DE COLONIAS Y DIMENSIONES ESTRUCTURALES DE LAS ESPECIES DEL
GÉNERO ASPERGILLUS DEL PHYLIM ASCOMYCOTA DEL ORDEN EUROTIALES CARACTERIZADAS
| Característica | A. flavus | A. niger |
| Diámetro de Colonia en Czapeck (mm) | 60-65 | 55-60 |
| Estipe (longitud, µm) | 500-700 | 400-2500 |
| Vesícula (anchura, µm) | 20-45 | 30-75 |
| Métula (µm) | 8-10x5-7 | 12-20x3-6 |
| Fialides (µm) | 8-12x3-4 | 7-10x3-4 |
| Conidios (µm) | 3-6 | 3,5-4,5 |
Las cepas de la especie Aspergillus niger presentaron características microscópicas con cabezas conidialesbiseriadas y totalmente radiales vesícula redonda, y métulas en toda la estructura radial, con conidios globosos y rugosos de color oscuro, su identificación incluye el nombre propuesto por [71] tomando en cuenta que tanto la clasificación como sección Nigri o el complejo de especies A. niger aún sigue basándose en caracteres morfológicos para su distinción. Unos de los aspectos de interés es que dentro del phylun Ascomycota el orden más común es el Eurotiales y dentro de este dentro este orden uno delos géneros con mayor frecuencia de aparición cosmopolita asociada a la degradación de hidrocarburos es el género Aspergillus [49].
Biocatalizadores fúngicos
Los métodos aplicados lograron recuperar esporas viables frescas del genero Aspergillus con cepas de las especies Aspergillus niger y Aspergillus flavus cuyas características son similares a una patente propuesta para catalizadores fúngicos [72]. Estas se suspendieron en una solución isotónica estéril de NaCL la cual se ajustó en 1,5 x106 esporas/ µL-1 escalando su volumen a los diversos tratamientos para cada microcosmo para activar la bioconversión in vivo del catalizador fúngico y propiciar la actividad carbonoclástica sobre los hidrocarburos policíclicos aromáticos (tabla 3).
TABLA 3. CONSTANTE DE CRECIMIENTO DE BIOCATALIZADORES DEL GÉNERO ASPERGILLUS
HIDROCARBONOCLÁSTICOS EVALUADOS MEDIDAS EN M (g/días)
|
| Aspergillus niger | Aspergillus flavus | ||||||||
| Días | C | CS | CG | CH | H20 | C | CS | CG | CH | H20 |
| 15 | 0,000 | 0,019 | 0,006 | 0,007 | 0,010 | 0,001 | 0,007 | 0,072 | 0,058 | 0,126 |
| 30 | 0,000 | 0,010 | 0,031 | 0,037 | 0,022 | 0,001 | 0,041 | 0,072 | 0,055 | 0,084 |
| 90 | 0,000 | 0,015 | 0,022 | 0,024 | 0,019 | 0,000 | 0,024 | 0,038 | 0,034 | 0,049 |
| 180 | 0,000 | 0,021 | 0,032 | 0,034 | 0,016 | 0,000 | 0,032 | 0,047 | 0,041 | 0,059 |
| 360 | 0,000 | 0,021 | 0,031 | 0,041 | 0,024 | 0,000 | 0,034 | 0,049 | 0,044 | 0,061 |
C: Czapeck sin fuente de carbono; CG: Czapeck + glucosa; CS control positivo 1; Czapeck + sacarosa
control positivo 2; CH: Czapeck + HPAs; CH20: Agua de La Bahía de Amuay.
Capacidad carbonoclástica de los catalizadores fúngicos
La evaluación de las velocidades de crecimiento mediante la ecuación cinética empleada para el cálculo de µ en las diversas especies empleadas como biocatalizadores mostró en los controles positivos como valor mínimo 0,010 g.dias-1 y máximo 0,032 g.dias-1 para A. niger. De igual manera, el X fue de 0,007 g.dias-1 como valor mínimo y 0,072 g.dias-1 como valor máximo de µ para A. flavus, Las unidades experimentales presentaron valores mínimo y máximo de 0,007 g.dias-1 y 0,041 g.dias-1 respectivamente para A. niger y 0,041 g.dias-1 y 0,126 g.dias-1 respectivamente para A. flavus. Las máximas velocidades de crecimiento se encontraron entre los 15 a 30 días con un máximo de 0,084-0,126 g.dias-1 equivalentes a la capacidad de degradar los HPA como un sustrato que proporciona fuente de carbono y energía para la producción de biomasa a esta tasa de crecimiento.
Los biocatalizadores presentaron diversos porcentajes de degradación según el tiempo establecido (tabla 4), durante los primeros 8-15 días los porcentajes de degradación fueron superiores al 10 % con una media de 19 % y un punto máximo de 31 % en los hongos evaluados dentro de los microscosmos que contenían agua de La Bahía. Entre los 15-30 días se presentaron porcentajes de degradación superiores al 20 % con una media de 29 % y un máximo de 40 % similares a lo reportado por otros autores [49]. De igual manera entre los 30-90 días se obtuvo porcentajes superiores al 50 % con una media del 61 % y un máximo de 68 % [4, 56, 59, 60, 61] . Las máximas conversiones con mayores rendimientos fueron entre los 90-180 días con porcentajes de degradación con un mínimo de 90 % un promedio de 94 % y un máximo del 95 % entre los 180 y 360 días fue posible la conversión total y remoción total del hidrocarburo dentro de los microcosmos evaluados, estudios similares han mostrado degradaciones desde 72-95 % hasta una 99 % aunque en tiempo disimiles a nuestro estudio [73]. Las especies estudiadas se encuentran dentro de un grupo capaz de generar conversiones carbonoclásticas puesto que la revisión sobre el tema de degradación de hidrocarburos como fuente energética establece entre las especies representativas a del género Aspergillus. Varios estudios demuestran que Aspergillus niger es capaz de degradar con facilidad HPAs [74, 75] y como especie es utilizada como un catalizador de interés en la industria clasificada como GRAS ( Generally Regarded As Safe ) por su amplia capacidad enzimática. De hecho es posible encontrar a A. niger con capacidad de degradar diversos tipos de HPAs. [73]. De igual manera, Aspergillus flavus se probado ser capaz de degradar diversos tipos de hidrocarburos [76], incluyendo la fracción aromática [49].
TABLA 4. PORCENTAJE DE DEGRADACIÓN DE HPAS DE LOS BIOCATALIZADORES HIDROCARBONOCLÁSTICOS
|
| Aspergillus niger | Aspergillus flavus | ||
| Días | CH | H20 | CH | H20 |
| 8-15. | 14 | 31 | 17 | 13 |
| 15-30 | 24 | 40 | 30 | 23 |
| 30-90 | 62 | 52 | 68 | 63 |
| 90-180 | 95 | 90 | 94 | 95 |
| 180-360 | 100 | 100 | 100 | 100 |
CH: Czapeck + HPAs; CH20: Agua de La Bahía de Amuay.
Los catalizadores del género Aspergillus probados en los diferentes tratamientos mostraron ser capaces de crecer en presencia de carbono de diferente procedencia. Al evaluar el aumento de transferencia de carbono en el proceso de biocátalisis fúngica se evidencia que las cepas de Aspergillus niger [A] y Aspergillus flavus [B], (figura 1) incorporaron a su biomasa el carbono presente en el medio de cultivo. Ambos microcosmos mostraron crecimientos consistentes con el modelo de crecimiento exponencial o Ley de Malthus. Los controles positivos en Czpeck con sacarosa y glucosa presentaron aumentos en la biomasa y no presentaron diferencias estadísticamente significativas; sin embargo, estos siempre estuvieron con valores superiores a las unidades experimentales evaluadas, pues este tipo de carbono es más accesible y su uso solo requiere de enzimas constitutivas. Las unidades experimentales estuvieron por debajo de esta, puesto que este tipo avidez es producto de la activación molecular de señalización para enzimas inducibles. El control negativo en medio Czapeck sin fuente de carbono no presentó aumento de biomasa. El estudio metabólico sobre el uso de estos carbohidratos por el género Aspergillus y las cepas estudiadas propone el aprovechamiento de los carbohidratos según su concentración y la capacidad de inducir comportamientos de represión y activación catabólica, que impulsan rutas anapleróticas para su uso [77, 78] lo que permite desplazar el control de la glucolisis para su aprovechamiento desde la ingeniería metabólica.
Los tratamientos para las unidades experimentales evaluadas presentaron valores de yergue en la biomasa y comportamiento similares a los controles positivos quienes incorporaron carbono disponible del que se propone sea de la fuente proporcionada la cual fue de los HPAs presentes en el medio. Esto es posible ya que el género Aspergillus posee un conjunto de oxidasas que le permiten la transformación de compuestos aromáticos como los HPAs presentes unidades experimentales de Czapeck con hidrocarburos (CH) y agua de La Bahía (CH2O) los cuales presentaron crecimientos durante el tiempo establecido similar a lo reportado por [49, 62] de hecho la actividad oxigenasa de Aspergillus sobre los HPA aumenta su actividad cuando es mayor el número de anillos en los hidrocarburos con un orden de actividad de benceno < antraceno < fenantreno < pireno. Este tipo de actividad enzimática tiene como primer paso asimilatorio la formación de moléculas intermediarias donadoras de electrones conocidas como sustratos de partida la cuales son donadores de electrones estas son el catecol, protocatecuato y el gentisato [79, 80, 81] que son transformados por degradación aerobia por las oxigenasas que incorporan el carbono al ciclo de Krebs, por medio de succinato, acetil-CoA, piruvato o bajo una vía glucolítica anaplerótica [82], que incluye la obtención de energía a partir de los HPA [57] en reacciones de óxido-reducción de la cadena respiratoria la cual constituye el principio bioquímico de la biorremediación [83].
Este estudio (figura 2) demuestra como disminuye la concentración de los hidrocarburos HPAs e inversamente proporcional aumenta la biomasa de los biocatalizadores. Entre los 8-15 se evidencia una dinámica de fase de adaptación típica a partir de 15 hasta 180 se evidencia una fase típica de crecimiento exponencial de la biomasa. De igual manera, se evidencia que las mayores degradaciones fueron entre los 90 y 180 días consistente con otras investigaciones que tratan sobre el tema, la cual propone la influencia del tiempo en el resultado lo que relaciona estos datos con la capacidad máxima de adaptación con aumento de biomasa y constante de crecimiento (tabla 4) así como la disminución de la concentración de los HPAs como sustrato [49]. Los resultados obtenidos son consistentes con el modelo no estructurado de crecimiento en el cual se relaciona el aumento de la biomasa del microorganismo y con la variación de la concentración del sustrato, el cual suele ser limitante [75]. Se presenta una correlación directa con la Ley de Malthus [68] (ver ecuación 3) en el que se describe un crecimiento balanceado en el que fue posible describir el sistema en el que existe un consumo del sustrato y un aumento de la biomasa, sin embargo este sistema no puede describir la fase estacionaria y solo es útil para los sistemas naturales donde la disponibilidad de sustrato tiende a ser ilimitada para el sistema.
El uso del carbono proveniente de los HPAs es producto de la escisión del anillo aromático el cual es usado como fuente de carbono [84] disminuyendo su presencia dentro de los microcosmos evaluados y su disminución es equivalente a la descontaminación de matrices como el agua la cual es el más conspicuo vehículo de este tipo de contaminante de interés ambiental por su parcial insolubilidad lo que lo hace persistente en esta matriz y capaz de incorporarse a las cadenas tróficas, ya que posee características químicas que le permiten unirse a los tejidos celulares y ser capaz de producir efectos teratogénicos y mutagénicos, que conducen a efectos para la salud en los seres humanos, por lo que pueden provocar cáncer [3]. No obstante, son capaces de generar efectos en los puntos de acceso a disruptores endocrinos causando efectos sobre la salud reproductiva [63]. Nuestros resultados muestran una evaluación de la cinética microbiana ya que las unidades experimentales presentaron como única fuente de carbono al hidrocarburo (HPAs) el cual dentro del sistema es el sustrato limitante que al disminuir en el cultivo también afecta directamente el crecimiento generando limites según su disponibilidad por lo que es posible evaluar los aspectos experimentales.
A través del análisis multivariado de los componentes principales y análisis de cluster. Se estructuraron jerarquías por similitud que dimensionaron las variables, se destaca la formación de dos grandes grupos compuestos en el dendograma o árbol binario (figura 3) entre el aumento de la biomasa y la degradación de los HPAs estos dos grupos heterogéneos poseen una variabilidad interna homogénea con reconocimiento de patrones. Cada rama posee dos nodos diferenciados entre la biomasa y la degradación de HPAs.
Esquema tecnológico
Entre los fenómenos básicos a tener en cuenta en el caso de transformaciones microbianas son destacables la transferencia de materia entre las fases del sistema.
Al determinar los valores de aumento de biomasa y disminución de HPAs se obtuvo un balance de materia que permitió establecer las condiciones del esquema tecnológico. El sistema tecnológico se establece en función de los elementos de entrada y salida en el flujo del proceso a partir de los resultados obtenidos y complementado con la bibliografía consultada. Esto permite establecer las fases de interés y para la preparación del biocatalizador y establecimiento de sus propiedades biocatalíticas el biotratamiento y separación entre el aumento de la biomasa y la descontaminación del agua con HPAs. En la figura 4 se describe el proceso de descontaminación aplicando biocatalizadores fúngicos de género Aspergillus.
CONCLUSIONES
Los hongos filamentosos del género Aspergillus se desarrollan en ambientes donde la fuente de carbono es de difícil acceso y proviene de compuestos recalcitrantes debido a la extraordinaria capacidad de adaptarse a los cambios ambientales utilizando su maquinaria enzimática la cual es útil para hacer disponibles compuestos tóxicos, exógenos y xenobióticos, por lo que son capaces de crecer en ambientes donde están presentes los HPAs y juegan un papel de interés en la mineralización de este tipo de contaminante ambiental. Es por esto que son una elección para generación de tecnologías que permitan la catálisis de reacciones carbonoclásticas para la remoción y descontaminación de matrices como los cuerpos de agua. Los catalizadores hidrocarnoclásticos utilizados son efectivos para la descontaminación de aguas contaminadas con HPAs. Se propone el aislamiento e inmovilización de las enzimas hidrocarbonoclásticas para procesos de biorremediación a gran escala.
REFERENCIAS BIBLIOGRÁFICAS
1. SAMSON, R. A., VARGA, J. Aspergillus systematics in the genomic era, CBS Fungal Utrecht: Biodiversity Centre, 2007, ISBN: 978-90-70351-69-4.
2. LEAHY, J. G., COLWELL, R. R., "Microbial degradation of hydrocarbons in the environment", Microbial Reviews, 1990, 54(3), 427–450.
3. VIVES, I., JOAN, O., GRIMAL, T., GUITART, R., "Los Hidrocarburos aromáticos policìclicos y la salud Humana", Apuntes de Ciencia y Tecnología, 2001, 3(2), 45-51.
4. GUIRAUD, P., BONNET, J. L., BOUMENDJEL, A., KADRI-DAKIR, M., DUSSER, M., BOHATIER, J., STEIMAN, R., "Involvement of Tetrahymenapyriformis and selected fungi in the elimination of anthracene, and toxicity assessment of the biotransformation products", Ecotoxicol Environ Saf., 2008, 69(2), 296-305.
5. SYED, K., DODDAPANENI, H., SUBRAMANIAN, V., LAM, Y. W., YADAV, J. S., "Genome-to-function characterization of novel fungal P450 monooxygenases oxidizing polycyclic aromatic hydrocarbons (PAHs)", Biochemical and biophysical research communications, 2010, 399(4), 492-497.
6. JUHASZ, A. J., NAIDU, R., "Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: a review of the microbial degradation of benzo[a]pyrene", International Biodeterioration& Biodegradation, 2000, (45), 57-88.
7. SILVA, I. S., SANTOS EDA, C., MENEZES, C. R., FARIA, A. F., FRANCISCON, E., GROSSMAN, M., DURRANT, L. R., "Bioremediation of a polyaromatic hydrocarbon contaminated soil by native soil microbiota and bioaugmentation with isolated microbial consortia", Bioresour Technol., 2010, 100(20), 4669-75.
8. BOURQUIN, A. I. W., "Biorremediation of Hazardous Materials Control", Enviromental Progress, 1989, 2(5), 17-24.
9. GONZALEZ MARTIN, M. J., "Tratamientos biológicos de suelos contaminados: contaminación por hidrocarburos. Aplicaciones de hongos en tratamientos de biorrecuperacion", Rev Iberoam Micol., 2004, (21), 103-120.
10. MORRISON, R. T., BOYD, R. N., Química orgánica, México D.F., Fondo educativo interamericano, 1985.
11. CRISPIN, R., SUMMERLIN, L., Química, México, Publicaciones, Cultura, 1998.
12. BEATON, L., Continúa el Derrame de Petróleo en el Golfo de México, Prensa Latina, publicado el 4 de mayo de 2010, consultado el 23 de noviembre de 2014, disponible en línea http://www.prensalatina.cu/index.php
13. VIÑAS, M., Biorremediación de suelos contaminados por hidrocarburos: caracterización microbiológica, química y ecotoxicológica, tesis doctoral, Universidad de Barcelona, 2007.
14. SAGAN, C., Un Punto Azul Pálido Una visión del futuro humano en el espacio, 7ma edición, Barcelona, Editorial Planeta, 2006, p. 429.
15. ATLAS RONALD, M ., "Bioremediation of petroleum pollutants", International Bioterioration and Biodegradation, USA, Department of Biology, University of Louisville., 1995, 35(1-3), 317-327.
16. BUMPUS, J. A., TIEN, M., WRIGHT, D., AUST, S. D., "Oxidation of persistent environmental pollutants by a white rot fungus", Science, 1985, 228(4706), 1434-1436.
17. BUMPUS, J. A., "Biodegradation of polycyclic aromatic hydrocarbons by Phanerochaete chrysosporium", Appl. Environ. Microbiol., 1989, (55), 154-158.
18. CERNIGLIA, C. E., "Fungal metabolism of polycyclic aromatic hidrocarbons: past,present and futire applications in bioremediation", J Ind Microbiol Biotechnol, 1997, (19), 324-333.
19. HAMMEL, K. E., GAI, Z, GREEN, B., MOEN, M. A., "Oxidative degradation of phenanthrene by ligninolytic fungus Phanerochaete chrysosporium", Appl. Environ. Microbiol., 1992, (58), 1832-1838.
20. SUTHERLAND, J. B., "Detoxification of polycyclic aromatic hydrocarbons by fungi", J. Ind. Microbiol., 1992, (9), 53-62.
21. ATLAS, R., "Microbial "Degradation of Petroleum Hydrocarbons: An Environmental Perspective", Microbial Rev., 1981, 45(1), 180-209.
22. XU, R., OBBARD, J., "Biodegradation of polycyclic aromatic hydrocarbons in oil- contaminated beach sediments treated whit nutrient amendments", Journal of Environmental Quality, 2004, (33), 861-867.
23. XU, Y., LU, M., "Bioremediation of crude oil-contaminated soil: comparison of different biostimulation and bioaugmentation treatments", J Hazard Mater., 2010, 15(1-3), 395-401.
24. MARINOS PEÑA, A., MORALES, J., LABASTIDAS, C., CAPELLA, S., "Extracción en fase sólida como una alternativa para el procedimiento de limpieza en la determinación de hidrocarburos aromáticos policíclicos por cromatografía de gases: aplicación a organismos", Rev. Int. Contam. Ambient., 2003, 19(1), 13-23.
25. TANGUAY, QIAOXIANG DONG, CHANGJIANG HUANG, "Polycyclic aromatic hydrocarbons in water, sediment, soil, and plants of the Aojiang River waterway", in WENZHOU; JIANWANG, LI.; XU, SHANG.; ZHIXU; ZHAO.; ROBERT, L., China, Journal of Hazardous Materials, 2010, 173(1), 75–81.
26. LAU E.V., GAN, S., NG, H. K., "Extraction Techniques for Polycyclic Aromatic Hydrocarbons in Soils", International Journal of Analytical Chemistry, 2010.
27. IWEGBUE, C. M., "Polycyclic aromatic hydrocarbons profile of kitchen dusts", Bull Environ ContamToxicol, 2011, 86(3), 298-301.
28. RUSSELL, A. G., "Emissions of PAHs from Indoor Crop Residue Burning in a Typical Rural Stove: Emission Factors, Size Distributions, and Gas-Particle Partitioning", in SHEN, G., WANG, W., YANG, Y., DING, J., XUE, M., MIN, Y., ZHU, C., SHEN, H., LI, W., WANG, B., WANG, R., WANG, X., TAO, S., Environ. Sci. Technol, 2011, 45(4), 1206–1212.
29. SIMONICH, S. L., MOTORYKIN, O., JARIYASOPIT, N., "PAH intermediates: Links between the atmosphere and biological systems", ChemBiol Interact., 2011, 129(1-2), 6-29.
30. LI, H., JÖNSSON, B.A., LINDH, C.H., ALBIN, M., BROBERG, K., "N-nitrosamines are associated with shorter telomere length", Scand J Work Environ Health, 2011, 3(15), 31-50.
31. BIN, P., LENG, S.G., CHENG, J., PAN, Z.F., DUAN, H.W., DAI, Y.F., LI, H.S., NIU, Y., LIU, Q.J., LIU, Q., ZHENG, Y.X., "Association between telomere length and occupational polycyclic aromatic hydrocarbons exposure", ZhonghuaYuFangYiXueZaZhi, 2010, 44(6), 535-8.
32. MEYER, T., LEI, Y.D., WANIA, F., "Transport of polycyclic aromatic hydrocarbons and pesticides during snowmelt within an urban watershed", Water Res, 2011, 45(3), 1147-56.
33 .CLEMENTS, W. H., ORIS, J. T. Y WISSING, T. E., "Accumulation and food chain transfer of fluoranthene and benzo(a)pyerene in Chironomusriparus and Lepomismacrochirus", Arch Environ Contam Toxicol., 1994, 26(1), 261-266.
34. GUO, W., PEI, Y., YANG, Z., WANG, C., "Assessment on the distribution and partitioning characteristics of polycyclic aromatic hydrocarbons (PAHs) in Lake Baiyangdian, a shallow freshwater lake in China", J Environ Monit., 2011, 13(3), 681-688.
35. WANG, L., YANG, Z., NIU, J., "Temperature-dependent sorption of polycyclic aromatic hydrocarbons on natural and treated sediments", Chemosphere, 2011, 82(6), 895-900.
36. DE LORENZO, V., "Designing microbial systems for gene expression in the field", Trends in Biotechnol., 1994, (2), 365-371.
37. MINOWA, T.S., YOKOYAMA, T., OKAKURA, "Oil production from algal cells of Dunaliella tertiolecta by direct thermochemical liquefaction", Fuel, 1995, (74), 1735-1738.
38. BEZALEL, L.Y., HADAR, C. E., CERNIGLIA, "Mineralization of polycyclic aromatic hydrocarbons by the white rot fungus Pleurotus ostreatus", Appl Environ Microbiol., 1996, (62), 292-295.
39. MAHRO, B., Biotechnology, Environmental Processes II, Soil Descontamination, 2000, p. 63-87.
40. LEAHY, J.G., COLWELL, R.R., "Microbial degradation of hydrocarbons in the environment", Microbial Reviews, 1990, 54(3), 427–450.
41. ABRAHAM, W. R., B. NOGALES, P. N., GOLYSHIN, D. H., PIEPER, Y K., N. TIMMIS., "Polychlorinated biphenyl-degrading microbial communities in soils and sediments", Curr Opin Microb., 2002, 5(3), 246-53.
42. LINDSTROM, J. E., R. C. PRINCE, J. C., CLARK, M. J., GROSSMANN T. R., YEAGER, "Microbial populations and hydrocarbon biodegradation potentials in fertilized shoreline sediments affected by the T/V Exxon Valdez oil spill", Appl.Environ. Microbiol., 1991, (57), 2514-2522.
43. BARTHA, R., ATLASR. M., "The microbiology of aquatic oil spills", Appl. Microbiol, 1977, (22), 225266.
44. CARMICHAEL, L., PFENDER, M F. K., "The effect of inorganic and organic supplements on the microbial degradation of phenanthrene and pyrene in soils", Biodegradation, 1997, (8), 1-13.
45. BAKER, K. H., et al., Bioremediation of surface and subsurface soils. Bioremediation, New York, McGraw-Hill, 1994.
46. GARBISU, C., AMEZABA, L., ALKOTA, L., Biorremediación y ecología de ecosistemas, 2002.
47. MADIGAN, M.T., MARTINKO, J.M., PARKER, J., Brock Biology of Microbiology, New Jersey, Pearson Education Inc, 2003.
48. KONEMAN, E., ROBERT, G., Micología Práctica de Laboratorio, tercera edición, Medica Panamérica, 1987.
49. PERNÍA, B., DEMEY, J., INOJOSA, Y., NARANJO, L., "Biodiversidad y potencial hidrocarbonoclastico de hongos aislados de crudo y sus derivados: Un meta-análisis", Rev. Latinoam. Biotecnol. Amb. Algal., 2012, 3(1), 1-40.
50. SALMANOV, M., ALIYEVA, S., VELIYEV, M., BEKRASHI, N., "The study of degradation ability of oil products and oil hydrocarbons by microscopic fungi isolated from polluted coastal areas of Absheron Peninsula of Caspian Sea", Ekoloji, 2008, 59-64.
51. OKERENTUGBA, P.O., EZERONYE, O.U., "Petroleum degrading potentials of single microbial cultures isolated from rivers and effluent in Nigeria", Afr J Biotechnol., 2003, 2(9), 288-292.
52. SARATALE, G., KALME, S., BHOSALE, S., GOVINDWAR, S., "Biodegradation of kerosene by Aspergillus ochraceus ", J Basic Microb., 2007, (47), 400–405.
53.GAYLARDE, C.C., BENTO, F.M., KELLEY, J., "Microbial contamination of stored hydrocarbon fuels and its control", Rev Microbiol., 1999, (30), 1-10.
54. BENTO, F.M., GAYLARDE, C.C., "Biodeterioration of stored diesel oil: Studies in Brazil", Int Biodeter Biodegr., 2001, (47), 107–112.
55. OUDOT, J., "Rates of microbial degradation of petroleum components as determined by computerized capillary gas-chromatography and computerized mass-spectrometry", Mar. Environ. Res., 1984, (13), 277-302.
56. SÁNCHEZ, O., FERRERA. I., VIGUÉS. N., GARCIA DE OTEYZA, T., GRIMALT, J.O., MAS, J., "Presence of opportunistic oil-degrading microorganisms operating at the initial steps of oil extraction and handling", IntMicrobiol, 2006, 9(2), 119-24.
57. CHAILLAN, F., LEFLECHE, A., BURY, E., GRIMONT, P., SALIOT, A., OUDOT, J., "Identification and biodegradation potential of tropical aerobic hydrocarbon-degrading microorganisms", Research in Microbiology, 2004, (155), 587-595.
58. PASSOS, C. T., BURKERT, J. F., M. KALIL, S. J., BURKERT, C. A. V., "Biodegradação de fenol por uma nova linhagem de Aspergillus sp. Isolada de um solo contaminado do Sul do Brasil", Química Nova, 2009, XY(00), 1-5.
59. QIANG, J., YIN, H., PENG, H., YE, J.S., QIN, H.M., HE, B.Y., ZHANG, N., "Aspergillus fumigatus A10 and its degradation characteristics", KeHuanJingXue, 2009, 30(5), 1298305.
60. YE, J.S., et al., "Biodegradation of anthracene by Aspergillus fumigatus", J Hazard Mater., 2011, 185(1), 174-181.
61. ACEVEDO, F.; PIZZUL, L.; CASTILLO, M.D.; GONZÁLEZ, M.E.; CEA, M.; GIANFREDA, L.; DIEZ, M.C., "Degradation of polycyclic aromatic hydrocarbons by free and nanoclay-immobilized manganese peroxidase from Anthracophyllum discolor", Chemosphere, 2010, 80(3), 271-278.
62. NARANJO, L.; URBINA, H.; DE SISTO, A.;, LEON, V., "Isolation of autochthonous non-white rot fungi with potential for enzymatic upgrading of Venezuelan extra-heavy crude oil". Biocatal Biotransfor, 2007, 25, 1-9.
63. SYED, K.; POROLLO, A.; LAM, Y. W.; YADAV, J. S., "A fungal P450 (CYP5136A3) capable of oxidizing polycyclic aromatic hydrocarbons aniorred endocrine disrupting alkylphenols: role of Trp129 and Leu324", PloS one, 2011, 6, 12, p. e28286.
64. SVOBODOVÁ, K.; MIKESKOVÁ, H.; PETRÁCKOVÁ, D., "Fungal microsomes in a biotransformation perspective: protein nature of membrane-associated reactions", Applied microbiology and biotechnology, 2013, 97(24), 10263-10273.
65. BRUICE, PY.; BRUICE, TC.; DANSETTE, PM.; SELANDER, HG.; YAGI, H., "Comparison of the mechanisms of solvolysis and rearrangement of K-region vs. non-K-region arene oxides of phenanthrene. Comparative solvolytic rate constants of K-region and non-K-region arene oxides". J Am Chem Soc., 1976, 98, 2965–2973.
66. CASAS, R. Micologia General. Caracas- Venezuela: Ediciones de la Biblioteca de la Universidad Central de Venezuela, 24, 1, p. 430-439.1994.
67. DE LA GARZA, L. Biodegradación de altas concentraciones de benzo(a)pireno como única fuente de carbono y energía por Aspergillus terreus en cultivo sólido. México: Tesis Doctoral Universidad Autónoma Metropolitana, p. 131. 2005.
68. TREFIL, J. S. The nature of science: An AZ guide to the laws and principles governing our universe. Houghton Mifflin Harcourt, 2003.
69. APHA. Standard Methods for the examination of water and wastewater. 20th ed. s.l.: APHA-AWWA-WEF, 1998.
70. KURTZMAN, CP.; SMILEY, MJ.; ROBNETT, CJ.; WICKLOW, DT., "DNA relatedness among wild and domesticated species in the Aspergillus flavus group", Mycologia, 1986, 78, 955–959.
71. KOZAKIEWICZ, K., "Aspergillus species on stored products", Mycological Papers, 1989, 161, 1–188.
72. LEÓN, V.; CÓRDOVA, J.; MUÑOZ, S.; DE SISTO, A.; NARANJO, L. Process for the upgrading of heavy crude oil, extra-heavy crude oil or bitumens through the addition of a biocatalyst. 20070231870 United States Patent Application, 2007.
73. CORTÉS-ESPINOSA, D.; ABSALÓN, EA. "Phenanthrene Removal from Soil by a Strain of Aspergillus niger Producing Manganese Peroxidase of Phanerochaete chrysosporium". p. 18, 2013.
74. BAMFORTH, S.; SINGLETON, I., "Bioremediation of polycyclic aromatic hydrocarbons: current knowledge and future directions", J Chem Tech Biotechnol, 2005.
75.WUNDER, T.; KREMER, S.; STERNER, O.; Y ANKE, H., "Metabolism of the polyciclic aromatic hydrocarbon pyrene by Aspergillus niger SK 9317", Appl Environ Microbiol, 1994, 42, 636–641.
76. ADEKUNLE, A.A.; OLUYODE, T. F., "Biodegradation of crude petroleum and petroleum products by fungi isolated from two oil seeds (melon and soybean)", J Environ Biol, 2005, 26(1), 37-42.
77. AGUILAR, C. N.; AUGUR, C.; FAVELA-TORRES, E.; VINIEGRA-GONZÁLEZ, G., "Production of tannase by Aspergillus niger Aa-20 in submerged and solid-state fermentation: influence of glucose and tannic acid", Journal of Industrial Microbiology and Biotechnology, 2001, 26(5), 296-302.
78. TORRES, N. V., "Modeling approach to control of carbohydrate metabolism during citric acid accumulation by Aspergillus niger: I. Model definition and stability of the steady state", Biotechnology and bioengineering, 1994, 44(1), 104-111.
79. SUBBA RAO, P.V.; MOORE, K.; TOWERS, G.H.N., "o-Pyrocatechuic acid carboxy-lyase from Aspergillus niger", Arch Biochem Biophys, 1967, 122, 466–473.
80. RAMACHANDRAN, A.; SUBRAMANIAN, V.; SUGUMARAN, M. VAIDYANATHAN, C.S., "Purification and properties of pyrocatechuate decarboxylase from Aspergillus niger", FEMS Microbiol Lett, 1979, 5, 421–425.
81. SANTHA, R.; SAVITHRI, H.S.; RAO, A.; VAIDYANATHAN, C.S., "2,3-Dihydroxybenzoic acid decarboxylase from Aspergillus niger. A novel decarboxylase", Eur J Biochem, 1995, 230, 104–110.
82. SAN MARTÍN, Y. B., "Biorremediación: una herramienta para el saneamiento de ecosistemas marinos contaminados con petróleo", Biotecnología Aplicada, 2011, 28(2), 60-68.
83. HÄGGBLOM M, VALO R., et al., Bioremediation of chlorophenol wastes. Microbial transformation and degradation of toxic organic chemicals. New York : John Wiley & Sons, 389-434,1995.
84. ROZALSKA, S.; SZEWCZYK, R.; DLUGONSKI. J., "Biodegradation of 4-n-nonylphenol by the non-ligninolytic filamentous fungus Gliocephalotrichum simplex: A proposal of a metabolic pathway", J Hazard Mater, 2010, 180, 323–331.
Recibido: 30/07/2015
Aceptado: 14/12/2015
MSc. José Araujo, Unidad de Microbiología Ambiental UNEFM, jaab19@gmail.com