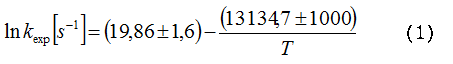Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.3 Santiago de Cuba dez. 2016
ARTICULOS
Descomposición térmica del diperóxido ácido de glutaraldehído en metanol, parámetros de activación y mecanismo de reacción
Thermal Decomposition of the Peroxide acid Glutaraldehyde in Solution of Methanol, Activation Parameters and Reaction Mechanism
Dra.C. Nelly Lidia Jorge-RodriguezI; Dr.C. Jorge Marcelo Romero-PáezI; Lic. Mariela Profeta–Lo MenzoI; Lic. Mónica Beatriz Reguera–MirandaII
IFacultad de Ciencias Exactas, Naturales y Agrimensura, Universidad Nacional del Nordeste, Argentina, nelly.jorge@gmail
IIUniversidad Nacional del Chaco Austral, Argentina
RESUMEN
En este trabajo se informan los resultados obtenidos en el estudio de la descomposición térmica del diperóxido ácido de glutaraldehído (DPAG) en solución de metanol para determinar los parámetros de activación correspondientes y dilucidar el mecanismo de reacción; este tipo de compuesto ha tomado importancia actualmente pues se ha comprobado que tienen acción farmacológica como bactericida, antitumoral y como antimalárico. La reacción se realizó entre 130,0 - 166,0 ºC y a concentración inicial de 5,49 x 10-4 mol/L, la misma cumple con una ley cinética de primer orden hasta conversiones del peróxido de ca. 50 %. El análisis de los productos de reacción y los valores del parámetro de activación contribuye a postular que el mecanismo para la termólisis del DPAG en solución de metanol comienza con la ruptura homolítica del enlace peroxídico produciendo un intermediario birradical, que sufre una ruptura CO resultando ácido glutárico y oxígeno.
Palabras clave: diperóxido, termólisis, mecanismo de reacción, activación.
ABSTRACT
This paper presents the results obtained in the study of the thermal decomposition of diperoxide acid glutaraldehyde (DPAG) in methanol solution, to determine the parameters for activation and elucidate the reaction mechanism; the importance of this type of compound is because it has now been found to have pharmacological action as bactericidal, antitumour and as antimalarials. The reaction was carried out between 130.0 to 166.0 °C and initial concentration of 5.49 x 10-4 mol/L, it satisfies with a first order kinetic law to conversions peroxide ca. 50 %. Analysis of the reaction products and the parameter values activation contributes to postulate that the mechanism for thermolysis of DPAG in methanol solution begins with the homolytic cleavage of the peroxidic bond giving a biradical intermediate, which undergoes CO rupture giving glutaric acid and oxygen as final products.
Keywords: diperoxide, thermolysis, reaction's mechanisms, activation.
INTRODUCCIÓN
El Plasmodium Falciparum es un protozoo parásito, una de las especies del género plasmodium que causa malaria en los humanos. Es transmitida por los mosquitos Anopheles. La prevención y cura de la malaria depende de un número limitado de drogas. Aparte del producto natural quinina, las drogas sintéticas son derivadas de la quinolina tales como, la primaquina, la cloroquina y la mefloquina. Desafortunadamente, estos remedios tradicionales no son adecuados. La incidencia de la malaria por el parásito Plasmodium Falciparum, la especie más peligrosa, continúa creciendo.
En este trabajo se presenta la síntesis y los resultados del estudio de la descomposición térmica en metanol (Me(OH) del diperóxido ácido de glutaraldehído (3,6-dibutanoico - 1, 2, 4, 5-tetroxano o DPAG) (figura 1), un miembro del grupo de los diperóxidos, con propiedades determinantes para ser usado como un precursor para la preparación de un probable antimalárico. Por lo tanto, resulta de interés para su aplicación en procesos farmacológicos.
MATERIALES Y MÉTODOS
Síntesis del diperóxido ácido de Glutaraldehído
El DPAG (figura 1) es sintetizado por oxidación del glutaraldehído con peróxido de hidrógeno en presencia de ácido sulfúrico concentrado, según el método de Bayer y Villinger modificado por Jorge y col., agua oxigenada al 60 % (0,04mol, 1,36g) y glutaraldehído (0,0762 mmol, 7,62g) son adicionados gota a gota a una solución agitada de agua (12 mL), EtOH (12 mL) y H2SO4 (12 mL) a -10°C. Se continúa la agitación por 4 h a -10 °C. El precipitado fue filtrado y lavado con agua destilada y luego secado al vacío. Se recristalizó en metanol. Se obtuvo una mezcla de isómeros cis (axial-ecuatorial), trans (ecuatorial-ecuatorial) y trans (axial-axial) en la relación 1:1:2, obtenido por RMN. El punto de fusión fue determinado en un aparato de punto de fusión marca Electrothermal: 63 °C, 83 °C y 90 °C, respectivamente.
Solventes Utilizados
El metanol (libre de metales) utilizado como solvente y el n-octano (patrón interno) fueron purificados según técnicas apropiadas [11] y controlada su pureza por CG.
Determinaciones cinéticas
Tubos Pyrex cerrados en un extremo (8 cm de largo x 2 mm diám. int.) fueron cargados con ca. 0,5 mL de la solución de DPAG en metanol (MeOH), desgasificados en la línea de vacío (-196 ºC) y sellados con la llama de un soplete.
Estas ampollas fueron sumergidas en un baño de aceite de silicona termostatizado (± 0,1ºC) a la temperatura elegida, extrayéndose las mismas a tiempos convenientemente determinados y deteniendo la descomposición del DPAG a 0 ºC, en un baño de hielo y agua.
Las determinaciones cuantitativas del DPAG remanente en las soluciones pirolizadas y la determinación cualitativa de los productos formados, se realizaron por CG utilizando el método de patrón interno (n-octano). Se empleó un cromatógrafo de gases marca Agilent Technologies 7890A, equipado con detector FID, columna capilar HP 5 de 12 m de largo y 0,53 mm de diámetro interno y se utilizó como gas transportador el nitrógeno.
Los análisis se realizaron a temperatura programada manteniendo inicialmente la columna a 60 ºC durante 2 min., luego se incrementó la temperatura hasta alcanzar una temperatura final de 160 ºC. La temperatura del inyector se fijó en 130 ºC.
Los valores de kexp de primer orden fueron calculados por el método de los mínimos cuadrados como la pendiente de la recta determinada cuando se representa ln [DPAG] en función del tiempo.
Utilizando la ecuación de Arrhenius se analizó el efecto de la temperatura sobre la kexp y se calculó la energía de activación y el factor preexponencial correspondiente. Los parámetros de activación (ΔH# y ΔS#) se calcularon utilizando la representación de Eyring y los errores de los mismos usando un método de los mínimos cuadrados [12].
RESULTADOS
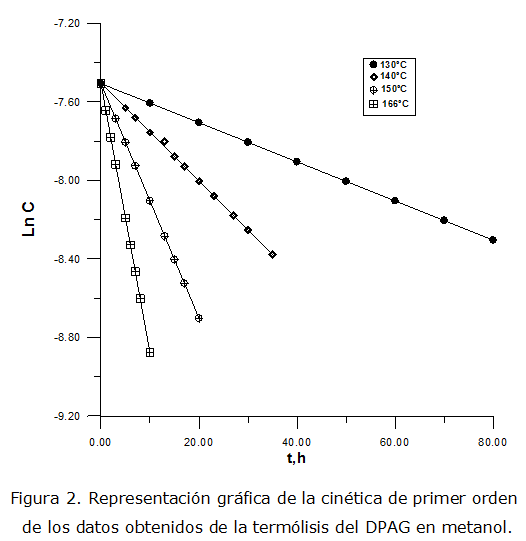
La descomposición térmica del DPAG en solución de metanol, a concentraciones iniciales de 5,49 x 10-4 mol/L, se ha estudiado en el ámbito de temperaturas de 130,0 ºC - 166,0 ºC (rango elegido debido a que el DPAG es muy estable y la descomposición es apreciable recién a los 130 °C). Se comprobó que la termólisis del DPAG en metanol, cumple con una ley cinética de primer orden hasta conversiones del peróxido de ca.50 % (figura 2).
El efecto de la temperatura sobre los valores de kexp, puede representarse por la ecuación de Arrhenius (ecuación 1) donde los errores expuestos corresponden a las desviaciones estándar, obtenidas por el tratamiento de los datos cinéticos con el método de los mínimos cuadrados y la energía de activación está expresada en cal mol-1.
La linealidad de la ecuación de Arrhenius (r = 0,990) en un intervalo de temperaturas relativamente amplio (36 ºC, tabla 1), explica que los parámetros de activación calculados (energía de activación y factor pre exponencial, ecuación 1), para la reacción del DPAG en MeOH corresponden a un proceso simple representado por la ruptura homolítica del enlace O-O.
TABLA 1. CONSTANTES DE VELOCIDAD DE PRIMER ORDEN A DISTINTAS TEMPERATURAS CORRESPONDIENTES A LA DESCOMPOSICIÓN TÉRMICA DE DPAG EN MEOH
| Temperatura[K] | Concentración inicial de DPAG x 104 [mol Kg.-1] | 106 x kexp [s-1] |
| 403,15 | 5,49 | 2,77 |
| 413,15 | 5,49 | 6,92 |
| 423,15 | 5,49 | 16,61 |
| 439,15 | 5,49 | 38,05 |
El birradical intermediario puede experimentar reacciones posteriores que involucren rupturas de enlaces C-O, evidenciando la aparición de ácido glutárico con un rendimiento del ca. 50 % (1,6 mol ácido glutárico/mol DPAG descompuesto). Así como también rupturas C-C, facilitando la formación de radicales, que luego reaccionan con el solvente extrayendo hidrógeno; esto último, en nuestro caso, no ocurre pues no se presentan otros productos de reacción. La descomposición térmica del DPAG resulta como producto de reacción dos moléculas de ácido de glutárico y una molécula de oxígeno.
Aplicando la ecuación de Eyring los parámetros de activación que resultan son: ΔS# = -21,83 ± 2,6 cal/mol K y ΔH# = 25,22 ± 1,0 kcal/mol (figura 3, tabla 2). El valor negativo de la entropía para la termólisis del DPAG en solución de metanol refleja la disminución en los grados de libertad de las moléculas de DPAG que se producen cuando pasan a un estado de transición algo más rígido, donde la ruptura del enlace peroxídico podría ser asistida por las moléculas del disolvente. Este valor negativo de la entropía también demostraría la existencia de un complejo molecular entre DPAG y la molécula de metanol estabilizado probablemente a través de enlaces de hidrógeno intermoleculares.
TABLA 2. PARÁMETROS DE ACTIVACIÓN DE LA TERMÓLISIS DEL DPAG EN METANOL
| Diperóxido | Eaa | (ΔHº)≠a | (ΔSº)≠a [cal/mol K] | (ΔGº)≠a |
| ACDPb | 22,80 ±0,9 | 26,90±0,3 | -16,90±0,6 | 33,90±0,3 |
| DFTc | 24,80±0,7 | 24,80±0,8 | -16,70±1,8 | 31,80±0,8 |
| DPAFd | 27,80±2.1 | 26,80±1.0 | -15,30±2,3 | 33,10±1.0 |
| DPAG | 26,10±1,0 | 25,22±1,05 | -21,83±2,6 | 30,47±1.05 |
aCálculo de errores realizados como en la ref. [12], bACDP: diperóxido cíclico de acetona cDFT: diperóxido cíclico de benzaldehído, dDPAF: diperóxido cíclico de acetofenona
En general, una variación en el solvente o en el tipo de sustituyentes presente en la molécula puede cambiar considerablemente la velocidad de la reacción estudiada. Según la teoría del estado de transición, los solventes pueden modificar los parámetros de activación por diferencias en la solvatación de los reactivos iniciales y el complejo activado.
La teoría de Arrhenius se basa en la asunción de que los reactivos tienen que vencer la barrera energética (la energía de activación) para ser transformados en productos. La variación en la energía de activación que se observa de un peróxido a otro se puede interpretar por las diferencias existentes en la solvatación de los reactivos y del complejo activado.
La velocidad de la reacción está determinada por la velocidad con la cual el complejo activado pasa la barrera energética en la dirección de formación de productos.
Si la reacción se lleva a cabo en solución, los diferentes reactivos, en este caso los compuestos peroxídicos mono, di y trifuncionales, pueden ser solvatados con diferente alcance, de acuerdo al poder de solvatación del solvente utilizado y además de acuerdo al tipo y tamaño de sustituyentes presente en cada molécula. Estas diferentes solvataciones pueden acelerar o retardar la reacción y determinan la velocidad de reacción en solución
En las condiciones experimentales, los parámetros de activación se corresponden con la reacción de descomposición térmica unimolecular de la molécula de DPAG. Los valores de los parámetros de activación de la etapa inicial de la reacción (ΔH# = 25,2 ± 1,0 kcal / mol; ΔS# = -21,83 ± 2,6 cal / mol K, Ea = 26,2 ± 1,0 kcal / mol), apoyan un mecanismo de reacción que incluye una ruptura homolítica de un enlace peroxídico de la molécula de DPAG con la participación del disolvente, dando un birradical como intermediario de reacción. Con el fin de observar el comportamiento del DPAG en MeOH, en la tabla 2 se puede observar los parámetros del DPAG y la de otros diperóxidos obtenidos de la cinética en el mismo solvente MeOH. Se deduce que si bien el valor de la energía de activación es casi parecido al de los otros diperóxidos, el de la entropía es un valor negativo mayor, lo que hace que este compuesto forme un estado de transición más polar.
El análisis de los productos de reacción y los valores del parámetro de activación contribuye a postular el mecanismo para la termólisis del DPAG en solución de metanol. La termólisis se produciría a través de un mecanismo en etapas, que comienza con la ruptura homolítica del enlace peroxídico que conduce a la formación de un intermediario birradical, este luego sufre una ruptura CO dando ácido glutárico y oxígeno como productos finales.
CONCLUSIONES
La reacción de termólisis del DPAG en solución de metanol sigue una ley cinética de primer orden hasta cerca del 60 % de conversión del diperóxido. Los parámetros de activación se corresponden con una ruptura homolítica inicial del enlace O-O de la molécula de diperóxido. El análisis de los productos de reacción es insuficiente para proponer un mecanismo completo de la descomposición térmica del DPAG, cálculos teóricos se están desarrollando para elucidarlo.
REFERENCIAS BIBLIOGRÁFICAS
1. MCINTOSH, H. M. y OLLIARO, P. "Artemisinin derivatives for treating uncomplicated malaria". Cochrane Database of Systematic Reviews, 1999, 2 DOI: 10.1002/14651858.CD000256. Published by JohnWiley & Sons, Ltd.
2. POSNER, G. H.; et.al.; "Malaria-infected mice are cured by a single dose of novel artemisinin derivatives". Journal Medical Chemistry, 2007, 50, 2516-2519.
3. POSNER, G. H.; et.al.; "Malaria-infected mice are cured by oral administration of new artemisinin derivatives". Journal Medical Chemistry, 2008, 51, 1035-1042.
4. KUMAR, N.; SINGH, R. y RAWAT, D. S. "Tetraoxanes: Synthetic and Medicinal Chemistry Perspective". Medicinal Research Reviews, 2012, 32(3), 581-610.
5. OPSENICA, D. M. y OLAJA, B. A. "Artemisinins And Synthetic Peroxides As Highly Efficient Antimalarials". Macedonian Journal of Chemistry and Chemical Engineering, 2012, 31(2), 137–182.
6. PAIK, I.H.; et.al. "Second generation, orally active, antimalarial, artemisinin-derived trioxane dimers with high stability, efficacy, and anticancer activity". Journal Medical Chemistry, 2006, 49, 2731-2734.
7. SINGH, C.; et. al.; "New adamantane-based spiro 1,2,4-trioxanes orally effective against rodent and simian malaria". Journal Medical Chemistry, 2007, 50, 521-527.
8. BUSTILLO, S.; et.al. "Solvent Effects In The Thermal Decomposition Reactions Of Cyclic Benzaldehyde Diperoxide". Trends in Applied Sciences Research, 2006, 1(6), 640-644.
9. BUSTILLO, S.; et.al. "Effect Of Cupric Ions On Thermal Decomposition Of 3,6-Diphenyl-1,2,4,5-Tetroxane". Trends in Applied Sciences Research, 2007, 2(2), 151-157.
10. REGUERA, M. B.; et.al. "Catalytic Decomposition Of 3,3,6,6-Tetramethyl-1,2,4,5-Tetroxane. Effect Of Ferric Ions (Fe3+)". Kragujevac Journal of Science, 2008, 30, 73-79.
11. LEIVA, L.; et.al. "The Mechanism Of The Thermal Decomposition Reaction Of Acetone Cyclic Diperoxide In Methyl t-butyl Ether Solution". International Journal of Chemical Kinetic, 2004, 36(5), 302-307.
12. HUYBERECHTS, S.; HALLEUX, A.y KRUYS, P. "Une Aplication de Calcule Statistique a la Cinetique Chimique". Bulletín de la Societé Chimique de Belgique, 1955, 64, 2003.
Recibido: 4/02/2016
Aceptado: 17/05/2016
Dra.C. Nelly Lidia Jorge-Rodriguez, Facultad de Ciencias Exactas, Naturales y Agrimensura, Universidad Nacional del Nordeste, Argentina, nelly.jorge@gmail