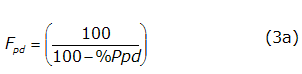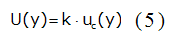Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.3 Santiago de Cuba dic. 2016
ARTICULOS
Validación y cálculo de la incertidumbre del resultado de la técnica cromatográfica para determinar G-1 y MBr en lotes de Furvina
Validation and Uncertainty of a Chromatographic Technique for Determining the G-1 and MBr Content in Furvina Lots
MSc. Isabel M. Caraballoso-Noa, MSc. Amalia M. Calvo-Alonso, MSc. Jorge B. de la Torre-López, Ing. Adalberto Quintana-Fernández, MSc. Yaidel A. Quiñones-García, MSc. Osvaldo Norman-Montenegro
Centro de Bioactivos Químicos, Universidad Central "Marta Abreu" de Las Villas, Santa Clara, Villa Clara, Cuba, isabelm@uclv.edu.cu, amaliac@uclv.edu.cu, yaidelq@uclv.edu.cu
RESUMEN
La Furvina (G-1), ingrediente farmacéutico activo del Dermofural, ungüento tópico con propiedades antibacteriana y antifúngica , se obtiene por síntesis química y está acompañada de una impureza, el monobromado (MBr). El objetivo de este trabajo es validar una técnica por cromatografía de gases para determinar el contenido de G-1 y de MBr en lotes de Furvina y calcular la incertidumbre del resultado. Se evaluaron los parámetros: adecuación del sistema, especificidad, linealidad, precisión, exactitud, y los límites de detección y cuantificación para la impureza. La técnica resultó ser específica, lineal en el intervalo de 8 mg/L a 12 mg/L para el G-1 y de 0,06mg/L a 0,14 mg/L para el MBr, precisa y exacta, con un límite de detección de 0,0006 mg/L y de cuantificación de 0,002 mg/L para la impureza . La incertidumbre expandida para el G-1 = 1,48 % y para el MBr = 0,05 %, (k=2; 95 % de confianza).
Palabras clave: Furvina, cromatografía de gases, validación, incertidumbre.
ABSTRACT
Furvina (G-1), Dermofural active pharmaceutical ingredient, a topical ointment with antibacterial and antifungal properties is obtained by chemical synthesis and it is accompanied by an impurity, the monobromate (MBr). The objective of this study is to validate a technique by gas chromatography, for determining the G-1 and MBr content in Furvina lots, and calculating the result uncertainty. The parameters: system adequacy, specificity, linearity, precision, accuracy or reliability, and detection and quantification limits, for impurity were evaluated. The technique was found to be specific, linear in the range of 8 mg / L 12 mg / L for G-1 and 0,06mg / L to 0,14 mg / L for MBr, precise and accurate, with a detection limit of 0,0006 mg / L and quantification limit of 0,002 mg / L for the impurity. The expanded uncertainty for G-1, 1,48% and for MBr 0,05% (k = 2; 95% confidence).
Keywords: Furvina, gas chromatography, validation, uncertainty.
INTRODUCCIÓN
El Centro de Bioactivos Químicos (CBQ) es una organización dedicada a la producción de ingredientes farmacéuticos activos (IFA) obtenidos por vía sintética, tal es el caso del 2-bromo-5-(2-bromo-2-nitrovinil)-furano (G-1), conocido también como Furvina, el cual es utilizado en la producción del Dermofural®, ungüento tópico con propiedades antibacteriana y antifúngica que forma parte del cuadro básico de medicamentos en Cuba desde el año 2007 [1].
Como parte integrante del CBQ se encuentra el laboratorio de control de la calidad donde se aplican técnicas para determinar la pureza de la Furvina; esta, d ebido al proceso de obtención por síntesis química, se encuentra acompañada de una impureza conocida como monobromado (MBr), por lo que dentro de las especificaciones de calidad está incluido, entre otras, el porcentaje de pureza del G-1 (entre 98,00 % y 102,00 %) y el contenido de la impureza (MBr) (no más de 1,00 %) [2].
El laboratorio es el responsable de la validez de los resultados de los ensayos realizados y que los mismos sean confiables para el uso que se les tiene destinado. En este sentido, debe demostrarse que los métodos de ensayo que se aplican tienen un desempeño adecuado, así como sus equipos y personal técnico. Por ello, en estos se exige la existencia de procedimientos encaminados a asegurar la confiabilidad de los resultados analíticos obtenidos.
El objetivo de este trabajo es validar la técnica de determinación simultánea del contenido de G-1 y MBr en lotes de Furvina por cromatografía de gases con columna capilar y detector de captura electrónica ( GC-ECD) y calcular la incertidumbre del resultado para asegurar la confiabilidad del mismo.
MATERIALES Y MÉTODOS
El equipamiento utilizado para desarrollar la técnica, así como la cristalería empleada fueron debidamente calibrados y/o verificados, por la Oficina Territorial de Normalización (OTN) y por la Empresa de Servicios Ingenieros Especializados (ESINES). Los reactivos utilizados también poseen la calidad requerida, avalados por los certificados de calidad de los proveedores.
El estudio de validación y el cálculo de incertidumbre se realizaron siguiendo las pautas establecidas por la Regulación No. 37-2012 (Anexo1) del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) [3], la ICH ( International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. Validation of analytical procedures: Text and Methodology Q2(R1) 20015 [4] , la NC TS 367:2008 Guía para la estimación y expresión de la incertidumbre de la medición en análisis químico [5] y la EURACHEM/CITAC (2000) Guide Quantifying Uncertainty in Analytical Measurement [6].
Equipos y materiales
Se utilizó un cromatógrafo de gases con detector de captura electrónica DANI/GC1000 con: Software Clarity Chromatografy Station/2.4.1; 2005; autosampler Hta/HT310A; detector ASPN – VA/ECD 86.10; inyector SL/Split–Splitless; Columna cromatográfica y precolumna HP –5,30 m; 0,32 mm; 0,25µm; US6595554H, J&W Scientific; generador de nitrógeno Dominick Hunter/G1001E y compresor de aire JUN–AIR/OF 301. Las temperaturas del horno, inyector y detector fueron 200 °C, 230 °C y 280 °C, respectivamente [7, 8]. Se utilizó flujo de fase móvil (Nitrógeno) 0,7 mL/min; flujo de hidrógeno 0,5 mL/min y flujo de aire 0,5 mL/min y 10 min de tiempo de corrida [9], volumen de inyección de 1 µL. Se utilizaron, además, balanza microanalítica Sartorius/MC5, baño ultrasónico SONOREX/RK 52, campana de extracción, estufa WTB binder/DVE GS, Zaranda THYS-2. Para los cálculos y el análisis estadístico se utilizaron los programas Statgraphics Plus for Windows 4.1, Professional Version, 1999 y Microsoft® Office Excel 2010.
Reactivos químicos, muestras y materiales de referencia
El material de referencia (MR) Furvina (lote 12-3-2; 99,87% de pureza) y el material de referencia (MR) MBr (lote 12-MBr-2; 99,64% de pureza) fueron suministrados por el propio CBQ. El lote 14-3-1 crudo y los lotes 14-3-1 y 92-3-39, puros, de Furvina se obtuvieron en la planta de producción de dicho centro. El Benzoato de bencilo 99+% p.a, utilizado como estándar interno, así como el Hidróxido de sodio p.a se obtuvieron de Panreac, el n-hexano > 99 % p.a utilizado como disolvente se adquirió de Sigma-Aldrich y el Ácido clorhídrico p.a de Merck.
Disoluciones
Disolución de estándar interno (SI): benzoato de bencilo en n-hexano (0,05 mol/L).
Disolución de G-1 (MR): G-1 en n-hexano (10 mg/L) con SI (0,025 mol/L).
Disolución de MBr (MR): MBr en n-hexano (0,1 mg/L) con SI (0,025 mol/L).
Disolución de ácido clorhídrico (HCl) 1N.
Disolución de hidróxido de sodio (NaOH) 0,1N.
Validación
Se realizó una validación completa o exhaustiva donde se estudiaron los siguientes parámetros de validación: pruebas de adecuación del sistema, especificidad, linealidad, precisión (repetibilidad y precisión intermedia), exactitud, límite de detección y límite de cuantificación, este último para la impureza, a través de la relación señal ruido.
La validación del método de ensayo se realizó utilizando disoluciones de G-1 MR en n-hexano de 10 mg/L de concentración y de MBr MR en n-hexano de 0,1 mg/L de concentración, para representar el 1 % de esta impureza que puede contener como máximo una muestra de Furvina.
Pruebas de adecuación del sistema
Repetibilidad de los tiempos de retención: se realizaron 6 inyecciones de cada disolución en el sistema cromatográfico. Se calculó la media, la desviación estándar y el coeficiente de variación de los tiempos de retención de los picos cromatográficos de G-1 y MBr.
Eficacia de la columna o número de platos teóricos: se realizaron 6 inyecciones de cada disolución. Se calculó el número de platos teóricos a través de la ecuación 1:
Simetría del pico de G-1 y MBr: se realizaron 3 inyecciones cada disolución. El dato del factor de simetría fue brindado por el software utilizado.
La resolución entre el pico de G-1 y MBr: se utilizó una disolución de G-1 (MR) (B) en n-hexano contaminada con MBr (A) al 1 %. Se inyectó 5 veces en el sistema cromatográfico. Se calculó la resolución entre los picos correspondientes a ambos analitos a través de la ecuación 2:
Especificidad
Se prepararon disoluciones de G-1 (MR) en n-hexano todas a 10 mg/L y en presencia del estándar interno en diferentes condiciones: recién preparada; contaminada con MBr al 1 %; empleando G-1 sin purificar; G-1 de más de 20 años de producido; después de 4h expuesta a la luz del laboratorio, a la luz indirecta del sol y protegida de la luz; G-1 (MR), a la que se le añadió 1:10 de una disolución de ácido clorhídrico (HCL) 1 N y se puso en una zaranda 4 horas protegida de la luz; G-1 (MR), a la que se le añadió 1:10 de una disolución de Hidróxido de sodio (NaOH) 0,1 N y se puso en una zaranda 4 horas protegida de la luz; preparada con G-1 después de ser sometido a 70 ° C en estufa durante 1 h y se registraron sus cromatogramas.
Linealidad
Se prepararon tres curvas de calibración en tres días diferentes, para el G-1 en un intervalo de concentraciones comprendido entre 80 % y 120 % de la concentración teórica, es decir desde 8 mg/L hasta 12 mg/L de G-1 (MR). Para el MBr donde el punto medio corresponde al límite de especificación para el contenido de MBr en la Furvina y se abarcó un intervalo que incluye el nivel reportado hasta el 120 % de la especificación, es decir, desde 0,06 mg/L hasta 0,14 mg/L de MBr (MR). El análisis se realizó por duplicado.
Precisión
La precisión del método se obtuvo mediante el análisis de la repetibilidad y la precisión intermedia, para ambos analitos (G-1 y MBr).
Repetibilidad instrumental
Se inyectaron 6 réplicas de cada disolución de G-1 (MR) y MBr (MR). Se calculó la media de los cocientes de respuesta (Rm), la desviación estándar (S) y el coeficiente de variación (CV %).
Repetibilidad del método
Para ambos analitos se realizó a tres niveles diferentes de concentraciones (nivel bajo, medio y alto de la curva de calibración), con un mínimo de tres réplicas para cada una en cada caso. Se calculó la media de las concentraciones (Xm), la desviación estándar (S) y el coeficiente de variación de la repetibilidad (CV %).
Precisión intermedia
Para ambos analitos se realizó a tres niveles diferentes de concentraciones (nivel bajo, medio y alto de la curva de calibración), por duplicado, en tres días diferentes, con dos analistas, en el mismo equipo y el mismo laboratorio. Se calculó la media de las concentraciones (Xm), la desviación estándar (S) y el coeficiente de variación (CV %) para cada grupo de análisis y el total. Se realizó, además, un análisis de varianza multifactorial para analizar la influencia de los factores concentración, analista y día en la variabilidad de los resultados, utilizando el estimador lnR2 (donde R son los residuales), con un nivel de confianza de 95 %.
Exactitud (Veracidad)
Para G-1: el análisis se realizó a tres niveles diferentes de concentraciones: (nivel bajo, medio y alto de la curva de calibración). Para MBr: se prepararon disoluciones de G-1 (MR) (10 mg/L) en n-hexano con estándar interno a las que se le añadió concentraciones conocidas de MBr a tres niveles diferentes de concentraciones ( nivel bajo, medio y alto de la curva de calibración), es decir, 0,06 mg/L, 0,10 mg/L, 0,14 mg/L. En ambos casos el análisis se realizó por triplicado. Se efectuó un test de t de student para determinar si los valores medios hallados a cada nivel de concentración y el valor considerado verdadero no difieren significativamente para un nivel de confianza de 95 %. Se calcularon los porcentajes de recuperación. Se evaluó la influencia del factor concentración mediante un análisis de varianza unifactorial con un nivel de confianza de 95 %.
Límites de detección y cuantificación (solo para MBr)
Los límites de detección y de cuantificación se determinaron mediante el diseño de relación señal ruido, para lo cual se procedió al análisis repetido del estándar interno. Se inyectó el estándar interno, en el sistema cromatográfico y una vez obtenido el cromatograma se delimitó dentro de la línea base, un intervalo de tiempo 20 veces la anchura en la base del pico de MBr.
Cálculo de la incertidumbre
Para el cálculo de la incertidumbre del resultado de esta técnica, se analizó un lote de Furvina. El desarrollo de la técnica se describe a continuación:
Se prepararon disoluciones de trabajo de Furvina (MR), MBr (MR) y dos réplicas del lote de Furvina, todas a 10 mg/L de concentración. Se realizaron las inyecciones a través del inyector del cromatógrafo de gases y según la secuencia programada:
- Tres inyecciones de Furvina (MR).
- Tres inyecciones de MBr (MR).
- Dos inyecciones por cada una de las réplicas del lote de Furvina.
Se obtuvieron los cromatogramas correspondientes a cada una de las disoluciones de trabajo.
A partir de los datos obtenidos y utilizando hoja de cálculo en Excel se obtuvo el contenido de G-1 (pureza) y de MBr (impureza) en el lote de Furvina analizado, utilizando la ecuación 3:
Fpd se determina de la manera siguiente (ecuación 3a):
Se definió como modelo matemático la ecuación (3). Se identificaron las fuentes de incertidumbre asociadas y con una tormenta de ideas con el criterio de diferentes expertos se confeccionó un diagrama de causa-efecto (espina de pescado), se establecieron las causas principales, secundarias y hasta terciarias que pueden influir en el resultado del por ciento de G-1 y MBr en base a materia seca en lotes de Furvina (% Xims).
Después de haber identificado todas las posibles fuentes que pueden aportar incertidumbre al resultado de la técnica, se determinaron aquellas que verdaderamente se pueden calcular. Para esto, se analizaron las causas de todos los posibles errores de medición de la técnica.
Las fuentes de incertidumbre se calcularon según los criterios Tipo A (utilizando una "t de student" con a = 0,05 y n-1 grados de libertad) y Tipo B mediante dos vías o distribución diferentes, rectangular o uniforme y normal o de Gauss.
Se combinaron las componentes de incertidumbre para determinar la "incertidumbre estándar combinada" aplicando las reglas para combinar las Incertidumbres Típicas [6, 10], en este caso el modelo de multiplicación y división, se aplicó en el modelo matemático y se obtuvo la ecuación 4 para el cálculo de la incertidumbre combinada:
Se calculó la incertidumbre expandida (U) según la ecuación 5:
Finalmente se expresó el resultado de la medición como % G-1 ± U (G-1) y % MBr ± U (MBr).
RESULTADOS Y DISCUSIÓN
Validación del método
En las condiciones cromatográficas descritas, el G-1 presenta un tiempo de retención a los 6,4 minutos, el MBr presenta un tiempo de retención a los 4,4 minutos y el SI presenta un tiempo de retención a los 7,2 minutos, como se observa en la figura 1.
Pruebas de adecuación del sistema
La repetibilidad de los tiempos de retención: se obtuvo un coeficiente de variación de 0,053 % para G-1 y 0,057 % para MBr, en ambos casos menores que 1 %. El número de platos teóricos en ambos casos fue mayor que 5000. La s imetría del pico, tanto para G-1 como para MBr se encontró en el intervalo entre 0,8 y 1,5. La resolución entre el pico de G-1 y MBr resultó mucho mayor que 1,5. Por tanto, el sistema cromatográfico a emplear es adecuado para su utilización en este método de ensayo.
Especificidad
En todos los casos se observó que no hay ningún pico cromatográfico adicional no suficientemente resuelto del pico correspondiente al G-1 y al MBr, por lo que se concluye que el método en las condiciones estudiadas es específico.
Linealidad
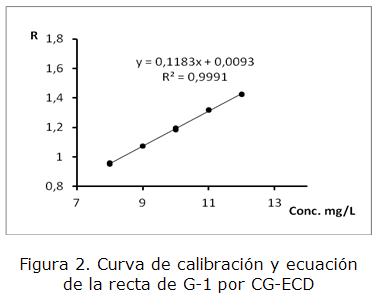
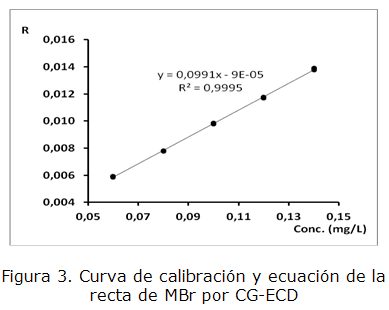
En la tabla 1 se presentan los parámetros estudiados con los resultados para ambos casos y en las figuras 2 y 3 las curvas de calibración correspondientes.
TABLA 1. PARÁMETROS ESTADÍSTICOS DE LAS RECTAS DE REGRESIÓN OBTENIDAS
| Parámetros | Resultados | |
| G-1 | MBr | |
| Ecuación de la recta y = ax + b | y = 0,118 3 x + 0,009 3 | y = 0,099 1 x + 9*10-5 |
| Coeficiente de correlación R ≥ 0,990 | 0,999 5 | 0,999 7 |
| Coeficiente de determinación | 0,999 1 | 0,999 5 |
| Coeficiente de variación de los factores de respuesta CVf≤ 5 % | 0,44 % | 0,71 % |
| t-test para la pendiente: tcal> ttab para a=0,05 y n-2 grados de libertad; ttab =2,16 | texp = 120,10 | texp = 161,14 |
| t-test para el intercepto: tcal < ttab para a=0,05 y n-2 grados de libertad; ttab =2,16 | texp = 0,93 | texp = 1,40821 |
Los parámetros calculados para evaluar la calidad de la regresión cumplen con los criterios de aceptación correspondientes, lo que indica que la técnica es lineal en el intervalo de concentraciones estudiado para G-1 y MBr.
Precisión
Repetibilidad instrumental
En la tabla 2 se muestran los resultados de la repetibilidad instrumental.
TABLA 2. RESULTADOS DE LA REPETIBILIDAD INSTRUMENTAL PARA G-1 Y MBr
|
| G-1 (10 mg/L) | MBr (0,1mg/L) | ||
| Inyecciones | Cociente de Respuesta | Parámetros estadísticos | Cociente de Respuesta | Parámetros estadísticos |
| 1 | 1,175 96 | Rm = 1,176 15 S = 0,002 18 CV(%) = 0,19 | 0,009 99 | Rm = 0,010 04 S = 3,873*10-5 CV(%) = 0,39 |
| 2 | 1,176 00 | 0,010 02 | ||
| 3 | 1,176 80 | 0,010 03 | ||
| 4 | 1,178 26 | 0,010 04 | ||
| 5 | 1,177 78 | 0,010 08 | ||
| 6 | 1,172 12 | 0,010 10 | ||
La variabilidad de la respuesta, expresada como coeficiente de variación es menor del 1 % para ambos analitos, con una adecuada correspondencia entre las respuestas obtenidas para las inyecciones repetidas. Dicho resultado demostró que con este procedimiento es posible minimizar los errores potenciales asociados a la inyección de las muestras y con ello conseguir la precisión instrumental requerida.
En consecuencia, para todas las determinaciones realizadas en este trabajo, se sigue el procedimiento de inyectar cada muestra por duplicado y utilizar para los cálculos el valor medio de la respuesta para ambas inyecciones.
Repetibilidad del método
En la tabla 3 se muestran los resultados obtenidos. Para ambos analitos el valor del coeficiente de variación es menor que 2 %, lo cual evidencia que el método de ensayo es repetible.
TABLA 3. RESULTADOS DE LA REPETIBILIDAD DEL MÉTODO
|
| G-1 | MBr | ||||
| Conc mg/L | 8 | 10 | 12 | 0,06 | 0,10 | 0,14 |
| Réplica 1 | 8,079 01 | 10,139 03 | 11,996 94 | 0,060 19 | 0,100 23 | 0,140 96 |
| Réplica 2 | 8,140 62 | 9,948 12 | 11,928 02 | 0,059 90 | 0,100 04 | 0,140 55 |
| Réplica 3 | 7,999 82 | 10,087 33 | 11,827 13 | 0,060 52 | 0,101 51 | 0,139 73 |
| Media | 8,073 15 | 10,058 16 | 11,917 36 | 0,060 20 | 0,100 60 | 0,140 41 |
| Desv. estándar | 0,070 59 | 0,0987 4 | 0,085 41 | 0,000 31 | 0,000 80 | 0,000 63 |
| Coefic. de Variación (%) | 0,87 | 0,98 | 0,72 | 0,52 | 0,80 | 0,45 |
Precisión intermedia
Los resultados del estudio se muestran en la tabla 4 para G-1 y en la tabla 5 para MBr.
TABLA 4. RESULTADOS DE LA PRECISIÓN INTERMEDIA PARA G-1
|
| Analista 1 | Analista 2 | |||||
| Conc. mg/L | 8 | 10 | 12 | 8 | 10 | 12 | |
| Día 1 | Xm | 7,945 43 | 9,936 27 | 11,983 23 | 7,915 39 | 10,116 51 | 11,984 89 |
| S | 0,019 07 | 0,028 40 | 0,125 59 | 0,004 89 | 0,042 78 | 0,151 43 | |
| CV % | 0,24 | 0,28 | 1,05 | 0,06 | 0,42 | 1,26 | |
| Día 2 | X | 8,039 41 | 10,043 57 | 11,962 48 | 7,902 43 | 10,035 66 | 11,967 67 |
| S | 0,056 00 | 0,134 99 | 0,048 73 | 0,015 89 | 0,074 39 | 0,058 55 | |
| CV % | 0,70 | 1,34 | 0,41 | 0,20 | 0,74 | 0,49 | |
| Día 3 | Xm | 8,007 55 | 10,020 65 | 11,947 97 | 7,898 03 | 10,030 06 | 11,957 17 |
| S | 0,118 39 | 0,165 11 | 0,030 70 | 0,065 29 | 0,068 29 | 0,073 41 | |
| CV % | 1,48 | 1,65 | 0,26 | 0,83 | 0,68 | 0,61 | |
|
| Total | ||||||
| Xm | 7,997 46 | 10,000 17 | 11,964 56 | 7,905 28 | 10,060 7 | 11,969 91 | |
| S | 0,073 01 | 0,108 69 | 0,063 79 | 0,031 19 | 0,065 40 | 0,080 66 | |
| CV % | 0,91 | 1,09 | 0,53 | 0,39 | 0,65 | 0,67 | |
TABLA 5. RESULTADOS DE LA PRECISIÓN INTERMEDIA PARA MBr
|
| Analista 1 | Analista 2 | |||||
| Conc. mg/L | 0,06 | 0,1 | 0,14 | 0,06 | 0,1 | 0,14 | |
| Día 1 | Xm | 0,060 04 | 0,100 14 | 0,140 76 | 0,060 12 | 0,099 62 | 0,139 83 |
| S | 0,00021 | 0,000 14 | 0,000 29 | 0,000 32 | 0,000 17 | 0,000 01 | |
| CV % | 0,34 | 0,14 | 0,21 | 0,53 | 0,17 | 0,01 | |
| Día 2 | X | 0,060 70 | 0,099 56 | 0,139 88 | 0,060 84 | 0,099 94 | 0,141 08 |
| S | 0,000 16 | 0,000 01 | 0,000 22 | 0,000 18 | 0,000 003 | 0,000 17 | |
| CV % | 0,26 | 0,01 | 0,15 | 0,29 | 0,003 | 0,12 | |
| Día 3 | Xm | 0,060 85 | 0,100 46 | 0,141 29 | 0,060 72 | 0,099 97 | 0,140 37 |
| S | 0,00007 | 0,000 32 | 0,000 11 | 0,000 26 | 0,000 02 | 0,000 28 | |
| CV % | 0,12 | 0,32 | 0,08 | 0,43 | 0,02 | 0,20 | |
|
| Total | ||||||
| Xm | 0,060 53 | 0,100 05 | 0,140 64 | 0,060 56 | 0,099 84 | 0,140 43 | |
| S | 0,000 40 | 0,000 44 | 0,000 66 | 0,000 40 | 0,000 19 | 0,000 58 | |
| CV % | 0,67 | 0,44 | 0,47 | 0,66 | 0,19 | 0,41 | |
En todos los casos se obtienen valores de coeficiente de variación menores de 2 % y el CV total de la precisión intermedia es para cada concentración inferior al doble del CV de la repetibilidad del método. Los resultados del análisis de varianza multifactorial para ambos analitos no revelan diferencias significativas en las concentraciones medias determinadas en los diferentes días. Tampoco las varianzas asociadas a esas concentraciones medias por día son significativamente diferentes. Además, tanto los valores del CV para cada día como la cifra total, están dentro de los límites admisibles para métodos cromatográficos, en los que se aceptan valores que no excedan el 2 %.
Teniendo en cuenta los resultados anteriores obtenidos para la repetibilidad y precisión intermedia se concluye que este método de ensayo es preciso en las condiciones estudiadas.
Exactitud (Veracidad)
Los resultados de la determinación de la exactitud para G-1 y MBr se encuentran en las tablas 6 y 7, respectivamente.
| Conc. (mg/L) | 8 | 10 | 12 |
| Conc. media calculada (mg/L) | 8,073 15 | 10,058 16 | 11,917 36 |
| S | 0,070 59 | 0,098 74 | 0,085 41 |
| CV (%) | 0,874 33 | 0,98169 | 0,716 65 |
| ttab | 4,303 | ||
| texp | 1,794 98 | 1,020 19 | 1,675 91 |
| % recuperación | 100,99 | 101,39 | 99,97 |
| 101,76 | 99,48 | 99,40 | |
| 100,00 | 100,87 | 98,56 | |
TABLA 7. RESULTADOS DE LA EXACTITUD PARA MBr, A TRES NIVELES DE CONCENTRACIÓN
| Conc. (mg/L) | 0,06 | 0,10 | 0,14 |
| Conc. media calculada (mg/L) | 0,060 20 | 0,100 09 | 0,140 41 |
| S | 0,000 31 | 0,000 13 | 0,000 63 |
| CV (%) | 0,52 | 0,13 | 0,45 |
| ttab | 4,303 | ||
| texp | 1,11647 | 1,116 47 | 1,116 47 |
| % recuperación | 100,31 | 100,23 | 100,69 |
| 99,83 | 100,04 | 100,39 | |
| 100,87 | 99,99 | 99,81 | |
Para ambos analitos a los tres niveles de concentración se obtuvieron porcentajes de recuperación entre 98 % y 102 % (criterio aceptado para métodos cromatográficos) y a las tres concentraciones las texp son menores que la ttab para n-1 grados de libertad y p = 0,05, lo cual significa que los valores obtenidos no son estadísticamente diferente de los valores teóricos. El análisis unifactorial demuestra que no existe influencia del factor concentración en los valores de por cientos de recuperación (p > 0,5).
Todos los ensayos y análisis estadísticos realizados indican que el método de ensayo es exacto en las condiciones estudiadas.
Límites de detección y cuantificación (solo para MBr)
Se obtuvo un límite de detección de 0,000 6 mg/L y un límite de cuantificación de 0,002 mg/L. Por lo que se puede cuantificar la impureza MBr en lotes de Furvina cuando se encuentre por encima de un 0,02 %.
Cálculo de la Incertidumbre del resultado de la técnica para la determinación del contenido de G-1 Y MBr en lotes de Furvina por GC-ECD
Incertidumbre estándar combinada
Sustituyendo las componentes de incertidumbre en la ecuación (4) se obtuvo que: La incertidumbre estándar combinada del G-1 (uc %G-1ms) es: 0,73 % y la incertidumbre estándar combinada del MBr (uc %MBrms) es: 0,025 %.
En la tabla 8 se presentan los valores de cada una de las componentes de incertidumbre considerada.
TABLA 8. COMPONENTES DE INCERTIDUMBRE
|
| Componentes de incertidumbre | Valores de incertidumbre | Valores de incertidumbre (MBr) |
| uPp | Pureza MR | 0,075 | 0,208 |
| uRp | Cociente de respuesta MR | 0,004 7 | 0,003 7 |
| uRm | Cociente de respuesta Muestra | 0,006 1 | 0,000 098 |
| uMp | Masa MR | 1·10-7 | 1·10-7 |
| u%Fpd | Factor de porciento de pérdidas por desecación | 0,000 25 | 0,000 25 |
| uc%Xims | Incertidumbre estándar combinada | 0,73 | 0,025 |
Incertidumbre Expandida
La incertidumbre expandida del G-1(UG-1) es: 1,46 % y la incertidumbre expandida del MBr (UMBr) es: 0,05 %, asumiendo un factor de cobertura k = 2 a un 95 % de confianza.
Resultado de la medición
En el lote de Furvina, objeto de estudio, el resultado final de la medición se expresa de la siguiente manera:
- %G-1 = 99,22 ± 1,46 % con k = 2 para un 95 % de confianza.
- %MBr = 0,14 ± 0,05 % con k = 2 para un 95 % de confianza.
CONCLUSIONES
La técnica para la determinación simultánea del contenido de G-1 y su impureza MBr en lotes de Furvina por cromatografía de gases con columna capilar y detector de captura electrónica resultó ser específica, lineal en el intervalo de concentraciones de 8 mg/L a 12 mg/L para G-1 y de 0,06 mg/L a 0,14 mg/L para MBr, precisa y exacta; con límite de detección igual a 0,0006 mg/L y límite de cuantificación igual a 0,002 mg/L para MBr.
Se identificaron todas las posibles fuentes de incertidumbre que influyen en la determinación del contenido de G-1 y su impureza MBr en lotes Furvina y se agruparon en cinco componentes: pureza del MR, cociente de respuesta del MR, cociente de respuesta de la muestra, masa del MR, factor de por ciento de pérdidas por desecación.
Se calculó la incertidumbre expandida del resultado de la técnica para la determinación simultánea del contenido de G-1 y su impureza MBr en lotes de Furvina por cromatografía de gases con columna capilar y detector de captura electrónica, siendo 1,46 % para G-1 y 0,05 % para MBr, con un factor de cobertura k = 2 y un nivel de confianza de 95 %.
REFERENCIAS BIBLIOGRÁFICAS
1. Dermofural®, (2014). Ungüento de uso tópico. Registro de Medicamentos de Uso Humano. No M-07-020-D01. CECMED. Ministerio de Salud Pública, La Habana, Cuba.
2. CASTAÑEDO, N. R.; GAITÁN, T. E. Información sobre la manufactura del 2-bromo-5-(2-bromo-2-nitrovinil)-furano. Centro de Bioactivos Químicos. Universidad Central "Marta Abreu" de Las Villas. Santa Clara. Cuba. 2003. En: Dermofural®, ungüento de uso tópico. Registro de Medicamentos de Uso Humano. No M-07-020-D01. CECMED. Ministerio de Salud Pública, La Habana, Cuba, 2014.
3. CECMED, Regulación 37-2012 Anexo 1 de las Buenas Prácticas de Laboratorio para el Control de Medicamentos. Validación de métodos analíticos. La Habana, Cuba.
4. ICH Harmonised Tripartite Guideline. (2005). International conference on Harmonisation of technical requirements for registration of pharmaceuticals for human use. Validation of analytical procedures: Text and Methodology. Q2(R1).
5. NC TS 367:2008 Guía para la estimación y expresión de la incertidumbre de la medición en análisis químico.
6. EURACHEM/CITAC. (2000). Guide Quantifying Uncertainty in Analytical Measurement, Second Edition, Final Draft: April 2000.
7. JIMÉNEZ, E.; BRAVO. L.; MORALES, S. (1993) II. Validación de la técnica de determinación por cromatografía gaseosa del contenido de 2-bromo-5-(2-nitrovinil)-furano. Método de control En: Dermofural®, ungüento de uso tópico. Registro de Medicamentos de Uso Humano. No M-07-020-D01. CECMED. Ministerio de Salud Pública, La Habana, Cuba, 2014.
8. BRAVO-SÁNCHEZ, L. R. y otros. "Validación de las técnicas para la determinación de la pureza del bioactivo 2-bromo-5-(2-bromo-2-nitrovinil)-furano". Afinidad, 1999, 56(479), 29-33. ISBN 0001-9704.
9. CALVO, A., MORALES S. (2007). "Determinación de Furvina en plasma humano utilizando extracción mediante dispersión de la matriz en fase sólida y Cromatografía de Gases". Afinidad, 2012, 69(560), 278–282.
10. ELIZABETH PRICHARD, Quality in the analytical chemistry laboratory. John Wiley & Sons (1997). ISBN 0-85404-432-9.
Recibido: 2/02/2016
Aceptado: 15/05/2016
MSc. Isabel M. Caraballoso-Noa, Centro de Bioactivos Químicos, Universidad Central "Marta Abreu" de Las Villas, Santa Clara, Villa Clara, Cuba, isabelm@uclv.edu.cu