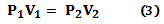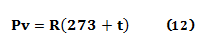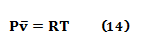Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.3 Santiago de Cuba dez. 2016
ARTICULOS
Filatelia y Didáctica de la Química: un ejemplo con los Gases Ideales
Philately and Teaching of Chemistry: an Example Using the Ideal Gas
MSc. Marlon Martínez-ReinaI,II, Dr. C. Eliseo Amado-GonzálezI
IUniversidad de Pamplona, Facultad de Ciencias Básicas, Pamplona, Colombia, marlon.martinez@unipamplona.edu.co
IIFundación Universitaria del Área Andina, Facultad de Educación, Bogotá, Colombia
RESUMEN
En este artículo se presentan 57 sellos postales emitidos por diferentes países para hacer una descripción didáctica de los gases ideales: se inicia con ejemplos de materia en estado gaseoso (aire, gas natural, dióxido de carbono, flúor, oxígeno, ozono, etc.), se continua con un desarrollo histórico de los gases (Paracelso, van Helmont, Cavendish, Priestley y Lavoisier); los aspectos disciplinares con las variables y unidades de la ecuación de estado (presión, temperatura, volumen y cantidad de sustancia); finalmente, se relacionan con sellos postales las leyes (Boyle, Charles, Gay-Lussac y Avogadro) y la teoría cinética molecular de los gases (van der Waals, Joule, Maxwell, Boltzmann y Gibbs).
Palabras clave: gases ideales, didáctica de la Química, filatelia, sellos postales.
ABSTRACT
This article presented fifty-seven postage stamps issued by different countries to do one description didactics of the ideal gases: begins with examples of gaseous matter (air, natural gas, carbon dioxide, fluorine, oxygen, ozone, etc.), we continue with a development historical of the gases (Paracelsus, Helmont, Cavendish, Priestley and Lavoisier). The disciplinary aspects with the variables and units of the equation of state (pressure, temperature, volume and amount of substance); finally, relate with postage stamps the laws (Boyle, Charles, Gay-Lussac and Avogadro) and the molecular kinetic theory of gases (van der Waals, Joule, Maxwell, Boltzmann and Gibbs).
Keywords: ideal gas, teaching of Chemistry, philately, postage stamp.
INTRODUCCIÓN
Los procesos histórico y epistemológico de la Química son importantes para la enseñanza de los gases ideales, porque relacionan un desarrollo gradual de la ciencia y de sus modelos. El estudio de la Química se basa en la interpretación de modelos acordes con los fenómenos estudiados: "el conocimiento científico no es una realidad absoluta, existen constantes avances en los modelos interpretativos, que son usados de acuerdo a la necesidad de los investigadores y a la interpretación que hacen de la realidad y de los fenómenos que estudian" [1].
Los mapas conceptuales ofrecen un método visual para ayudar a los alumnos a organizar su propio pensamiento, son el reflejo de la organización de los conceptos y una herramienta útil para seguir la evolución de la estructura cognitiva en diferentes etapas del proceso enseñanza/aprendizaje de un tema determinado en el ámbito de las ciencias [2].
Por otra parte, los sellos postales (estampillas) y sobres de primer día (SPD) son emitidos para conmemorar acontecimientos e informar y educar al público; de acuerdo con Rappoport [3], la colección de material filatélico relacionado con la química permite combinar una afición con un interés profesional; el término "Chemophilately" se refiere al estudio de la Historia de la Química desde la filatelia; según lo señalado por Chenier [4], el uso de sellos postales representa una ayuda interesante y valiosa para la enseñanza de la Química. Ejemplos de publicaciones relacionadas con "Chemophilately" son: tabla periódica y símbolos químicos de los elementos [5, 6], teoría cinético molecular de los gases [7], premios Nobel de Química y filatelia [8-10], estructura atómica [11], Sistema Internacional de Unidades en sellos postales [12-16], vida y obra de Marie Curie [17] y Año Internacional de la Química (2011) [18].
Históricamente los gases ocupan un lugar especial en el desarrollo de la Química, su estudio llevó a desarrollar gran cantidad de conocimientos: leyes y teorías, de ahí la importancia de las características que distinguen el estado gaseoso. En este trabajo se utilizan 57 sellos postales para elaborar mapas conceptuales que relacionen de una forma didáctica la historia, definiciones y leyes de los Gases Ideales: presión (Pascal y Torricelli), temperatura (Celsius, Fahrenheit y Kelvin), Ley de Boyle, Ley de Charles, Ley de Gay-Lussac, Principio de Avogadro, Ley de las Presiones Parciales de Dalton, y el concepto de gas real con la ecuación de Van der Waals.
Mapa conceptual No. 1: Materia en estado gaseoso
Se denomina gas al estado de agregación de la materia que no tiene forma ni volumen propio. Su principal composición son moléculas no unidas, expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y forma definida, provocando que éste se expanda para ocupar todo el volumen del recipiente que lo contiene; en el estado gaseoso, las fuerzas gravitatorias y de atracción entre partículas resultan insignificantes. El término "gas" es considerado en algunos diccionarios como sinónimo de vapor, pero no hay que confundirlos, ya que el término de vapor se refiere estrictamente para aquel gas que se puede condensar por presurización a temperatura constante [19].
La figura 1 muestra sellos postales en un mapa conceptual que hace referencia a materia en estado gaseoso; los elementos que son gases en condiciones atmosféricas: hidrógeno (sello 5), nitrógeno, oxígeno (sello 6), flúor (sello 5) y cloro existen como moléculas gaseosas diatómicas H2, N2, O2, F2 y Cl2. Un alótropo del oxígeno, el ozono (O3) (sellos 6, 7 y 8), es también un gas a temperatura ambiente [19]. Todos los elementos del grupo 8A (19), los gases nobles, son gases monoatómicos: He, Ne, Ar, Kr, Xe, Rn y Uuo [20-22]. Otros ejemplos de gases a condiciones atmosféricas son el eteno (C2H4), precursor del polietileno (sello 9), el dióxido de carbono (CO2, sello 10) y el gas natural (sello 11), fuente de energía no renovable formada por una mezcla de gases ligeros que se encuentra en yacimientos de petróleo.
A continuación, una descripción de los sellos usados en la elaboración del mapa conceptual No. 1: el sello 1 usado para mostrar la definición de la química fue emitido en 1976 por Estados Unidos; el sello 2 emitido por Portugal en 2008 con motivo del Año Internacional de la Tierra, muestra el aire: "mezcla de gases".
Los sellos 3 y 4 muestran a John William Strutt (tercer barón de Rayleigh) (1842-1919) y a Sir William Ramsay (1852-1916) ganadores del premio Nobel de Física y Química en 1904 "por el descubrimiento de elementos gaseosos inertes (gases nobles)" [23, 24].
El sello 5 muestra al químico francés Henri Moissan (1852-1907) ganador del Premio Nobel de Química en 1906 "por su investigación y aislamiento del flúor elemental " [25].
El sello 6 muestra al ingeniero mexicano Mario Molina (1943-) con una de las reacciones involucradas en la destrucción de la capa de ozono: Cl + O3 -> O2 Mario Molina compartió el Premio Nobel de Química en 1995 con el holandés Paul Jozef Crutzen (1933-) y con el estadounidense Frank Sherwood Rowland (1927-2012) "por su trabajo en la química de la atmósfera, particularmente en lo que respecta a la formación y desintegración del ozono" [26].
Los sellos 7 y 8 muestran la formula molecular del ozono (O3): el sello 7 conmemora el Día Internacional de la Protección de la Capa de Ozono (16 de septiembre) y el sello 8 hace referencia a los 200 años del nacimiento del químico suizo Christian Friedrich Schönbein (1799-1868), conocido por identificar el ozono como un compuesto químico [27]. En el sello 9 hay una representación de una molécula de eteno: "un compuesto químico orgánico formado por dos átomos de carbono enlazados mediante un doble enlace" [19]. El sello 10 emitido en 2011 con motivo del Año Internacional de la Química muestra la estructura de las moléculas de CO2 (molécula lineal) y H2O (molécula angular, ángulo de enlace 104.5°), a condiciones atmosféricas el dióxido de carbono es un gas; el agua es un líquido. En general, mientras más fuertes sean las fuerzas de atracción entre las moléculas de un compuesto (puente de hidrógeno para el agua), menor es la posibilidad de que exista como gas a condiciones atmosféricas [19]. El sello 12 muestra a Fritz Haber (1865-1934), ganador del premio Nobel de Química en 1918 por la síntesis del gas amoniaco (NH3) desde de sus elementos [28].
Mapa conceptual No. 2: Desarrollo histórico
Para empezar, es importante tener en cuenta el surgimiento y desarrollo de las primeras culturas. Por ejemplo, en el siglo IV a.C., el filósofo griego Demócrito de Abdera (460-370 a.C.) y su maestro Leucipo (460-370 a.C.) fueron de los primeros en proponer la existencia de unidades fundamentales de la materia a las que llamó "átomos" (que significa aquello que no se puede dividir); "Nada tiene, pues, de extraño que la hipótesis atomística hubiera de esperar al siglo XVII para recuperar su credibilidad teórica y al siglo XIX para recibir por fin su confirmación empírica" [29].
En el siglo XVII de nuestra era Jan Baptista van Helmont (1577-1644) identificó el dióxido de carbono y el óxido de nitrógeno; fue el primer científico que introdujo la palabra "gas" del latín "chaos" en el vocabulario científico: " llamó al gas que obtuvo de la madera "gas silvestre" (gas de madera). Era el que actualmente llamamos dióxido de carbono". En épocas posteriores y desde resultados experimentales derivados de los cambios de peso durante los procesos de combustión surgieron interrogantes: ¿qué ocurría con los vapores liberados por la materia ardiente?, y ¿había tomado la herrumbre algo del aire? Antes de poder dar respuesta a estas preguntas, era preciso que los químicos se familiarizaran más con lo gases. Había que vencer el miedo a una sustancia tan difícil de coger, confinar y estudiar [30].
El químico inglés Stephen Hales (1667-1761) a principios del siglo XVIII logró recoger gases sobre agua "los vapores formados como resultado de una reacción química pudieron conducirse a través de un tubo, al interior de un recipiente que se había colocado lleno de agua y boca abajo en una jofaina con agua. El gas burbujeaba dentro del recipiente, desplazando el agua y forzándola a través del fondo abierto" "Hales mismo no distinguió entre los diferentes gases que preparó y confinó, ni tampoco estudió sus propiedades, pero el solo hecho de haber ideado una técnica sencilla para retenerlos era de la mayor importancia". El químico escocés Joseph Black (1 728-1 799) calentó fuertemente la piedra caliza (carbonato cálcico). Este carbonato se descompuso, en cal (óxido de calcio) liberando un gas, el gas liberado pudo recombinarse con el óxido de calcio para formar de nuevo carbonato cálcico. El gas (dióxido de carbono) era idéntico al "gas silvestre" de Van Helmont, pero Black lo llamó "aire fijado", porque cabía combinarlo "fijarlo" de tal manera que formase parte de una sustancia sólida [30].
El alumno de Black, Daniel Rutherford (1749-1819) en 1772 aisló un gas "aire flogisticado" hoy día se llama nitrógeno, y se concede a Rutherford el crédito de su descubrimiento [30-32]. Otro aporte al estudio de los gases en esta época fue realizado por Henry Cavendish (1731-1810). "Era un excéntrico acaudalado que investigó en diversos campos, pero que se guardaba para sí los resultados de su trabajo y pocas veces los publicaba. Afortunadamente, sí publicó los resultados de sus experiencias sobre los gases" [30]. Cavendish estudió el gas que se forma cuando los ácidos reaccionan con ciertos metales, midió el peso de volúmenes de gas, es decir, determinó su densidad. A Cavendish se le atribuye el descubrimiento del H2: "(...) el hidrógeno es extraordinariamente ligero, con una densidad de sólo una catorceava parte la del aire"; el hidrógeno ya había sido descrito por Paracelso (1493-1541) al mezclar metales con ácidos fuertes [30, 32].
Joseph Priestley (1733-1804) "recogiendo dióxido de carbono sobre agua, observó que una parte se disolvía y daba al agua un agradable sabor ácido" [30, 33], lo que en la actualidad se llama agua de soda.
En 1774, el uso del mercurio en su trabajo con los gases dio lugar al descubrimiento más importante de Priestley. El mercurio, cuando se calienta en el aire, forma un «calcinado» de color rojo ladrillo (que ahora llamamos óxido de mercurio). Priestley puso algo de este calcinado en un tubo de ensayo y lo calentó con una lente que concentraba los rayos del sol sobre él. El calcinado se transformó de nuevo en mercurio, que aparecía como bolitas brillantes en la parte superior del tubo de ensayo. Además, la descomposición liberaba un gas de propiedades muy extrañas. Los combustibles ardían antes y con más brillo en este gas que en el aire. A Priestley se atribuye el descubrimiento del oxígeno [30, 32-33].
El químico sueco Karl Wilhelm Scheele (1742-1786) preparó e investigó gases altamente venenosos: fluoruro, cianuro y sulfuro de hidrógeno. Scheele trabajó en condiciones muy peligrosas, tenía la costumbre de probar los productos químicos que descubría; algunos autores suponen su temprana muerte como resultado de un lento envenenamiento. En su único libro Chemische Abhandlung von der Luft und der Feuer (Tratado químico del aire y del fuego) publicado en 1777, describe cuidadosamente el descubrimiento del oxígeno y del nitrógeno. Para ese entonces ya habían aparecido los trabajos de Rutherford y Priestley, que se llevaron la fama de los descubrimientos [30, 34].
Kuhn [35] explica que el descubrimiento del oxígeno permitió el desarrollo de la Química moderna, entre otros factores, porque posibilitó la comprensión adecuada del fenómeno de la combustión. Descubrimiento que generó un cambio en uno de los paradigmas de la Química establecidos hasta ese momento: la teoría del flogisto.
Los numerosos e importantes descubrimientos hechos con los gases tenían que ser unificados en una teoría, lo que ocurrió a finales del siglo XVIII:
El descubrimiento del oxígeno no fue por sí mismo la causa del cambio en la teoría química; era necesario que Antoine Laurent Lavoisier (1743-1794) estuviese convencido de dos situaciones: la primera, que había algo que no encajaba en la teoría del flogisto (anomalía); la segunda, que los cuerpos en combustión absorbían alguna parte de la atmósfera, para luego descubrir que el oxígeno es, en efecto, la sustancia que la combustión extrae de la atmósfera [30, 35-36].
Lavoisier argumentaba que el aire se combinaba con los metales para formar un calcinado, pero no todo el aire se combinaba de esta manera, sino que solo lo hacía aproximadamente una quinta parte. ¿Por qué ocurría de este modo? [30, 35-36].
Lavoisier propone que el aire es una mezcla de dos gases en una proporción de 1:4. Un 20 % corresponde al "aire desflogisticado" de Priestley, era esta porción del aire la encargada de los procesos de combustión.
Fue Lavoisier quien dio a este gas su nombre, oxígeno, derivado de los vocablos que en griego significan «productor de ácidos», pues Lavoisier tenía la idea de que el oxígeno era un compuesto necesario de todos los ácidos. En esto, como se demostró posteriormente, estaba equivocado [30].
El 80 % restante del aire, que no permitía la combustión es un gas diferente "el aire flogisticado de Rutherford", Lavoisier lo llamó "azoe", de la palabra griega que significa sin vida, pero posteriormente lo reemplazó el término nitrógeno [30, 37].
En 1783 Cavendish quemó una muestra de su "gas inflamable" y comprobó que los vapores producidos al arder se condensan para formar un líquido, que al analizarlo, resultó ser "agua"; Lavoisier, enterado del experimento, llamó al gas de Cavendish hidrógeno "productor de agua", y dedujo que el hidrógeno ardía por combinación con el oxígeno, y que, por tanto, el agua era una combinación de hidrógeno y oxígeno. La conclusión de Lavoisier supone otro duro golpe a la teoría griega de los elementos, demostró que el agua no era una sustancia simple, sino el producto de la combinación de dos gases.
En 1789 Lavoisier publicó un libro (Tratado elemental de Química) que aportó al mundo una visión unificada del conocimiento químico en base a sus nuevas teorías y nomenclatura. Fue el primer texto moderno de química. Lavoisier murió en 1794, es recordado en la actualidad como "el padre de la Química moderna":
Uno de los más grandes químicos que jamás ha existido, fue muerto innecesaria e inútilmente en lo mejor de su vida. -Bastó un instante para cercenar esa cabeza, y quizá un siglo no baste para producir otra igual-, dijo Joseph Lagrange, el insigne matemático [30, 37].
La figura 2 muestra sellos postales en un mapa conceptual que relacionan el desarrollo histórico de los gases ideales: el sello 13 emitido por Grecia en 1961 muestra a Demócrito de Abdera en reconocimiento al "Democritus Nuclear Research Centre".
El sello 14 (Austria 1991) conmemora los 450 años de la muerte de Paracelso "Theophrastus Phillips Aureolus Bombastus von Hohenheim"; el sello 15 (Bélgica) muestra a Jan Baptista van Helmont, el primer investigador que acuño la palabra "gas" en el ámbito científico.
El sello 16 muestra la calcita, el mineral que calentó Joseph Black para documentar el dióxido de carbono: CaCO3 -> CaO + CO2.
El sello 17 emitido por Malí en 2011 es en honor de Henry Cavendish, conmemora los 200 años de la muerte de quien descubriera el hidrógeno (H2); el sello 18 emitido por Alemania en 1980 conmemora los 200 años del nacimiento del químico alemán Johann Wolfgang Döbereiner (1780-1849), Döbereiner es considerado el pionero en la catálisis con platino [38], estudió la reacción Zn + H2SO4 -> ZnSO4 + H2, que involucra la producción de gas hidrógeno utilizando platino como catalizador; el sello 19 emitido por las Maldivas con motivo de la llegada del nuevo milenio (2000) muestra a Joseph Priestley con la fórmula molecular del O2 "1774, Brithis Scientist Joseph Priestley discovers oxygen"; los sellos 20, 21 y 22 son en honor a Antoine Laurent Lavoisier, el sello 20 muestra su laboratorio, el sello 21 emitido por Francia en 1943 conmemora los 200 años de su nacimiento y el sello 22 emitido en 1983 (Malí) conmemora los 200 años de la determinación de la composición del agua. El sello 23 muestra al francés Philippe le Bon (1767-1804) que en 1799 obtuvo la patente de una "termolámpara", para obtener iluminación mediante gas [39].
Mapa conceptual No. 3: Aspectos disciplinares: Presión (P), Temperatura (T), Volumen (V) y Cantidad de Sustancia (n)
El comportamiento físico de un gas ideal es independiente de su composición química y se define por medio de las variables: presión, volumen, temperatura y cantidad de sustancia. La presión (P) se define, como la fuerza (F) por unidad de área (A), ver ecuación 1:
En el Sistema Internacional la unidad de presión es el pascal (Pa), que equivale a la presión de tipo uniforme, que una fuerza de 1 newton (N) desarrolla sobre un plano perpendicular y de área 1 metro cuadrado (m2). La unidad fue nombrada en homenaje al matemático y físico francés Blaise Pascal (1623-1662), debido a que el Pa es una unidad de presión muy pequeña, se suelen usar otras unidades como el bar (1 bar = 105 Pa), la atmósfera (1 atm = 101 325 Pa), el milímetro de mercurio (1 atm = 760 mmHg) y el torricelli (1 Torr = 1 mmHg) en honor al matemático y físico italiano Evangelista Torricelli (1608-1647).
La presión atmosférica se define como la presión que ejerce el aire sobre los cuerpos y disminuye con el aumento de la altura sobre el nivel del mar; se midió por primera vez en un aparato llamado barómetro de Torricelli, en la primavera de 1 644, Torricelli llevó a cabo el experimento:
Introdujo mercurio en el interior de un tubo de 1 m de longitud, abierto por un extremo y cerrado por el otro, una vez que el tubo estuvo completamente lleno invirtió la posición y lo volcó en un recipiente que a su vez contenía mercurio, después observó que la columna descendía parcialmente y se detenía en una altura aproximada de 76 cm. Torricelli interpretó que el espacio que quedaba libre estaba vacío y que la altura de la columna de mercurio dependía de la fuerza que el aire ejercía sobre la superficie del mercurio de la cubeta [40].
La presión de los gases se mide con un aparato llamado manómetro o tubo de Bourdon [41], es un tubo en forma de U, lleno parcialmente con mercurio. Un extremo se conecta con el recipiente que contiene el gas y el otro extremo se deja abierto a la atmósfera; el extremo conectado al recipiente, recibe los efectos de la presión del gas, una diferencia de altura (h) entre los dos niveles de mercurio permite calcular la presión manométrica del gas.
La temperatura (T) en un cuerpo es la propiedad que determina el flujo de calor hacia otro cuerpo o de otros cuerpos hacia él [42]. En 1592 Galileo Galilei (1564-1642) diseña el primer termómetro, un tubo de vidrio vertical, cerrado por ambos extremos, que contiene un líquido en el que se encuentran sumergidas varias esferas de vidrio cerradas; cada una de las esferas contiene, a su vez, una cierta cantidad de líquido coloreado. Al aumentar la temperatura, la densidad del líquido disminuye, este cambio densidad altera la flotabilidad de las ampollas. La posición de la ampolla que muestre flotabilidad neutra indica la temperatura.
Daniel Gabriel Fahrenheit (1 686-1 736), logró en 1714 el primer termómetro a base de mercurio, perfeccionando así el "termómetro de Galileo", su aporte más relevante fue el diseño de la escala termométrica arbitraria, que lleva su nombre, la escala se establece con las temperaturas de congelación y ebullición del agua, 32 0F y 212 0F respectivamente. En 1740 Anders Celsius (1701-1744), modificó la escala Fahrenheit tomando como puntos fijos los puntos de congelación y ebullición del agua al nivel del mar, 0 0C y 100 0C [43]. La escala kelvin o absoluta se debe al trabajo del físico y matemático escocés Lord William Thomson Kelvin (1824-1907), quien realizó múltiples contribuciones al estudio del calor, la importancia de esta escala es que tiene un significado físico propio, pues no depende de puntos fijos arbitrarios, sino de la visión de la temperatura como expresión de la cinética molecular [16, 44].
El volumen (V) es una magnitud derivada de la longitud y se define como la extensión en tres dimensiones de una región del espacio. La unidad de volumen en el Sistema Internacional es el metro cúbico (m3), en el caso de los gases, el volumen usualmente se mide en litros (L, 1 m3 =103 L) o decímetros cúbicos (dm3). Debido al pequeño tamaño de las partículas de las cuales se componen los gases, la mayor parte del volumen de un gas está compuesta por espacio vacío [19, 45].
El mol es la cantidad de sustancia (n) de un sistema que contiene entidades elementales (átomos, moléculas o iones), tantas como átomos en 0,012 Kg del isótopo de carbono 12, su símbolo es mol. El número de entidades en un mol es la constante de Avogadro, NA, con un valor aproximado de 6,022 136 5 x 1023, el último digito es incierto [16, 46].
La figura 3 muestra sellos postales en un mapa conceptual que muestra las variables (P, T, V y n) necesarias para definir el estado de un gas: el sello 24 fue emitido por la antigua Unión Soviética para conmemorar el aniversario 350 del nacimiento de Evangelista Torricelli; el sello 25 emitido por Francia en 1962, conmemora el aniversario 300 de la muerte de Blaise Pascal que en 1647 demostró que existía el vacío y en 1648 comprobó que la presión atmosférica disminuía a medida que aumentaba la altura [40]. Los sellos 26 y 27 emitidos por Italia (1958) y San Marino (1983) muestran el barómetro de Torricelli; el sello 28 emitido por Liberia (2000) hace referencia al estudio de la presión barométrica.
Los sellos 29-33 se relacionan con las diferentes escalas de temperatura: el sello 29 emitido por Suecia en 1982 muestra a Ander Celsius, el sello 30 emitido por Uganda, Tanzania y Kenia compara las escalas Fahrenheit y Celsius; el sello 31 (Australia, 1973) muestra la equivalencia entre 38 °C y 100 °F; el sello 32 (Ghana, 1976) con la temperatura corporal (37 °C) y los puntos de referencia de la escala Celsius: punto de congelamiento del agua (0 °C) y punto de ebullición del agua (100 °C) yel sello 33 emitido por Serbia en 2007 conmemora los 100 años de la muerte de Lord William Thomson Kelvin, el creador de la escala absoluta de temperatura. Los sellos 34 y 35 (Australia, 1973 y Guyana, 1982) muestran unidades de volumen: la onza liquida británica = 28,41 mL y el litro (L). El sello 36 emitido por Cuba en 1977 muestra las siete unidades fundamentales del Sistema Internacional (S.I.): el metro, el kilogramo, el segundo, el amperio, el kelvin, la candela y el mol como unidad de la cantidad de sustancia.
Mapa conceptual No. 4: Leyes de los gases
Los estudios de Evangelista Torricelli (inventor del barómetro) que demostró que el aire ejercía presión y del físico alemán Otto von Guericke (1602-1686) que demostró la presión ejercida por el peso de la atmosfera, despertaron gran interés en el estudio de las propiedades del aire.
Y excitaron en particular la curiosidad del químico irlandés Robert Boyle (1627-1691), quien proyectó una bomba de aire más perfeccionada que la de Guericke. En vez de, por así decir, extraer el aire de un recipiente aspirándolo, probó el procedimiento opuesto de comprimirlo [30].
Boyle comprobó experimentalmente que el volumen de una cantidad fija de gas ideal, es inversamente proporcional a la presión del gas [47]. Matemáticamente, la ley de Boyle se puede expresar mediante la ecuación 2:
La relación matemática se puede ampliar para dos estados del gas, (ecuación 3):
En los trabajos de Boyle no se especificó que durante los experimentos la temperatura se debe mantener constante. El físico francés Edme Mariotte (1630-1684), descubrió independientemente la ley de Boyle en 1680, especificando que se cumple en condición isotérmica (temperatura constante) [48]. Por esta razón, la ley que establece una relación inversa entre la presión y el volumen de un gas se conoce como la ley de Boyle-Mariotte.
En 1787 Jacques Alexandre César Charles (1746-1823) analizó el efecto de la temperatura en el volumen del oxígeno, hidrógeno, dióxido de carbono y aire; Joseph Louis Gay-Lussac (1778-1850) también estudio este fenómeno [36]. Los resultados de ambos científicos indicaban una relación directa entre el volumen y la temperatura, cuando la presión es constante (condiciones isobáricas). El enunciado de la ley de Charles y Gay-Lussac es: "A presión constante, el volumen ocupado por una masa definida de una muestra de gas es directamente proporcional a la temperatura" [19]. Matemáticamente esta ley puede expresarse según las ecuaciones 4 y 5:
La ley fue publicada primero por Gay-Lussac en 1803, pero tomaba como referencia el trabajo no publicado de Charles, lo que condujo a que la ley sea usualmente conocida como ley de Charles.
La relación existente entre los cambios de temperatura y presión a volumen constante (condición isocórica) se atribuye a Joseph Louis Gay-Lussac y a Guillaume Amontons (1663-1705). Las observaciones de ambos científicos se resumen en la segunda ley de Gay-Lussac: "A volumen constante, la presión de una masa fija de un gas es directamente proporcional a la temperatura" [19, 36]. Matemáticamente esta ley puede expresarse según las ecuaciones 6 y 7:
En este momento la diferencia entre átomos y moléculas no se entendía, el físico italiano Amadeo Avogadro (1776-1866) propone que los gases elementales no estaban formados por átomos simples, sino por agregados de átomos a los que llamo moléculas. En 1811 Avogadro establece su famoso principio: "volúmenes iguales de gases diferentes a las mismas condiciones de presión y temperatura contienen el mismo número de moléculas" [7]. El trabajo de Avogadro complementó los estudios de Boyle, Charles, y Gay-Lussac: "el volumen de cualquier gas debe ser proporcional al número de moléculas presentes", como puede expresarse según las ecuaciones 8 y 9:
La ecuación 9 es la expresión matemática de la ley de Avogadro, la cual establece: "que a presión y temperatura constantes, el volumen de un gas es directamente proporcional al número de moles del gas presente" [49]. El trabajo de Avogadro quedo en el olvido por aproximadamente 50 años [7]. En 1860, cuatro años después de su muerte, el primer congreso internacional de química fue realizado en Karlsruhe (Alemania), fue convocado por los químicos europeos para discutir temas de nomenclatura química, notación de fórmulas y masas atómicas.
El tema más importante del congreso fue la aclaración de la confusión entre masas atómicas y masas moleculares. En el último día del congreso Stanislao Cannizzaro (1826-1910) mostró como la hipótesis de Avogadro permitía una distinción entre átomos y moléculas. La idea fue rápidamente aceptada y la diferencia entre las masas atómicas y moleculares claramente reconocida. En este congreso se estableció que ciertos elementos, como el hidrógeno, nitrógeno y oxígeno, se componen de moléculas diatómicas (gaseosas) y no de átomos individuales. De acuerdo con Miller [7] a partir del congreso de Karlsruhe la ley del gas ideal se podía escribir como una combinación de las leyes de Boyle, Charles, Gay-Lussac y Avogadro (ecuación 10):
La ecuación 10 conocida como ecuación del gas ideal, explica la relación entre las cuatro variables de un gas ideal, un gas hipotético cuyo comportamiento de presión, volumen y temperatura se pueden describir completamente con la ecuación 10. El ingeniero francés, Benoit-Paul Emile Clapeyron (1799-1864) combinó la ley de Boyle y la ley de Gay-Lussac;en su famoso libro La fuerza directora del calor (Puissance motrice de la chaleur) de 1834 sobre el ciclo de Carnot, escribió la ecuación combinada según expresa la ecuación 11.
En 1850 el físico alemán, Rudolf Clausius (1822-1888), usando datos experimentales del químico francés, Henri Victor Regnault (1810-1878), reescribió la ecuación 11 para obtener la ecuación 12:
y en 1864 la simplificó utilizando la escala absoluta de temperatura para obtener la ecuación 13:
Clapeyron y Clausius usaron en las ecuaciones 11-13 el volumen por unidad de masa de gas (v). En 1873 el químico alemán August Friedrich Hortsmann (1842-1929) introduce el volumen molar ( ) y convierte la constante específica de Clapeyron y Clausius en la constante universal de los gases [50] (ver ecuación 14):
) y convierte la constante específica de Clapeyron y Clausius en la constante universal de los gases [50] (ver ecuación 14):
La figura 4 muestra sellos postales utilizados en un mapa conceptual que relaciona las leyes de los gases ideales: el sello 37 fue emitido en 2010 por Gran Bretaña, muestra a Robert Boyle y conmemora los 350 años de la Real Sociedad de Londres para el Avance de la Ciencia Natural (Royal Society of London for Improving Natural Knowledge) fundada en 1660; el sello 38 (Alemania 1977) muestra a Otto von Guericke con Los hemisferios de Magdeburgo, un par de grandes hemisferios de cobre que se ajustan con un anillo de acoplamiento para formar una esfera y que se utilizan para demostrar el poder de la presión atmosférica [51]; los sellos 39 y 40 de Granada (1987) e Irlanda (2012) hacen referencia a la ley de Boyle; el sello irlandés muestra en una gráfica la relación inversa entre el volumen y la presión de un gas ideal, y conmemora los 350 años de la ley de Boyle.
El sello 41 (en hoja filatélica) emitido por Nicaragua en 1999 muestra a Jacques Alexandre César Charles: "Unos 200.000 parisinos vieron a J.A.C. Charles y M.N. Robert cuando realizaban el primer ascenso en globo de hidrógeno y agitaban banderas a la multitud reunida al momento de partir de las Tullerías. El primero de diciembre de 1783, recorrer unos 48,3 kilómetros desde París les tomó 2 horas de viaje".
Los sellos 42 y 43 muestran a Joseph Louis Gay-Lussac, el sello Centroafricano de 1983 conmemora los 200 años de la primera ascensión del hombre en globo: "Gay-Lussac en 1804 efectúa un ascenso, alcanzando una altura de 4000 m". El sello francés de 1951 conmemora 100 años de la muerte (1850) de Gay-Lussac. El sello 44 (Italia 1956), hace referencia al principio de Avogadro: "volúmenes iguales de gases diferentes a las mismas condiciones de temperatura y presión contienen el mismo número de moléculas".
El sello 45 (Guinea-Bisáu 2009) conmemora los 150 años del nacimiento del sueco Svante August Arrhenius (1859-1927), ganador del premio Nobel de Química en 1903 "por su contribución al desarrollo de la química con sus experimentos en el campo de la disociación electrolítica" [52]; el sello muestra la ecuación de Arrhenius "dependencia de la constante de velocidad k de reacciones químicas con la temperatura T", con la energía de activación (Ea) de una reacción química y la constante universal de los gases (R). Los sellos 46 y 47 muestran a Jhon Dalton (1766-1844), el aporte de Dalton a los gases ideales es la ley de las presiones parciales: "la presión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si sólo uno ocupase todo el volumen de la mezcla, sin variar la temperatura" [19].
Teoría cinética de los gases
Un caso interesante y que ilustra el papel de las teorías en la construcción de conocimiento científico es el desarrollo y aceptación de la teoría cinética de los gases que ha sido sujeto de considerables debates y controversias en la historia y en la filosofía de la ciencia. En 1738, el físico suizo Daniel Bernoulli (1700-1782) en su obra "Hidrodinámica", publicó un desarrollo cuantitativo de un modelo cinético de los gases. "Pensaba que los corpúsculos de un gas en su rápido movimiento en todas las direcciones, chocan unos con otros y también con las paredes del recipiente". Bernoulli mostró una visión atomística del movimiento de las partículas de gas en el vacío y una equivalencia directa del calor con el movimiento interno.
Admitir que el calor no es más que el movimiento de las partículas era una idea revolucionaria que chocaba frontalmente con la teoría del calórico ( ) fueron pocos los científicos que expresaron puntos de vista favorables a la teoría de átomos moviéndose libremente, ni siquiera en los gases. Se aceptaba que vibraban alrededor de posiciones fijas, captados en un medio compuesto de calórico o éter. Incluso John Dalton (1766-1844), que publicó la teoría atómica en 1808, no llegó a admitir el movimiento intrínseco de los átomos, ni el concepto de vacío [53].
Un siglo después de los aportes de Bernoulli aparecen los primeros científicos que aceptan la teoría cinética. El inglés John Herapath (1790-1868) presentó en 1816 una descripción compresiva de la estructura de un gas, enunció una teoría similar a la de Bernoulli y encontró una relación entre la presión de un gas y la velocidad de sus partículas [54]. El químico escoces John James Waterston (1811-1883) en 1843 publicó su teoría cinética: "la presión de un gas es función del número de moléculas por unidad de volumen, N; la masa molar, M; y la velocidad cuadrática media molecular,  " [55]. El físico inglés James Prescott Joule (1818-1889) concluyó que la temperatura del gas es proporcional al cuadrado de la velocidad de las partículas y, por tanto, a la energía cinética de las mismas [53, 55].
" [55]. El físico inglés James Prescott Joule (1818-1889) concluyó que la temperatura del gas es proporcional al cuadrado de la velocidad de las partículas y, por tanto, a la energía cinética de las mismas [53, 55].
En la década 1850-1860 se dan las bases de la teoría cinética de los gases. El trabajo matemático para construir la teoría en función de datos experimentales fue realizado en poco tiempo por Rudolf Clausius (1822-1888) en Alemania, Jamex Clerk Maxwell (1831-1879) en Inglaterra y Ludwig Boltzmann (1844-1906) en Austria [53]. Clausius en su artículo "Sobre la naturaleza del movimiento que llamamos calor" de 1857 sugería que en el estado gaseoso las moléculas escapan de la influencia de sus vecinas y se desplazan en línea recta.
Los choques entre moléculas los consideró como colisiones elásticas. Maxwell aportó el enfoque estadístico de la teoría cinética de los gases, consideraba que las numerosas colisiones entre las moléculas de un gas produciría una distribución de velocidades de las moléculas con una probabilidad conocida [53]. Boltzmann justificó la hipótesis de Maxwell y obtuvo una ecuación para la evolución de la función de distribución de velocidades [55]. Los trabajos de Clausius, Maxwell y Boltzmann conducen a un modelo simple y directo:
Un gas ideal o perfecto consiste en un gran número de partículas, cuyas dimensiones son pequeñas en comparación con la distancia entre ellasy con el tamaño del recipiente que las contiene. Estas partículas están en continuo movimiento, un movimiento aleatorio en el que las colisiones son perfectamente elásticas y siguen las leyes de la mecánica clásica. La energía cinética promedio de las moléculas es proporcional a la temperatura absoluta.
Con este modelo fue posible calcular la presión, el camino libre medio, el número de colisiones por segundo, la viscosidad, la velocidad de difusión, la conductividad térmica y la distribución de velocidades moleculares con la ecuación de Maxwell-Boltzmann de 1859 [7]. Con la teoría cinética molecular se pudo calcular la velocidad de efusión de un gas por un pequeño agujero. La teoría muestra que a condiciones constantes de temperatura y presión, la velocidad de efusión es inversamente proporcional a la raíz cuadrada del peso molecular. Thomas Graham (1805-1869) había demostrado esta relación inversa en 1829, por lo que este resultado de la teoría cinética de los gases se conoce como ley de Graham [7].
El estudio de las propiedades de los gases fue revisado nuevamente a finales del siglo XIX cuando Henri Victor Regnault (1810-1878), desde datos experimentales demostró que al elevar la presión o al bajar la temperatura, los gases no seguían el comportamiento predicho por la ley de Boyle y su comportamiento se alejaba del de los gases perfectos o ideales [53]. Johannes Diderik Van der Waals (1837-1923) propone una ecuación (ecuación de los gases reales) que relaciona la presión, el volumen molar y la temperatura de un gas, incluyendo dos valores constantes para cada gas que consideraban las atracciones entre moléculas (a) y el tamaño de las mismas (b) (ecuación 15) [56]:
Esta vuelta a la realidad no significaría un abandono de la teoría cinética de los gases ni del modelo de gas ideal. En 1873, Van der Waals demostró que la teoría cinética podría explicar no sólo las propiedades de los gases, sino también, al menos aproximadamente, la transición de gas a líquido. A comienzos del siglo XX, Josiah Willard Gibbs (1839-1903) había desarrollado un método general de mecánica estadística que podía aplicarse a los tres estados de la materia [53].
De este modo, el campo de aplicación de la teoría cinética de los gases se extendió a otros estados de la materia, permitiendo profundizar en el conocimiento de sus propiedades macroscópicas. Un ejemplo, es la interpretación cinética del movimiento browniano, Albert Einstein (1879-1955) en 1905 demostró que pequeñas partículas suspendidas en un líquido pueden seguir las leyes de los gases. Jean Baptiste Perrin (1870-1942) realizó medidas experimentales que confirmaron las predicciones de Einstein y que en 1909 lo conducen a la determinación experimental del número de Avogadro [9].
La figura 5 muestra sellos postales relacionados con la teoría cinética de los gases: el sello 48 emitido por Guinea-Bisáu en 2009 conmemora los 120 años de la muerte de James Prescott Joule; el sello 49 (México 1967) muestra a Jamex Clerk Maxwell y Heinrich Rudolf Hertz (1857-1894).
El sello 50 (Austria 1981) conmemora los 75 años de la muerte de Ludwig Boltzmann, el sello 51 (Nicaragua 1971) hace referencia a la ley de Boltzmann, pertenece a una serie que muestra las 10 fórmulas que cambiaron la faz de la tierra, se incluyen entre otras: la ley de Pitágoras, Einstein y de Broglie. Los sellos 52, 53 y 54 muestran a van der Waals, el sello 52 (Suecia 1970) conmemora los 60 años de los premios Nobel de Física y Química de 1910: van der Waals y Otto Wallach (1847-1931), el sello representa las notas de laboratorio: de Wallach con la imagen de un compuesto alicíclico y de van der Waals con isotermas PV para un gas real. Los sellos 53 y 54 emitidos por Holanda hacen referencia a la ecuación de van der Waals y al premio Nobel de Física en 1910. El sello 55 emitido por Estados Unidos en 2005 muestra a Josiah Willard Gibbs como un pionero de la termodinámica. El sello 56 emitido por Argentina en 2005 con motivo del Año Internacional de la Física, muestra a Albert Einstein con una representación de la revista Annalen der Physik donde Einstein publicó (1905) los artículos del "Annus Mirabilis" sobre el efecto fotoeléctrico, el movimiento Browniano y la teoría especial de la relatividad [57]. El sello 57emitido por Guinea muestra a Jean Baptiste Perrin ganador del premio Nobel de Física en 1926. Perrin en 1909 calculó de forma exacta el número de Avogadro (número de moléculas contenidas en un mol de gas en condiciones normales) [58].
Identificación de los sellos postales recogidos en este trabajo
El "catálogo StampWorld" de sellos postales es una publicación online (www.stampworld.com) que reúne los sellos emitidos a nivel mundial. En la tabla 1 se muestra la identificación de los sellos ilustrados en este artículo.
TABLA 1. IDENTIFICACIÓN DE LOS SELLOS ILUSTRADOS EN ESTE TRABAJO
| Sello No. | País | Año de emisión | StampWorld No. |
| 1 | Estados Unidos | 1976 | 1 409 |
| 2 | Portugal | 2008 | 3 250 |
| 3 | Guinea-Bisáu | 2009 | 3 893 |
| 4 | Suecia | 1964 | 532 |
| 5 | Francia | 1986 | 2 525 |
| 6 | México | 1997 | 2 701 |
| 7 | Croacia | 1999 | 521 |
| 8 | Suiza | 1999 | 1 691 |
| 9 | Corea del Sur | 2006 | 2 501 |
| 10 | Eslovaquia | 2011 | 658 |
| 11 | Gran Bretaña | 1978 | 739 |
| 12 | Alemania (Berlín) | 1957 | 165 |
| 13 | Grecia | 1961 | 755 |
| 14 | Austria | 1991 | 2 032 |
| 15 | Bélgica | 1942 | 588 |
| 16 | Francia | 1986 | 2 556 |
| 17 | Mali | 2011 | No encontrado + |
| 18 | Alemania (RDA) | 1980 | 2 234 |
| 19 | Maldivas | 2000 | 3 382 |
| 20 | Granada | 1987 | 916 |
| 21 | Mali | 1980 | 965 |
| 22 | Francia | 1943 | 586 |
| 23 | Francia | 1955 | 1 029 |
| 24 | Antigua Unión Soviética | 1959 | 1 982 |
| 25 | Francia | 1962 | 1 390 |
| 26 | San Marino | 1983 | 1 282 |
| 27 | Italia | 1958 | 994 |
| 28 | Liberia | 2000 | 2 972 |
| 29 | Suecia | 1982 | 1 184A |
| 30 | Uganda, Tanzania y Kenia | 1971 | 184 |
| 31 | Australia | 1973 | 513 |
| 32 | Ghana | 1976 | 623 |
| 33 | Serbia | 2007 | 212 |
| 34 | Australia | 1973 | 512 |
| 35 | Guyana | 1982 | 505 |
| 36 | Cuba | 1977 | 2 272 |
| 37 | Gran Bretaña | 2010 | 2 807 |
| 38 | Alemania (RDA) | 1977 | 1 942 |
| 39 | Granada | 1987 | 1 703 |
| 40 | Irlanda | 2012 | 2 012 |
| 41 | Nicaragua | 1999 | 4 162 |
| 42 | Imperio Centroafricano | 1983 | 980 |
| 43 | Francia | 1951 | 903 |
| 44 | Italia | 1956 | 945 |
| 45 | Guinea-Bisáu | 2009 | 3 877 |
| 46 | Madagascar | 1993 | 1 532 |
| 47 | Islas Marshall | 2012 | 2 931 |
| 48 | Guinea-Bisáu | 2009 | 4 092 |
| 49 | México | 1967 | 1 315 |
| 50 | Austria | 1981 | 1 671 |
| 51 | Nicaragua | 1971 | 1 670 |
| 52 | Suecia | 1970 | 700 |
| 53 | Holanda | 1993 | 1 484 |
| 54 | Holanda |
| No encontrado + |
| 55 | Estados Unidos | 2005 | 4 071 |
| 56 | Argentina | 2005 | 2 989 |
| 57 | Guinea | 2002 | 3 381 |
+ sellos referenciados en http://th.physik.uni-frankfurt.de/~jr/physstamps.html
CONCLUSIONES
La filatelia es un arte que permite profundizar en diversos temas; en este artículo se han relacionado 57 sellos postales para realizar una descripción didáctica de las propiedades de los gases ideales. Discutir filatelia en el aula de clase, involucrando mapas conceptuales e historia pueden aumentar el entusiasmo de los estudiantes hacia la Química; en este caso, la filatelia dedicada a los científicos nos permitió discutir la historia, los aspectos disciplinares y los trabajos que dieron origen al concepto de gas ideal.
El uso de material filatélico (sellos postales, SPD y hojas filatélicas) con fines pedagógicos es la combinación de un arte y un interés profesional en una herramienta educativa que se puede enfocar a diferentes disciplinas del conocimiento.
REFERENCIAS BIBLIOGRÁFICAS
1. CALDIN, E. F. "The Structure of Chemistry". International Journal for Philosophy of Chemistry, 2002, 8, 103-121.
2. REGIS, A.; ALBERTAZZI, P. G. "Concept Maps in Chemistry Education". Journal of Chemical Education, 1996, 73(11), 1084-1088.
3. RAPPOPORT, Z. "Chemistry on Stamps". Accounts of Chemical Research, 1992, 25(1), 24-31.
4. CHENIER, P. J. "Postage Stamp Displays Teach Chemistry". Journal of Chemical Education, 1986, 63(6), 498-500.
5. MARTÍNEZ, J. G.; SALAS, J. M. "La Química a través de sus sellos: Una revisión comparativa de la filatelia dedicada a Mendeléiev" Anales de Química, 2007, 103(1), 50-57.
6. NORKUS, P.; NORKUS, E.; VAITAITIS, A. P. "Chemistry in philately 1. Symbols of Chemical Elements". Chemija, 2007, 18(4), 21-33.
7. MILLER, F. A. "Some Stamps Related to the Kinetic Molecular Theory of Gases". Journal of Chemical Education, 1986, 63(8), 685-686.
8. KAUFFMAN, G. "Nobel Laureates in Chemistry – A Philatelic Survey. Part I. 1901-1910". Journal of Chemical Education 1990, 67(6), 451-456.
9. KAUFFMAN, G. "Nobel Laureates in Chemistry – A Philatelic Survey. Part II. 1911-1934". Journal of Chemical Education, 1990, 67(7), 569-574.
10. KAUFFMAN, G. "Nobel Laureates in Chemistry – A Philatelic Survey. Part III. 1935-1988". Journal of Chemical Education, 1990, 67(9), 775-781.
11. MORGAN, M. A. "A Postage Stamp History of the Atom, part II: The Quantum Era". Philatelia Chimica et Physica, 1996, 18(3/4), 184-189.
12. HILLGER, D. W.; SOKOL, L. F. "The Modern Metric System on Postage Stamps". Journal of Chemical Education, 1988, 65(5), 384-387.
13. FAZIO, M.; ROTA, S. L. "Metrology on Stamps". Physics Education, 1995, 30, 289-297.
14. HILLGER, D. W. "Metric units and postage stamps". The Physics Teacher, 1999, 37, 507-510.
15. RABINOVICH, D. "A Philatelic Tribute to the SI". Chemistry International, 2010, 32(6), 4-5.
16. MARTÍNEZ-REINA, M. "Filatelia y Sistema Internacional de Unidades ". Anales de Química, 2012, 108(3), 215-224.
17. MARTÍNEZ-REINA, M.; AMADO-GONZÁLEZ, E. "Historia y didáctica de la Química a través de sellos postales: un ejemplo con Marie Curie". Educación Química, 2013, 24(1), 71-78.
18. NAWLAKHE, U. A.; NAWLAKHE, A. M. "International Year of Chemistry postage stamps: omnibus mass communicator". Current Science, 2011, 101(7), 830-831.
19. CHANG, R. Química, 6a ed., Ciudad de México, McGraw-Hill, 1999.
20. WOLFENDEN, J. H. "The Noble Gases and the Periodic Table". Journal of Chemical Education, 1968, 46(9), 569-576.
21. KAROL, P. J.; NAKAHARA, H.; PETLEY, B. W.; VOGT, E. "On the claims for discovery of elements 110, 111, 112, 114, 116, and 118". Pure and Applied Chemistry, 2003, 75(10), 1601-1611.
22. NASH, C. S. "Atomic and Molecular Properties of Elements 112, 114 and 118". The Journal of Physical Chemistry A, 2005, 109, 3493-3500.
23. RICHARDS, T. W. "Atomic Weights and Isotopes". Chemical Review, 1924, 1(1), 1-40.
24. The Nobel Prize in Chemistry 1904. Nobelprize.org. 27 de enero de 2016. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1904/index.html.
25. MORACHEVSKII; A. G. "Henri Moissan (To 150th Anniversary of His Birthday)". Russian Journal of Applied Chemistry, 2002, 75(10), 1720-1722.
26. HOUTEN, J. V. "A Century of Chemical Dynamics Traced through the Nobel Prizes. 1995: Paul Crutzen, Sherwood Rowland, and Mario Molina". Chemical Education Today, 2002, 79(10), 1182-1188.
27. RUBIN, M. B. "The History of Ozone. The SCHÖNBEIN Period, 1839-1868". Bulletin for the History of Chemistry, 2001, 26(1), 40-56.
28. FELDMAN, M. R.; TARVER, M. L. "Profiles in Chemistry. Fritz Haber". Journal of Chemical Education, 1983, 60(6), 463-464.
29. CANDEL, M. "Demócrito y Epicuro: el átomo como elemento y como límite onto-lógico". Convivium. Revista de Filosofía, 1999, 12, 1-20.
30. ASIMOV, I. Breve Historia de la Química, Madrid, Alianza Editorial, 1975. Disponible en: http://www.librosmaravillosos.com/brevehistoriaquimica/.
31. CHENG, Q. "Perspectives in Biological Nitrogen Fixation Research". Journal of Integrative Plant Biology, 2008, 50(7), 784-796.
32. PEREZ-BUSTAMANTE, J. A. "Descubrimiento de nuevos elementos químicos en el periodo de vida de J. L. Proust (En conmemoración del 250 aniversario del nacimiento de Proust)". Llull, Revista de la Sociedad Española de Historia de las Ciencias y de las Técnicas, 1995, 18, 517-544.
33. VENKATESWARAN, T. V. "Discovery of Oxygen: Birth of Modern Chemistry". Science Reporter, 2011, 48(4), 34-39.
34. SVEDBERG, G. A tribute at the memory of Carl Wilhelm Scheele (1742-1786),presented at the 2012 Annual Meeting of the Royal Swedish Academy of Engineering Sciences, Estocolmo, 2012. Disponible en: https://bloqm.files.wordpress.com/2013/12/a-tribute-to-the-memory-of-carl-wilhelm-scheele.pdf
35. KUHN, T. La Estructura de las Revoluciones Científicas, México, Fondo de Cultura Económica de México, 1971.
36. TRIANA, M. Propuesta experimental aplicada al aula para la enseñanza del tema de gases, Bogotá, Tesis de Maestría, Universidad Nacional de Colombia, 2002.
37. ANDRADE, L. E. "Lavoisier y la Química del siglo XVIII". Revista de la Academia Colombiana de Ciencias, 1990, 17(67), 785-793.
38. COLLINS, P. M. D. "The Pivotal Role of Platinum in the Discovery of Catalysis: The Pioneering work of Johann Wolfgang Döbereiner during 1820s". Platinum Metals Review, 1986, 30(3), 141-146.
39. ALAYO, J. C.; BARCA, F. X. Historia del Gas. 6. La Tecnología del Gas a través de su Historia, Barcelona, Fundación Gas Natural Fenosa, 2011.
40. HERRERA, R. M. "Historia del Experimento Barométrico". Pensamiento Matemático, 2012, 2(1), 14-24.
41. REIF-ACHERMAN; S.; MACHUCA-MARTÍNEZ, F. "Eugene Bourdon y la evolución del manómetro". Revista Brasileira de Ensino de Física, 2010, 32(1), 1601-1610.
42. GONZÁLEZ, J. P.; PÉREZ, R. "Análisis de la transposición didáctica de los conceptos de calor y temperatura en los libros de texto para la enseñanza de la Química". Tecné, Episteme y Didaxis, 2005, 17, 117-128.
43. VELASCO, S.; FERNÁNDEZ, C. "Un paseo por la historia de la termometría". Revista Española de Física, 2005, 19(3), 46-56.
44. SHERRY, D. "Thermoscopes, thermometers, and the foundations of measurement". Studies in History and Philosophy of Science, 2011, 42, 509-524.
45. WILLIAMS, D. J.; DYER, L. "Physics of gases". Anaesthesia &Intensive Care Medicine, 2006, 7(3), 97-100.
46. GORIN, G. "Mole, Mole per Liter, and Molar: A Primer on SI and Related Units for Chemistry Students". Journal of Chemical Education, 2003, 80(1), 103-104.
47. GARCÍA, C.; RUIZ, M. S. "La ley de Boyle, el análisis de dos experimentos". Revista Latinoamericana de Física Educativa, 2010, 4, 957-962.
48. MIRALLES, L. "Compleja historia de la formulación de la Ley de Boyle". Didáctica de las Ciencias Experimentales y Sociales, 2003, 17, 37-53.
49. MUÑOZ, R.; BERTOMEU, J. R. "La Historia de las Ciencias en los libros de texto: La(s) hipótesis de Avogadro". Enseñanza de las Ciencias, 2003, 21(1), 147-159.
50. JENSEN, W. B. "The Universal Gas Constant". Journal of Chemical Education, 2003, 80, 731-732.
51. PELKOWSKI, J. "El vacío de Guericke y sus virtudes". Meteorología Colombiana, 2001, 4, 127-138.
52. The Nobel Prize in Chemistry 1903. Nobelprize.org. 02 de febrero de 2016. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1903/.
53. BLANCO, Á.; RUÍZ. L.; PRIETO, T. "El desarrollo histórico del conocimiento sobre las disoluciones y su relación con la teoría Cinético-Molecular. Implicaciones Didácticas". Enseñanza de las Ciencias , 2010, 28(3), 447-458.
54. WISNIAK, J. "John Herapath – The beginning of the kinetic theory of gases". Indian Journal of Chemical Technology, 2004, 11, 275-285.
55. WISNIAK, J. "Kinetic Theory – From Euler to Maxwell". Indian Journal of Chemical Technology, 2005, 12, 730-742.
56. BONILLA, B.; HERRERA, J. N. "Revisando la ecuación de van der Waals". Revista Mexicana de Física E, 2006, 52(1), 65-77.
57. GALINDO, A. "En recuerdo de Albert Einstein (1)". Revista Española de Física, 2005, 19(1), 2-3.
58. The Nobel Prize in Physics 1926. Nobelprize.org. 02 de febrero de 2016. http://www.nobelprize.org/nobel_prizes/physics/laureates/1926/.
Recibido: 12/02/2016
Aceptado: 6/05/2016
Msc. Marlon Martínez-Reina, Universidad de Pamplona, Facultad de Ciencias Básicas, Pamplona, Colombia, marlon.martinez@unipamplona.edu.co