Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.29 no.1 Santiago de Cuba ene.-abr. 2017
ARTICULOS
Características promotoras de crecimiento vegetal en rizobacterias aisladas de suelos contaminados con compuestos fenólicos
Promoting Plant Growth Characteristics in Isolated Rizobacterias of Soil Contaminated with Compound Phenolic
MSc. Irasema Pérez-PortuondoI; Lic. Lidieska Meriño-ReyesII, Dra. C. Arelis Ábalos-RodríguezI; Dra. C. Rosa María Pérez-SilvaI
ICentro de Estudios de Biotecnología Industrial (CEBI), Universidad de Oriente, Santiago de Cuba, Cuba, rperezs@uo.edu.cu
IIEspecialista CITMA, Empresa Geocuba Oriente-Sur, Santiago de Cuba, Cuba
RESUMEN
El motivo de investigación fue determinar características de promotoras de crecimiento vegetal en cepas aisladas de rizosfera de plantas crecidas en suelo contaminados con compuestos fenólicos. Se colectaron plantas que visualmente tenían una representatividad dentro del conjunto que crecía en el Área Movimiento y Almacenaje de Productos (MAP) de la Refinería "Hermanos Díaz". Las plantas fueron extraídas cuidando que sus raíces no fueran dañadas y depositadas en bolsas plásticas para preservarlas, llevadas al Laboratorio y conservadas a 4 °C hasta su uso, dentro de los 30 días. La característica de promotora de crecimiento vegetal fue determinada por técnicas colorimétricas cualitativas para la detección de metabolitos como ácidos orgánicos, ácido indolacético (IAA) y acetoína. Se determinó el potencial para fijar el nitrógeno y solubilizar el fosfato. En total, se lograron 63 aislados bacterianos de las rizosferas de 4 plantas, de las cuales 52 mostraron características de promotoras del crecimiento vegetal.
Palabras clave: rizobacteria, compuestos fenólicos, promotoras de crecimiento vegetal.
ABSTRACT
The reason for this research was to determine characteristics of plant growth promoters in isolated strains of rhizosphere of plants grown in soil contaminated with phenolic compounds. For this, plants that visually had a representative within the group that grew in the Movement and Storage Area Product (MAP) "Hermanos Díaz" Refinery were collected. Plants were extracted taking care that their roots were not damaged and deposited in plastic bags to preserve them, taken to the laboratory and stored at 4 °C until use within 30 days. The promoting plant growth characterization was determined by qualitative colorimetric techniques for detecting these metabolites how organic acid, indolacetic acid (IAA) and acetoin. Also was determined the potential for nitrogen fix and phosphate solubilisation. In total 63 bacterial isolates were obtained from the rhizosphere of 4 floors, of which 52 showed features of plant growth promoters.
Keywords: rizobacteria, phenolic compound, plant growth promoters.
INTRODUCCIÓN
La actividad microbiana en la vecindad de las raíces (rizosfera) ofrece un ambiente favorable para el cometabolismo de los químicos recalcitrantes, muchos de los cuales, debido a su naturaleza, no pueden ser tomados por las plantas. Por tanto, las transformaciones desarrolladas por los microorganismos en el suelo pueden jugar un papel importante en hacerlos accesibles para ser tomados y degradados por las plantas [1].
Las bacterias que al mismo tiempo degraden contaminantes orgánicos, y tengan la capacidad de actuar como promotoras del crecimiento vegetal para las plantas, son usadas en los protocolos de fitorremediación permitiendo que el proceso de remediación sea más eficaz debido a la relación que se establece entre la planta y las bacterias [2].
Las bacterias que habitan en las rizosfera de las plantas, que viven en terrenos contaminados, tienen más probabilidades de ser buenas degradadoras de compuestos tóxicos, apoyados en las evidencias de las ventajas que aportan las plantas al proporcionar precursores de estructuras similares a los compuestos objeto de degradación, todo lo cual potencia dicho proceso al seleccionar rutas de degradación específicas para estos contaminantes.
MATERIALES Y MÉTODOS
Aislamiento de rizobacterias a partir de plantas que viven en suelos contaminados con compuestos fenólicos
Se colectaron plantas que visualmente tenían una representatividad dentro del conjunto que crecía en el Área Movimiento y Almacenaje de Productos (MAP) de la Refinería "Hermanos Díaz" de Santiago de Cuba. Las plantas fueron extraídas cuidando que sus raíces no fueran dañadas y depositadas en bolsas plásticas para preservarlas, llevadas al Laboratorio y conservadas a 4 °C hasta su uso, dentro de los 30 días. Se tomaron ejemplares suficientes para la extracción de bacterias, así como para la identificación botánica de las mismas.
Las plantas fueron sacudidas ligeramente para limpiarles el exceso de tierra. En condiciones de esterilidad, las raíces fueron cortadas e inmediatamente sellados los cortes con parafina para prevenir contaminanción con endobacterias. Se pesó 1 g de raices que fue depositado en frascos con 100 mL de solución de MgSO4.7 H2O, 10 mM. Los frascos fueron llevados a un sonicador para obtener en la solución las rizobacterias. Las condiciones del sonicador fueron dos intervalos de 2 min con 120 seg de pulso cada uno con un total de 4 min para cada muestra, mantenida en un baño de hielo. Se dejó reposar unos minutos.
Se tomó 1 mL del sobrenadante, considerado como el cultivo puro, y se realizaron diluciones seriadas del mismo utilizando como diluente la solución de partida. Se inocularon 10 µL de cada dilución y del cultivo puro en placas con agar nutriente. Las placas fueron incubadas de 24-40 h a 30 °C. Las colonias separadas fueron recultivadas para su purificación en otras placas con agar nutriente. Se tomaron hasta 10 representantes de cada tipo de colonia diferente observadas en las placas. Las bacterias fueron llevadas a tubos con cuñas de agar nutriente para constituir el banco de trabajo. Las bacterias además fueron conservadas en medio glicerol a 4 °C.
Determinación de características de promotoras de crecimiento vegetal en rizobacterias de plantas crecidas en suelos contaminado con compuestos fenólicos
La capacidad de las bacterias aisladas para promover el crecimiento vegetal fue determinada atendiendo a varias propiedades como: capacidad para producir ácidos orgánicos, la auxina ácido indolacético (IAA) y acetoína. Además, se determinó el potencial para fijar el nitrógeno y solubilizar el fosfato.
Medios de cultivos
Medio-ST (medio Sacarosa-triptona para determinar la producción de ácidos orgánicos) se compuso de (g.L-1): Sacarosa (20), Triptona (5), solución de elementos trazas (SET) (10 mL). La solución SET estuvo compuesta por (mg por litro): Na2MoO4.2H2O (20), H3BO3(200), CuSO4.5H2O (20), FeCl3(100), MnCl2.4H2O (20), ZnCl2(280) [3].
Medio NBRIP (medio National Botanical Research Institute's Phosphate, para determinar la capacidad solubilizadora de fosfato) se compuso de (g.L-1): Glucosa (10), Ca3(PO4)2(5), MgCl2.6H2O (5), MgSO47H2O (0,25), KCl (0,2), (NH4)2SO4(0,1), Agar (15) [4].
Medio Voges-Proskauer (medio para determinar la producción de acetoína) se compuso de (g.L-1): Peptona (7), Glucosa (5), KH2PO4(5), pH 7,0 ±0,2 unidades.
Procedimiento
La capacidad de las r+izobacterias aisladas para promover el crecimiento vegetal fue evaluada atendiendo a varias propiedades como: capacidad para producir ácidos orgánicos, la auxina ácido indolacético (IAA) y acetoína. Además, se determinó el potencial para fijar el nitrógeno y solubilizar el fosfato.
La producción de ácidos orgánicos se evaluó acorde al método colorimétrico de [3], adicionando el indicador Alizarina roja al 0,1 % luego de inocular las bacterias en medio sacarosa-triptona (ST). El indicador cambia de rosa al amarillo por la acumulación de los ácidos orgánicos en el medio.
La producción de ácido indolacético (IAA) se evaluó mediante el ensayo de Salkowski [5]. Esta producción se ensayó inoculando las bacterias en medio rico suplementado con 0,5 g.L-1 de triptófano. Después de la incubación se añadió 1 mL del reactivo de Salkowski. La positividad del ensayo se observó mediante el cambio de amarillo a rosa producto de la unión de las moléculas de IAA al hierro del reactivo [6].
Las cepas que utilizan la vía del butilenglicol para producir acetoína fueron detectadas inoculando las mismas en medio Voges-Proskauer. Luego de 48 h de incubación se indujo una respuesta colorimétrica acorde a [7], para observar las colonias positivas mediante la cual la acetoína producida se transforma en diacetil dando una coloración rosa-rojiza al combinarse con a-naftol y KOH.
La capacidad de fijar el nitrógeno fue ensayada por el método descrito por [8]. Las bacterias fueron cultivadas en medio N con bromotimol azul como indicador del cambio de pH ocurrido. El medio fue preparado con y sin NH4Cl como fuente de nitrógeno mineral e incubado 336 h a 30 °C. Se evaluó el cambio de color. Solo las bacterias que poseen la enzima nitrogenasa, que catalizan la reducción del nitrógeno atmosférico a amonio, provocan el cambio de color en el medio sin NH4Cl.
El ensayo para detectar las bacterias que solubilizan el fosfato fue desarrollado acorde a [4]. Las cepas crecidas en un medio rico fueron inoculadas en placas con medio NBRIP que contiene el fosfato en una forma insoluble (Ca3(PO4)2) e incubadas a 28 °C por 12 días. Se evaluó el halo (zona de solubilización) alrededor de las colonias reportando su diámetro en cm. Todos los ensayos se realizaron por triplicado.
RESULTADOS Y DISCUSIÓN
Aislamiento y catacterización de rizobacterias a partir de plantas que viven en suelos contaminados con compuestos fenólicos
Para el estudio, se muestreó en áreas de una refinería de petróleo donde la literatura refiere que los suelos cercanos se encuentran contaminados no solo con petróleo sino con compuestos fenólicos de diverso tipo que se forman durante el proceso de refinación o que acompañan al crudo. En el lugar muestreado se encontró abundancia de plantas, generalmente herbáceas, y pocos ejemplares de tipo arbustivo. Se observaron cuatro tipos distintivos y tres de ellos con gran cantidad de ejemplares. Se tomaron muestras de estos ejemplares y se trasladaron al laboratorio (figura 1).
Las plantas fueron identificadas en el Centro Oriental de Ecosistemas y Biodiversidad (BIOECO). Los ejemplares recogidos tuvieron dos representantes de la Familia Cyperaceae: Cyperus rotundus L (planta 1) y Scleria sp (planta 2) y un representante de la Familia Poaceae: Cynodon dactylon (L) (planta 3). Todas son de la Clase Monocotyledonea. Se tomaron también ejemplares representantes de la Familia Fabaceae , especie Cassia sp. (planta 4) perteneciente a la Clase Magnoliopsida.
Las raíces de tres de las plantas fueron fibrosas, características de las monocotiledóneas. Para obtenerlas se rechazó la parte más cercana al tallo y superficie del suelo utilizando el resto de la raíz. La cuarta planta, perteneciente a las Magnoliopsida, tenía la raíz pivotante con raices secundarias, característica de las plantas dicotiledóneas. Para obtener la muestra de estas se rechazó la parte cercana al tallo y superficie del suelo, tomándose las raices secundarias y la raíz principal para la obtención de las bacterias.
Se realizó el conteo de bacterias de la solución obtenida luego de la sonicación de las raíces de las plantas muestreadas. Se observó en todas las soluciones una elevada concentración de bacterias, siendo mayores para las especies Scleria sp y Cassia sp (plantas 2 y 4 respectivamente) (tabla 1).
TABLA 1. CONTEO BACTERIANO DE LAS SOLUCIONES OBTENIDAS DE LAS PLANTAS CRECIDAS EN AMBIENTES CONTAMINADOS
| Planta | Concentración bacteriana (UFC/g de raices) |
| Cyperus torundus | 2,6x104 |
| Scleria sp | 5,0x109 |
| Cynodon dactylon | 2,0x105 |
| Cassia sp | 1,0x107 |
Los aislados bacterianos fueron extraídos del rizoplano de la raíz [9], resultados inferiores a los reportados en la literatura de rizosferas consultadas.
La rizosfera es la zona del suelo más cercana a las raíces de las plantas, donde se alberga consorcios de microorganismos capaces también de degradar plaguicidas, provee un hábitat para un amplio rango de microorganismos.
El número bacteriano en la rizosfera frecuentemente excede los 109 células por gramo de peso seco del suelo, aproximadamente de 10-100 veces mayor que en el suelo no cultivable. Esto es debido a la presencia de nutrientes como: azúcares, aminoácidos, ácidos orgánicos y otras pequeñas moléculas que se encuentran en los exudados de las raíces de las plantas que pueden constituir un tercio del carbono que es fijado por las mismas [10].
El procedimiento de aislamiento de rizobacterias condujo a la obtención de un total de 63 aislados bacterianos, los cuales fueron conservados en cuñas de agar nutriente a 4°C para usos posteriores.
Características de promotoras de crecimiento vegetal de los aislados de rizosfera de plantas crecidas en ambientes contaminados con compuestos fenólicos
Los microorganismos de rizosfera establecen relaciones no patogénicas con sus hospedadores que pueden incrementar su crecimiento y la resistencia a estrés biótico o abiótico. Algunos microorganismos proporcionan nutrientes directamente, como nitrógeno o fósforo, otros, los ponen en condiciones de ser utilizados, también los hay que producen sustancias promotoras del crecimiento (fitohormonas), entre otros. En base a estas propiedades, se ha atribuido, en su conjunto, el acrónimo PGPR (del inglés, rizobacterias que promueven el crecimiento vegetal). Aunque la mayoría de las interacciones positivas más importantes ocurren a nivel de raíz no hay que olvidar otras partes de la planta, como la filosfera, donde la abundancia de microorganismos es manifiesta [11].
Los mecanismos por los que los PGPR manifiestan su actividad son varios y no del todo completamente conocidos. Ligada a la promoción del crecimiento aparece la producción de hormonas: auxinas, giberelinas, citoquininas, etileno, entre otros. En relación con la protección frente a patógenos, puede detectarse antagonismos, producción de antibióticos, liberación de enzimas como chitinasas y glucanasas, que actúan sobre la pared de los hongos o cubiertas de los insectos, entre otros., además de la inducción de una resistencia sistémica, de toda la planta, a virus, bacterias y hongos. Y más directamente relacionadas con la nutrición, la fijación de nitrógeno, la solubilización de fosfato y otros nutrientes, la movilización de los mismos, etcétera [2].
Una cuestión importante a tener en cuenta en el estudio de esta microbiota (término que encuadra a los microorganismos en su conjunto y que ha sustituido al antiguo de microflora), es que toda ella está en competencia consigo misma y se puede modificar si cambian las condiciones ambientales, como la simple adición de fertilizante, que puede ser positiva en una dirección o contraproducente en otra. La fijación de nitrógeno no ocurre, por ejemplo, si el suelo se abona con nitrato, amonio, urea, etc. Pero así como la presencia de otros organismos puede ser detrimental para el propio PGPR, otras veces es beneficiosa. La producción o liberación de vitaminas y otros factores de crecimiento por microorganismos neutros de la rizosfera favorecen la actuación de PGPR potenciales que requieren de estos compuestos [2].
La colonización de la raíz se considera un requisito importante para que el microorganismo asociado ejerza su función. La colonización y la supervivencia dependen de factores físicos, químicos y biológicos tan importantes como el pH, la textura del suelo, disponibilidad de nutrientes, humedad, temperatura, presencia de materia orgánica, competencia con otros microorganismos por la ocupación del mismo nicho, y el propio "quorum sensing", fenómeno tan de actualidad, y que se entiende como el control que cada microorganismo tiene sobre su propia población manteniéndola a través de un intercambio de señales dentro de unos límites determinados [12].
Prácticamente toda la investigación realizada sobre la microbiota del suelo se ha llevado a cabo sobre los microorganismos cultivables. Ahora se conoce la existencia en la rizosfera de una gran cantidad de organismos viables pero no cultivables (VBNC) y que representan una alta proporción en el conjunto de la población del suelo que algunos llevan a más del 90 %. De ellos, unos pueden estar en estado de dormencia permanente, otros, aún siendo muy activos, como los hongos formadores de micorrizas, no crecen en los habituales medios de cultivo. Algunos autores afirman dice que unos pueden estar simplemente muertos, solo se detectan por métodos indirectos, de ahí la polémica que existe acerca de estos organismos VBNC [10, 11, 12].
A los efectos directos e indirectos ya apuntados debidos a estos organismos hay que añadir su participación en los ciclos biogeoquímicos de los elementos que pasan por etapas de libre disposición para las plantas y por otras que los estabilizan y quedan listos para su utilización posterior [11].
En este conjunto, no hay que olvidar la materia orgánica que tiene una importancia clave en la nutrición. Su presencia, además de mejorar las características físicas del suelo, es imprescindible para la vida microbiana y de su transformación se van a derivar compuestos directamente asimilables por las plantas y otros que van a facilitar la solubilización y movilización de muchos nutrientes [11].
Las bacterias asociadas a plantas pueden promover el crecimiento y desarrollo de estas por medio de mecanismos directos e indirectos [12, 2]. Los mecanismos directos influyen en facilitar la adquisición de recursos como son los nutrientes. Entre los nutrientes que pueden ser adquiridos con ayuda de este tipo de bacterias se encuentran el nitrógeno, hierro y fósforo.
También puede ser modulando los niveles de fitohormonas. Dentro de los mecanismos indirectos se encuentran la producción de antibióticos y enzimas líticas, producción de etileno o induciendo la resistencia sistémica [12, 2].
En este trabajo, para dar seguimiento a esto, fueron seleccionadas las pruebas: producción de ácidos orgánicos y la capacidad de solubilizar el fosfato como mecanismos directos, así como producción de acetoína como mecanismo indirecto.
Los ensayos realizados mostraron que la aparición de las características de promotoras del crecimiento vegetal evaluadas difirió en las cuatro plantas seleccionadas (figura 1), indicando que la especie vegetal influye en la colonización y aparición de estas especies, a pesar de haber sido recogidas del mismo ambiente (tablas 2, 3, 4 y 5). Se observó, además, que la característica menos frecuente de encontrar fue la producción de acetoína, y la más frecuente la capacidad de producir ácidos orgánicos, al obtener solo 5 aislados productores de la primera y 45 productores de ácidos orgánicos.
Varios autores han mostrado que las características de promover el crecimiento vegetal es típico de bacterias que crecen en las raíces de las plantas o en la zona de la rizosfera; explicando, además, que se desarrolla una interacción entre la planta y las bacterias que la rodean, donde las bacterias se benefician de muchos compuestos que la planta exuda y, a la vez, las plantas también se benefician de los productos bacterianos excretados, así como de compuestos parcialmente metabolizados que se vuelven asequibles para ellas [12, 9, 3].
TABLA 2. PROPIEDADES DE PROMOTORES DE CRECIMIENTO VEGETAL DE LOS AISLADOS DE CYPERUS ROTUNDUS
| Aislados | Producción Acetoína (+/-) | Producción de ácidos orgánicos (+/-) | Solubilización de fosfato (halo en cm) |
| 40 | - | + | 0,1 |
| 41 | - | - | - |
| 42 | - | + | 0,3 |
| 43 | - | - | - |
| 44 | - | - | - |
| 45 | - | + | 0,1 |
| 46 | - | + | - |
| 47 | + | - | 0,5 |
| 48 | - | + | 0,1 |
| 49 | - | - | - |
| 50 | - | + | 0,4 |
| 51 | - | + | 0,1 |
| 52 | - | + | 0,1 |
| 53 | - | + | 0,1 |
| 54 | - | + | 0,1 |
| 55 | - | + | - |
| 56 | - | + | 0,2 |
| 57 | - | - | - |
| 58 | - | - | - |
Los resultados obtenidos en la determinación de las características de promotoras del crecimiento vegetal permitieron apreciar que C. rotundus y Cassia sp fueron las que menos aislados mostraron con estas características, mientras que Cynodon dactylon fue la que más aportó.
TABLA 3. PROPIEDADES DE PROMOTORES DE CRECIMIENTO VEGETAL DE LOS AISLADOS DE SCLERIA SP
| Aislados | Producción Acetoína (+/-) | Producción de ácidos orgánicos (+/-) | Solubilización de fosfato (halo en cm) |
| 59 | - | + | - |
| 60 | - | + | - |
| 61 | - | + | - |
| 62 | - | + | 1,2 |
| 63 | - | + | 0,4 |
| 64 | - | + | 0,1 |
| 65 | - | - | - |
| 66 | - | + | - |
| 67 | - | - | - |
| 68 | - | + | - |
| 69 | - | + | 0,5 |
| 70 | - | + | - |
| 71 | - | - | 0,3 |
| 72 | - | + | 1,7 |
| 73 | - | - | 0,4 |
| 74 | - | - | 0,4 |
| 75 | - | + | 0,2 |
TABLA 4. PROPIEDADES DE PROMOTORES DE CRECIMIENTO VEGETAL DE LOS AISLADOS DE CYNODON DACTYLON
| Aislados | Producción Acetoína (+/-) | Producción de ácidos orgánicos (+/-) | Solubilización de fosfato (halo en cm) |
| 76 | - | + | 0,1 |
| 77 | - | + | - |
| 78 | - | + | - |
| 79 | - | + | 0,5 |
| 80 | - | + | - |
| 81 | - | + | 0,2 |
| 82 | - | + | - |
| 83 | - | + | - |
| 84 | - | + | 2,9 |
| 85 | - | + | 0,1 |
| 86 | + | + | - |
| 87 | + | + | - |
| 88 | + | + | - |
| 89 | - | + | - |
TABLA 5. PROPIEDADES DE PROMOTORES DE CRECIMIENTO VEGETAL DE LOS AISLADOS DE CASSIA SP
| Aislados | Producción Acetoína (+/-) | Producción de ácidos orgánicos (+/-) | Solubilización de fosfato (halo en cm) |
| 90 | - | + | - |
| 91 | - | + | 0,3 |
| 92 | - | + | - |
| 93 | + | + | 0,4 |
| 94 | - | + | - |
| 95 | - | - | 1,2 |
| 96 | - | - | - |
| 97 | - | - | 0,7 |
| 98 | - | - | - |
| 99 | - | - | - |
| 100 | - | + | 0,3 |
| 101 | - | - | - |
| 102 | - | + | 0,7 |
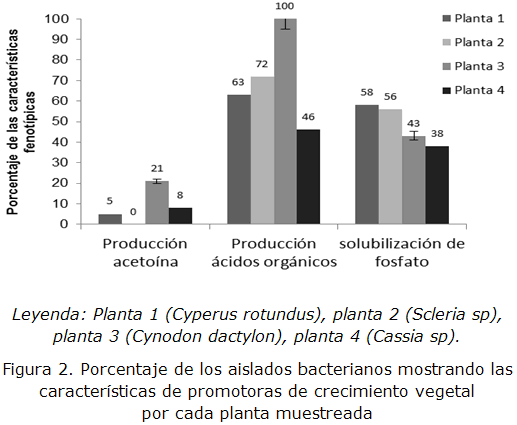
La figura 2, muestra los porcentajes de aislados obtenidos con algunas de las características de promotoras de crecimiento vegetal, destacándose la planta Scleria sp. (planta 2) con un 72 % de aislados con características de producir ácidos orgánicos y 56 % de aislados capaces de solubilizar fosfato.
Por su parte, Cyperusrotundus (planta 1) solo aportó un 5 % de aislados con características de producir acetoína, 63 % de aislados con capacidad de producir ácidos orgánicos y 58 % de aislados capaces de solubilizar fosfatos. Sin embargo, el 100 % de los asilados obtenidos de la planta 3 (Cynodon dactylum) dieron positivo a los ensayos de solubilización de fosfatos.
Las bacterias relacionadas con la liberación del fósforo se han considerado siempre como paradigma de las PGPR y han sido conocidas por mucho tiempo como IPSB (del inglés, bacterias solubilizadoras de fosfato inorgánico). Son muy variadas y están ampliamente extendidas por todos los suelos y condiciones ambientales. Los valores de fósforo asimilable en los suelos son generalmente bajos para soportar un cultivo intensivo, mientras que la cantidad total del mismo es más que suficiente. Muchas bacterias y hongos son capaces de liberar ácidos orgánicos que solubilizan el llamado fosfato de roca. No solo el fosfato, también ponen en condiciones de ser utilizado por las plantas micronutrientes que en determinados suelos están insolubilizados, como el manganeso [13].
De manera general, de todas las plantas se aislaron bacterias solubilizadoras de fosfatos pero de la planta C. dactylon se aisló la mejor solubilizadora con un halo de 2,9 cm (aislado 84), seguida por Scleria sp con dos aislados con halos de 1,2 (aislado 62) y 1,7 cm (aislado 72) (tablas 2-5).
En la agricultura, el fósforo es el segundo nutriente luego del nitrógeno en términos de requerimientos cuantitativos para los cultivos. Este se encuentra en el suelo, plantas y microorganismos en ambas formas orgánica e inorgánica, pero solo una pequeña parte está disponible para las plantas debido a su fijación química y su baja solubilización [14].
En los suelos de la rizosfera esudiada, el contenido de nitrato es muy bajo, 3,82 mg.g-1 de suelo mientras que el de fosfato es de 5,6 x 10-2 mg.g-1 de suelo, resultado que indica que no tiene concen t ración suficiente de nutrientes para que la població n microbiana pueda asimilar y degradar los contaminantes clorofenólicos presentes en los suelos estudiados [15]. El suelo objeto de análisis está sometido continuamente a aportes de contaminantes de residuos industriales, pero no se tiene claridad sobre la fuente de aporte de fosfato.
La deficiencia en fósforo es la mayor limitación para la producción agrícola y bajo ciertas condiciones los microorganismos ofrecen un sistema de rescate biológico capáz de solubilizar las formas insolubles de fósforo y hacerlo disponible para las plantas [14].
Típicamente, la solubilización del fósforo inorgánico ocurre a consecuencia de ácidos orgánicos de bajo peso molecular como el ácido cítrico y glucónico, los cuales son sintetizados por bacterias del suelo [2].
Se conocen otros ácidos orgánicos producidos por las bacterias como son oxálico, malónico, láctico, málico, 2-cetoglucónico, entre otros [16]. No obstante, la cantidad de ácidos orgánicos producidos, la solubilización del fosfato es más relacionada con la producción de los ácidos cítrico, glucónico y 2-ceto-glucónico que con los otros; de ahí que aunque en el trabajo presentado se encuentre un gran número de bacterias productoras de ácidos orgánicos, no necesariamente esta característica está estrictamente relacionada con la solubilización del fosfato.
Se ha planteado en la literatura que la solubilización de fosfato es el resultado de la acidificación del espacio periplásmico, debido a la oxidación directa de la glucosa para formar los ácidos orgánicos [16].
Por el contrario, otros autores habían planteado que los ácidos orgánicos producidos por las bacterias solubilizadoras no son determinantes en la solubilización y que el único factor determinante es la concentración de iones hidronios originados, que se producen en la respiración o en la asimilación de iones amonio (NH4+) [17], lo cual altera el pH del medio, lo suficiente, para movilizar minerales del suelo. En este trabajo se evaluaron las capacidades de producir ácidos orgánicos y de solubilizar el fósforo insoluble.
Algunos agentes biocontroladores inducen un cambio sostenido en las plantas e incrementan su tolerancia a la infección contra patógenos bacterianos y fúngicos, un fenómeno conocido como Resistencia Sistémica Inducida. Varias rizobacterias patógenas tienen la habilidad de inducir este estado de resistencia en las plantas [11].
Kloeper y col (2004) estudiaron este mecanismo en un Bacillus spp promotor del crecimiento vegetal, encontrando que la bacteria activó la resistencia sistémica inducida en Arabidopsis mediante la producción de 2,3-butanodiol [18]. Otra molécula que al igual que el 2,3-butanodiol induce esta resistencia es su derivado, la 3-hidroxibutanona, más conocida como acetoína [19]. En este trabajo se encontraron 5 aislados capaces de producir acetoína.
Basado en esta evaluación fueron seleccionados las bacterias que presentaban las tres características seguidas de las que presentaban dos. Se seleccionaron entonces 31 bacterias para posteriormente relizar ensayos de tolerancia y degradación a ompuestos clorofenólicos, como el 4-clorofenol, 2,4-diclorofenol y 2,4-D.
CONCLUSIONES
Se lograron obtener 63 aislados bacterianos de las rizosferas de 4 plantas, extraídas de suelos contaminados. De las 63 bacterias aisladas 52 mostraron características de promotoras del crecimiento vegetal.
REFERENCIAS BIBLIOGRÁFICAS
1. CHAUDHRY, Q.; et al. "Utilising the synergy between plants and rhizosphere microorganisms to enhance breakdown of organic pollutants in the environment". Plant-Microbial Interactions, 2005, 12 (1):34-48.
2. GLICK, B. R. "Plant Growth-Promoting Bacteria: Mechanisms and Applications". Scientifica, 2012, 1, 1-15.
3. CUNNINGHAM, J.; KUIACK, C. "Production of citric and oxalic acids and solubilization of calcium phosphate by Penicillium bilaii". Appl Environ Microbiol, 1992. 58, 1451–1458.
4. NAUTIYAL, C. S. "An efficient microbiological growth medium for screening phosphate solubilizing microorganisms". FEMS Microbiology Letters, 1999, 170(1), 265-270.
5. PATTEN, C.; GLICK, B. "Role of Pseudomonas putida indoleacetic acid in development of the host plant root system". Applied and Environmental Microbiology, 2002, 68, 3795-3801.
6. GORDON, S.A.; WEBER, R.A. "Colorimetric estimation of indolacetic acid". Plant Physiol, 1951, 26, 192-195.
7. ROMICK, T.L.; FLEMING, H.P. "Acetoin production as an indicator of growth and metabolic inhibition of Listeria monocytogenes". J Appl Microbiol, 1998, 84, 18–24.
8. XIE, G.; et al . "Identification of nif genes in N2-fixing bacterial strains isolated from rice fields along the Yangtze River Plain". Journal of Basic Microbiology, 2006, 46, 56-63.
9. NIHORIMBERE ,V.; et al . "Beneficial effect of the rhizosphere microbial community for plant growth and health". Biotechnol Agron Soc Environ., 2011, 15(2), 327-337.
10. KARTHIKEYAN, R.; et al. "Potential for plant-based remediation of pesticides contaminated soil and water using nontarget plants as trees, shrubs and grasses". Critical Review in Plant Science, 2004, 23(1), 91-101.
11. GAMALERO, E.; GLICK, B. Mechanisms Used by Plant Growth-Promoting Bacteria. D.K. Maheshwari (ed.), Bacteria in Agrobiology: Plant Nutrient Management, DOI 10.1007/978-3-642-21061-7_2, # Springer-Verlag Berlin Heidelberg, 2011
12. BONFANTE, P.; ANCA, I. "Plants, Mycorrhizal Fungi, and Bacteria: A Network of Interactions". Annu. Rev. Microbiol, 2009, 63, 363–83.
13. BELTRÁN, M. E. "Phosphate solubilization as a microbial strategy for promoting plant growth". Corpoica Ciencia y Tecnología Agropecuaria, 2014, 15(1),101-113, ISSN 0122-8706.
14. SINDHU, S.S., et al.; Growth Promotion of Legumes by Inoculation of Rhizosphere Bacteria. In: Microbes for Legume Improvement, Khan, M.S., A. Zaidi and J. Musarrat (Eds.). Springer-Wien, New York, pp: 195-235, 2010.
15. OBED, Y. "Aislamiento de bacterias a de suelos contaminados con capacidad de crecer en hidrocarburos y 2,4 diclorofenol". Tesina de Diplomado en Biodegradación de Xenobióticos. CEBI, Universidad de Oriente, 2015.
16. PAREDES, M.; ESPINOSA, D. "Ácidos orgánicos producidos por rizobacterias que solubilizan fosfato: Una revisión crítica". Terra Latinoamericana, 2010, 28(1), 61-70.
17. ILMER, P.; SCHINNER F. "Solubilization of inorganic calcium phosphates solubilization mechanisms". Soil Biol Biochem, 1995, 27, 257-263.
18. KLOEPPER, J.W., RYU, C.H.M.; ZHANG S. "Induced systemic resistance and promotion of plant growth by Bacillus spp". Phytopathology 2004, 94(11), 1259-1266.
19. YOUNG, K., et al . "The multifactorial basis for p lant health promotion by plant-associated bacteria". App Env Microbiol, 2011, 77(5), 1548-1555.
Recibido: 8/05/2016
Aceptado: 30/09/2016
Dra. C. Rosa María Pérez-Silva, Centro de Estudios de Biotecnología Industrial (CEBI), Universidad de Oriente, Santiago de Cuba, Cuba, rperezs@uo.edu.cu