Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.29 no.2 Santiago de Cuba may.-ago. 2017
ARTICULOS
Comparación de métodos que utilizan ácido sulfúrico para la determinación de azúcares totales
Comparison of methods using sulfuric acid for determination of total sugars
MSc. Xiomara López-Legarda, Andony Taramuel-Gallardo, PhD. Carolina Arboleda-Echavarría, PhD. Freimar Segura-Sánchez, Esp. Luis Fernando Restrepo-Betancur
Universidad de Antioquia, Medellín, Colombia, xiomara.lopezl@udea.edu.co, gallardo.andony@udea.edu.co, carolina.arboleda@udea.edu.co, freimar.segura@udea.edu.co, frbstatistical@gmail.com
RESUMEN
Este artículo presenta una comparación entre el método fenol-ácido sulfúrico y dos variaciones de este, las cuales consisten en cambiar el orden de adición de reactivos y la eliminación del fenol. Se realizaron varias curvas de calibración comparando las pendientes obtenidas de la ecuación de la recta. Se confirmó que la adición de fenol no es necesaria para la cuantificación de carbohidratos totales. Se evaluó la capacidad del método para cuantificar diferentes azúcares (glucosa, xilosa, galactosa y 1,3-ß-glucano), la estabilidad de la reacción en el tiempo, la necesidad de agitación y la reducción del volumen de reacción; además se realizó la validación de la curva de calibración propuesta. Se logró concluir que el método no requiere el uso de fenol y que se puede reducir el volumen final de la reacción de 8 mL hasta 1,3 mL conservando la reproducibilidad y disminuyendo costos de reactivos y cantidad de residuos.
Palabras clave: carbohidratos, ácido sulfúrico, fenol, espectrofotometría.
ABSTRACT
This article presents a comparison between phenol-sulfuric acid method and two variations, that propose to vary the order of reagents addition or remove phenol reaction. It was performed several calibration curves to compare the slopes obtained from the straight-line equation. It was confirmed that the addition of phenol is not necessary for the quantification of total carbohydrates. The ability of the method to quantify different sugars (glucose, xylose, galactose and 1,3-ß-glucan), the stability of the reaction, the agitation and the reaction volume were evaluated. A validation of calibration curve was made. It was concluded that the method for the determination of total sugars does not require the use of phenol and can reduce the final reaction volume of 8 mL to 1,3 mL. This research has a positive impact in order to reduce costs of reagents and the amount of wastes.
Keywords: carbohydrates, sulfuric acid, phenol, spectrophotometry.
INTRODUCCIÓN
Los carbohidratos son biomoléculas que tienen una gran importancia en el campo de la investigación de las ciencias de la vida y en la aplicación industrial derivada de ello [1–5]. De ahí, la importancia en su determinación y cuantificación. En la literatura se han reportado diferentes métodos analíticos para la determinación de carbohidratos, basados en la espectrofotometría, la cromatografía líquida de alta resolución (HPLC), la refractometría, entre otras [6–9].
Existe una variedad de métodos colorimétricos los cuales utilizan reactivos distintos como antrona, fenol, orcinol o resorcinol [10–12 ]. El método colorimétrico para la determinación de la concentración de carbohidratos más ampliamente utilizado es el desarrollado por DuBois et al. [13] debido a la facilidad del procedimiento, sensibilidad, rapidez de los resultados y por ser apropiado para cuantificar diferentes azúcares como monosacáridos, oligosacáridos y polisacáridos.
Desarrollo de la metodología de cuantificación de carbohidratos utilizando fenol y ácido sulfúrico
Todos los carbohidratos tanto oligosacáridos como polisacáridos pueden ser determinados, pues bajo hidrólisis ácida producen monosacáridos. La adición de algunos ácidos minerales a las soluciones acuosas de carbohidratos, como el ácido sulfúrico al igual que el fosfórico y el clorhídrico, provoca la deshidratación de los carbohidratos con la eliminación de tres moles de agua [14, 15]. Con esta reacción se forman derivados del furfural [16–18 ], y el 5-hidroximetilfurfural (HMF) [19, 20], el cual es de gran importancia como precursor de otras biomoléculas útiles en la industria alimentaria y energética [21–23]. En el caso de pentosas, se produce una deshidratación a furfural y en las hexosas a HMF [24]. La presencia del fenol y su interacción con el HMF facilita la formación de complejos que permiten la coloración de la solución y en consecuencia facilitan la cuantificación de los carbohidratos a través de la espectrofotometría [12, 25–27].
El método de DuBois et al. demostró ser simple, estable y reproducible, logrando acortar el tiempo necesario para la determinación de carbohidratos comparado con otros métodos colorimétricos [25, 26, 28]. Por ejemplo, la cuantificación con antrona es limitada puesto que este reactivo es inestable; debido a su degradación y el consecuente oscurecimiento de la solución que altera su lectura colorimétrica, además de poseer una menor capacidad en el análisis de polisacáridos conformados por mezclas de azúcares [11, 25, 29, 30]. Por otra parte, el método establecido por Monsigny et al. [10]., utilizando resorcinol y ácido sulfúrico, propone procedimientos más complejos y de duración larga, presentando sensibilidades menores en la lectura de las absorbancias de soluciones acuosas de carbohidratos [25].
Variaciones del método fenol-ácido sulfúrico
En distintos estudios [25–27] los resultados de la cuantificación de carbohidratos obtenidos con el método de DuBois et al . fueron comparados. Diferentes autores propusieron algunas variaciones con el fin de aumentar la sensibilidad, la estabilidad y facilitar el manejo de los reactivos de esta metodología.
Investigaciones realizadas por Rao y Pattabiraman [27], plantean que, en la reacción de fenol-ácido sulfúrico ocurre una sulfonación in situ del fenol, el ácido fenolsulfónico formado es capaz de disminuir la intensidad de color del HMF, el furfural y otras hexosas y pentosas analizadas, afectando la lectura espectrofotométrica. Como contribución, sugirieron un cambio en la secuencia de la adición de los reactivos, de esta forma, el ácido sulfúrico se agrega primero a la solución acuosa de carbohidratos para hacer la hidrólisis, seguido por la adición del fenol, que genera la reacción colorimétrica y conservando la longitud de onda de 490 nm propuesta en el método original para las lecturas de absorbancia.
Partiendo de los resultados anteriores Masuko et al. [25], ratificaron que la adición de ácido sulfúrico concentrado a la muestra seguida por fenol, arroja los mejores resultados. Estos autores, adaptaron el método para utilizarlo en microplacas de 96 pozos, optimizando así el número de muestras a analizar, obteniendo una reducción en los volúmenes de muestra y reactivos utilizados en su metodología. A la solución de carbohidratos estos autores adicionaban el ácido sulfúrico concentrado, seguido inmediatamente por fenol al 5 %, la mezcla se dejaba en incubación a 90 °C por 5 min y se sometía a enfriamiento en baño a 25 °C por 5 min.
Albalasmeh, Berhe y Ghezzehei [26], presentaron un procedimiento alternativo basado en la capacidad de absorción que posee el HMF en longitudes de onda de luz en el rango ultravioleta. Esta modificación en la lectura de carbohidratos en el método de ácido sulfúrico-UV fue propuesta gracias a los ensayos llevados a cabo por Itagaki, quien logró comprobar que el HMF podía ser cuantificado a una longitud de onda de 320 nm. En la metodología desarrollada por Albalasmeh, Berhe y Ghezzehei, fue suprimido el uso de fenol, reportando una sensibilidad de lectura mayor a una longitud de 315 nm. Además, se optimizó el tiempo utilizado en la preparación para la lectura de los ensayos, puesto que no fue necesario esperar los 20 min requeridos para la reacción completa entre el HMF y el fenol, debido a la ausencia de este último reactivo. La eliminación del uso del fenol reduce una variable en el desarrollo del método, evitando la interacción entre el ácido sulfúrico y el anillo aromático, y en consecuencia la posible sulfonación del fenol [26].
Desventajas del uso del fenol en la metodología
Evitar el empleo de fenol en la metodología reduce costos por uso de reactivos, igualmente reduce el riego de exposición inherente a esta sustancia nociva para la salud [32, 33]. La exposición prolongada al fenol provoca cambios en piel, pulmones, hígado, riñones, y tracto urinario, los cuales están relacionados con la peroxidación lipídica de algunas membranas celulares [34]. Estudios en mamíferos han establecido la capacidad genotóxica del fenol, capaz de provocar cambios en cromosomas, síntesis de ADN y expresión de genes mutantes [35–39].
De acuerdo a lo expuesto anteriormente, hay ambigüedades en la cuantificación espectrofotométrica de azúcares totales utilizando ácido sulfúrico, ya que existen varias modificaciones al método original propuesto por DuBois et al. En el presente artículo se pretende establecer la mejor metodología para la determinación espectrofotométrica de mono y polisacáridos; la cual sea sensible, reproducible, y que se realice en el menor tiempo y consumo de reactivos posibles. Para ello se comparan los métodos fenol-ácido sulfúrico [13], ácido sulfúrico-fenol [27] y ácido sulfúrico-UV [26], utilizando soluciones acuosas de carbohidratos. Además, se propondrá la reducción del volumen de los reactivos utilizados; realizando la validación de una curva de calibración con siete concentraciones cumpliendo con los parámetros estadísticos de límite de detección (LOD), límite de cuantificación (LOQ), exactitud, precisión y linealidad.
MATERIALES Y MÉTODOS
Materiales
Los reactivos químicos utilizados en este estudio fueron grado analítico. El ácido sulfúrico (H2SO4) se obtuvo de J.T. Baker®, el fenol (C6H6O) y la glucosa (Glu) (C6H12O6) fueron obtenidos de PANREAC®, la galactosa (Gal) (C6H12O6) y la xilosa (Xyl) (C5H10O5) se obtuvieron de SIGMA-ALDRICH®, y finalmente, el 1,3-ß-glucano (ß-glucano) fue obtenido de ChromaDex®. Los análisis en el presente artículo se realizaron en un espectrofotómetro UV-Vis CARY 50 Bio.
Preparación de soluciones estándar para las curvas de calibración
Se utilizaron concentraciones conocidas de los estándares a 10, 20, 30, 40, 50, 60 y 70 mg/L, dependiendo del ensayo realizado, utilizando como solvente agua tipo I. El único ensayo en el cual se utilizaron los siete puntos de concentración preparados fue en la elaboración de la curva de calibración para su validación; los demás ensayos fueron realizados utilizando tres concentraciones 10, 50 y 70 mg/L. Todos los ensayos fueron realizados por triplicado.
Métodos analíticos utilizados
Método fenol-ácido sulfúrico
El método de DuBois et al. [13], tiene como procedimiento que a 2 mL de una solución de azúcares, se agrega 1 mL de una solución de fenol al 5 %; posteriormente, se deben agregar 5 mL de ácido sulfúrico concentrado, realizando el procedimiento rápidamente entre cada una de las adiciones de los reactivos. Se debe asegurar la adición de los reactivos directamente sobre el líquido y no por las paredes del tubo. Los tubos de ensayo se dejan en reposo durante 10 min, seguido de una agitación durante 30 s, y su posterior reposo en un baño de agua a temperatura ambiente durante 20 min. Finalmente, la medición se realiza en el espectrofotómetro utilizando una longitud de onda de 490 nm.
Método ácido sulfúrico-fenol
El método de Rao y Pattabiraman [27] tiene como procedimiento que a 1 mL de las soluciones de carbohidratos, se agregue 3 mL de ácido sulfúrico concentrado y luego se agite la muestra. La solución es enfriada en baño de hielo durante 2 min. Posteriormente, se adiciona 2 mL de una solución de fenol al 5 %, esperando 30 min antes de leer la solución en el espectrofotómetro a 490 nm. Cabe aclarar que en el método original de estos autores el fenol se empleaba a una concentración del 80 % utilizando 0,05 mL, pero con el fin de mantener volúmenes similares en los métodos y disminuir al máximo las variables, el fenol se empleó al 5 % según lo reportado en el procedimiento inicial de DuBois et al. [13], donde se afirma la posibilidad de utilizar cualquiera de las dos concentraciones de este reactivo.
Método ácido sulfúrico-UV
El método de Albalasmeh, Berhe y Ghezzehei [26] tiene como procedimiento que a 1 mL de las soluciones de carbohidratos, se agregue 3 mL de ácido sulfúrico concentrado y posteriormente se agite durante 30 s. La solución se enfría en baño de hielo durante 2 min. Finalmente, se realiza la medición en el espectrofotómetro utilizando una longitud de onda de 315 nm.
Método ácido sulfúrico-UV propuesto
El método que se planteó en el presente artículo tiene como procedimiento que, en un tubo de ensayo de 7,5 cm de altura por 1,0 cm de diámetro, a 0,3 mL de las soluciones de carbohidratos, se agregue 1 mL de ácido sulfúrico concentrado. La solución se enfría en baño de hielo durante 2 min. Finalmente, se realiza la medición en el espectrofotómetro utilizando una longitud de onda de 315 nm.
Diseño experimental
Se empleó el Modelo Lineal General con el fin de construir los modelos de regresión lineal simple y los coeficientes de determinación asociados a cada modelo. La prueba de diferencia significativa honesta de Tukey, HSD, pos sus siglas en inglés [40], fue utilizada para la evaluación del efecto en las pendientes de los diferentes modelos que fueron propuestos, para ello se utilizó como herramienta informática el paquete estadístico SAS UNIVERSITY.
Comparación de los métodos fenol-ácido sulfúrico, ácido sulfúrico-fenol, y ácido sulfúrico-UV
Los tres métodos para la cuantificación de carbohidratos mencionados anteriormente fueron comparados teniendo en cuenta la linealidad, sensibilidad y precisión en la cuantificación de dichas biomoléculas. Se construyeron curvas de calibración por triplicado evaluándose soluciones acuosas de Glu a las concentraciones establecidas.
Comparación de volúmenes empleados en el método ácido sulfúrico-UV
Con el fin de optimizar el método, disminuir costos en reactivos y reducir el volumen de residuos contaminantes; se propone una modificación en los volúmenes del método ácido sulfúrico-UV propuesto por Albalasmeh, Berhe y Ghezzehei [26]. Los volúmenes propuestos fueron: 0,3 mL de solución de carbohidratos con 1 mL de ácido sulfúrico y 0,2 mL de solución de carbohidratos con 1 mL de ácido sulfúrico.
Influencia de la agitación sobre la absorbancia de la muestra
La influencia de la agitación fue evaluada en este artículo, para esto fueron construidas curvas de calibración por triplicado. Una de las curvas de calibración fue sometida a agitación en vórtex durante 30 s después de adicionar el ácido sulfúrico tal como lo reporta Albalasmeh, Berhe y Ghezzehei [26] y la otra curva de calibración fue elaborada sin ningún tipo de agitación posterior a la reacción.
Aplicación del método ácido sulfúrico-UV propuesto a diferentes soluciones de carbohidratos
En el presente artículo también fueron evaluados diferentes soluciones de carbohidratos: los monosacáridos Glu, Gal y Xyl, además del polisacárido 1,3-ß-glucano. Se construyeron espectros de los carbohidratos mencionados anteriormente con el fin de conocer los valores máximos de absorbancia presentados. Igualmente, se construyeron curvas de calibración por triplicado a concentraciones de 10, 50 y 70 mg/L para la Glu, Gal y 1,3-ß-glucano y 5, 20 y 50 mg/L para la Xyl.
Estabilidad de la reacción en el tiempo
Una solución de Glu a una concentración de 50 mg/L fue utilizada para comparar la estabilidad de la reacción en el tiempo a partir del momento en que el ácido sulfúrico fue adicionado. Se evaluó la absorbancia por espectrofotometría en los tiempos 0, 60, 240 y 1 440 min, conservándose en condiciones idénticas de temperatura y humedad ambiental.
Comparación del método utilizando espectrofotómetros diferentes
Las absorbancias obtenidas en el equipo disponible del grupo de investigación Biopolimer de la Universidad de Antioquia (UV-Vis CARY 50 Bio) fueron comparadas con un espectrofotómetro de otro laboratorio (UV/vis EVOLUTION 60S de Thermo Scientific) con el fin de analizar la repetibilidad del método.
Validación del método ácido sulfúrico-UV propuesto
Para validar el método propuesto en este artículo se construyeron curvas de calibración por triplicado. Fueron utilizadas soluciones de Glu a siete concentraciones distintas: 10, 20, 30, 40, 50, 60 y 70 mg/L. Se analizaron LOD, LOQ, exactitud, precisión y linealidad, de acuerdo a lo estipulado por la Conferencia Internacional de Armonización (ICH), para la validación de métodos analíticos.
RESULTADOS Y DISCUSIÓN
Comparación de los métodos fenol-ácido sulfúrico, ácido sulfúrico-fenol, y ácido sulfúrico-UV
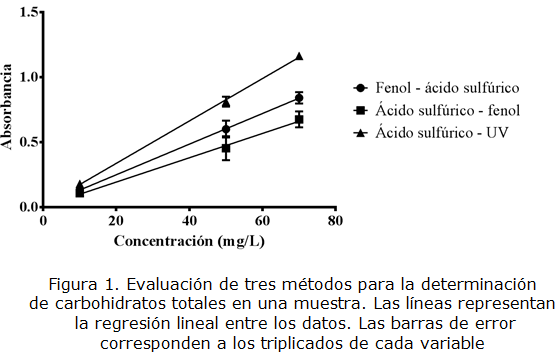
La figura 1 y la tabla 1 comparan los tres métodos evaluados para determinar azúcares totales en una muestra. Se puede observar que la curva de calibración del método de ácido sulfúrico-UV, presenta una mayor pendiente en comparación a los dos métodos que utilizan fenol, indicando que la absorbancia es mayor a la misma concentración y que el método es más sensible. Adicionalmente, teniendo en cuenta las barras de error para los triplicados en cada punto, las desviaciones de lectura en el método ácido sulfúrico-UV son menores; indicando que el método es más confiable porque hay menor variabilidad entre cada medición.
TABLA 1. COEFICIENTES DE LAS CURVAS DE CALIBRACIÓN (CORRESPONDIENTES A LA ABSORBANCIA VERSUS LA CONCENTRACIÓN DE GLUCOSA)
| Método | Pendiente | Intercepto | Coeficiente de regresión (R2) |
| Fenol – ácido sulfúrico | 0,011 8a | 0,014 6 | 0,999 9 |
| Ácido sulfúrico - fenol | 0,009 3b | 0,006 8 | 0,995 9 |
| Ácido sulfúrico - UV | 0,016 3c | 0,012 0 | 0,999 2 |
En la tabla 1 también se puede observar que el coeficiente de determinación es mayor a 0,99 en los tres métodos, indicando que las variables absorbancia y concentración de glucosa, tienen una relación lineal. Según el test de Tukey, existen diferencias significativas (p<0,05) entre las pendientes de los tres métodos para la determinación de carbohidratos totales, esto corresponde con lo reportado por Albalasmeh, Berhe y Ghezzehei [26]. Por lo anterior, teniendo en cuenta la pendiente, el coeficiente de correlación y la desviación estándar, el método más sensible y preciso es el método de ácido sulfúrico-UV. Adicionalmente, con este método se evita el uso del fenol disminuyendo costos, tiempos de análisis, riesgos para el analista y para el ambiente.
Los valores de cada método para la cuantificación de carbohidratos seguidos por la misma letra no son significativamente diferentes a un nivel de probabilidad α=0,05 de acuerdo a la prueba de diferencia significativa honesta de Tukey (HSD).
Comparación de volúmenes empleados en el método ácido sulfúrico-UV
Al determinar que el método más sensible y preciso es el método de ácido sulfúrico-UV, además de considerar las ventajas previamente mencionadas, se utilizó este método para todos los análisis posteriores. Buscando optimizar el método, disminuir costos en reactivos y reducir el volumen de residuos contaminantes, se propone utilizar una tercera parte del volumen de reacción y que se puedan hacer las lecturas en celdas de 1 mL, de tal forma que con el ácido que se utiliza para 1 análisis, se pueden hacer 3. Se evaluó la influencia del volumen final utilizado en la reacción para la cuantificación de los carbohidratos.
En la tabla 2, de acuerdo al test de Tukey, es posible observar que no hay diferencias significativas (p>0,05) en las pendientes obtenidas utilizando un volumen de reacción total de 1,3 mL con el de 4,0 mL propuesto por Albalasmeh, Berhe y Ghezzehei. El volumen final de 1,2 mL presentó diferencias significativas frente al volumen final del método original (p<0,05).
TABLA 2. VOLÚMENES TOTALES EVALUADOS PARA EFECTUAR EL MÉTODO ÁCIDO SULFÚRICO-UV
| Volumen total de reacción (mL) | Pendiente | Intercepto | Coeficiente de regresión (R2) |
| 4 | 0,017 1a | 0,009 0 | 0,999 9 |
| 1,3 | 0,017 2a | 0,007 0 | 0,999 8 |
| 1,2 | 0,011 6b | 0,045 0 | 0,994 0 |
La relación 1:3 entre la muestra y el ácido sulfúrico se mantiene próxima al método ácido sulfúrico-UV al obtener un volumen final de 1,3 mL, esto aseguraría el exceso de ácido necesario para la conversión de los carbohidratos al furfural [14, 15]. No se aplica la misma relación de disminución de volumen para el ácido y para la muestra buscando un método final fácil de realizar con medidas volumétricas cercanas a la mayoría de los instrumentos de laboratorio disponibles. En el método original la relación de muestra vs volumen final es de 25 %, en el de 1,3 es del 23 % y en el de 1,2 es del 16 % por lo tanto el de 1,2 ya no es aconsejable porque se pierde sensibilidad del método al tener una dilución mayor de los carbohidratos.
Los valores de cada ensayo seguidos por la misma letra no son significativamente diferentes a un nivel de probabilidad a=0,05 de acuerdo a la prueba de diferencia significativa honesta de Tukey (HSD).
Influencia de la agitación posterior a la adición del ácido sulfúrico sobre la muestra
En los métodos similares a este [13, 26, 27] se recomienda la agitación como parte fundamental de la reacción con el fin de garantizar una homogenización de la muestra. En la tabla 3 se pueden observar las comparaciones entre las curvas de calibración realizadas con agitación de la muestra en vórtex durante 1 min después de la reacción y la muestra sin agitación. Según la prueba de Tukey no existen diferencias significativas (p>0,05) entre las variables, es decir que de acuerdo a los datos estadísticos se puede omitir la agitación del procedimiento.
TABLA 3. INFLUENCIA DE LA AGITACIÓN SOBRE LA ABSORBANCIA DEL CARBOHIDRATO
| Agitación | Pendiente | Intercepto | Coeficiente de regresión (R2) |
| Agitado (1 min) | 0,017 1a | 0,025 5 | 0,998 6 |
| No Agitado | 0,017 9a | 0,023 1 | 0,999 8 |
Los valores de cada ensayo seguidos por la misma letra no son significativamente diferentes a un nivel de probabilidad α=0,05 de acuerdo a la prueba de diferencia significativa honesta de Tukey (HSD).
Aplicación del método ácido sulfúrico-UV propuesto a diferentes soluciones de carbohidratos
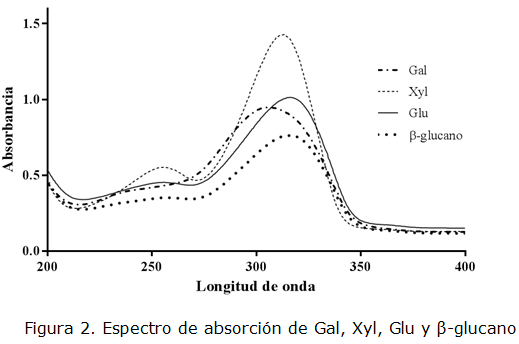
La figura 2 muestra los espectros de absorción, después de haber realizado la reacción con el ácido sulfúrico, de carbohidratos de diferentes tamaños como: Gal, Xyl, Glu y ß-glucano a longitudes de onda entre 200 y 400 nm. Se encontraron los picos máximos de absorción a 307,0, 313,5, 316,0 y 315,0 respectivamente. Esto nos indicó que los azúcares evaluados presentaron máximos de absorción cercanos al utilizado en el método de ácido sulfúrico-UV, que tiene como longitud de onda fija de lectura 315 nm. Sin embargo, se recomienda realizar este tipo de ensayos previamente antes de utilizar un carbohidrato diferente, para obtener el pico de absorción máximo y tener una mayor sensibilidad en la lectura.
En la tabla 4 se puede observar los parámetros de las ecuaciones de la recta de los tres carbohidratos Glu, Xyl y Gal además del polisacárido ß-glucano utilizados en este artículo.
TABLA 4. COEFICIENTES DE LAS CURVAS DE CALIBRACIÓN PARA DIFERENTES AZÚCARES
| Azúcar | Pendiente | Intercepto | Coeficiente de regresión (R2) |
| Gal | 0,012 4a | 0,036 6 | 0,999 2 |
| Xyl * | 0,027 6b | 0,020 5 | 0,999 6 |
| Glu | 0,016 3c | 0,012 0 | 0,999 2 |
| ß-glucano | 0,010 5c | 0,015 6 | 0,996 8 |
* Se utilizaron las concentraciones de 5, 20 y 50 ppm para ajustar la curva de calibración a la ley de Beer Lambert
Según la prueba de Tukey no existen diferencias significativas (p>0,05) entre las pendientes obtenidas para la ecuación de la recta de Glu y ß-glucano, probablemente porque este último es un polímero de Glu el cual se hidroliza por las características ácidas del método [42, 43]. Los demás azúcares presentan diferencias significativas (p<0,05) en las pendientes obtenidas de las curvas de calibración, esto indica la necesidad de realizar una curva de calibración con el monosacárido que se quiera determinar en una muestra.
Los valores de cada ensayo seguidos por la misma letra no son significativamente diferentes a un nivel de probabilidad a=0,05 de acuerdo a la prueba de diferencia significativa honesta de Tukey (HSD).
Estabilidad de la reacción en el tiempo
En la tabla 5, el test de Tukey muestra que existen diferencias significativas (p<0,05) en el método dependiendo del tiempo que se tome para realizar las lecturas de absorbancia, contrario a lo que afirman DuBois et al. [13] y Albalasmeh, Berhe y Ghezzehei [26] quienes plantean que el furfural o sus derivados se mantiene estables por días con la posibilidad de realizar las lecturas espectrofotométricas sin ninguna variación. En los ensayos realizados se pudo observar una estabilidad mejor durante la primera hora, sin diferencias significativas (p>0,05) en la pendiente de la curva de calibración, por lo cual se sugiere realizar la lectura de los ensayos realizados con el método durante el transcurso de la primera hora después llevar a cabo la reacción química con el ácido sulfúrico.
TABLA 5. ESTABILIDAD DE LA REACCIÓN EN EL TIEMPO
| Tiempo (min) | Pendiente | Intercepto | Coeficiente de regresión (R2) |
| 0 | 0,015 4ab | 0,013 8 | 0,997 7 |
| 60 | 0,016 5a | 0,027 3 | 1,000 0 |
| 240 | 0,013 8bc | 0,022 4 | 0,999 9 |
| 1 440 | 0,012 7c | 0,019 2 | 0,998 4 |
Los valores de cada ensayo seguidos por ala misma letra no son significativamente diferentes a un nivel de probabilidad α=0,05 de acuerdo a la prueba de diferencia significativa honesta de Tukey (HSD).
Comparación del método utilizando espectrofotómetros diferentes
La tabla 6 muestra que no existen diferencias estadísticamente significativas (p>0,05), de acuerdo a la prueba de Tukey, en el uso de equipos diferentes para las lecturas de absorbancia en el método propuesto. Con estos resultados se comprueba la repetibilidad del método planteado.
| Equipo | Pendiente | Intercepto | Coeficiente de regresión (R2) |
| UV-Vis CARY 50 Bio | 0,017 4a | 0,007 2 | 0,999 9 |
| UV/Vis EVOLUTION 60S | 0,017 3a | 0,001 9 | 0,998 5 |
Los valores de cada ensayo seguidos por la misma letra no son significativamente diferentes a un nivel de probabilidad a=0,05 de acuerdo a la prueba de diferencia significativa honesta de Tukey (HSD).
Validación del método ácido sulfúrico-UV propuesto
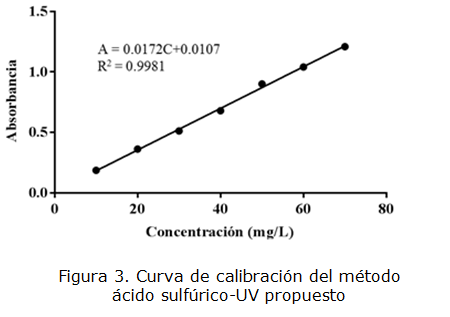
El LOD y el LOQ se hallaron con base en la desviación estándar de las absorbancias, y en la pendiente obtenida de la curva de calibración. La desviación de la respuesta corresponde a la desviación estándar obtenida para las réplicas del blanco utilizado [41 ]. Los valores obtenidos para el LOD y el LOQ fueron 1 y 2 mg/L respectivamente. Si bien la curva de calibración se podría empezar desde una concentración de 2 mg/L, para evitar lecturas muy bajas de absorbancias y mayores errores, se decide trabajar la curva de calibración desde 10 mg/L puesto que es un valor 5 veces mayor que el LOQ permitiendo realizar lecturas confiables. Por lo tanto, se realizó una curva de calibración con siete puntos en un rango de concentración entre 10 y 70 mg/L. Ver Tabla 7. En la figura 3 se muestra la curva de calibración del método ácido sulfúrico-UV propuesto.
TABLA 7. EXACTITUD Y PRECISIÓN DEL MÉTODOÁCIDO SULFÚRICO-UV PROPUESTO
| Concentración (mg/L) | Media | Desviación estándar (SD) | Desviación estándar relativa (RSD) | Porcentaje de recuperación (%R) | Error relativo (%E) |
| 10 | 0,186 0 | 0,002 6 | 1,4 | 98,1 | 1,9 |
| 20 | 0,362 2 | 0,006 9 | 1,9 | 10,3 | 0,3 |
| 30 | 0,511 9 | 0,006 4 | 1,3 | 95,9 | 4,3 |
| 40 | 0,678 9 | 0,009 0 | 1,3 | 96,2 | 4,0 |
| 50 | 0,900 4 | 0,008 5 | 0,9 | 10,7 | 2,6 |
| 60 | 1,040 4 | 0,004 2 | 0,4 | 99,1 | 0,9 |
| 70 | 1,209 0 | 0,017 5 | 1,4 | 99,0 | 1,0 |
CONCLUSIONES
El método de fenol-ácido sulfúrico ha sido uno de los métodos más utilizados en investigaciones alrededor del mundo para la determinación de carbohidratos totales. Rao y Pattabiraman [19, 27] y Albalasmeh, Berhe y Ghezzehei [26] fueron algunos de los autores que modificaron el método inicial propuesto por DuBois et al. [11, 13], contribuyendo en la mejora de este. Sin embargo, en publicaciones recientes, se puede observar que muchos investigadores continúan utilizando el método original a pesar de sus desventajas mayoritarias.
Con esta investigación se puede afirmar que el uso del fenol para la reacción colorimétrica es innecesario. Las lecturas de absorbancia por espectrofotometría UV en el método de determinación de carbohidratos totales se pueden realizar satisfactoriamente con la hidrólisis de los azúcares a furfural o sus derivados utilizando solamente ácido sulfúrico concentrado. Estas modificaciones al método original del fenol-ácido sulfúrico permitieron disminuir los costos de reactivos, el tiempo de ejecución y los impactos de los reactivos en los analistas y de los residuos en el ambiente.
AGRADECIMIENTOS
Los autores agradecen a la Estrategia de Sostenibilidad CODI 2013-2014 de la Universidad de Antioquia, e igualmente a Colciencias por la financiación del proyecto 1115-521-28123 contrato 465-2011, resultante de la convocatoria 521 de 2010.
REFERENCIAS BIBLIOGRÁFICAS
1. LEOPOLD, L. F.; LEOPOLD, N.; DIEHL, H.; SOCACIU, C.. "Quantification of carbohydrates in fruit juices using FTIR spectroscopy and multivariate analysis". Spectroscopy. 2011, 26, 93–104. DOI 10.3233/SPE-2011-0529.
2. BAHADUR, A.; CHAUDHRY, Z.; JAN, G.; DANISH, M.; REHMAN, A.; KHALID, S.; SHAH, Z.; ALI, F.; MUSHTAQ, T.; JAN, F. G. "Nutritional and elemental analyses of some selected fodder species used in traditional medicine". Afr J Pharm Pharmacol. 2011, 5(8), 1157–1161. DOI 10.5897/AJPP11.205.
3. MARTÍNEZ MONTERO, C.; RODRÍGUEZ DODERO, M. C.; GUILLÉN SÁNCHEZ, D. A.; BARROSO, C. G. "Analysis of Low Molecular Weight Carbohydrates in Food and Beverages: A Review". Chromatographia. 2004, 59(1), 15–30. DOI 10.1365/s10337-003-0134-30009-5893/04/0.
4. ZHU, B.; LIU, F.; LI, X.; WANG, Y.; GU, X.; DAI, J.; WANG, G.; CHEN, Y.; YAN, C. "Fast quantification of endogenous carbohydrates in plasma using hydrophilic interaction liquid chromatography coupled with tandem mass spectrometry". J Sep Sci. 2014, 38(1), 1–34–41. DOI 10.1002/jssc.201400899.
5. RAKUS, J. F.; MAHAL, L. K. "New technologies for glycomic analysis: toward a systematic understanding of the glycome". Annu Rev Anal Chem . 2011, 4 , 367–92. DOI 10.1146/annurev-anchem-061010-113951.
6. NOGUEIRA, L. C.; SILVA, F.; FERREIRA, I.; M.P.L.V.O.; TRUGO, L.C. "Separation and quantification of beer carbohydrates by high-performance liquid chromatography with evaporative light scattering detection". J Chromatogr A. 2005, 1065(2), 207–210. DOI 10.1016/j.chroma.2004.12.074.
7. BAKSI, A.; PUTATUNDA, S.; SEN, D.; SARKAR, A.; BHATTACHARJEE, C. "Protocol Development for the Carbohydrate Quantification in Black Liquor with Brix Refractometer". J Inst Eng (India): Series E. 2013, 93 (2), 69–74. DOI 10.1007/s40034-013-0012-y.
8. QURESHI, M. N., STECHER, G., SULTANA, T., ABEL, G., POPP, M.; BONN, G. K. "Determination of carbohydrates in medicinal plants--comparison between TLC, mf-MELDI-MS and GC-MS". Phytochem Anal. 2011, 22(4), 296–302. DOI 10.1002/pca.1280.
9. PARC, A. L.; LEE, H.; CHEN, K.; BARILE, D. "Rapid Quantification of Functional Carbohydrates in Food Products". Food Nut Sci. 2014, 71–78. DOI 10.4236/fns.2014.51010.
10. MONSIGNY, M.; PETT, C.; ROCHE, A C. "Colorimetric Determination of Neutral Sugars by a Resorcinol Sulfuric Acid Micromethod". Anal Biochem. 1988, 175 , 525–530. DOI 10.1016/0003-2697(88)90578-7.
11. LOEWUS, F. A. "Improvement in Anthrone Method for Determination of Carbohydrates". Anal Chem. 1952, 24(1), 219–219. DOI 10.1021/ac60061a050.
12. DUBOIS, M.; GILLES, K.; HAMILTON, J. K.; REBERS, P.; SMITH, F. "A Colorimetric Method for the Determintion of Sugars". Nature. 1951, 168, 167. DOI 10.1038/168167a0.
13. DUBOIS, M.; GILLES, K. a.; HAMILTON, J. K.; REBERS, P.; SMITH, Fred. "Colorime tric Method for Determination of Sugars and Related Substances". Anal Chem. 1956, 28(3), 350–356. DOI 10.1021/ac60111a017.
14. ASGHARI, F. S.; YOSHIDA, H. "Acid-Catalyzed Production of 5-Hydroxymethyl Furfural from D-Fructose in Subcritical Water". Ind Eng Chem Res. 2006, 45, 2163–2173. DOI 10.1021/ie051088y.
15. BICKER, M.; HIRTH, J.; VOGEL, H. "Dehydration of fructose to 5-hydroxymethylfurfural in sub- and supercritical acetone". Green Chem. 2003, 5(2), 280–284. DOI 10.1039/b211468b.
16. KUSTER, B.; VAN DER BAAN, H. "The influence of the initial and catalyst concentrations on the dehydration of D-fructose". Carbohy Res. 1977, 54 , 165–176. DOI 10.1016/S0008-6215(00)84806-5.
17. TAHVILDARI, K.; TAGHVAEI, S.; NOZARI, M. "The Study of Hydroxymethylfurfural as a Basic Reagent for Liquid Alkanes Fuel Manufacture from Agricultural Wastes". Int J Chem Environ Eng. 2011, 2(1), 62–68.
18. CARATZOULAS, S.; VLACHOS, D. G. "Converting fructose to 5-hydroxymethylfurfural: a quantum mechanics/molecular mechanics study of the mechanism and energetics". Carbohy Res. 2011, 346(5), 664–72. DOI 10.1016/j.carres.2011.01.029.
19. RAO, P.; PATTABIRAMAN, T. N. "Further Studies on the Mechanism of Phenol-Sulfuric Acid Reaction with Furaldehyde Derivates". Anal Biochem. 1990, 189, 178–181. DOI 10.1016/0003-2697(90)90103-G.
20. GÁMEZ, S., GONZÁLEZ CABRIALES, J. J.; RAMÍREZ, J. A., GARROTE, G.; VÁZQUEZ, M. "Study of the hydrolysis of sugar cane bagasse using phosphoric acid". J Food Eng. 2006, 74(1), 78–88. DOI 10.1016/j.jfoodeng.2005.02.005.
21. YONG, G.; ZHANG, Y.; YING, J. Y. "Efficient Catalytic System for the Selective Production of 5-Hydroxymethylfurfural from Glucose and Fructose". Angew Chem. 2008. 120 (48), 9485–9488. DOI 10.1002/ange.200803207.
22. ROSATELLA, A.; SIMEONOV, S. P.; FRADE, R. F. M.; AFONSO, C. a. M. "5-Hydroxymethylfurfural (HMF) as a building block platform: Biological properties, synthesis and synthetic applications". Green Chem. 2011, 13(4), 754. DOI 10.1039/c0gc00401d.
23. DE SOUZA LOPES, R.; YU, H.; RATABOUL, F.; ESSAYEM, N.. "5-Hydroxymethylfurfural (5-HMF) Production from Hexoses: Limits of Heterogeneous Catalysis in Hydrothermal Conditions and Potential of Concentrated Aqueous Organic Acids as Reactive Solvent System". Challenges. 2012, 3(2), 212–232. DOI 10.3390/challe3020212.
24. SUZANNE NIELSEN, S. "Phenol-Sulfuric Acid Method for Total Carbohydrates". En : FOOD SCIENCE TEXTS SERIES (ed.), Food Analysis Laboratory Manual, 2009, p. 47–53.
25. MASUKO, T.; MINAMI, A.; IWASAKI, N.; MAJIMA, T.; NISHIMURA, S.; LEE, Y. C. "Carbohydrate analysis by a phenol-sulfuric acid method in microplate format". Anal biochem. 2005, 339(1), 69–72. DOI 10.1016/j.ab.2004.12.001.
26. ALBALASMEH, A.; BERHE, A. A.; GHEZZEHEI, T. "A new method for rapid determination of carbohydrate and total carbon concentrations using UV spectrophotometry". Carbohydr Polym. 2013, 97(2), 253–261. DOI 10.1016/j.carbpol.2013.04.072.
27. RAO, P.; PATTABIRAMAN, N. "Reevaluation of the phenol-sulfuric acid reaction for the estimation of hexoses and pentoses". Anal Biochem. 1989, 181(1), 18–22. DOI 10.1016/0003-2697(89)90387-4.
28. HALL, M. B. "Efficacy of reducing sugar and phenol–sulfuric acid assays for analysis of soluble carbohydrates in feedstuffs". Anim Feed Sci Technol. 2013, 185(1-2), 94–100. DOI 10.1016/j.anifeedsci.2013.06.008.
29. ROE, J. H. "The determination of dugar in blood and spinal fluid with anthrone reagent". J. Biol. Chem. 1955, 212, 335–343.
30. LAURENTIN, A. ; EDWARDS, C.a. "A microtiter modification of the anthrone-sulfuric acid colorimetric assay for glucose-based carbohydrates". Anal Biochem. 2003, 315(1), 143–145. DOI 10.1016/S0003-2697(02)00704-2.
31. ITAGAKI, H. "Saccharification process of cellulose in 97 % sulfuric acid monitored by sulfuric acid induced ultraviolet absorption behaviour". Polymer. 1994, 5(1), 50–52. DOI Saccharification process of cellulose in 97 % sulfuric acid monitored by sulfuric acid induced ultraviolet absorption behaviour.
32. BOATTO, G.; NIEDDU, M.; CARTA, A.; PAU, A.; LORENZONI, S.; MANCONI, P. ; SERRA, D. "Determination of phenol and o-cresol by GC/MS in a fatal poisoning case". Forensic Sci Int. 2004, 139(2-3), 191–4. DOI 10.1016/j.forsciint.2003.10.023. A fatality due to the ingestion of solution containing phenol and o-cresol is described. T
33. BUKOWSKA, B.; MICHALOWICZ, J.; KROKOSZ, A.; SICINSKA, P. "Comparison of the effect of phenol and its derivatives on protein and free radical formation in human erythrocytes (in vitro)". Blood Cells Mol Dis. 2007, 39(3), 238–44. DOI 10.1016/j.bcmd.2007.06.003.
34. MICHALOWICZ, J.; DUDA, W. "Phenols – Sources and Toxicity". Polish J of Environ Stud. 2007, 16(3), 347–362.
35. EUROPEAN FOOD SAFETY AUTHORITY (EFSA). "Scientific Opinion on the toxicological evaluation of phenol". EFSA J. 2013, 11(4). DOI 10.2903/j.efsa.2013.3189.
36. WAN, J.; WINN, L. M. "The effects of benzene and the metabolites phenol and catechol on c-Myb and Pim-1 signaling in HD3 cells". Toxicol Appl Pharmacol . 2004, 201 (2), 194–201. DOI 10.1016/j.taap.2004.05.010.
37. CHANG, Y.; TAI, K.; HUANG, F.; HUANG, M. "Cytotoxic and Nongenotoxic Effects of Phenolic Compounds in Human Pulp Cell Cultures". J Endod. 2000, 26(8), 440–443. DOI 10.1097/00004770-200008000-00002.
38. PARDOE, R.; SCHLESINGER, S. L.; MINAMI, T.; SATO, M. "Phenol burns". Burns. 1976, 3, 29–41.
39. CAMPBELL, M. Evidence on the Developmental and Reproductive Toxicity of Phenol. California, Estados Unidos: DRAFT, 2003.
40. ABDI, H.; WILLIAMS, L. J. Tukey's Honestly Significant Difference (HSD) Test. In: Encyclopedia of Research Design. United States: Thousand Oaks, 2010. 1–5.
41. INTERNATIONAL CONFERENCE ON HARMONISATION (ICH). Validation of analytical procedures: Methosology. In: Validation of Analytical Procedures: Text and Methodology Q2(R1) . United States, 2005. 6–13.
42. JOHANSSON, L. Structural analyses of (1→3),(1→4)-ß-D-glucan of oats and barley. University of Helsinki, 2006.
Recibido: 20/09/2016
Aceptado: 7/01/2017
MSc. Xiomara López-Legarda, Universidad de Antioquia, Medellín, Colombia, xiomara.lopezl@udea.edu.co